酒精引起的肝损伤会引起脂肪肝、肝炎、肝纤维化和肝硬化[1]等酒精性肝病,严重威胁人类健康。酒精进入机体后产生的氧自由基和代谢产物是损伤肝脏的主要物质,过量酒精进入机体后,在铁离子的参与下会与细胞色素P450结合产生大量的氧自由基,这些自由基会影响肝脏正常的氧化还原状态,引起脂质过氧化,细胞膜通透性被破坏,进而损伤肝脏细胞的完整性和功能[2];其代谢产物乙醛会与肝脏中参与代谢、转录的蛋白质结合,破坏蛋白质的生理功能,继而引起DNA修复异常,破坏线粒体结构和功能,导致细胞损伤[3-4];此外,线粒体中的谷胱甘肽与氧自由基反应被大量消耗,降低线粒体氧化损伤的修复能力,进一步增加肝细胞的损伤程度[5]。
针对上述的损伤途径,糖皮质激素、S-腺苷蛋氨酸、多烯磷脂酰胆碱、还原型谷胱甘肽等一系列治疗药物被相继研发并成功地应用。但这些药物会引起过敏、代谢紊乱等副作用,对人体健康产生危害[6]。药食两用植物包含的多酚、多糖、黄酮等生物活性物质,具有抗氧化、抑菌[7]、抗炎等功效,能够清除自由基、缓解机体应激反应,保护肝脏细胞[8]。
蒲公英是我国常见的药食两用植物,富含多糖、黄酮、酚酸等多种生物活性物质,中医和现代医学研究表明其具有保肝沥胆,利尿,抗炎,抗菌和辅助保护化学性肝损伤作用[9-10]。蒲公英乙醇提取物可提高药物损伤小鼠肝脏中超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽(glutathione,GSH)的含量,并使谷草转氨酶(glutamic oxaloacetic transaminase,AST)、谷丙转氨酶(glutamic pyruvic transaminase,ALT)的含量减少,有效的保护肝脏[11];水提物可降低四氯化碳对肝脏的损伤[12]。现有研究多采用不同溶剂提取蒲公英中的活性组分,研究其保肝作用,不同溶剂提取物中活性成分的种类、含量各不相同,无法对其中各类活性组分的作用进行系统性的比较和分析。基于现有研究现状,本试验采用水、乙醇作为溶剂提取蒲公英中活性组分,系统比较、分析不同提取物对酒精性肝损伤小鼠和HHL-5肝细胞保护作用和差异。在此基础上,以抗氧化能力为切入点,探究其与保肝作用的内在联系,为系统分析蒲公英作用成分与机制提供实验基础。
1 材料与方法
1.1 试验材料
蒲公英全草,山东省新泰市野菜野生水果养殖基地;SPF级昆明种雄性小鼠,4周龄,体重25~30 g,泰山医学院,许可证号SCXK(鲁)20170023;HHL-5细胞系,山东诺丁生物科技有限公司。
1.2 试剂与仪器
无水乙醇、苯酚,均为分析纯;胎牛血清Gibco,美国Thermo Fisher Scientific公司;RPMI-164 0培养基,Biological Industries公司;ALT、AST、丙二醛(malondialdehyde,MDA)、SOD、GSH、甘油三酯(triglyceride,TG)试剂盒,南京建成生物工程研究所;联苯双酯,北京协和药厂;Infinite2000多功能酶标仪,法国Tecan公司;5415R台式高速冷冻离心机,德国Eppendorf公司;荧光倒置显微镜,日本Olympus公司。
1.3 试验方法
1.3.1 蒲公英提取物的制备
去离子水清洗蒲公英全草,在70 ℃下干燥至恒重,打碎成粉,过40目筛,置于干燥器中备用。取50 g蒲公英全草粉,分别加入500 mL的水和乙醇制成提取液。提取液超声2 h后抽滤、离心取上清液。使用旋转蒸发仪(35 ℃)浓缩至膏状,冷冻干燥得所需样品,置于-80 ℃条件下避光保存。
1.3.2 小鼠肝损伤模型的建立与试验设计
小鼠都被安置在(25±3) ℃、相对湿度50%~60%的环境,每天喂食和饮水。小鼠环境适应7 d后,将其随机分为9组,分别为对照组,损伤组,联苯双酯组,水提物的高、中、低剂量组和醇提物的高、中、低剂量组,每组8只。所有处理组小鼠均进行损伤和给药处理(2次处理间隔12 h),具体处理方式如表1所示,连续灌胃21 d。于最后1次灌胃后,禁食16 h进行器官处理和相关指标的测定[13]:摘除眼球取血、离心(3 500 r/min,10 min,4 ℃)获得血清;摘取肝脏后生理盐水冲洗,按照肝组织与生理盐水1∶9(g∶mL)制备匀浆,离心(4 000 r/min,10 min,4 ℃)后收集上清液进行后续分析;取肝组织左叶浸泡于10%(体积分数)甲醛中,脱水制成石蜡切片,用苏木精-伊红染色,光学显微镜观察。
表1 各组小鼠实验处理
Table 1 Treatment of mice in each group
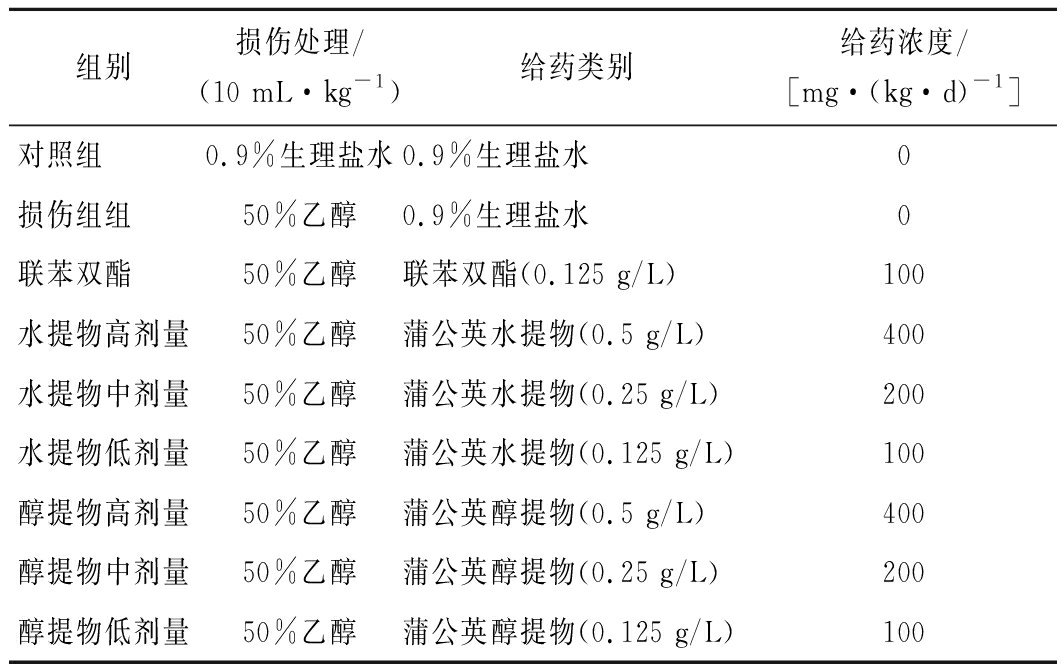
组别损伤处理/(10 mL·kg-1)给药类别给药浓度/[mg·(kg·d)-1]对照组 0.9%生理盐水0.9%生理盐水0损伤组组 50%乙醇0.9%生理盐水0联苯双酯 50%乙醇联苯双酯(0.125 g/L)100水提物高剂量50%乙醇蒲公英水提物(0.5 g/L)400水提物中剂量50%乙醇蒲公英水提物(0.25 g/L)200水提物低剂量50%乙醇蒲公英水提物(0.125 g/L)100醇提物高剂量50%乙醇蒲公英醇提物(0.5 g/L)400醇提物中剂量50%乙醇蒲公英醇提物(0.25 g/L)200醇提物低剂量50%乙醇蒲公英醇提物(0.125 g/L)100
1.3.3 HHL-5肝细胞损伤模型建立与试验设计
消化对数生长期的HHL-5肝细胞并计数,以1×105 个/mL浓度接种于24孔板中,每个孔中加入0.5 mL细胞培养基,置于37 ℃细胞培养箱中培养12 h。除对照组外,其他处理组采用3%乙醇处理15 min[14]进行损伤;对照组和损伤组使用细胞培养基培养,其余各组使用添加提取物的细胞培养基培养(高剂量组提取物终质量浓度为0.5 g/L;中剂量组提取物终质量浓度为0.25 g/L;低剂量组提取物终质量浓度为0.125 g/L),培养24 h后,收集细胞培养液离心得上清液用于测定AST、ALT。用4 ℃的PBS冲洗24孔板后加入0.5 mL 1%(体积分数) Triton-X 100细胞裂解液,充分吹打混匀,收集细胞裂解液,离心(4 000 r/min,10 min,4 ℃)取上清液测定SOD、MDA、GSH含量。
1.3.4 生化指标检测
参考邢佳等[15]的方法,分别测定9组小鼠血清和细胞上清液中AST、ALT、TG,肝脏组织和细胞中MDA、SOD、GSH等指标。
1.3.5 体外抗氧化试验
分别配制质量浓度为0.125、0.25、0.5、1、2、3、4、5 g/L的蒲公英全粉的水提取液和乙醇提取液,测定上述提取液的DPPH自由基清除能力[16],羟自由基清除能力[17]和ABTS阳离子自由基清除能力[18]。
1.4 试验结果统计分析
采用Origin 7.5软件分析细胞内抗氧化指标和体外自由基清除能力的相关关系;采用单因素方差分析法分析处理组间显著性差异,采用一般线性模型分析不同提取方式(水、醇提取)的差异,显著性水平为P<0.05。
2 结果与分析
2.1 蒲公英提取物对酒精性肝损伤小鼠血清中ALT、AST、TG含量和肝比重的影响
不同蒲公英提取物对小鼠血清中AST、ALT、TG含量和肝比重的影响如图1所示。与对照组相比,损伤组小鼠血清中的AST、ALT、TG含量和肝比重均显著增高(P<0.05),说明酒精性肝损伤模型建模成功。水提物和醇提物的中、高剂量处理组与联苯双酯组处理的ALT含量无显著性差异(图1-a);水提物和醇提物的高剂量组与联苯双酯处理组的AST含量无显著性差异,表明2种提取物高剂量组可以有效保护线粒体(图1-b)。上述结果表明蒲公英水、醇提物的高剂量组均能有效地保护细胞膜完整性(P<0.05)。低剂量和中剂量的水提物能够有效维持细胞膜完整性,对线粒体的保护作用不显著。从图1-c可以看出,蒲公英水、醇提取物高剂量处理均能有效降低小鼠血液中TG含量;从肝比重的角度来看(图1-d),水提取物的全部剂量组和醇提物的高剂量组能有效降低肝比重(P<0.05)。此外,蒲公英的水、醇提物对血液中的AST、ALT和TG含量的影响有显著性差异(P<0.05)。AST、ALT存在于肝细胞线粒体[19]和细胞质[15]中,过量的酒精进入机体后,会引起细胞质中自由基增加和氧化应激反应,引起线粒体和细胞膜损伤,通透性增加,血清中含量升高。高浓度的蒲公英提取物能显著降低血清中AST、ALT含量,低浓度的提取物作用效果不明显,说明高浓度的蒲公英提取物可能会与细胞质中自由基反应,或是参与细胞通路的调节;而低浓度的提取物清除自由基能力较低,或调节能力相对不足,无法起到有效保护作用。当使用中浓度的提取物处理肝脏时,提取物中功能组分均可与细胞质中氧自由基,氧化应激反应通路Nrf-2[20],抗凋亡通路Bcl-2/Bax[21],以及炎症通路TLR4/NF-κB[22]发生作用,减少炎症因子释放、调节信号通路;而线粒体膜与细胞膜所处的微环境不同,受损伤程度,细胞因子、反应通路作用,和提取物调节程度也不同,宏观上表现出中等浓度提取物能够保持细胞膜完整性,但对线粒体膜保护作用不明显。综合上述结果,细胞蒲公英水、醇提取物的高剂量组能有效保护小鼠肝细胞,蒲公英水提物在维持生物膜完整性、降低血液中甘油三脂含量等方面均优于醇提物。

a-ALT变化;b-AST变化;c-TG变化;d-肝比变化
图1 蒲公英提取物对酒精性肝损伤小鼠血清中ALT、AST、TG和肝比重的影响
Fig.1 Effects of dandelion extract on ALT, AST, TG and liver specific gravity in alcoholic liver injury mice
注:图中*代表具有显著性差异(P<0.05)(下同)
2.2 蒲公英提取物对酒精性肝损伤小鼠肝脏中SOD、GSH、MDA活力的影响
酒精会导致机体活性氧(reactive oxygen species,ROS)等自由基含量增加,使非酶性抗氧化物含量降低和内源性抗氧化酶(如SOD等)活性显著降低,进而损伤肝脏[23]。从图2可以看出,损伤组小鼠肝脏GSH、MDA、SOD活性较对照组活性显著变化,联苯双酯处理组能有效保护肝脏(P<0.05)。具体来说,水提物各剂量和醇提物高剂量处理组均能显著提高GSH(图2-a)和SOD(图2-b)的含量,仅水提物的高剂量组能有效降低MDA的含量(P<0.05),醇提物作用效果不显著(图2-c)。综合上述结果,水提物不同剂量组均能有效减轻细胞氧化损伤,醇提取高剂量组对SOD和GSH等酶活有显著地保护作用,但对细胞中的MDA含量没有影响;2种提取方式在细胞中MDA含量和抗氧化指标等方面存在显著性的差异。
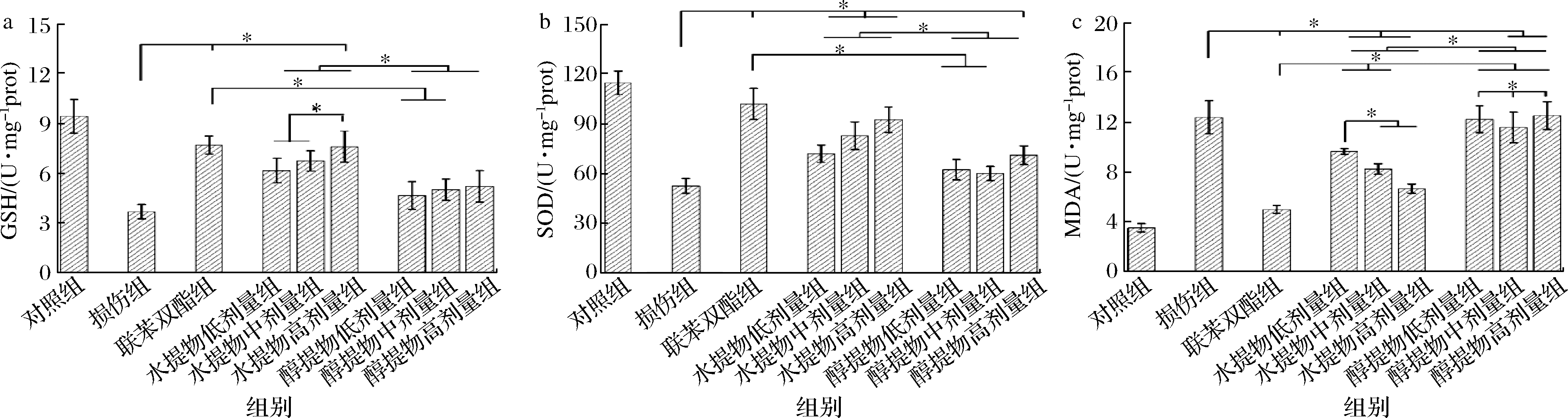
a-GSH变化;b-SOD变化;c-MDA变化
图2 蒲公英提取物对酒精性肝损伤小鼠肝脏中SOD、GSH、MDA活力的影响
Fig.2 Effects of dandelion extract on SOD, GSH and MDA activity in liver of mice with alcoholic liver injury
2.3 肝损伤病理切片分析
如图3所示,对照组(图3-a)肝细排列整齐,细胞分布规律,形态正常,有明显边界,细胞核大小合适且呈圆状,未见异常。损伤组(图3-b)细胞排布散乱,细胞边界不清晰且间隙大小无规律,部分细胞质中出现脂肪,有些细胞核不明显,肝细胞出现变性。联苯双酯组(图3-c)和各提取物组(水提物组:图3-d~图3-f;醇提物组图3-g~图3-i)可以改善酒精损伤肝细胞的程度,细胞排列较为整齐,细胞质中脂肪减少,细胞核较为规整。各提取物高剂量组改善程度好于中低剂量组,水提物组优于醇提物组。

a-对照组;b-损伤组;c-联苯双酯组;d-水提物高剂量组;
e-水提物中剂量组;f-水提物低剂量组;g-醇提物高剂量组;
h-醇提物中剂量组;i-醇提物低剂量组
图3 肝脏组织病理学切片(×200)
Fig.3 Histological observation of liver tissue (×200)
2.4 蒲公英提取物对酒精损伤肝细胞HHL-5中ALT、AST、GSH和SOD的影响
不同蒲公英提取物对酒精损伤肝细胞HHL-5中ALT、AST、GSH和SOD含量的影响结果如图4所示。与对照组相比,损伤组ALT、AST、GSH和SOD含量均发生显著变化(P<0.05),说明酒精损伤肝细胞模型建立成功;与损伤组相比,联苯双酯组和蒲公英水、醇提物均能有效地减轻肝细胞损伤。具体来说,水提物高剂量组能有效降低AST含量(图4-b);与小鼠血清中AST含量变化不同,蒲公英水、醇提物高剂量组均不能有效降低肝细胞中ALT含量(图4-a),2种提取方法对HHL-5肝细胞SOD含量没有影响(图4-d),但其高剂量组能有效提高肝细胞中GSH含量(图4-c)[24]。
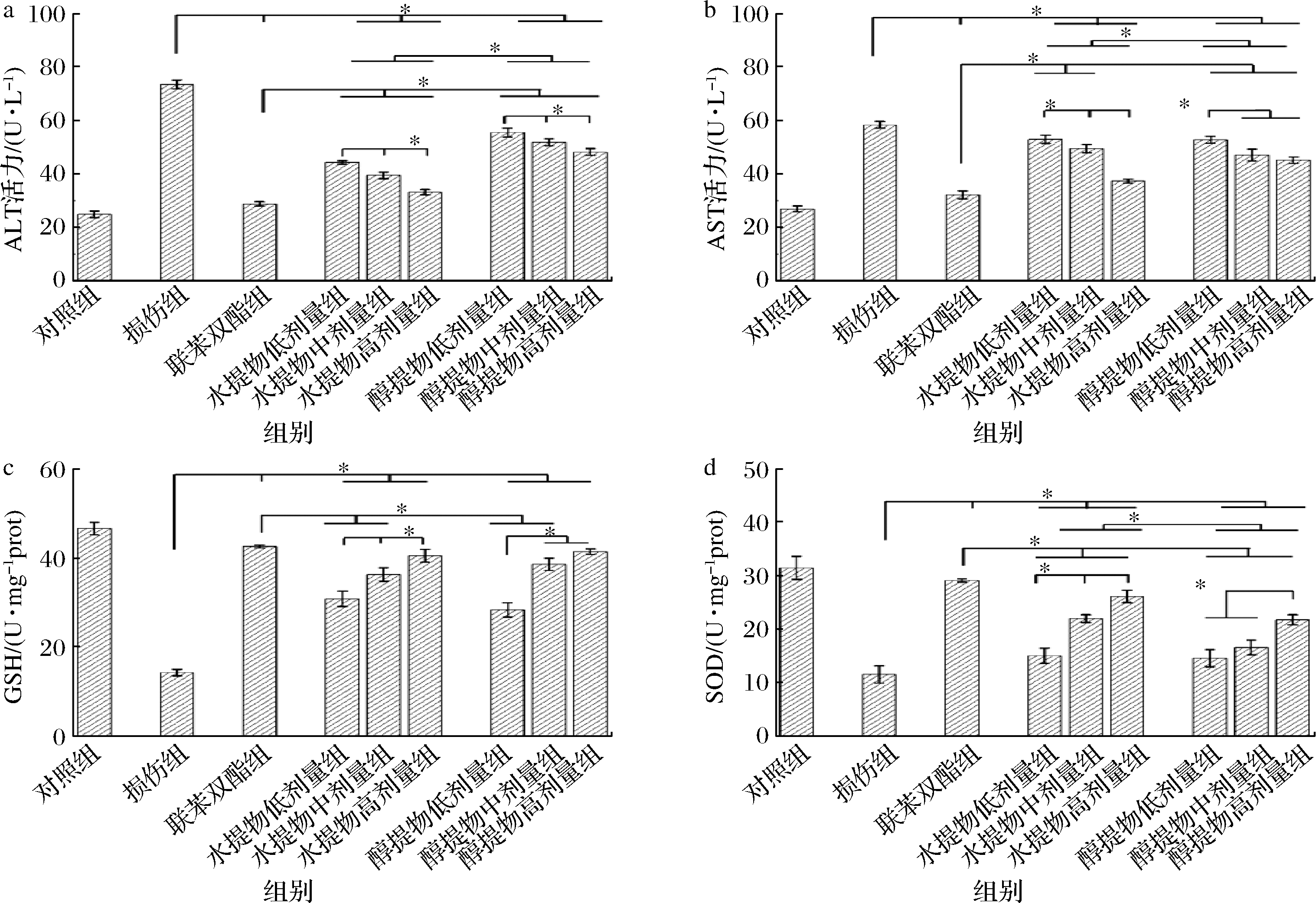
a-ALT变化;b-AST变化;c-GSH变化;d-SOD变化
图4 蒲公英提取物对酒精损伤肝细胞HHL-5中ALT、AST、SOD和GSH的影响
Fig.4 Effects of dandelion extract on serum ALT, AST, SOD and GSH in alcoholic liver injury mice
2.5 不同蒲公英提取物保护作用与抗氧化能力相关性分析
蒲公英提取物的DPPH自由基、羟自由基、ABST阳离子自由基清除能力结果如表2所示。在0~2.0 g/L,水、醇提取物均具有较强的DPPH自由基清除能力,其清除能力随着添加量的增加而增加;与DPPH自由基清除结果类似,2种提取物均具有较强的羟自由基、ABTS阳离子自由基清除能力。采用一般线性模型对不同提取物自由基清除结果进行分析,蒲公英全粉水提物体外自由基清除能力优于醇提物,且不同浓度处理结果均具有显著性的差异(P<0.05)。
表2 蒲公英提取物自由基清除能力
Table 2 Free radical scavenging capacity of dandelion extract
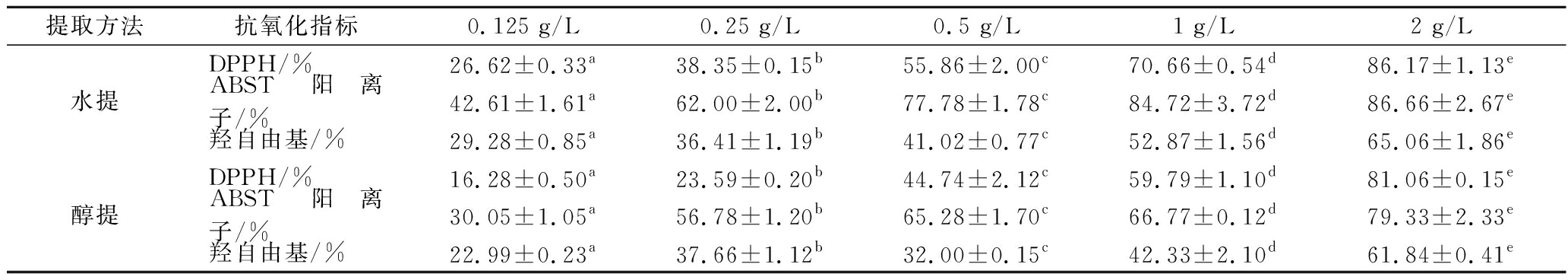
提取方法抗氧化指标0.125 g/L0.25 g/L0.5 g/L1 g/L2 g/LDPPH/%26.62±0.33a38.35±0.15b55.86±2.00c70.66±0.54d86.17±1.13e水提ABST阳离子/%42.61±1.61a62.00±2.00b77.78±1.78c84.72±3.72d86.66±2.67e羟自由基/%29.28±0.85a36.41±1.19b41.02±0.77c52.87±1.56d65.06±1.86eDPPH/%16.28±0.50a23.59±0.20b44.74±2.12c59.79±1.10d81.06±0.15e醇提ABST阳离子/%30.05±1.05a56.78±1.20b65.28±1.70c66.77±0.12d79.33±2.33e羟自由基/%22.99±0.23a37.66±1.12b32.00±0.15c42.33±2.10d61.84±0.41e
注:表中不同小字母代表具有显著性差异(P<0.05)
为了进一步探究蒲公英抗氧化能力与细胞损伤指标的相关关系,对相同浓度的蒲公英提取物体外抗氧化剂值和小鼠细胞损伤相关指标进行相关分析,结果如表3所示。蒲公英水、醇提物的体外抗氧化能力与细胞中SOD活性和GSH含量均呈现出较高地相关性(R>0.82)。上述结果进一步证实了蒲公英提取物中抗氧化组分是保护肝细胞的重要基础[25]。
表3 蒲公英水提物和醇提物的自由基清除能力与胞内细胞损伤指标的相关性分析
Table 3 Correlation analysis of radical scavenging capacity and related indexes in water extractand ethanol extract
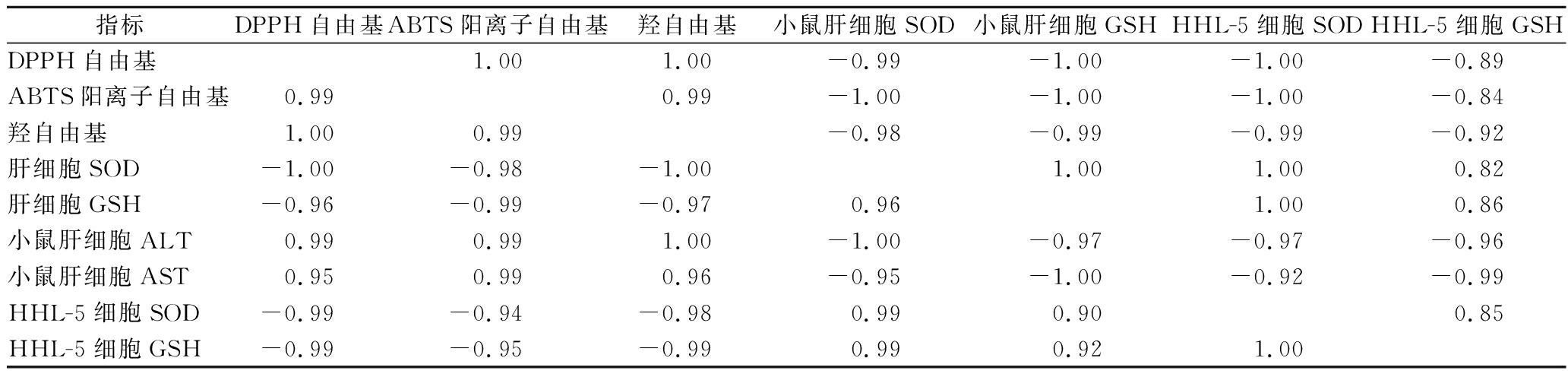
指标DPPH自由基ABTS阳离子自由基羟自由基小鼠肝细胞SOD小鼠肝细胞GSHHHL-5细胞SODHHL-5细胞GSHDPPH自由基1.001.00-0.99-1.00-1.00-0.89ABTS阳离子自由基0.990.99-1.00-1.00-1.00-0.84羟自由基1.000.99-0.98-0.99-0.99-0.92肝细胞SOD-1.00-0.98-1.001.001.000.82肝细胞GSH-0.96-0.99-0.970.961.000.86小鼠肝细胞ALT0.990.991.00-1.00-0.97-0.97-0.96小鼠肝细胞AST0.950.990.96-0.95-1.00-0.92-0.99HHL-5细胞SOD-0.99-0.94-0.980.990.900.85HHL-5细胞GSH-0.99-0.95-0.990.990.921.00
3 结论
动物和细胞实验表明,高剂量的蒲公英水提物、醇提物对酒精诱导的肝损伤均具有保护作用,减轻肝细胞膜和线粒体膜损伤程度,提高肝脏中SOD、GSH等抗氧化酶的水平,降低MDA的含量;与醇提物相比,水提物的作用剂量更低,保护作用更好;体外抗氧化能力及相关性分析表明,水提物和醇提物都具有很强的自由基清除能力,与胞内抗氧化能力呈正相关性,水提物抗氧化效果更好。
蒲公英提取物保肝效果与其抗氧化作用有关,水提物与醇提物中多糖、多酚等主要活性物质含量不同,水提物中比醇提物含有更多的抗氧化活性物质,可能是水提物保肝作用效果好的重要原因,蒲公英中主要保肝物质成分及其是否有协同作用需进一步研究阐明。
[1] YANG Y, JI J, DI L Q, et al.Resource, chemical structure and activity of natural polysaccharides against alcoholic liver damages[J].Carbohydrate Polymers, 2020, 241:116 355.
[2] LEUNG T M, NIETO N.CYP2E1 and oxidant stress in alcoholic and non-alcoholic fatty liver disease[J].Journal of Hepatology, 2013, 58(2):395-398.
[3] WANG F S, FAN J G, ZHANG Z, et al.The global burden of liver disease:the major impact of china[J].Hepatology, 2014, 60(6):2 099-2 108.
[4] MENG X, LI Y, LI S, et al.Natural products for prevention and treatment of chemical-induced liver injuries[J].Comprehensive Reviews in Food Science and Food Safety, 2018, 17(2):472-495.
[5] ZENG T, XIE K Q.Ethanol and liver:Recent advances in the mechanisms of ethanol-induced hepatosteatosis[J].Archives of Toxicology, 2009, 83(12):1 075-1 081.
[6] 董晋钢, 董晋瑛.美他多辛联合硫普罗宁治疗酒精性肝病的疗效观察[J].中国药房, 2017, 28(8):1 091-1 094.
DONG J G, DONG J Y.Efficacy observation of metadoxine combined with tiopronin in the treatment of alcoholic liver disease[J].China Pharmacy, 2017, 28(8):1 091-1 094.
[7] WU T, SHEN M Y, GUO X M, et al.Cyclocarya paliurus polysaccharide alleviates liver inflammation in mice via beneficial regulation of gut microbiota and TLR4/MAPK signaling pathways[J].International Journal of Biological Macromolecules, 2020, 160:164-174.
[8] QU H, GAO X, CHENG C L, et al.Hepatoprotection mechanism against alcohol-induced liver injury in vivo and structural characterization of Pinus koraiensis pine nut polysaccharide[J].International Journal of Biological Macromolecules, 2020, 154:1 007-1 021.
[9] 夏炎, 管晓辉, 崔艳艳, 等.蒲公英糖蛋白体外抗炎作用及对NF-κB信号通路的调控[J].食品科学, 2017, 38(19):182-188.
XIA Y, GUAN X H, CUI Y Y, et al.Inhibitory effect of Taraxacum glycoprotein on lipopolysaccharide-induced inflammation via regulating NF-κB pathway[J].Food Science, 2017, 38(19):182-188.
[10] 朱坤, 丁米娜, 杨洋, 等.蒲公英萜醇对人乳腺癌细胞MCF-7增殖及凋亡的影响[J].食品科学, 2018, 39(17):140-144.
ZHU K, DING M N, YANG Y, et al.Effect of taraxerol on the proliferation and apoptosis of MCF-7 human breast cancer cells[J].Food Science, 2018, 39(17):140-144.
[11] REN Y S, ZHENG Y,DUAN H,et al.Dandelion polyphenols protect against acetaminophen-induced hepatotoxicity in mice via activation of the Nrf-2/HO-1 pathway and inhibition of the JNK signaling pathway[J].Chinese Journal of Natural Medicines, 2020, 18(2):103-113.
[12] 李春兰, 赵亮.蒲公英多糖对四氯化碳肝损伤小鼠的保护作用[J].中国实用神经疾病杂志, 2010, 13(17):33-35.
LI C L, ZHAO L.Protective effect of dandelion polysaccharide on liver injury of mice with carbon tetrachloride[J].Chinese Journal of Practical Nervous Diseases, 2010, 13(17):33-35.
[13] WANG C X, ZHENG L Y, LIU S N, et al.A novel acidic polysaccharide from the residue of Panax notoginseng and its hepatoprotective effect on alcoholic liver damage in mice[J].International Journal of Biological Macromolecules, 2020, 149:1 084-1 097.
[14] 刘雪姣. 玉米低聚肽保肝作用的研究[D].镇江:江苏大学, 2016.
LIU X J.Study of corn oligopeptide on hepatoprotective effect[D].Zhenjiang:Jiangsu University, 2016.
[15] 邢佳, 陆文娟, 赵云霞, 等.石榴叶多酚对小鼠急性酒精性肝损伤的保护作用[J].食品科学, 2015, 36(21):253-257.
XING J, LU W J, ZHAO Y X, et al.Protective effect of polyphenols from Punica granatum L.leaves against alcohol-induced acute hepatic injury in mice[J].Food Science, 2015, 36(21):253-257.
[16] CAI L L, ZOU S S, LIANG D P, et al.Structural characterization, antioxidant and hepatoprotective activities of polysaccharides from Sophorae tonkinensis Radix[J].Carbohydrate Polymers, 2018, 184:354-365.
[17] TANG Z Z, ZHOU C X, CAI Y, et al.Purification, characterization and antioxidant activities in vitro of polysaccharides from Amaranthus hybridus L.[J].PeerJ, 2020, 8(24):e9 077.
[18] LIU X G, BIAN J, LI D Q, et al.Structural features, antioxidant and acetylcholinesterase inhibitory activities of polysaccharides from stem of Physalis alkekengi L[J].Industrial Crops and Products, 2019, 129:654-661.
[19] MA X W, MCKEEN T, ZHANG J H, et al.Role and mechanisms of mitophagy in liver diseases[J].Cells, 2020, 9(4):837.
[20] XIA T, ZHANG J, YAO J H, et al.Shanxi aged vinegar protects against alcohol-induced liver injury via activating Nrf2-mediated antioxidant and inhibiting TLR4-Induced inflammatory response[J].Nutrients, 2018, 10(7):805.
[21] KUMARI A, KAKKAR P.Lupeol prevents acetaminophen-induced in vivo hepatotoxicity by altering the Bax/Bcl-2 and oxidative stress-mediated mitochondrial signaling cascade[J].Life Sciences, 2012, 90(15-16):561-570.
[22] HAN J, LIU L X, YU N, et al.Polysaccharides from Acanthopanax senticosus enhances intestinal integrity through inhibiting TLR4/NF-κB signaling pathways in lipopolysaccharide-challenged mice[J].Animal Science Journal, 2016, 87(8):1 011-1 018.
[23] ZHOU X, DENG Q F, CHEN H G, et al.Characterizations and hepatoprotective effect of polysaccharides from Mori Fructus in rats with alcoholic-induced liver injury[J].International Journal of Biological Macromolecules, 2017, 102:60-67.
[24] 曲航, 高鑫, 伊娟娟, 等.食源性天然产物对酒精性肝损伤的防护作用研究进展[J].食品科学, 2020, 41(17):283-290.
QU H, GAO X, YI J J, et al.Review on the protective effects of food-derived natural compounds on alcohol-induced liver injury[J].Food Science, 2020, 41(17):283-290.
[25] GRAUSO L, EMRICK S, FALCO B D, et al.Common dandelion:A review of its botanical, phytochemical and pharmacological profiles[J].Phytochemistry Reviews, 2019, 18(4):1 115-1 132.