牛血清白蛋白(bovine serum albumin,BSA)是一种血浆蛋白,具有维持渗透压、可作为载体等作用[1]。特别是其传递营养物质的作用,近年来受到广泛关注。但受到其自身结构性能(如乳化性、乳化稳定性、起泡性等)的影响,由其制备成的载体不稳定,易发生相分离[2]。而研究改性的BSA,对于改善其功能性质,开发新的应用途径有着非常重要的意义。
目前,研究发现美拉德反应能够改善蛋白质的功能特性,且由多糖-蛋白形成的共聚物制备的乳浊液稳定性良好[3]。美拉德反应是糖分子中还原末端羰基与蛋白质分子中的氨基酸残基侧链上的ε-氨基进行的接枝反应,是一种绿色、安全、无污染的蛋白质改性方法[4]。通过美拉德反应接枝多糖后的蛋白质在pH稳定性、乳化性、起泡性和热稳定性等方面都有明显改善[5-7]。改性后的蛋白质不仅可以应用于食品的功能成分、添加剂,还可以对不稳定的生物活性进行包埋和运输[8-9]。MENGIBAR等[10]发现乳球蛋白-壳聚糖美拉德共聚物可提高乳液体系的氧化稳定性和物理稳定性;YANG等[11]研究表明大豆蛋白-多糖共聚物可提高整个乳液体系的储存稳定性;CHENG等[12]研究得出葡聚糖(dextran,DEX)的接枝可提高大米蛋白的乳化性与乳化稳定性;WANG等[13]的研究表明BSA-DEX共聚物包埋姜黄素可改善其储藏稳定性及抗氧化活性。由此可见,接枝反应改性的蛋白已经在食品中的挥发性成分(包括精油)、辛香料及生物活性物质的包埋中发挥举足轻重的作用[14]。但是,DEX的分子质量对于接枝产物的性质也会产生影响。
目前,对于多糖分子质量是否会影响其共聚物的理化性质及稳定性鲜有报道,这就使得改性糖蛋白的应用受到环境、条件和应用领域的制约。本研究通过BSA-DEX共聚物中蛋白质分子质量、结构,乳化性及乳化稳定性、起泡及泡沫稳定性等方面的测定,分析DEX分子质量对BSA-DEX共聚物理化性质的影响。
1 材料与方法
1.1 材料与仪器
牛血清白蛋白Ⅴ(分子质量68 kDa),Solarbio公司;4种葡聚糖(分子质量分别为1 k、5 k、70 k、100 kDa),MACKLIN公司;三羟甲基氨基甲烷,中奥天元公司;考马斯亮蓝R-250,Beyotime公司;1-苯胺基-8苯磺酸(1-anilino-8-napthalene sulfonic acid,ANS),Sigma Aldrich公司;邻苯二甲醛(o-phthalaldehyde,OPA)、SDS,其他试剂均为国产分析纯。
FD-5N型真空冷冻干燥机,日本EYELA公司;紫外可见分光光度计、Seven Excellence pH计,瑞士METTLER公司;T10basic ULTRA-TURRAX小型分散机,德国IKA公司;SE 260型垂直电泳系统,美国Hoefer公司;NanoPhotometer-N50型超微量紫外分光光度计,德国IMPLEN公司;Essential V6型凝胶成像系统,英国uvitec公司;FL970荧光分光光度计,香港Techcomp公司。
1.2 试验方法
1.2.1 BSA-DEX共聚物的制备
参考TU等[15]的方法并做调整:将DEX与BSA以1∶1的质量比溶解在PBS中(0.01 mol/L,pH 7.0),调节蛋白溶液的最终质量浓度为10.00 mg/mL,室温下搅拌至完全溶解,冻干,冻干的样品密封后置于温度60 ℃,湿度79%的密闭环境中反应24 h。设置参数为:对照组BSA为未添加DEX;BSA与分子质量分别为1 k、5 k、70 k、100 kDa的DEX所得共聚物分别命名为BDC 1、BDC 5、BDC 70和BDC 100。
1.2.2 SDS-PAGE
参照FAN等[16]的方法。分离胶10%、浓缩胶4%、蛋白质质量浓度5 mg/mL,上样量7.0 μL,电压200 V、电泳时间50 min左右。
1.2.3 傅里叶红外光谱
傅里叶红外光谱(Fourier transform infrared spectrometer,FTIR)参照 ZHAO 等[17]的方法。称取适量样品[m(样品)∶m(溴化钾)=1∶100],研磨成均匀的粉末并压成薄片,用傅里叶变换红外谱仪作全波段(4 000~400 cm-1)扫描,扫描16次,扫描前用溴化钾薄片扣除背景。
1.2.4 接枝度的测定
参考FENG等[18]的方法。准确称取40.00 mg的OPA,溶解在1.0 mL的甲醇中,然后依次加入2.5 mL的SDS(20%,质量分数),25 mL的四硼酸钠(0.1 mol/L),100 μL的β-巯基乙醇,最后用蒸馏水定容至50 mL。测定样品时,取4.0 mL的OPA溶液,加200 μL的样品混合均匀,置于35 ℃的水浴中反应2 min,在波长340 nm下测吸光度值A。空白对照加入200 μL蒸馏水代替样品。按照上述方法用赖氨酸代替样品绘制赖氨酸标准曲线。根据该曲线,计算样品中游离氨基的含量,并根据公式(1)测定样品的接枝度:
接枝度![]()
(1)
式中:c0,接枝反应前溶液中自由氨基的浓度,mol/L;c1,接枝反应后溶液中自由氨基的浓度,mol/L。
1.2.5 表面疏水性的测定
参考XUE等[19]的方法,20.0 μL ANS溶液(8 mmol/L)和5.0 mL不同质量浓度蛋白溶液(0.01~0.05 mg/mL)均匀混合,在室温下反应1.0 min后,测定其荧光强度。测定条件:激发波长(EX)和发射波长(EM)分别为280和490 nm,以上述不同浓度的蛋白溶液(0.01~0.05 mg/mL)为空白。以蛋白质质量浓度为横坐标,荧光强度为纵坐标作图,直线斜率即是蛋白质表面疏水性指数。
1.2.6 荧光光谱的测定
按照YAN等[20]的方法测定样品的内源性荧光。调节蛋白终质量浓度为0.02 mg/mL,激发波长280 nm,扫描波段310~450 nm,狭缝宽度5 nm,扫描速率2 400 nm/min。
1.2.7 美拉德反应褐变程度的测定
褐变程度的测定参照DJELLOULI等[21]的方法。调节蛋白质量浓度为5.00 mg/mL,以不加蛋白样品的PBS为空白样,在420 nm下测定吸光度值,即表示共聚物蛋白的褐变程度。
1.2.8 色差的测定
采用SANMARTIN等[22]的方法,稍作调整。采用色差仪对样品的色泽进行测定,颜色参数L*、a*、b*值分别表示亮度值、黄绿值和红蓝值。
1.2.9 乳化性及乳化稳定性的测定
蛋白的乳化活性(emulsion activity index,EAI)和乳化稳定性(emulsion stability index,ESI)的测定分别参照崔珊珊[23]和CHEN[24]的方法测定。配制蛋白溶液至终质量浓度为1.0 mg/mL,并以体积比3∶1加入玉米胚油,用均质头均质(转速16 000 r/min)1 min后,立即从底部抽取100 μL溶液,并加入5.0 mL SDS溶液(0.1%、pH 7.0),混合后再混合均匀,测定500 nm波长下的吸光度记为A0,20 min后,重复之前操作,测定吸光度,记为A20。乳化性和乳化稳定性计算分别如公式(2)(3)所示:
乳化性![]()
(2)
乳化稳定性![]()
(3)
式中:φ,油相体积分数(油的体积/乳化体系的体积,1/3);ρ,蛋白质质量浓度,g/L;A0和A20为乳化体系分别在0、20 min时的吸光度;N为稀释倍数,此处的稀释倍数为50。
1.2.10 起泡性与泡沫稳定性
蛋白质的起泡性和泡沫稳定性的测定参照付本宁[25]的方法测定。统一调节共聚物蛋白质溶液的终质量浓度为3.0 mg/mL,记录起始溶液体积为V0,在均质机中,以10 000 r/min均质2 min,测量蛋白质溶液和泡沫的总体积,计为V1,30 min后,再次测量蛋白溶液和泡沫的总体积,计为V2。
起泡性、泡沫稳定性计算分别如公式(4)和公式(5)所示:
起泡性![]()
(4)
泡沫稳定性![]()
(5)
式中:h0,初始时的液面高度,cm;h1,均质后的液面高度,cm;h2,静置30 min后的液面高度,cm。
1.2.11 流变性的测定
根据FILONZI等[26]的方法,检测参数:温度25 ℃,cp50锥板,样品板与测试板之间的距离0.8 mm,剪切速率扫描范围0~100 s-1。操作步骤如下:在测试板上滴入2 mL的乳液,保证顶板与样品液接触,擦去平板周围多余的溶液,启动程序,采集数据。
1.2.12 统计分析
每组实验重复3次,每次实验测定3个平行样,数据作图使用Origin 8.1软件,显著性分析使用SPSS 22.0进行处理(P<0.05)。
2 结果与分析
2.1 SDS-PAGE
采用SDS-PAGE 法测定BSA-DEX共聚物的分子质量,结果如图1所示。BSA的分子质量分布于67.2 kDa,与ANTHONY-REGNITZ[27]用电喷雾电离质谱测得的结果(66.4 kDa)相一致;对照 BSA的分子质量条带没有发生变化,这说明干热处理对BSA不产生影响,BSA-DEX共聚物分子质量有明显的增加。BDC 1的条带显示原BSA条带消失,共聚物BDC 1的分子质量集中分布在77.4 k~95.1 kDa,没有较大分子质量的共聚蛋白条带,这可能是因为1 kDa分子质量的DEX有较小的空间位阻,更易与BSA发生反应,但由于BSA含量较少,不足以与1 kDa的DEX完全发生反应[28];BDC 5的条带分布在77.4 k~274.4 kDa,出现微弱的漫散射现象。而BDC 70与BDC 100的分子质量分布在68 k~261 kDa,68 kDa处的BSA条带依旧清晰。

图1 SDS-PAGE图谱
Fig.1 Band diagram of SDS-PAGE
2.2 傅里叶红外光谱测定
FTIR可以衡量物质分子中官能团或化学键的存在或变化,进行物质定性分析[29]。用FTIR对蛋白质-多糖共聚物进行定性分析。由图2可知,3 307 cm-1处的谱带表示为BSA的酰胺A(NH延伸并结合氢键)。与BSA相比,BDC分别在3 300~3 430 cm-1和1 000~1 280 cm-1波长范围内出现强吸收峰,是由C—O—C 糖苷键的伸缩振动和游离—OH 的伸缩振动产生的[30],这说明多糖以共价键的形式与蛋白质形成了共聚复合物。此外,BSA-DEX共聚物在酰胺Ⅰ(1 689 cm-1)和酰胺Ⅲ(1 409 cm-1)处的吸收峰增强,这是因为美拉德反应消耗了一些羰基和氨基,并生成了Amadori化合物(C![]() O),席夫碱(C
O),席夫碱(C![]() N)和吡嗪(C—N),而导致了峰强度和位置的改变。在大豆分离蛋白与羧甲基纤维素接枝反应的研究中也发现了相似的现象[31]。这些变化都可以说明多糖的共价使BSA的结构发生了改变。
N)和吡嗪(C—N),而导致了峰强度和位置的改变。在大豆分离蛋白与羧甲基纤维素接枝反应的研究中也发现了相似的现象[31]。这些变化都可以说明多糖的共价使BSA的结构发生了改变。
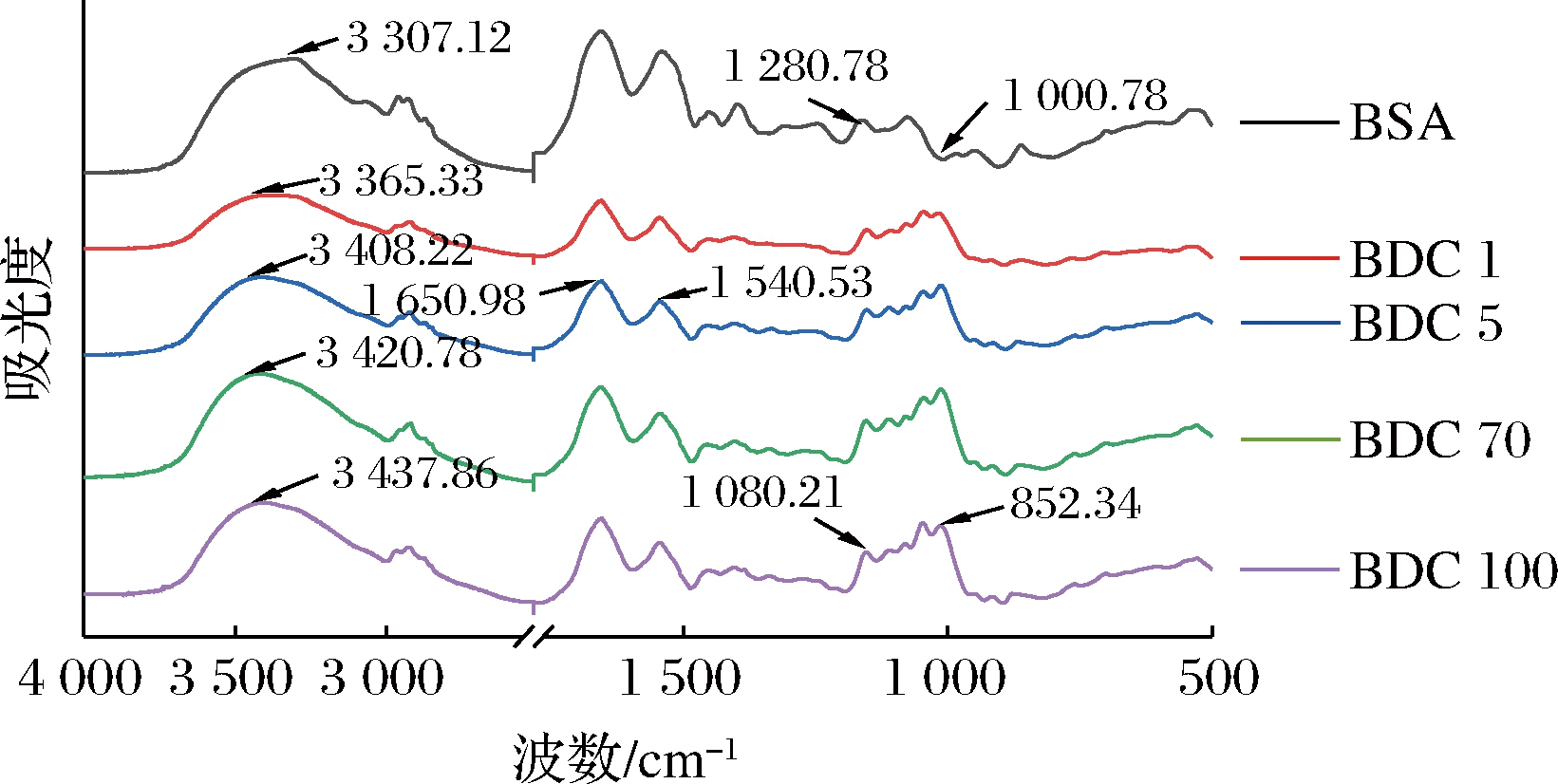
图2 BSA-DEX共聚物的红外光谱图
Fig.2 Infrared spectrum of BSA-DEX conjugates
2.3 接枝度与表面疏水性
如表1所示,不同分子质量的DEX都能与BSA发生接枝反应,接枝度具有显著的差异。其中BDC 5的接枝度最大,其次是BDC 1,BDC 70和BDC 100的接枝度依次减少。这是因为随着分子质量的增加,空间位阻也会增加,因此不利于反应基团的相互接触,从而抑制了反应的进行[32];相反,分子质量小,空间位阻降低,BSA更易与其发生反应,这时蛋白质的分子量则是影响接枝度的关键。分子质量1 kDa的DEX更易与BSA发生反应,但由于BSA的量不足以与DEX完全反应,因此导致接枝度小于BDC 5。
表1 BSA-DEX共聚物的接枝度与表面疏水性
Table 1 Grafting degree and surface hydrophobicity of BSA-DEX conjugates
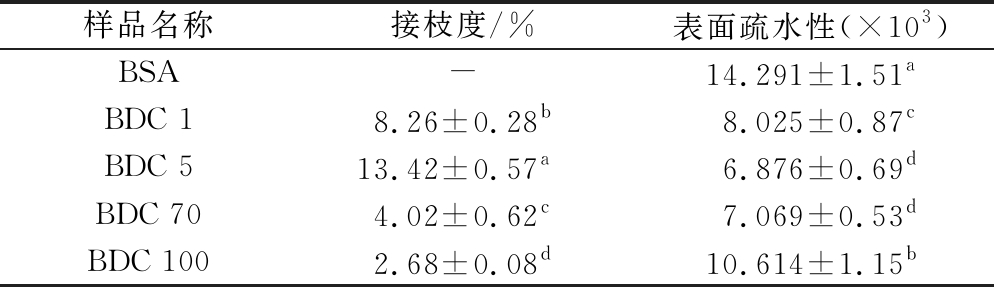
注:不同的小写字母代表差异显著性(P<0.05)(下同)
样品名称接枝度/%表面疏水性(×103)BSA-14.291±1.51aBDC 18.26±0.28b8.025±0.87cBDC 513.42±0.57a6.876±0.69dBDC 704.02±0.62c7.069±0.53dBDC 1002.68±0.08d10.614±1.15b
在蛋白质的三级结构中,非极性基团即疏水基团转向分子内部形成疏水键,极性基团即亲水基团或者转向分子内部相互作用形成氢键,或者转向分子表面与极性水分子相互作用[33]。由表1中共聚物的表面疏水性可知,BSA发生接枝反应后形成的共聚物表面疏水性发生不同程度的下降,接枝度越大,下降程度越明显。当BSA与强亲水性的DEX发生接枝反应时,蛋白质的肽链中的亲水基团增加,蛋白质表面的亲水性增强;另一方面蛋白质结构发生伸展,使得蛋白质分子内部的极性基团暴露,从而疏水性降低[34]。蛋白质接入的糖链越多,接枝度越大,其亲水性越强,表面疏水性就越小。
2.4 荧光强度
含芳香族氨基酸残基(即色氨酸、酪氨酸和苯丙氨酸)的蛋白质在280或295 nm的激发光下会产生内源性荧光。其中色氨酸的荧光峰位波长位于348 nm,荧光强度也是最大,因而也是研究蛋白质的结构是否发生变化的主要的内源探针。BSA的一级序列中含有2个色氨酸残基:一个位于疏水区域,另一个位于亲水区域的表面[35]。图3表示 BSA与DEX形成共聚物后的荧光强度,其中BSA的荧光强度最大,BSA与DEX共聚物荧光强度发生不同程度的降低,BDC 5的荧光强度降低最为明显,且接枝度越高,荧光强度的降低越明显。这是因为接枝反应后,多糖对蛋白质本身含有的色氨酸残基形成掩蔽作用,从而引起了最大荧光强度的降低。SUN等[36]在对卵清蛋白与多糖的接枝反应研究中发现共聚物的荧光强度的降低;赵城彬[33]研究发现接枝度越大,DEX与玉米醇溶蛋白共聚物的荧光强度降低越明显。这与本文的研究结果相对应。

图3 BSA-DEX共聚物的荧光强度
Fig.3 Fluorescence intensity of BSA-DEX conjugates
BSA-DEX共聚物的最大荧光强度所对应的波长见表2,BSA与 DEX 形成共聚物的 λmax相比于BSA都发生了偏移,其中,BDC 5的偏移现象最为明显,结合接枝度结果可以发现,BDC 5的接枝度最高。这说明BSA与 DEX发生接枝反应后,会引起蛋白质的三级结构发生改变。SPOTTI等[37]在乳清蛋白-葡聚糖接枝物的荧光光谱分析中发现,共价接枝后 λmax发生红移,接枝度越大,偏移现象越明显。
表2 BSA-DEX共聚物的最大荧光强度及对应的波长
Table 2 Maximum fluorescence intensity and corresponding wavelength of BSA-DEX conjugates

样品波长(λmax)/nm 荧光强度BSA340.2±0.118 357±25BDC 1343.7±0.212 485±16BDC 5345.3±0.16 065±21BDC 70342.5±0.315 628±17BDC 100341.3±0.117 468±2
2.5 色差和褐变程度
在接枝反应期间,蛋白质和多糖会因为美拉德反应形成褐色复合物,可通过测定色度分析样品的色泽变化和褐变程度。由表3可知,与BSA相比,BSA-DEX共聚物的接枝度越高,L*(明暗值)降低越明显,而a*(红绿值)和 b*(黄蓝值)显著增加(P<0.05),发生显著褐变。其中BDC 5的变化尤为明显,与接枝度的分析结果相对应。这说明分子质量为5 kDa的多糖在与蛋白接枝反应中能够暴露出更多活性羰基,使活性中间产物的含量增加,并与其他活性前体发生连接和聚合,最后在美拉德反应的最终阶段形成较多的褐色聚合物[38]。
表3 BSA-DEX共聚物的色差数据及褐变程度
Table 3 Color difference and degree of browning in BSA-DEX conjngates

样品色差L*a*b*褐变程度BSA95.94±1.08a1.33±0.09c4.24±0.07c0.119±0.002dBDX 192.42±1.25c2.44±0.05d7.47±0.05b,d0.129±0.008bBDX 589.48±1.05d5.44±0.07a17.85±0.09a0.158±0.007aBDX 7093.30±0.98b2.22±0.03b7.36±0.08b0.123±0.006b,cBDX 10093.22±1.01b2.29±0.08b7.21±0.06b0.127±0.005b
2.6 乳化性和乳化稳定性
乳化性是蛋白质重要的功能特性之一,对蛋白质的加工应用具有重要的意义[39]。如图4所示,BSA-DEX 共聚物的乳化性和乳化稳定性较BSA均有显著增加。其中BDC 5的乳化性最好为(49.06±0.85)m2/g,而乳化稳定性较其他共聚物而言较小。这是因为蛋白质与多糖发生接枝反应后,空间结构变的松散,疏水基团暴露,改变了蛋白质中亲水基团和疏水基团之间的平衡,降低蛋白乳液的界面张力,最终使得乳化性升高[40]。BDC乳化性的变化,与接枝度的大小相关,接枝度越大,乳化性越强。
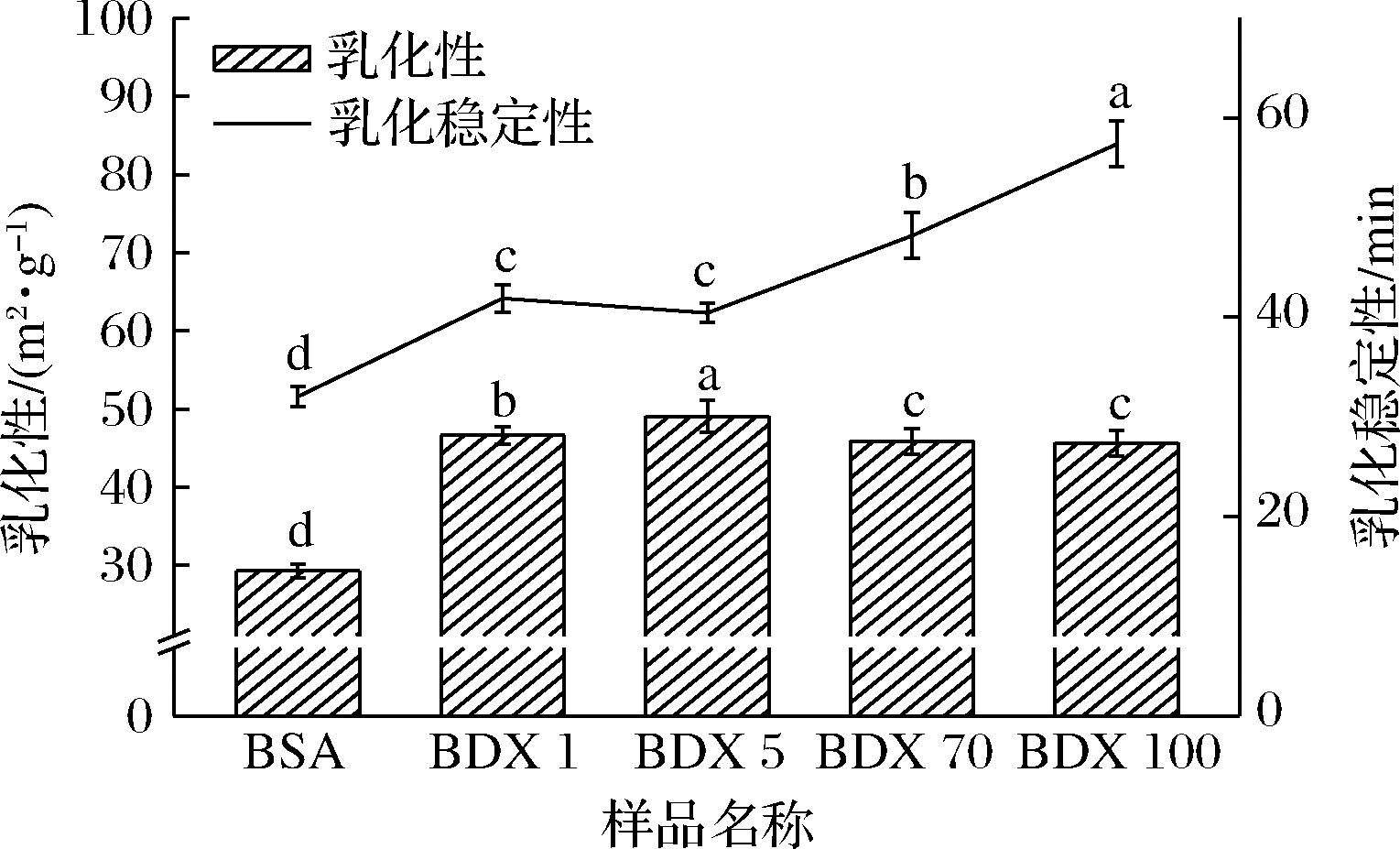
图4 BSA-DEX共聚物的乳化性与乳化稳定性
Fig.4 Emulsion ability and emulsion stability of BSA-DEX conjugates
注:不同组内小写字母代表显著性差异(P<0.05)(下同)
BDC 70和BDC 100的乳化稳定性最大,这是因为多糖的分子质量越大,空间位阻作用越大,稳定性就越好。PUGNALONI[34]研究表明,蛋白质-多糖接枝物能够在液滴附近形成混合的多分子层结构,从而降低液滴的聚集程度,达到改善乳化性的目的。
2.7 起泡性与泡沫稳定性
图5为BDC的起泡性与泡沫稳定性曲线,接枝后共聚物的起泡性较BSA显著降低,而泡沫稳定性显著升高。BDC 5的起泡性最低,泡沫稳定性最大。蛋白质结构越疏松,起泡性就越好;相反蛋白质分子结构越紧密,刚性越好,越难变形,则蛋白质的起泡性越低[41]。蛋白质分子中暴露在表面的疏水性氨基酸数量也影响着起泡能力。结合分析可得,干热法接枝产物虽溶解度有所提高,但其蛋白分子是一类结构紧密、刚性强、难于变形的分子,因而无法迅速吸附在气-水界面上展开形成有序的蛋白分子层,起泡能力差,其泡沫体积保留量也少。
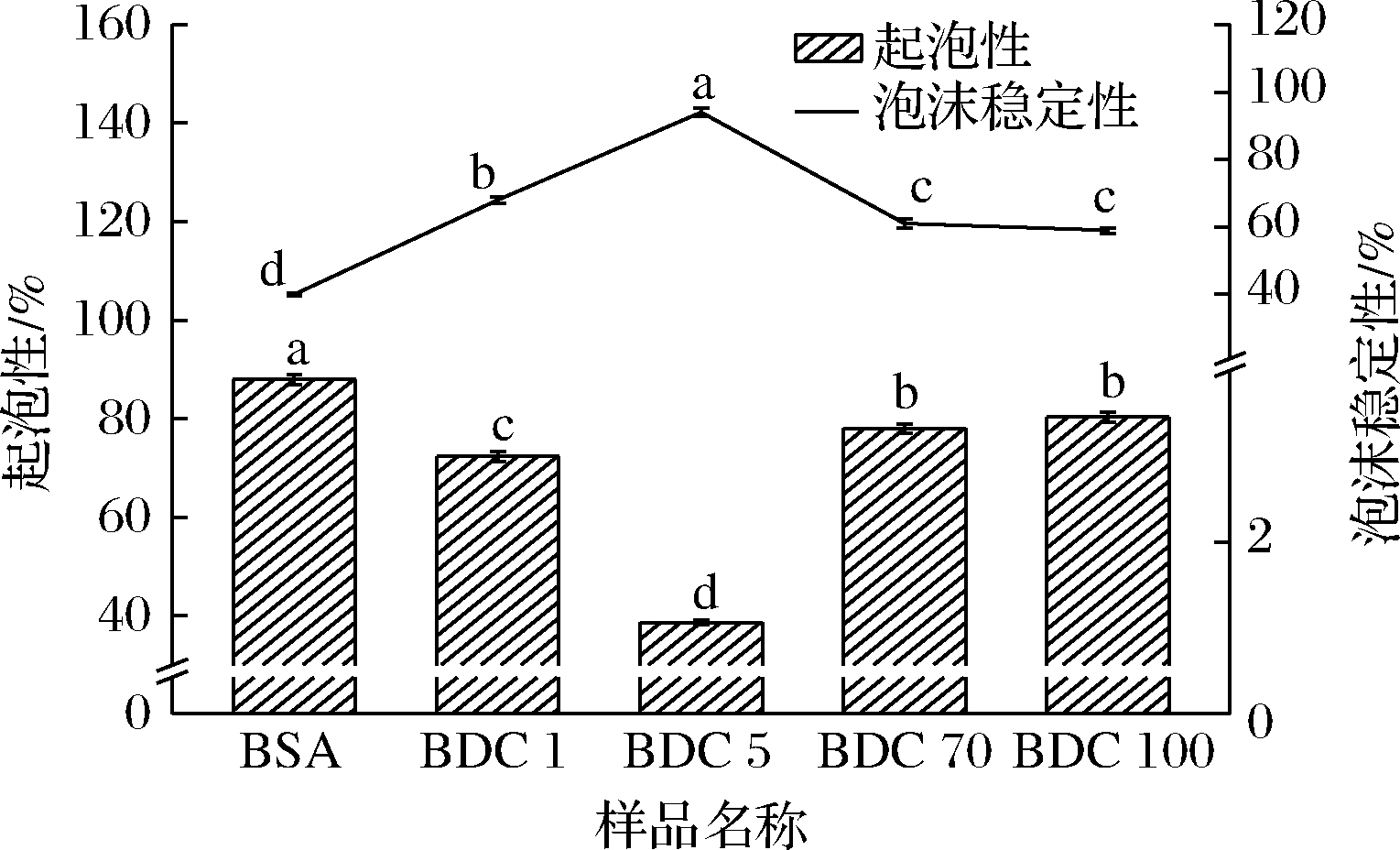
图5 BSA-DEX共聚物的起泡性与泡沫稳定性
Fig.5 Foaming ability and foaming stability of BSA-DEX conjugates
2.8 流变性
如图7所示,BSA-DEX共聚物的乳液黏度随着剪切速率的增加而降低,最终达到平衡,此为典型的牛顿流体特性;随着 DEX 分子质量的增大黏度也在升高。DEX接入BSA后,其本身具有增稠作用,引起了乳液体系黏度的增加,生成了更加稳定的共聚物,增强了在乳液体系中的相互作用和抗剪切作用力,从而引起黏度增大[42]。LIU等[43]对核桃乳状液的研究发现,高黏度乳液能够阻碍液滴的相互聚集,从而提高乳状液的物理稳定性。

图7 BSA-DEX共聚物的乳液黏度随剪切速率的变化
Fig.7 Variation of the emulsion viscosity of BSA-DEX conjugates with the shear rate
3 结论
接枝反应后,SDS-PAGE和FTIR分析证明了BSA与不同分子质量 DEX 均形成了共聚物,且共聚物的结构和功能特性较BSA发生了明显的变化。接枝度越高的共聚物 (BDC 1、BDC 5)结构变化越明显,颜色越深,疏水性降低越显著,BDC 5疏水性为(6.876±0.69)。荧光光谱分析表明,不同分子质量的BDC共聚物均能够导致荧光猝灭的发生,低分子质量 DEX(1 kDa、5 kDa)与BSA形成的共聚物荧光猝灭现象更显著,且最大发射波长的红移程度变化越大,说明较高接枝度的BDC共聚物具有更松散的三级结构。乳化性分析表明,接枝反应能够提高BSA的乳化性(29.321±0.89) m2/g和乳化稳定性(32.034±0.99)min,并且乳化性随着接枝度的增加而增加,BDC 5的乳化性达到(49.058±0.88)m2/g,而高分子质量 DEX 与BSA形成的共聚物具有更高的乳化稳定性(57.357±0.47)min和黏度,这是因为高分子质量的DEX具有较高的空间位阻,会对乳液中液滴的聚集起到抑制的作用,增加乳液黏度,利于BDC共聚物乳液的稳定。
[1] MARTINEZ N Y,ANDRADE P F,DURAN N,et al.Development of double emulsion nanoparticles for the encapsulation of bovine serum albumin[J].Colloids and Surfaces B:Biointerfaces,2017,158:190-196.
[2] MAINARDES R M,KHALIL N M.Nanoparticles of bovine serum albumin for encapsulation of food ingredients[M].Biopolymer Nanostructures for Food Encapsulation Purposes.Amsterdam:Elsevier,2019:169-186
[3] WENG J Y,QI J R,YIN S W,et al.Fractionation and characterization of soy β-conglycinin-dextran conjugates via macromolecular crowding environment and dry heating[J].Food Chemistry,2016,196(51):1 264-1 271.
[4] NOOSHKAM M,VARIDI M.Maillard conjugate-based delivery systems for the encapsulation,protection,and controlled release of nutraceuticals and food bioactive ingredients:A review[J].Food Hydrocolloids,2020,100:105 389.
[5] FENG J L,QI J R,YIN S W,et al.Fabrication and characterization of stable soy β-conglycinin-dextran core-shell nanogels prepared via a self-assembly approach at the isoelectric point[J].Journal of Agricultural & Food Chemistry,2015,63(26):6 075-6 083.
[6] LIU J,CHEN W M,SHAO Y H,et al.The mechanism of the reduction in allergenic reactivity of bovine α-lactalbumin induced by glycation,phosphorylation and acetylation[J].Food Chemistry,2020,310:125 853.
[7] ZHONG J Z,XU Y J,LIU W,et al.Antigenicity and functional properties of β-lactoglobulin conjugated with fructo-oligosaccharides in relation to conformational changes[J].Journal of Dairy Science,2013,96(5):2 808-2 815.
[8] ZHANG J C,LIU L,JIANG Y R,et al.High-moisture extrusion of peanut protein-/carrageenan/sodium alginate/wheat starch mixtures:Effect of different exogenous polysaccharides on the process forming a fibrous structure[J].Food Hydrocolloids,2020,99:105 311.
[9] 侯惠静,张晓燕,陈建波,等.BSA-葡聚糖-叶黄素纳米颗粒的制备及其抗氧化活性[J].食品研究与开发,2020,41(20):137-145.
HOU H J,ZHANG X Y,CHEN J B,et al.Preparation of BSA-dextran-luteinnanoparticle and its anti-oxidative properties[J].Food Research and Development,2020,41(20):137-145.
[10] MENGIBAR M,MIRALLES B,HERAS  .Use of soluble chitosans in Maillard reaction products with β-lactoglobulin:Emulsifying and antioxidant properties[J].LWT,2017,75:440-446.
.Use of soluble chitosans in Maillard reaction products with β-lactoglobulin:Emulsifying and antioxidant properties[J].LWT,2017,75:440-446.
[11] YANG Y X,CUI S W,GONG J H,et al.A soy protein-polysaccharides Maillard reaction product enhanced the physical stability of oil-in-water emulsions containing citral[J].Food Hydrocolloids,2015,48(6):155-164.
[12] CHENG Y H,TANG W J,XU Z,et al.Structure and functional properties of rice protein-dextran conjugates prepared by the Maillard reaction[J].International Journal of Food Science & Technology,2018,53(2):372-380.
[13] WANG C N,LIU Z J,XU G R,et al.BSA-dextran emulsion for protection and oral delivery of curcumin[J].Food Hydrocolloids,2016,61:11-19.
[14] VHANGANI L N,VAN WYK J.Antioxidant activity of Maillard reaction products (MRPs) in a lipid-rich model system[J].Food Chemistry,2016,208:301-308.
[15] TU Y Q,XU Y,REN F Z,et al.Characteristics and antioxidant activity of Maillard reaction products from α-lactalbumin and 2′-fucosyllactose[J].Food Chemistry,2020,316:126 341.
[16] FAN Y T,YI J,ZHANG Y Z,et al.Fabrication of curcumin-loaded bovine serum albumin (BSA)-dextran nanoparticles and the cellular antioxidant activity[J].Food Chemistry,2018,239:1 210-1 218.
[17] ZHAO C B,ZHANG H,XU X Y,et al.Effect of acetylation and succinylation on physicochemical properties and structural characteristics of oat protein isolate[J].Process Biochemistry,2017,57:117-123.
[18] FENG J,WU S S,WANG H,et al.Improved bioavailability of curcumin in ovalbumin-dextran nanogels prepared by Maillard reaction[J].Journal of Functional Foods,2016,27:55-68.
[19] XUE H,TU Y G,XU M,et al.Changes in physicochemical properties,gel structure and in vitro digestion of marinated egg white gel during braising[J].Food Chemistry,2020,330:127 321.
[20] YAN Y,ZHU Q,DIAO C,et al.Enhanced physicochemical stability of lutein-enriched emulsions by polyphenol-protein-polysaccharide conjugates and fat-soluble antioxidant[J].Food Hydrocolloids,2020,101:105 447.
[21] DJELLOULI M,LOPEZ-CABALLERO M E,ARANCIBIA M Y,et al.Antioxidant and antimicrobial enhancement by reaction of protein hydrolysates derived from shrimp by-products with glucosamine[J].Waste and Biomass Valorization,2020,11(6):2 491-2 505.
[22] SANMARTIN P,VAZQUEZ-NION D,ARINES J,et al.Controlling growth and colour of phototrophs by using simple and inexpensive coloured lighting:A preliminary study in the Light4Heritage project towards future strategies for outdoor illumination[J].International Biodeterioration & Biodegradation,2017,122:107-115.
[23] 崔珊珊,木泰华,张苗,等.酶解产物浓度和油相体积分数对甘薯蛋白酶解产物乳化特性的影响[J].现代食品科技,2017,33(3):203-209.
CUI S S,MU T H,ZHANG M,et al.Effects of hydrolysate concentrations and oil volume fractions on the emulsifying properties of sweet potato protein hydrolysates[J].Modern Food Science and Technology,2017,33(3):203-209.
[24] CHEN Y,HU J,YI X Z,et al.Interactions and emulsifying properties of ovalbumin with tannic acid[J].LWT,2018,95:282-288.
[25] 付本宁, 李超,潘姝璇,等.花椒籽仁分离蛋白起泡力及泡沫稳定性的影响因素[J].中国油脂,2018,43(9):40-48.
FU B N,LI C,PAN S X,et al.Factors affecting foaming ability and foam stability of Zanthoxylum bungeanum Maxim. seed kernel protein isolate[J].China Oils and Fats,2018,43(9):40-48.
[26] FILONZI A,LEE S K,FERREIRA W,et al.A micro-extraction method for use with 4 mm plate geometry in the Dynamic Shear Rheometer to evaluate asphalt binder rheology[J].Construction and Building Materials,2020,252:119 024.
[27] ANTHONY-REGNITZ C M,WILSON A E,SWEAZEA K L,et al.Fewer exposed lysine residues may explain relative resistance of chicken serum albumin to in vitro protein glycation in comparison to bovine serum albumin[J].Journal of Molecular Evolution,2020,88(8):653-661.
[28] WANG T R,HU Q B,LEE J Y,et al.Solid lipid-polymer hybrid nanoparticles by in situ conjugation for oral delivery of astaxanthin[J].Journal of Agricultural and Food Chemistry,2018,66(36):9 473-9 480.
[29] CAMACHO N P,WEST P,TORZILLI P A,et al.FTIR microscopic imaging of collagen and proteoglycan in bovine cartilage[J].Biopolymers,2001,62(1):1-8.
[30] NOOSHKAM M,MADADLOU A.Maillard conjugation of lactulose with potentially bioactive peptides[J].Food Chemistry,2016,192:831-836.
[31] SU J F,HUANG Z,YUAN X Y,et al.Structure and properties of carboxymethyl cellulose/soy protein isolate blend edible films crosslinked by Maillard reactions[J].Carbohydrate Polymers,2010,79(1):145-153.
[32] ZHANG Y T,TAN C,ZHANG X M,et al.Effects of maltodextrin glycosylation following limited enzymatic hydrolysis on the functional and conformational properties of soybean protein isolate[J].European Food Research & Technology,2014,238(6):957-968.
[33] 赵城彬, 张浩,鄢健楠,等.葡聚糖分子量对玉米醇溶蛋白接枝物结构和乳化性的影响[J].农业工程学报,2018,34(14):288-295.
ZHAO C B,ZHANG H,YAN J N,et al.Effect of dextran molecular weight on structure and emulsifying property of zein conjugates[J].Transactions of the Chinese Society of Agricultural Engineering,2018,34(14):288-295.
[34] PUGNALONI L A,DICKINSON E,ETTELAIE R,et al.Competitive adsorption of proteins and low-molecular-weight surfactants:Computer simulation and microscopic imaging[J].Advances in Colloid & Interface Science,2004,107(1):27-49.
[35] YOKOI T,HATTORI S,ISHII K.Encapsulation of zinc phthalocyanine into bovine serum albumin aggregates[J].Journal of Coordination Chemistry,2019,72(4):707-715.
[36] SUN Y X,HAYAKAWA S,CHUAMANOCHAN M,et al.Antioxidant effects of Maillard reaction products obtained from ovalbumin and different D-aldohexoses[J].Bioscience Biotechnology Biochemistry,2006,70(3):598-605.
[37] SPOTTI M J,MARTINEZ M J,PILOSOF A M R,et al.Influence of Maillard conjugation on structural characteristics and rheological properties of whey protein/dextran systems[J].Food Hydrocolloids,2014,39:223-230.
[38] 张淇云, 谢晶,邵则淮,等.大豆分离蛋白美拉德反应研究进展[J].中国粮油学报,2020,35(10):196-202.
ZHANG Q Y,XIE J,SHAO Z H,et al.Research progress on Maillard reaction of soybean protein isolate[J].Journal of the Chinese Cereals and Oils Association,2020,35(10):196-202.
[39] 王雪, 郭兴凤.蛋白质乳化性研究进展[J].粮食加工,2017,42(1):39-43.
WANG X,GUO X F.The research progress of protein emulsification[J].Grain Processing,2017,42(1):39-43.
[40] ROBITAILLE G,AYERS C.Effects of κ-casein glycosylation on heat stability of milk[J].Food Research International,1995,28(1):17-21.
[41] JIMENEZ-CASTAO L,VILLAMIEL M,LOPEZ-FANDIO R.Glycosylation of individual whey proteins by Maillard reaction using dextran of different molecular mass[J].Food Hydrocolloids,2007,21(3):433-443.
[42] MCCLEMENTS D J.Comments on viscosity enhancement and depletion flocculation by polysaccharides[J].Food Hydrocolloids,2000,14(2):173-177.
[43] LIU S,SUN C X,XUE Y H,et al.Impact of pH,freeze-thaw and thermal sterilization on physicochemical stability of walnut beverage emulsion[J].Food Chemistry,2016,196:475-485.