糖尿病为全球流行病[1],胰高血糖素样肽-1(GLP-1)通过竞争性抑制胰高血糖素的释放可起到降低血糖的效果,但二肽基肽酶-IV(dipeptidyl peptidase-IV,DPP-IV,EC3.4.14.5)可快速降解GLP-1,不利于其降血糖[2]。DPP-IV抑制肽可通过竞争性结合DPP-IV抑制其活性[3]。DPP-IV抑制肽通常含有脯氨酸,该结构特点为筛选或合成DPP-IV抑制肽提供了靶点。牦牛乳酪蛋白富含脯氨酸[4],牦牛乳酪蛋白的木瓜蛋白酶水解物DPP-IV抑制率可达53.95%[5]。传统方法对蛋白酶的筛选具有盲目性,借助生物信息学手段有望实现对利用牦牛乳酪蛋白制备DPP-IV抑制肽蛋白酶的快速筛选[6]。此外,酪蛋白的高级结构阻碍了其与酶的结合,不利于肽段释放。超声波频率高、波长短,可一定程度影响酪蛋白结构,使酪蛋白更易与蛋白酶结合,从而提高酶解效果[7]。超声波辅助单酶水解已应用于生物活性肽的制备,但与多酶水解的联合作用尚未见报道[8-9]。
本研究首先利用生物信息学方法对牦牛乳酪蛋白进行模拟酶切,筛选制备DPP-IV抑制肽的蛋白酶,并对单酶和多酶组合水解效果进行研究,确定最佳蛋白酶组合。进一步利用超声波预处理技术对组合酶水解过程进行优化,确定制备DPP-IV抑制肽的最佳工艺。本研究可为利用牦牛乳酪蛋白生产DPP-IV抑制肽,实现我国牦牛乳的高值化利用提供参考。
1 材料与方法
1.1 实验材料
1.1.1 主要实验原料与试剂
牦牛乳酪蛋白,甘肃华羚乳品股份有限公司;蛋白酶,丹麦Novozymes公司。
1.1.2 主要仪器与设备
Alpha1-4真空冷冻干燥机,德国Marin Christ公司;Multiskan FC酶标仪,赛默飞世尔(上海)仪器有限公司;SCIENTZ-IID超声波细胞破碎机,宁波新芝生物科技有限公司。
1.2 实验方法
1.2.1 生物信息学工具筛选蛋白酶
1.2.1.1 牦牛乳酪蛋白序列获取
在UniProt数据库(https://www.uniprot.org/)中选取编号分别为A0A344X7B7(αs1-casein)、A0A344X7B8(αs2-casein)、A0A344X7B9(β-casein)和A0A344X7C0(κ-casein)的牦牛乳酪蛋白主要氨基酸序列进行后续实验。
1.2.1.2 牦牛乳酪蛋白模拟酶切探究DPP-IV抑制肽释放情况
利用BIOPEP工具(http://www.uwm.edu.pl/biochemia/index.php/pl/biopep)对牦牛乳酪蛋白模拟酶切,统计不同酶水解释放的DPP-IV抑制肽数量,并以4条序列的相对含量比αs1-casein∶αs2-casein∶β-casein∶κ-casein=4.3∶1.2∶3.2∶1.3进行加权平均计算后排序[10]。
1.2.2 模拟酶切结果验证及蛋白酶筛选
1.2.2.1 牦牛乳酪蛋白酶解
将牦牛乳酪蛋白用蒸馏水湿润后添加5%(质量分数)Na2CO3,搅拌3 h至完全溶解。蛋白质溶液在不同蛋白酶的最适温度下(表1)预热30 min后开始酶解,反应过程中用1 mol/L HCl溶液或1 mol/L NaOH溶液稳定pH。酶解结束后,酶解液经沸水浴10 min灭酶,冰水浴迅速冷却,8 000 r/min,4 ℃离心15 min后取上清液,调节pH至8.0后冻干,保存于-20 ℃冰箱。
表1 各蛋白酶最适反应条件
Table 1 Optimal conditions of the proteases

蛋白酶温度/℃pH底物质量分数/%酶活力/底物/(U·g-1)胃蛋白酶372.243 000木瓜蛋白酶376.043 000菠萝蛋白酶377.043 000胰凝乳蛋白酶378.043 000碱性蛋白酶508.043 000
1.2.2.2 酶解产物上清液蛋白含量测定
操作步骤按照碧云天公司的BCA蛋白浓度测定试剂盒说明书进行。
1.2.2.3 酶解产物上清液水解度测定
采用茚三酮比色法[11]。按公式(1)计算:
DH/%=
(1)
式中:DH,水解度,%;htot,每克原料蛋白质的肽键量,mmol/g。
1.2.2.4 酶解产物DPP-IV抑制率测定
利用发色底物法测定酶解产物离心上清液冻干粉的DPP-IV抑制率[6]。按公式(2)计算:
抑制率![]()
(2)
式中:A样品,样品吸光度;A样品空白对照,以缓冲液代替DPP-IV溶液所测吸光度;A阴性对照,以缓冲液代替样品所测吸光度;A阴性空白对照,以缓冲液代替DPP-IV溶液和样品所测吸光度。
1.2.3 组合酶优化水解工艺
双酶组合:以碱性蛋白酶酶解0.5 h后的样品为底物,调节pH和温度后分别加入胃蛋白酶、木瓜蛋白酶、菠萝蛋白酶和胰凝乳蛋白酶进行水解。
三酶组合:以依次用碱性蛋白酶、木瓜蛋白酶酶解0.5 h后的样品为底物,调节pH和温度后分别加入胃蛋白酶、菠萝蛋白酶和胰凝乳蛋白酶进行水解。
1.2.4 超声波预处理优化水解工艺
对牦牛乳酪蛋白溶液进行超声波预处理:超声波温度64 ℃、超声波功率460 W、超声波时间82 min[12]。
1.2.5 数据处理
使用SPSS 22.0进行单因素ANOVA方差分析,数据结果表示为平均值±标准偏差(SD),以不同字母表示显著性差异(P<0.05)。除模拟酶切外,所有实验均重复3次。
2 结果与分析
2.1 牦牛乳酪蛋白模拟酶切生成DPP-IV抑制肽的研究
检索统计发现,BIOPEP中有28种酶可对牦牛乳酪蛋白产生酶切作用,释放的DPP-IV抑制肽数量统计结果见表2。结合酶获取难易程度和DPP-IV抑制肽数量,选取胃蛋白酶、木瓜蛋白酶、菠萝蛋白酶、胰凝乳蛋白酶和碱性蛋白酶用于水解牦牛乳酪蛋白制备DPP-IV抑制肽。
表2 BIOPEP对牦牛乳酪蛋白模拟酶切所产生的DPP-IV抑制肽数量*
Table 2 Amount of DPP-IV inhibitory peptides produced by yak milk casein with BIOPEP in silico

注:*表中仅列举酶解牦牛乳酪蛋白产生DPP-IV抑制肽数量排名前10的蛋白酶
蛋白酶编号αs1-caseinαs2-caseinβ-caseinκ-casein平均值胃蛋白酶(pH>2)EC 3.4.23.12222362727.13胰凝乳蛋白酶 CEC 3.4.21.21610351721.49钙蛋白酶 2EC 3.4.22.531925241921.32胰弹力蛋白酶EC 3.4.21.361310312019.31无花果蛋白酶EC 3.4.22.31516231117.16菠萝蛋白酶EC 3.4.22.321310261216.67蛋白酶 KEC 3.4.21.671417181716.03木瓜蛋白酶EC 3.4.22.21316201515.86碱性蛋白酶EC 3.4.21.621313211415.69白细胞弹性蛋白酶EC 3.4.21.37116241515.08嗜热菌蛋白酶EC 3.4.24.2788131210.12
2.2 单酶酶解生成DPP-IV抑制肽验证研究
对所筛选的5种蛋白酶酶解牦牛乳酪蛋白生成DPP-IV抑制肽的效果进行了验证,结果发现5种蛋白酶水解产物均具有DPP-IV抑制活性(图1-a)。木瓜蛋白酶产物的DPP-IV抑制率最高,为(20.35±0.47)%,碱性蛋白酶的水解度最高,为(58.20±0.57)%,3 h后各蛋白酶基本完成水解。水解度与产物DPP-IV抑制率之间无明显联系(图1-a和图1-b),水解度达最大值时DPP-IV抑制肽已基本释放完全,这与KARIMI等[13]的研究结果相同。
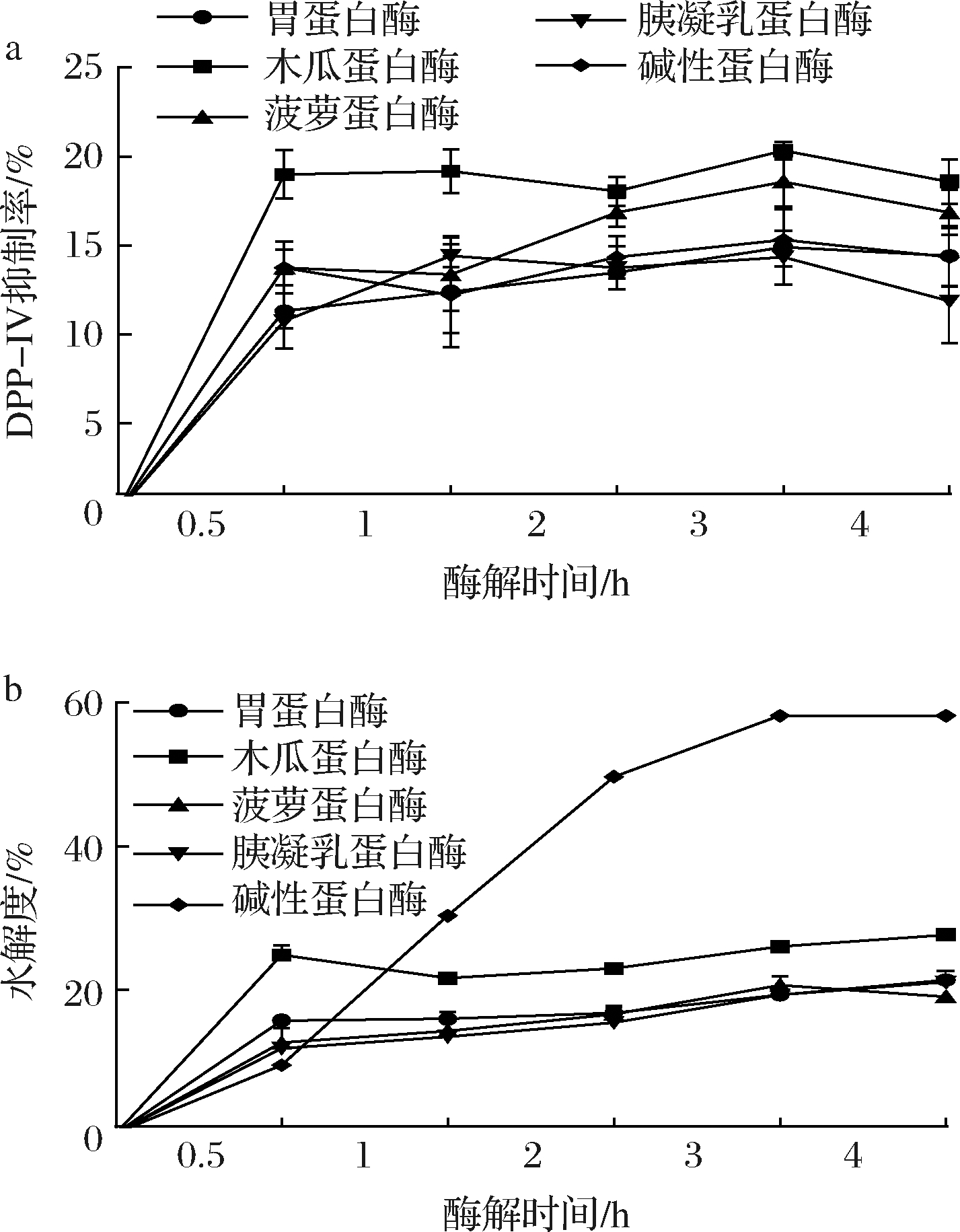
a-DPP-IV抑制率曲线;b-水解度曲线
图1 不同蛋白酶酶解酪蛋白产物的DPP-IV抑制率和水解度
Fig.1 DPP-IV inhibition rates and hydrolysis degrees of the casein hydrolysates produced by different enzymes
同时研究发现,实际酶解与模拟酶切结果并不完全一致。这可能是酶解反应条件和底物特性等多种因素的影响,如酪蛋白凝乳不利于蛋白酶发挥作用[14]。此外,目前仅可统计模拟酶切产物的DPP-IV抑制肽数量,数据库中缺少单个肽的活性信息[15]。模拟酶切工具仅基于已报道过的酶解位点和DPP-IV抑制肽数量,而实际酶解过程更为复杂[16]。
2.3 多酶水解生成DPP-IV抑制肽的组合优化
2.3.1 双酶组合优化
对双酶组合水解牦牛乳酪蛋白制备DPP-IV抑制肽进行了研究。结果表明,木瓜蛋白酶与碱性蛋白酶组合的酶解产物DPP-IV抑制率最高(图2-a),为(19.77±2.14)%。双酶组合的水解度较碱性蛋白酶单独酶解时均有显著提高(图2-b)。双酶组合过程中,反应条件的变化和第2种蛋白酶的加入都可能会影响酪蛋白底物的结构,抑制碱性蛋白酶的进一步水解[17]。不同蛋白酶的特异性酶解位点有所差异,第2种蛋白酶会进一步释放碱性蛋白酶产物中的DPP-IV抑制肽[18]。
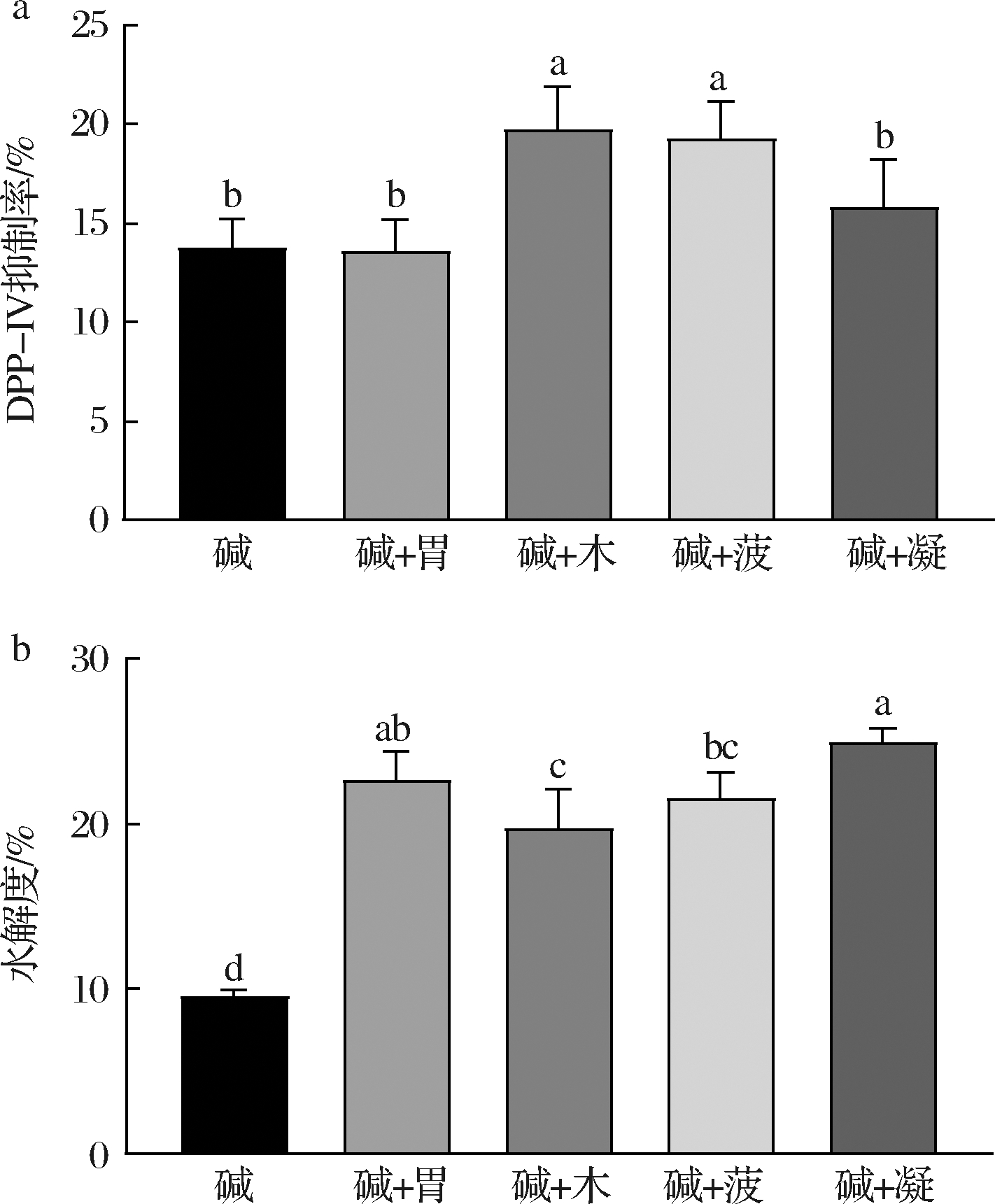
a-双酶产物DPP-IV抑制率;b-双酶产物水解度“碱”表示碱性蛋白酶;“胃”表示胃蛋白酶;“木”表示木瓜蛋白酶;“菠”表示菠萝蛋白酶;“凝”表示胰凝乳蛋白酶(下同)
图2 双酶组合酶解酪蛋白产物的DPP-IV抑制率和水解度
Fig.2 DPP-IV inhibition rates and hydrolysis degrees of the casein hydrolysates produced by double enzymes
2.3.2 三酶组合优化
对三酶组合水解牦牛乳酪蛋白制备DPP-IV抑制肽进行了研究。结果显示,“碱+木+菠”组合酶解产物DPP-IV抑制率显著提升,抑制率最高(25.29±3.55)%,但其水解度并未提高。在碱性蛋白酶、木瓜蛋白酶和菠萝蛋白酶组合的过程中,酶解产物的DPP-IV抑制率不断提升,三酶组合>双酶组合>单酶(图2-a和图3-a),但水解度依次为双酶组合>三酶组合>单酶(图2-b和图3-b),表明水解度与产物的DPP-IV抑制活性之间无必然联系。因此,在酶解法制备DPP-IV抑制肽的过程中,水解度仅可作为控制酶解程度的指标[19]。

a-三酶产物DPP-IV抑制率;b-三酶产物水解度
图3 三酶组合酶解酪蛋白产物的DPP-IV抑制率和水解度
Fig.3 DPP-IV inhibition rates and hydrolysis degrees of the casein hydrolysates produced by triple enzymes
2.4 超声波预处理结合三酶组合优化水解
牦牛乳酪蛋白以稳定的胶束状态存在,不利于与蛋白酶的结合[20]。超声波处理可对酪蛋白胶束的结构产生影响,增加酪蛋白溶解度并减小酪蛋白胶束尺寸[21]。预处理结果表明,超声波有助于牦牛乳酪蛋白制备DPP-IV抑制肽。结合超声波预处理牦牛乳酪蛋白,牦牛乳水解产物的DPP-IV抑制率为(67.05±0.79)%,水解度为(30.57±0.72)%,与未经超声波处理相比,抑制效果与水解度均显著提高(图4)。

a-超声结合三酶产物DPP-IV抑制率;b-超声结合三酶产物水解度
图4 超声波预处理结合三酶组合酶解酪蛋白产物的DPP-IV抑制率和水解度
Fig.4 DPP-IV inhibition rates and hydrolysis degrees of the casein hydrolysates produced by ultrasonic pretreatment and triple enzymes**表示极显著差异(P<0.01)
3 结论
利用生物信息学工具模拟酶切,筛选获得了可用于水解牦牛乳酪蛋白制备DPP-IV抑制肽的胃蛋白酶、木瓜蛋白酶、菠萝蛋白酶、胰凝乳蛋白酶和碱性蛋白酶。多酶水解产物的DPP-IV抑制效果优于单酶水解产物,最佳酶组合为碱性蛋白酶、木瓜蛋白酶和菠萝蛋白酶。确定了组合酶水解牦牛乳酪蛋白制备DPP-IV抑制肽的最佳工艺为超声温度64 ℃、超声功率460 W、超声波时间82 min,碱性蛋白酶、木瓜蛋白酶和菠萝蛋白酶依次酶解0.5 h,加酶量3 000 U/g,酶解产物DPP-IV抑制率为(67.05±0.79)%,水解度为(30.57±0.72)%。本研究将组合酶水解方法应用于酶解牦牛乳酪蛋白制备DPP-IV抑制肽的研究,并利用超声预处理进行了工艺优化,明显提高了酶解效果。
[1] ROGLIC G.WHO Global report on diabetes:A summary[J].International Journal of Noncommunicable Diseases,2016,1:3-8.
[2] DAVID H.Diabetes:Concerns about long-term use of GLP-1 analogues[J].Nature Reviews Endocrinology,2016,12(4):186.
[3] TRICCO A C,ANTONY J,KHAN P A,et al.Safety and effectiveness of dipeptidyl peptidase-4 inhibitors versus intermediate-acting insulin or placebo for patients with type 2 diabetes failing two oral antihyperglycaemic agents:A systematic review and network meta-analysis[J].BMJ Open,2014,4(12):1-10.
[4] NONGONIERMA A B,FITZGERALD R J.Features of dipeptidyl peptidase IV (DPP-IV) inhibitory peptides from dietary proteins[J].Journal of Food Biochemistry,2019,43(1):1-11.
[5] 宋佳佳, 白函瑜,王倩,等.牦牛乳酪蛋白酶解产物二肽基肽酶-Ⅳ抑制活性和特性分析[J].乳业科学与技术,2015,38(1):1-4.
SONG J J,BAI H Y,WANG Q,et al.Dipeptidyl peptidase-IV inhibitory activity and physicochemical properties of yak milk casein hydrolysates[J].Dairy Science and Technology,2015,38(1):1-4.
[6] 张颖. 牛、羊乳酪蛋白源DPP-Ⅳ抑制肽的制备、鉴定及抑制机理研究[D].北京:中国农业大学,2016.
ZHANG Y.Enzymatic preparation,identification and inhibition mechanism of DPP-IV inhibitory peptides derived from bovine and caprine milk casein[D].Beijing:China Agricultural University,2016.
[7] KHANDPUR P,GOGATE P R.Effect of novel ultrasound based processing on the nutrition quality of different fruit and vegetable juices[J].Ultrasonics Sonochemistry,2015,27:125-136.
[8] 蓝尉冰, 韩鑫,陈冠余,等.超声波预处理协同酶提取近江牡蛎活性肽研究[J].食品研究与开发,2018,39(8):48-52.
LAN W B,HAN X,CHEN G Y,et al.Research on extraction of bioactive peptides from ostrea rivularis gould by ultrasonic pretreatment combined with enzyme[J].Food Research and Development,2018,39(8):48-52.
[9] 赵换维. 杏鲍菇多肽制备工艺及体外活性研究[D].西安:西北大学,2019.
ZHAO H W.Study on preparation technology and the activity of polypeptide from pleurotus eryngii in vitro[D].Xi’an:Northwest University,2019.
[10] YAN Z,YUAN L,PENGJIE W,et al.Rennet-induced coagulation properties of yak casein micelles:A comparison with cow casein micelles[J].Food Research International,2017,102:25-31.
[11] 侯虎. 鳕鱼免疫活性肽的可控制备及其免疫活性研究[D].青岛:中国海洋大学,2011.
HOU H.The controllable preparation of pollock immunomodulating peptide and its immunity activity[D].Qingdao:Ocean University of China,2011.
[12] 徐荣荣, 张珍,张盛贵,等.超声波辅助酶法水解酪蛋白工艺研究[J].甘肃农业大学学报,2017,52(6):153-158;163.
XU R R,ZHANG Z,ZHANG S G,et al.Optimum on ultrasonic-associated enzymatic hydrolysis of casein[J].Journal of Gansu Agricultural University,2017,52(6):153-158;163.
[13] KARIMI A,AZIZI M H,GAVLIFHI H A.Fractionation of hydrolysate from corn germ protein by ultrafiltration:In vitro antidiabetic and antioxidant activity[J].Food Science & Nutrition,2020,8(5):2 395-2 405.
[14] LI N,ZHONG Q X.Stable casein micelle dispersions at pH 4.5 enabled by propylene glycol alginate following a pH-cycle treatment[J].Carbohydrate Polymers,2020,233:1-13.
[15] MINKIEWICZ P,IWANIAK A,DAREWICZ M.BIOPEP-UWM database of bioactive peptides:Current opportunities[J].International Journal of Molecular Sciences,2019,20(23):5 978.
[16] UDENIGWE C C.Bioinformatics approaches,prospects and challenges of food bioactive peptide research[J].Trends in Food Science & Technology,2014,36(2):137-143.
[17] DING Y,CHEN L,SHI Y G,et al.Emulsifying and emulsion stabilizing properties of soy protein hydrolysates,covalently bonded to polysaccharides:The impact of enzyme choice and the degree of hydrolysis[J].Food Hydrocolloids,2021,113:1-15.
[18] TAVANO O L.Protein hydrolysis using proteases:An important tool for food biotechnology[J].Journal of Molecular Catalysis B:Enzymatic,2013,90:1-11.
[19] 邢琛. 牛乳酪蛋白深度水解配方食品研究[D].武汉:武汉轻工大学,2019.
XING C.Study on bovine casein deep hydrolysis formula[D].Wuhan:Wuhan Polytechnic University,2019.
[20] 李子超, 王丽娜,李昀锴,等.3种乳源酪蛋白粒径及胶束结构的差异性[J].食品科学,2012,33(5):58-61.
LI Z C,WANG L N,LI Y K,et al.Differences in particle size and structure of casein micelle from different milk sources[J].Food Science,2012,33(5):58-61.
[21] ZHANG R H,PANG X Y,LU J,et al.Effect of high intensity ultrasound pretreatment on functional and structural properties of micellar casein concentrates[J].Ultrasonics Sonochemistry,2018,47:10-16.