单宁酶(tannase,EC 3.1.1.20),又称单宁酰基水解酶,可以催化水解单宁中的酯键与缩酚羧键生成葡萄糖、没食子酸等化合物[1-2],被广泛应用于食品、动物饲料、速溶茶、酿造、制药等工业领域[3-6]。单宁酶是一种胞外诱导酶,由真菌、细菌等多种微生物诱导产生,如GOVINDARAJAN等[7]使用阴沟肠杆菌进行液态发酵产酶,并进行发酵条件优化,其单宁酶酶活力为2.26 U/mL;SHARMA等[8]以茶渣作为发酵底物,使用黑曲霉固态发酵产酶,30 ℃下培养96 h后,单宁酶酶活力达1.86 U/g,并探究其在番石榴汁中的应用。目前主要选择丝状真菌作为单宁酶的工业化生产菌株,但存在产酶活力低、生产成本高的缺点[9]。因此,采用诱变选育技术提高菌株单宁酶产量是降低生产成本的可行途径。常见的诱变方法有紫外诱变[10]、N+注入[11]、甲基磺酸乙酯[12]等,但这些诱变方法存在对操作人员有危害、突变库容量小、菌种遗传稳定性差等缺点。
常压室温等离子体 (atmospheric room temperature plasma,ARTP)是一种新型微生物诱变育种技术[13],具有安全性高、突变率高等优势,目前已经成功应用于细菌、放线菌、真菌、微藻等近60种微生物[14]。例如,LIU等[15]采用ARTP诱变技术与实验室适应性进化相结合的方法,提高了凝结芽孢杆菌的pH耐受性和细胞膜通透性;毛斌等[16]为获得高产中性蛋白酶菌株,使用ARTP对米曲霉进行处理,筛选得到1株高产突变株,其中性蛋白酶活力提高21.0%。
本研究以实验室前期分离获得的1株产单宁酶能力较强的炭黑曲霉Aspergillus carbonarius FCYN212为研究对象,进行ARTP诱变选育高产单宁酶菌株,并利用5 L全自动发酵罐进行发酵参数优化,为单宁酶的大规模发酵生产及在食品发酵中的应用提供参考。
1 材料与方法
1.1 材料
1.1.1 菌株
出发菌株:炭黑曲霉(Aspergillus carbonarius)FCYN212(GenBank No.KX912228)由本实验室前期筛选获得。
1.1.2 培养基
马铃薯葡萄糖琼脂(potato detrose agar,PDA)培养基:称取200 g马铃薯,加入1 L水,煮沸20 min,冷却过滤后补足水至1 L,加入20 g葡萄糖和20 g琼脂,pH自然。121 ℃ 20 min灭菌。
初筛培养基:3 g NaNO3、1 g K2HPO4、0.5 g KCl、0.5 g MgSO4、0.01 g FeSO4·7 H2O、30 g蔗糖、0.04 g溴酚蓝、10 g单宁酸,蒸馏水1 L,调节pH 至4.5~5 (固体培养基外加30 g琼脂)。121 ℃ 15 min灭菌。
液体发酵培养基:3 g NaNO3、1 g K2HPO4、0.5 g KCl、0.5 g MgSO4、0.01 g FeSO4·7 H2O、30 g蔗糖,调pH为5.0;添加10 g单宁酸。121 ℃ 15 min灭菌。
1.1.3 仪器与设备
SP-756P可见分光光度计,上海光谱仪器有限公司;ARTP-Ⅱ型ARTP诱变育种仪,无锡源清天木生物科技有限公司;BioCore QF-5全自动发酵罐,上海楚怡生物科技有限公司。
1.2 实验方法
1.2.1 孢子悬浮液的制备
将炭黑曲霉A.carbonarius FCYN212接种于PDA斜面培养基,28 ℃培养 4 d,用预先灭菌的0.9%的生理盐水冲洗孢子,得到单孢子悬液。
1.2.2 炭黑曲霉生长时间与产单宁酶关系
将1 mL孢子悬浮液(108 CFU/mL)接种到液体培养基中,28 ℃、180 r/min培养24、48、72、96、120 h,抽滤菌丝,105 ℃烘干至恒重;发酵液4 ℃透析后,测定胞外单宁酶酶活力[17]。
1.2.3 ARTP诱变
将10 μL炭黑曲霉菌悬液涂布于无菌金属载片上,设置处理功率120 W,气量10 SLM,诱变处理时间分别为60、120、180、210、240、300、360 s。将金属载片放入装有1 mL无菌生理盐水的离心管中,振荡1 min。取100 μL稀释涂布于初筛培养基,28 ℃培养4 d,以未经ARTP处理的悬浮液作为对照。计算不同处理时间的致死率,如公式(1)所示:
致死率![]()
(1)
式中:A,菌液处理时间0 s(对照组),稀释涂布菌落计数;B,菌液处理一定时间(实验组),稀释涂布菌落计数。
1.2.4 初筛
将诱变后的菌悬液,稀释涂布于初筛培养基,测定菌落周围显色圈直径(H)与菌落直径(D),以H/D值衡量菌株产单宁酶能力。
1.2.5 复筛
选取H/D值较大的菌株,按照1.2.2的方法进行液体发酵复筛,筛选出产单宁酶能力提高的突变菌株。
1.2.6 单宁酶活性的测定
参考MONDAL等[17]的检测方法。酶活力定义:每分钟水解1 μmol单宁酸底物所需要的酶量定义为1个酶活力单位 (U)。
1.2.7 遗传稳定性实验
将复筛得到的突变株在初筛斜面培养基中28 ℃连续传代8次,液态发酵测定传代后菌株产酶能力。
1.2.8 炭黑曲霉突变株发酵产酶条件优化
以单宁酶酶活力为评价指标,以诱导物浓度、接种量、培养时间、溶氧量、诱导物添加时间为单因素变量,利用全自动发酵罐进行产酶优化实验。
1.2.8.1 种子液培养
按照1.2.2的方法,培养2 d为种子液,将种子液按照体积分数1%接种于全自动发酵罐中,进行发酵参数优化。
1.2.8.2 诱导物浓度对突变株发酵产酶的影响
以单宁酸为诱导物,改变其质量浓度为20~70 g/L,设置转速180 r/min、培养温度28 ℃、溶氧浓度按体积分数控制为40% (溶氧浓度与转速、气体偶联),接种后发酵3 d,测定发酵液中酶活力,确定最优浓度。
1.2.8.3 接种量对突变株发酵产酶的影响
按照上述优化后发酵参数,将接种量(体积分数)设置为0.5%、1%、2%、3%、4%,发酵完成后,测定发酵液中酶活力,确定最优接种量。
1.2.8.4 发酵时间对突变株发酵产酶的影响
按照上述优化后发酵参数,于2、3、4、5 d取样,测定发酵液中酶活力,确定最优发酵时间。
1.2.8.5 溶氧体积分数对突变株发酵产酶的影响
设置溶氧体积分数为30%、35%、40%、45%、50% (溶氧体积分数与转速、气体偶联),按照上述优化后参数,发酵完成后,测定发酵液中单宁酶酶活力,确定最优溶氧体积分数。
1.2.8.6 诱导物添加时间对突变株发酵产酶的影响
按照上述优化后参数,设置诱导物添加时间为24、36、48、60 h,发酵完成后,测定发酵液中酶活力确定最优添加时间。
1.2.9 数据处理
采用Excel 2016和Origin 9.0对实验数据进行处理与分析,结果以平均值±标准偏差形式表示。采用SPSS 24.0软件进行单因素方差分析,P<0.05时表示数据间具有显著差异。每组实验重复测定3次。
2 结果与分析
2.1 炭黑曲霉生长时间与产单宁酶关系
如图1所示,炭黑曲霉在培养48 h后进入对数生长期末期,此时酶活力增加最快;在培养96 h时进入稳定期,此时酶活力最高达到了(0.095 3±0.003 6) U/mL,趋于稳定。对数生长期的菌体生长活跃、细胞密度大,能提高诱变效率[18]。因此选择生长48 h的菌体进行诱变处理,选择培养96 h作为酶活力对比的时间点,进行后续筛选工作。
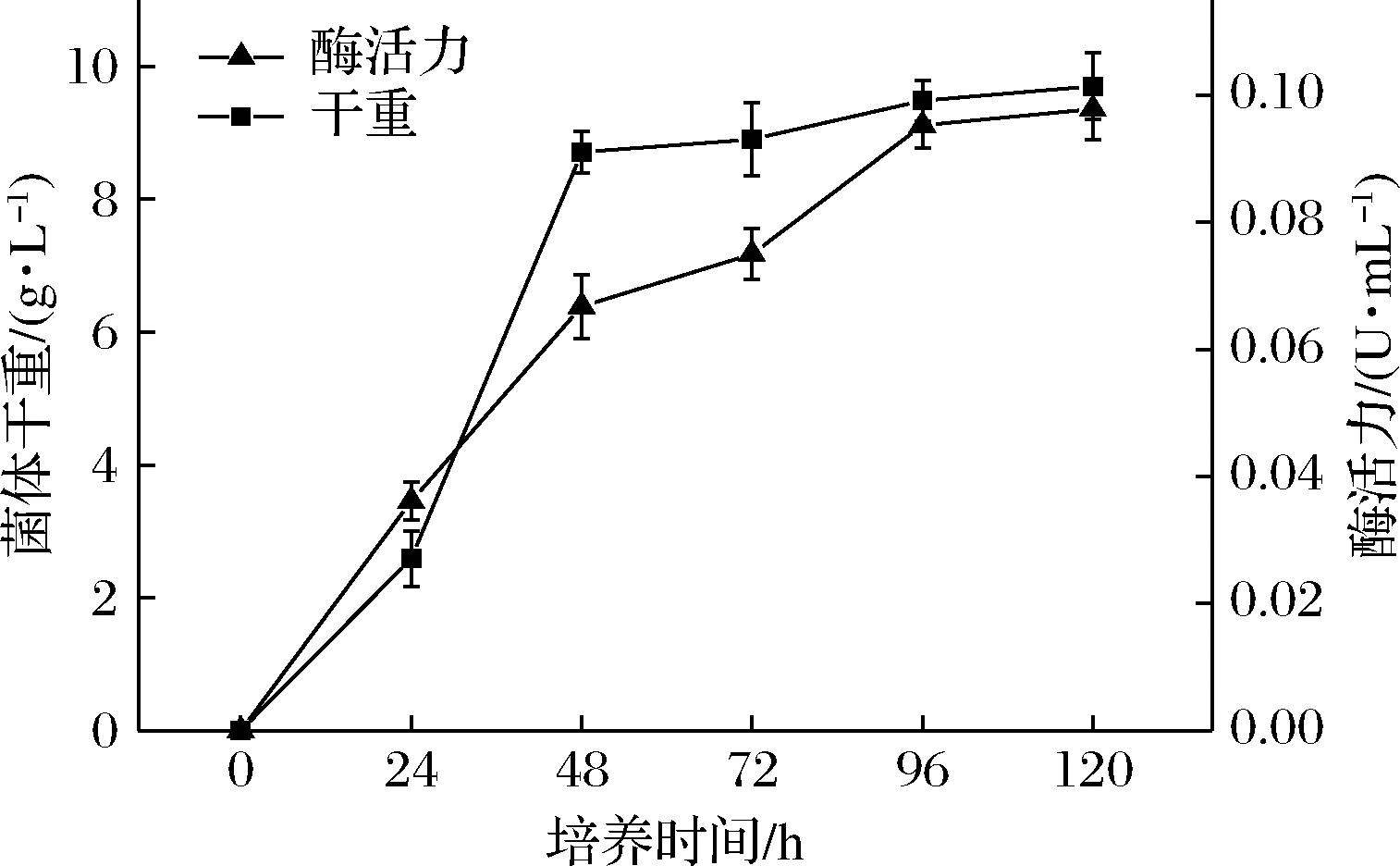
图1 炭黑曲霉生长时间与产单宁酶关系
Fig.1 Relationship of growth time and enzyme-producing of A.carbonarius
2.2 炭黑曲霉致死率
炭黑曲霉致死率如图2所示。菌体的致死率在前120 s急剧上升,处理120 s时致死率接近90%;处理120~240 s时,呈现逐渐平稳的趋势,这可能是因为微生物的自我修复功能发挥作用,此时易发生回复突变;处理420 s致死率接近100%。据文献报道,当致死率处于85%~95%时,可获得最大程度的正突变[19],结合正突变率曲线,选择诱变时间为180 s。
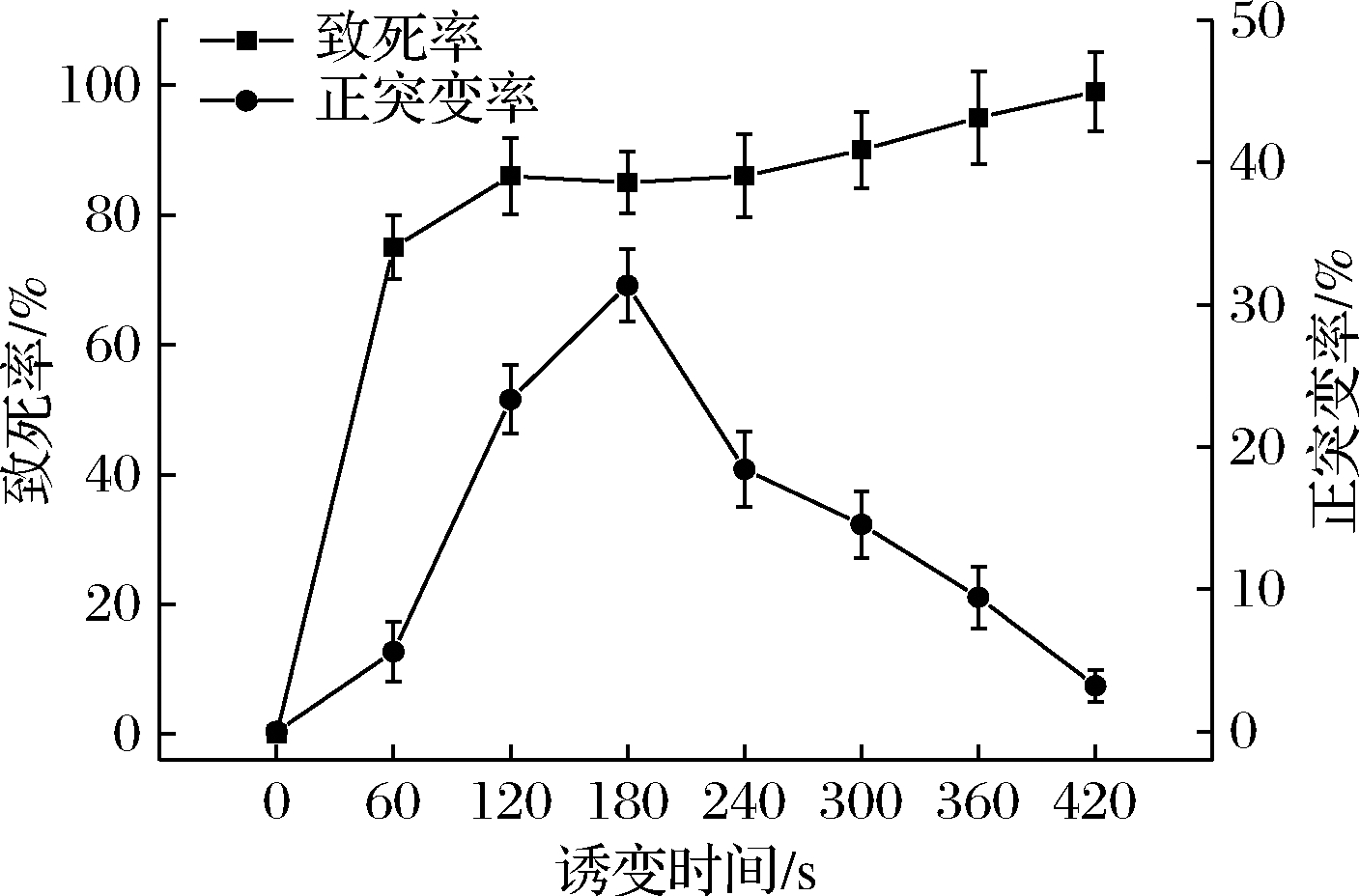
图2 ARTP诱变时间对炭黑曲霉的致死率和正突变率的影响
Fig.2 Influence of ARTP mutagenesis time on mortality rate and mutation rate of A.carbonarius
2.3 炭黑曲霉突变株初筛实验结果
如图3所示,诱变后的阳性突变株显色圈显著大于初始菌株,说明ARTP诱变显著提高了炭黑曲霉的产单宁酶能力。
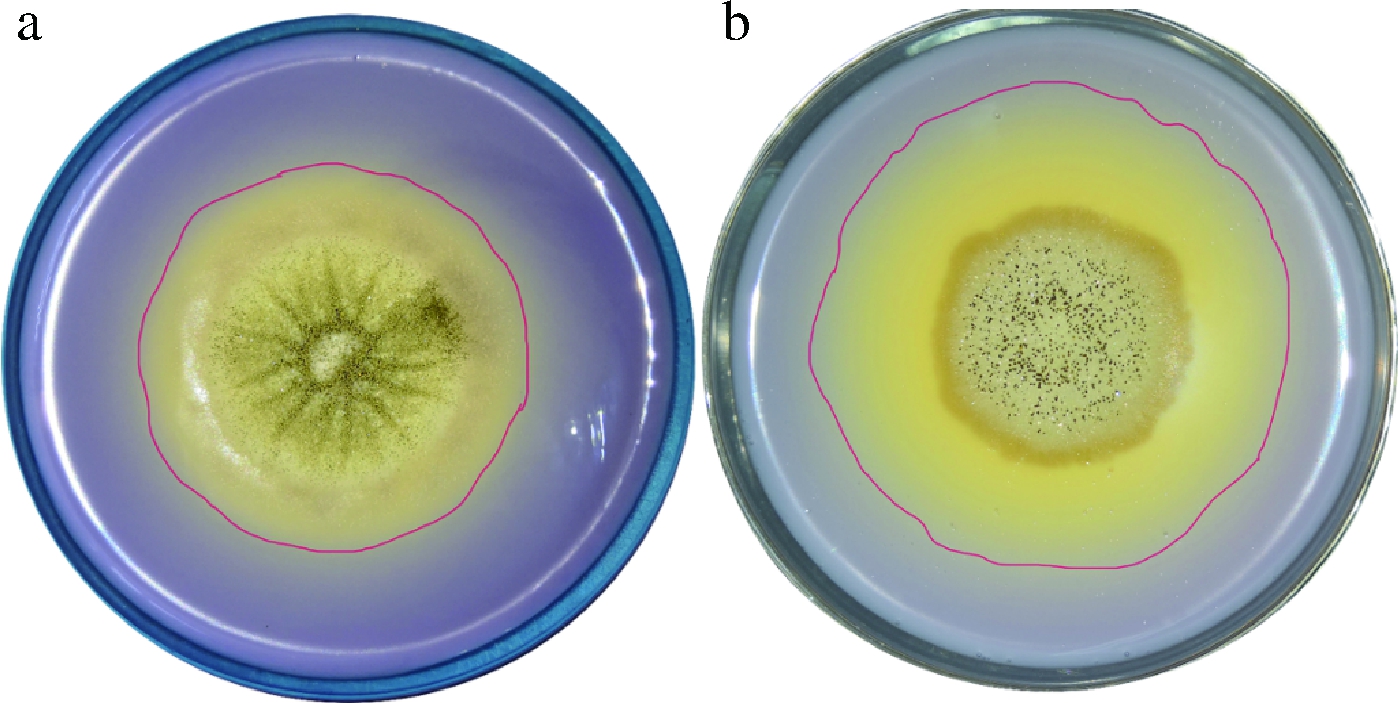
a-诱变前;b-诱变后
图3 诱变前后菌株显色圈
Fig.3 Color circle of before and after mutagenesis
如表1所示,以H/D值衡量菌株产单宁酶能力,挑选100株H/D值较大的菌株。初始菌株H/D值为1.356,诱变后最小值为1.405,最大值1.847。
表1 诱变后的阳性突变株显色圈 (初筛结果)
Table 1 Color circle of positive mutant after mutagenesis (first screening results)
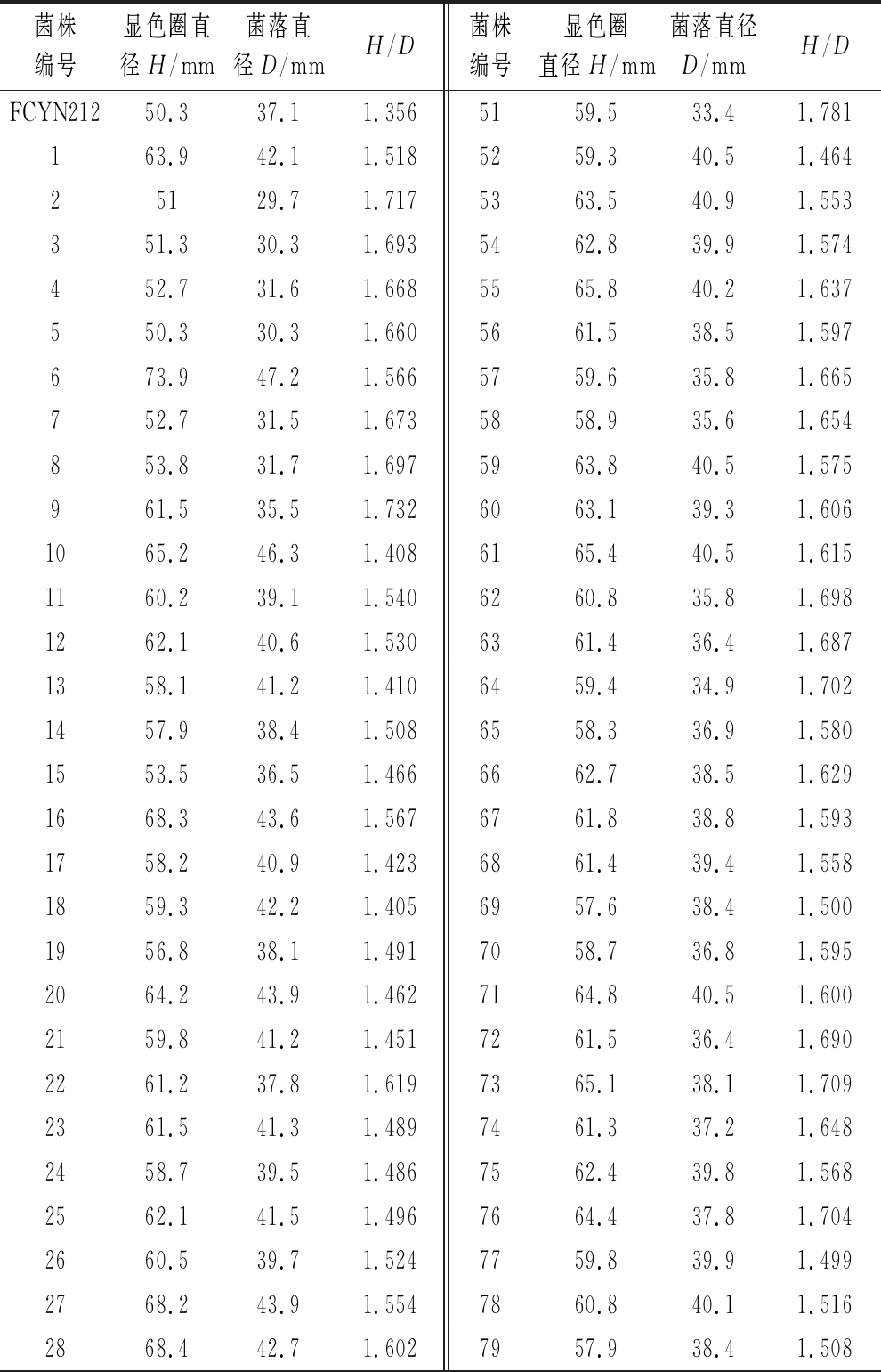
菌株编号显色圈直径H/mm菌落直径D/mmH/D菌株编号显色圈直径H/mm菌落直径D/mmH/DFCYN21250.337.11.3565159.533.41.781163.942.11.5185259.340.51.46425129.71.7175363.540.91.553351.330.31.6935462.839.91.574452.731.61.6685565.840.21.637550.330.31.6605661.538.51.597673.947.21.5665759.635.81.665752.731.51.6735858.935.61.654853.831.71.6975963.840.51.575961.535.51.7326063.139.31.6061065.246.31.4086165.440.51.6151160.239.11.5406260.835.81.6981262.140.61.5306361.436.41.6871358.141.21.4106459.434.91.7021457.938.41.5086558.336.91.5801553.536.51.4666662.738.51.6291668.343.61.5676761.838.81.5931758.240.91.4236861.439.41.5581859.342.21.4056957.638.41.5001956.838.11.4917058.736.81.5952064.243.91.4627164.840.51.6002159.841.21.4517261.536.41.6902261.237.81.6197365.138.11.7092361.541.31.4897461.337.21.6482458.739.51.4867562.439.81.5682562.141.51.4967664.437.81.7042660.539.71.5247759.839.91.4992768.243.91.5547860.840.11.5162868.442.71.6027957.938.41.508
续表1
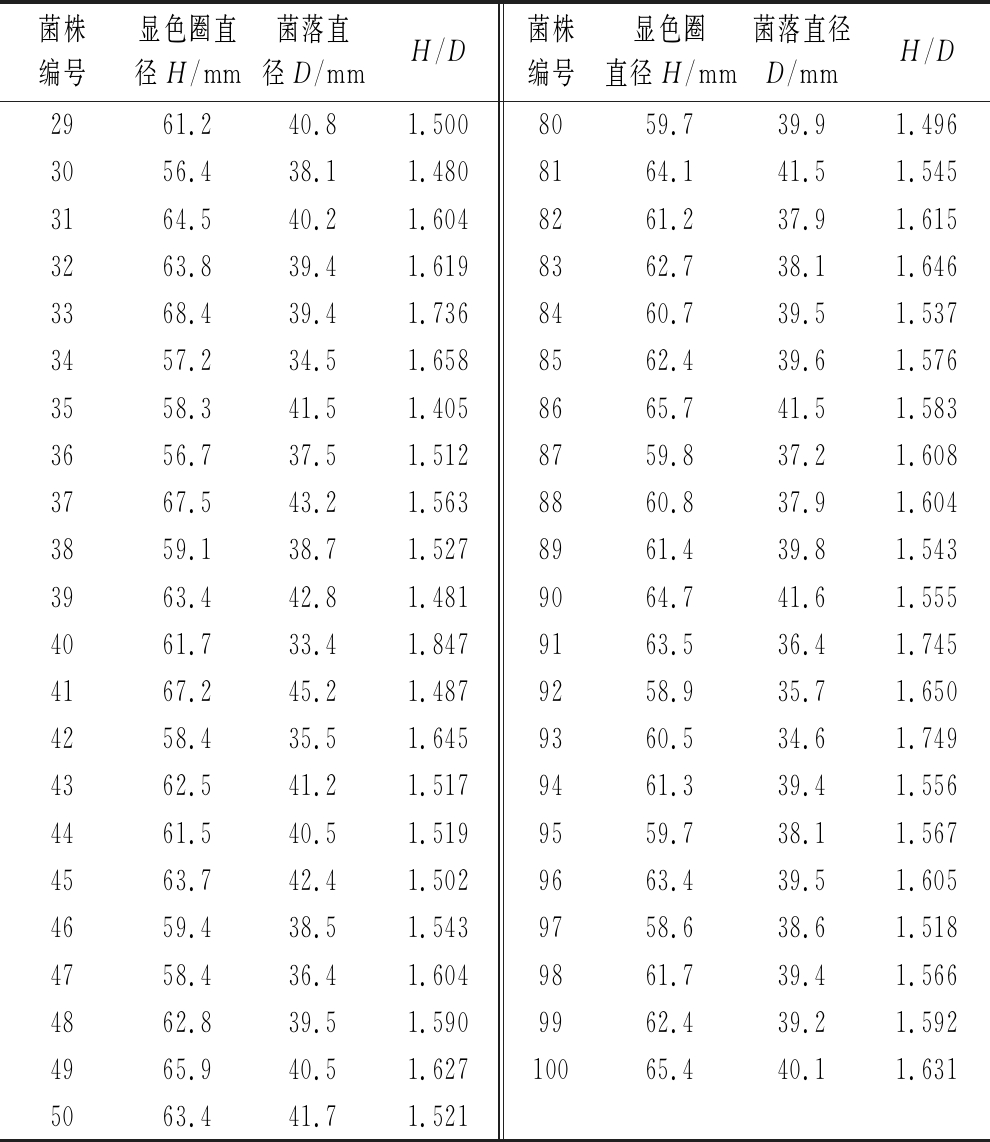
菌株编号显色圈直径H/mm菌落直径D/mmH/D菌株编号显色圈直径H/mm菌落直径D/mmH/D2961.240.81.5008059.739.91.4963056.438.11.4808164.141.51.5453164.540.21.6048261.237.91.6153263.839.41.6198362.738.11.6463368.439.41.7368460.739.51.5373457.234.51.6588562.439.61.5763558.341.51.4058665.741.51.5833656.737.51.5128759.837.21.6083767.543.21.5638860.837.91.6043859.138.71.5278961.439.81.5433963.442.81.4819064.741.61.5554061.733.41.8479163.536.41.7454167.245.21.4879258.935.71.6504258.435.51.6459360.534.61.7494362.541.21.5179461.339.41.5564461.540.51.5199559.738.11.5674563.742.41.5029663.439.51.6054659.438.51.5439758.638.61.5184758.436.41.6049861.739.41.5664862.839.51.5909962.439.21.5924965.940.51.62710065.440.11.6315063.441.71.521
2.4 炭黑曲霉突变株的复筛
将初筛得到的100株菌进行摇瓶发酵复筛,复筛结果如图4所示,筛选得到1株产单宁酶能力较高的突变株,酶活力为0.212 U/mL,与原始菌株酶活力0.135 U/mL相比提高了57%,远高于KUMAR等[20]所报道的0.062 5 U/mL。将得到的单宁酶高产菌株命名为NCUF M8。

图4 100株炭黑曲霉突变株摇瓶发酵复筛结果
Fig.4 Re-screening results of 100 positive mutants by flask fermentation
注:不同小写字母表示差异显著(P<0.05)(下同)
2.5 高产菌株的传代稳定性分析
如图5所示,菌株经过8次传代并进行液态发酵,单宁酶平均酶活力为 (0.208±0.002 5) U/mL。结果表明炭黑曲霉突变株NCUF M8具有较好的稳定性,能高效生产单宁酶。
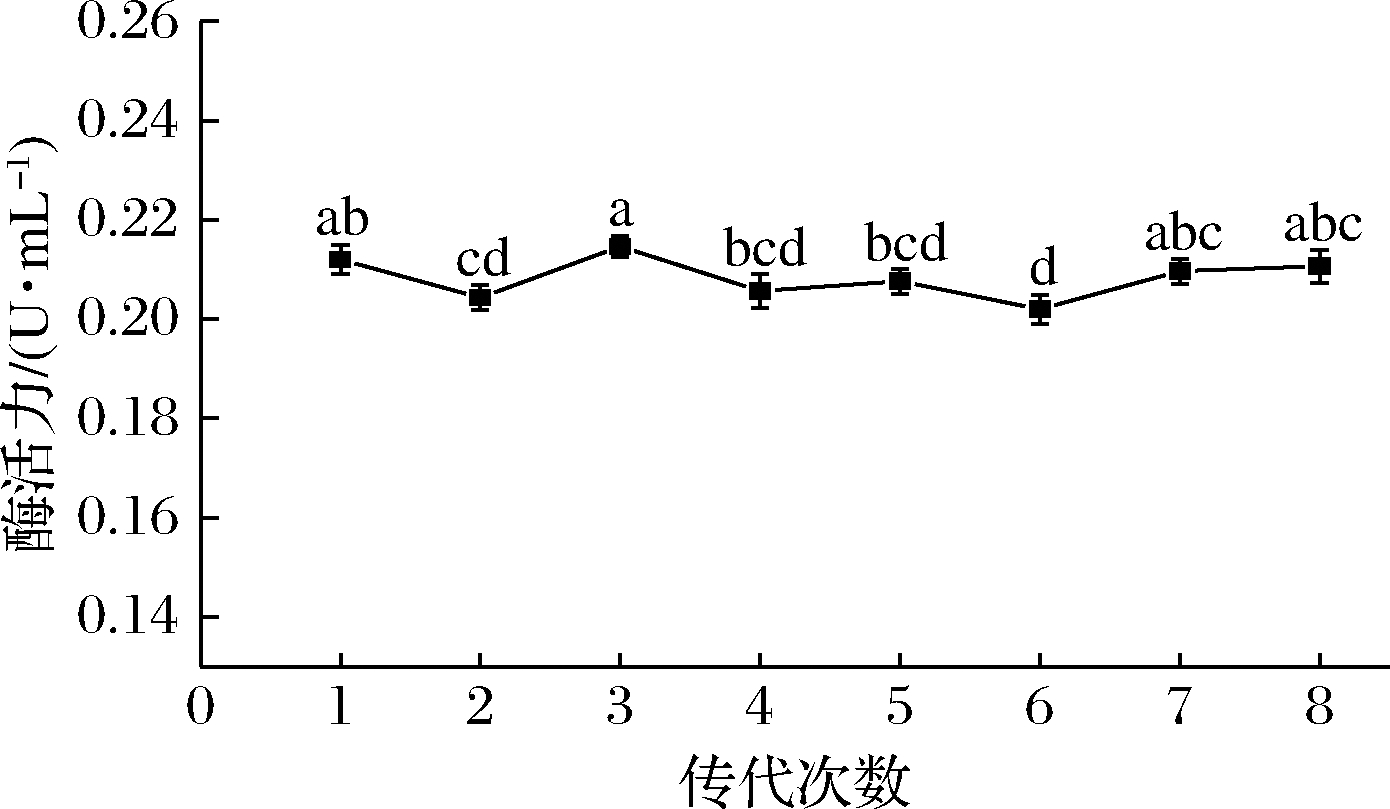
图5 突变株NCUF M8的遗传稳定性
Fig.5 Genetic stability of mutant NCUF M8
2.6 炭黑曲霉突变株发酵产酶条件的优化
2.6.1 诱导物浓度对菌株产单宁酶的影响
如图6所示,随着诱导物单宁酸浓度的逐渐升高,菌株NCUF M8产单宁酶酶活力逐渐升高,在单宁酸质量浓度为60 g/L时达到最高,为 (0.752±0.019) U/mL;当单宁酸质量浓度>60 g/L,酶活力有所降低,这可能是高浓度的单宁酸对微生物生长有着一定的抑制作用[21]。
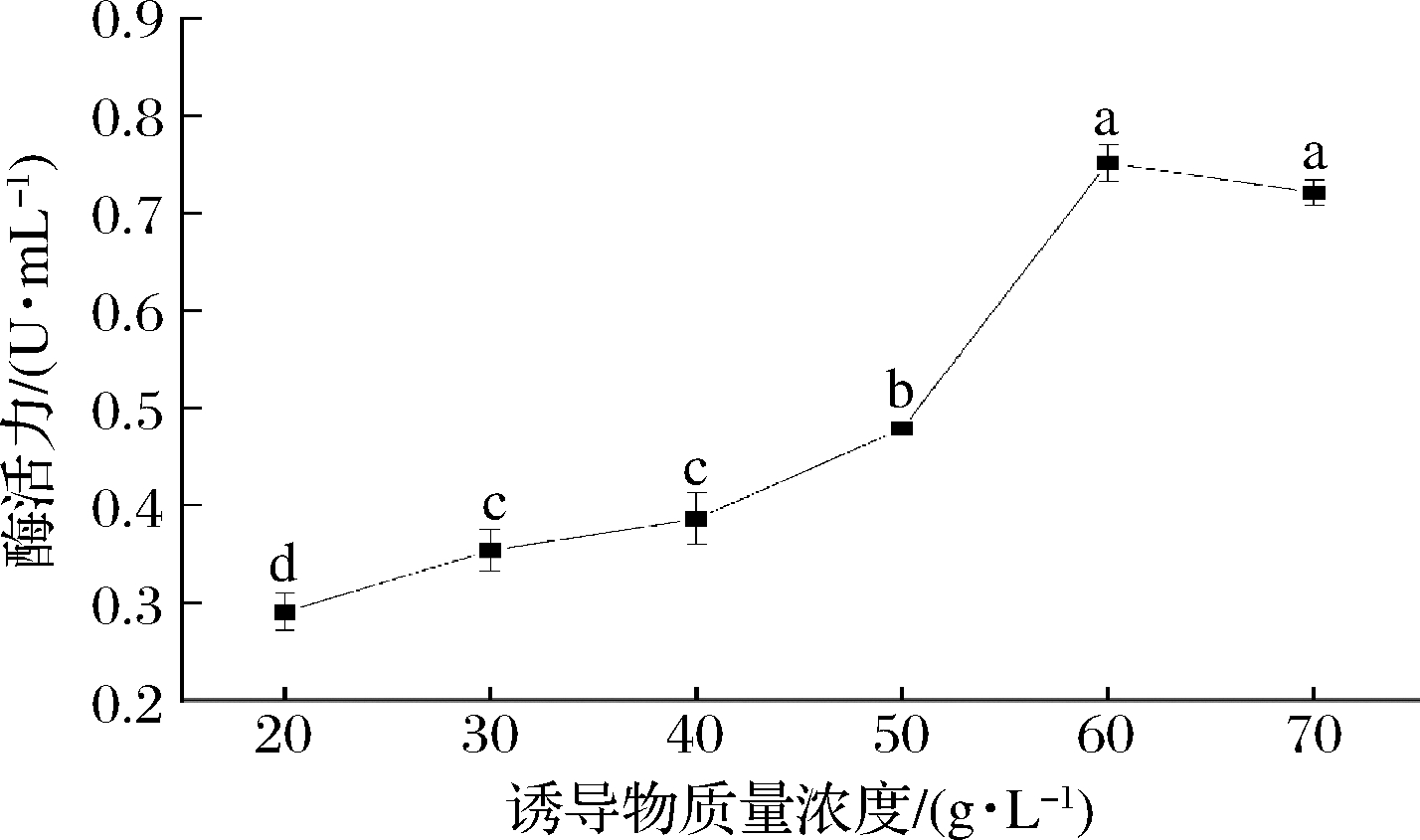
图6 诱导物浓度对突变株产单宁酶能力的影响
Fig.6 Effect of inducer concentration on tannase production of mutant strain
2.6.2 接种量对菌株产单宁酶的影响
如图7所示,当接种量为2%时,发酵液中的单宁酶酶活力最高为(0.783±0.017 6) U/mL。在发酵产酶过程中,接种量过高,营养物质消耗过快,积累的代谢物会影响细胞的生长,从而影响酶的产量[22];接种量过低,细胞生长缓慢,从而延长了发酵周期,使产酶量偏低。
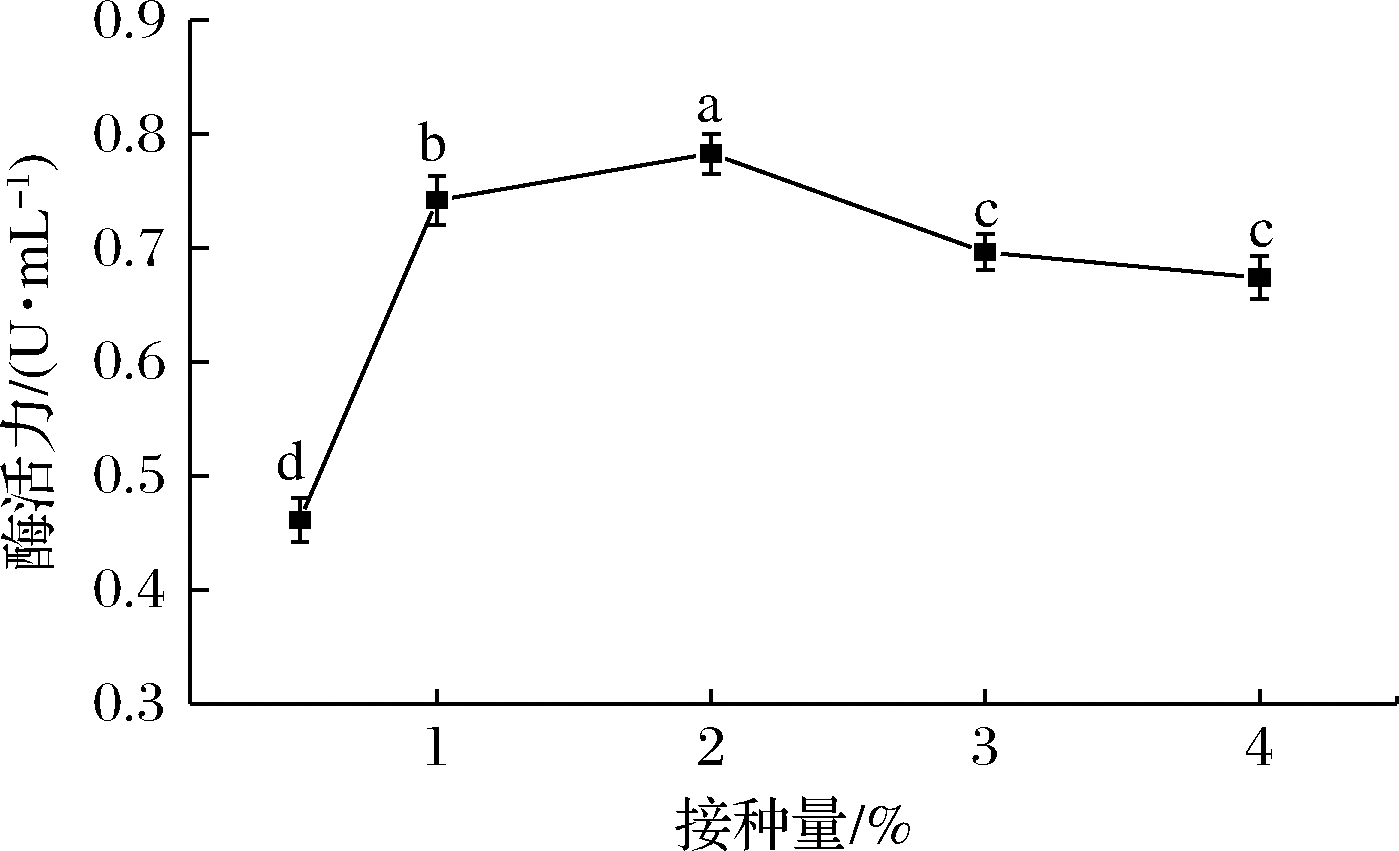
图7 不同接种量对突变株产单宁酶能力的影响
Fig.7 Effect of different inoculum on tannase production of mutant strain
2.6.3 发酵时间对菌株产单宁酶的影响
如图8所示,当发酵时间为4 d时,菌株产单宁酶能力最高,酶活力达(0.815±0.018) U/mL,此后酶活力趋于平稳。这是因为进入发酵后期,培养基中营养物质消耗殆尽,微生物开始衰老,导致酶产量降低[23]。发酵时间确定为4 d。
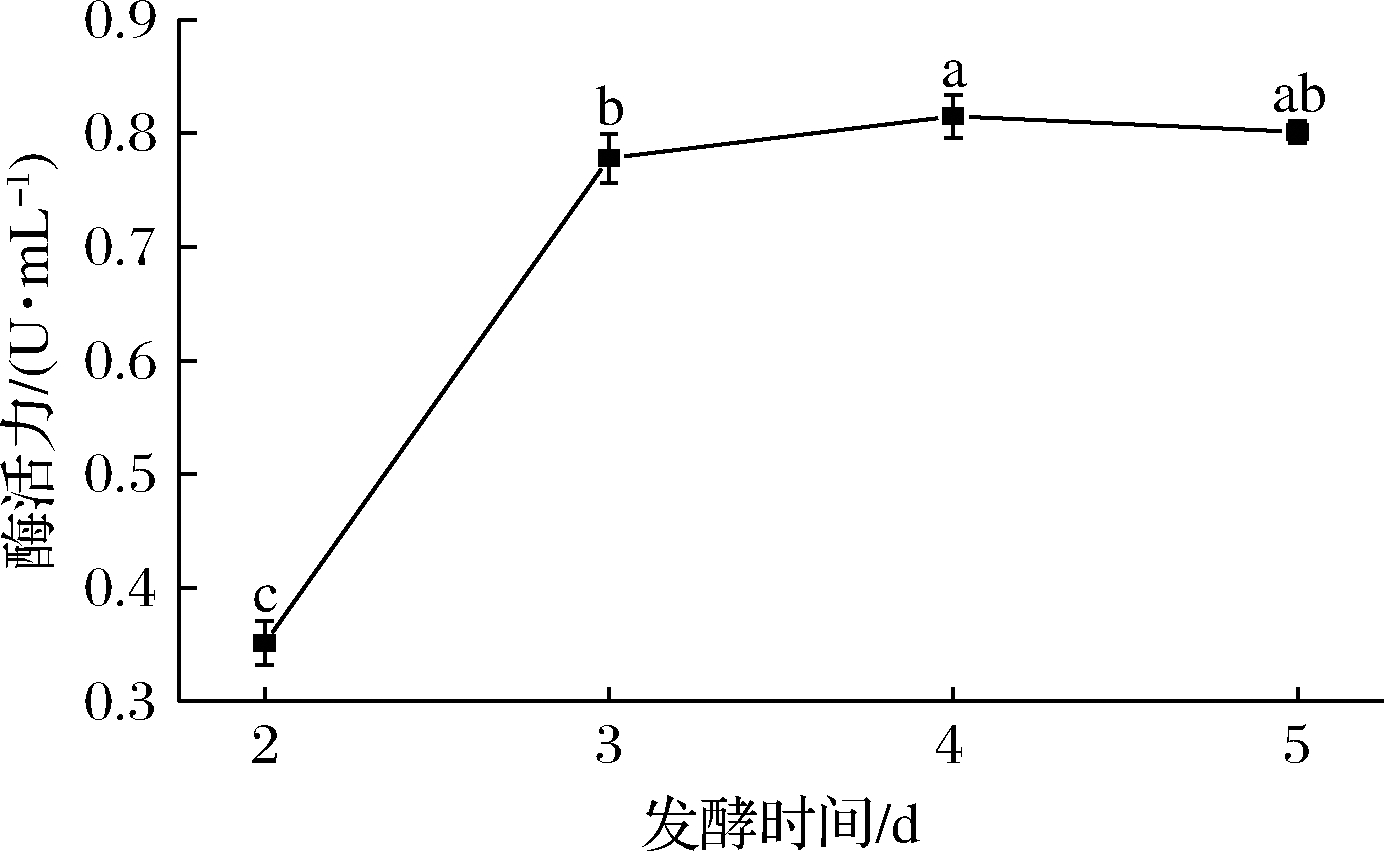
图8 发酵时间对突变株产单宁酶能力的影响
Fig.8 Effect of fermentation time on tannase production of mutant strain
2.6.4 溶氧体积分数对发酵产单宁酶的影响
发酵液中的溶氧体积分数对微生物的繁殖和代谢物形成有着重要的影响。炭黑曲霉为好氧微生物,发酵液的溶氧体积分数直接影响其产单宁酶能力。如图9所示,当溶氧体积分数为45%时,单宁酶酶活力最高达到 (0.882±0.011) U/mL,此后酶活力开始下降。
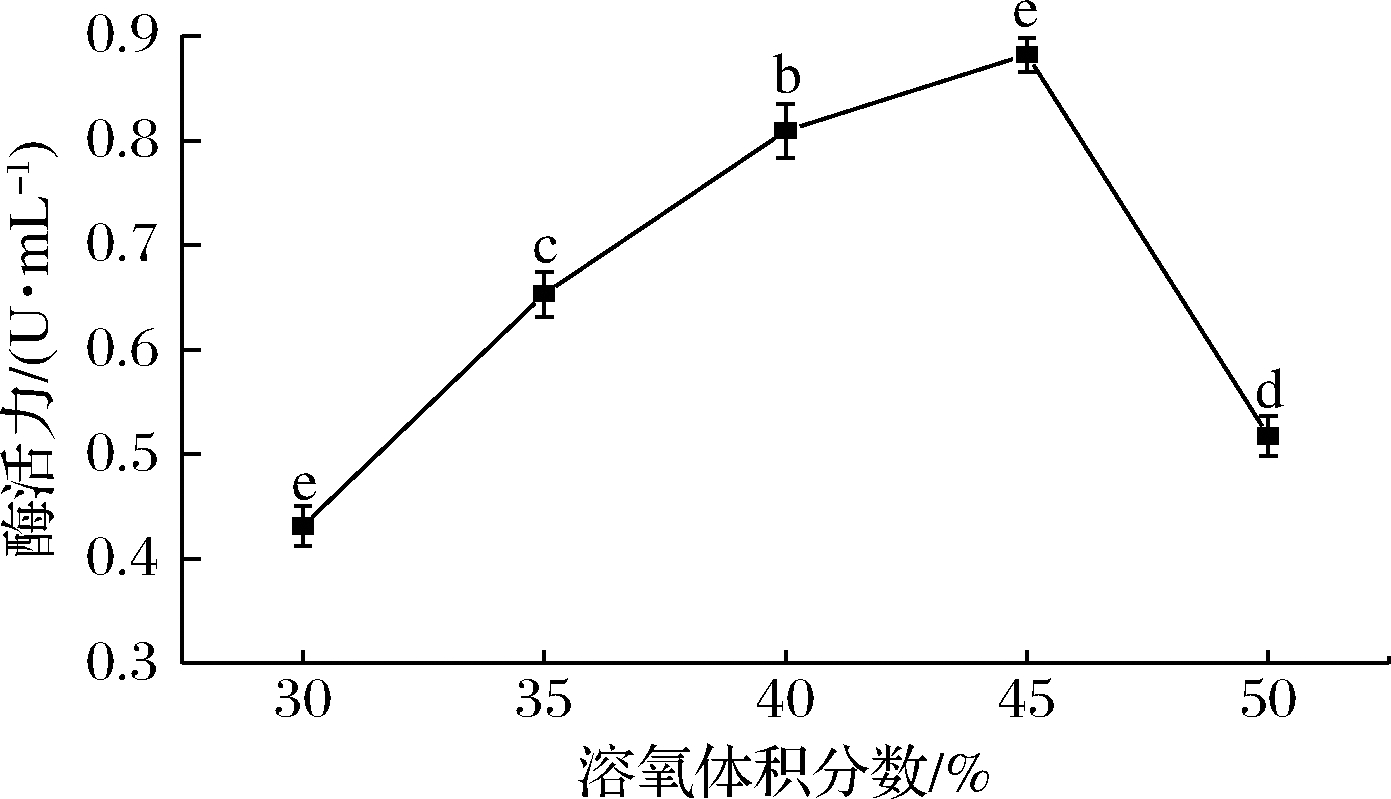
图9 溶氧体积分数对突变株产单宁酶能力的影响
Fig.9 Effect of dissolved oxygen volume on tannase production of mutant strain
2.6.5 诱导物添加时间对发酵产单宁酶的影响
如图10所示,当诱导物添加时间为24 h时,对菌株产单宁酶能力影响不明显;当添加时间为36 h时,菌株产酶能力最高,酶活力达 (1.377±0.029) U/mL,此后添加诱导物菌株产酶能力显著下降。这是由于炭黑曲霉突变株NCUF M8生长速度较快,在36 h时达到对数生长末期,此时添加诱导物有益于菌株生产单宁酶[24]。
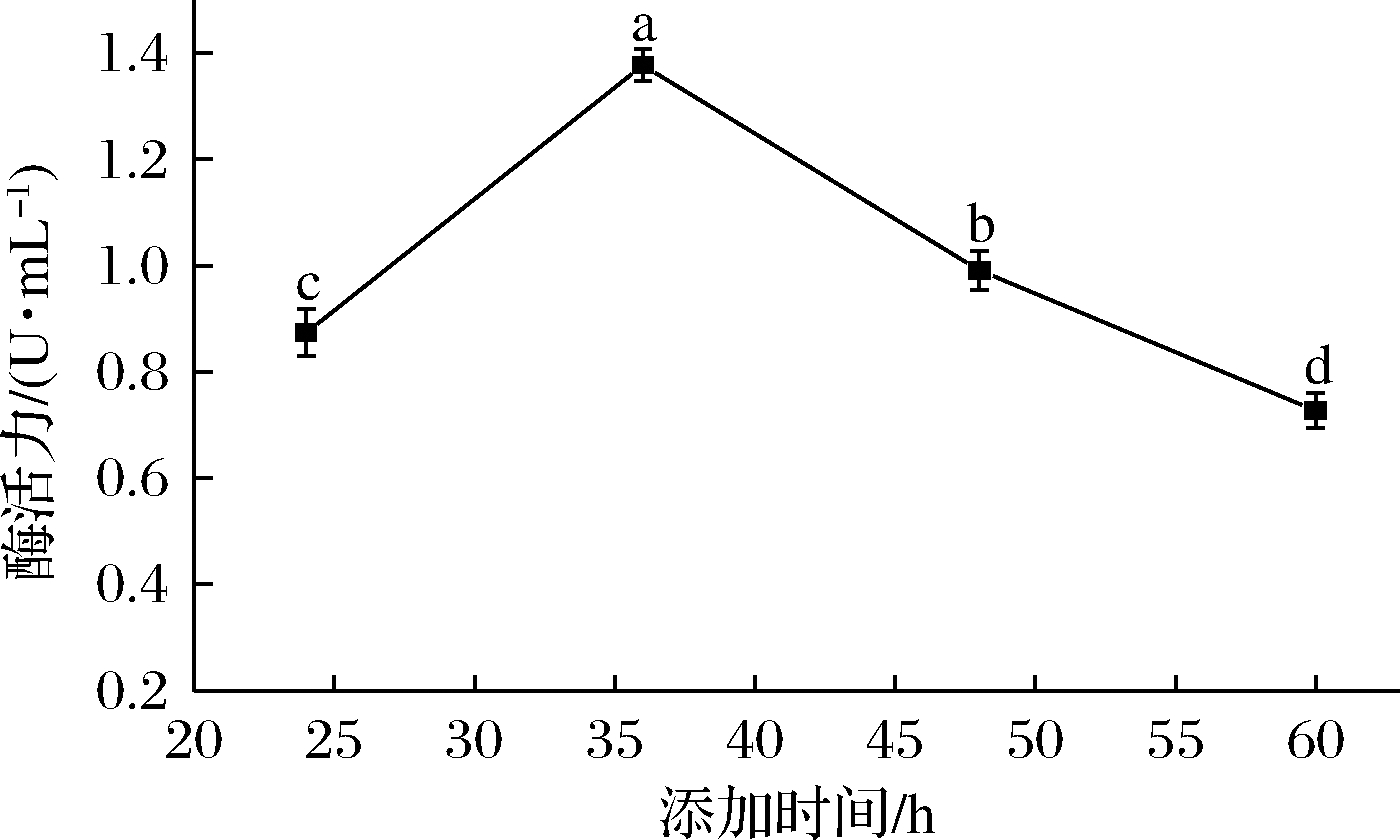
图10 单宁酸添加时间对突变株产单宁酶能力的影响
Fig.10 Effect of tannic acid adding times on tannase production of mutant strain
3 结果与讨论
本研究利用ARTP诱变技术对炭黑曲霉FCYN212进行诱变,结合溴酚蓝显色圈法的初筛和摇瓶发酵复筛,选育出产单宁酶能力较高的突变株NCUF M8。突变菌株NCUF M8于28 ℃、180 r/min摇瓶发酵96 h,胞外酶活力达到0.212 U/mL,较原始菌株提高57%。经过8次的传代培养,突变株产单宁酶能力稳定。优化后发酵工艺为:发酵时间4 d、接种量2%、单宁酸质量浓度60 g/L、溶氧体积分数45%、诱导物添加时间36 h,此时胞外单宁酶酶活力达到最大,为1.377 U/mL,与优化前相比发酵参数提高了549%。本研究通过诱变育种提高单宁酶酶活力,进一步通过工艺优化,将炭黑曲霉产酶能力提高了920%,为进一步开发该菌株产单宁酶的工业化奠定了基础。
[1] LI R Y,FU G M,LIU C M,et al.Tannase immobilisation by amino-functionalised magnetic Fe3O4-chitosan nanoparticles and its application in tea infusion[J].International Journal of Biological Macromolecules,2018,114:1 134-1 143.
[2] SIRVEN M A,NEGRETE M,TALCOTT S T.Tannase improves gallic acid bioaccessibility and maintains the quality of mango juice[J].International Journal of Food Science & Technology,2019,54(5):1 523-1 529.
[3] GOVINDARAJAN R K,REVATHI S,RAMESHKUMAR N,et al.Microbial tannase:Current perspectives and biotechnological advances[J].Biocatalysis & Agricultural Biotechnology,2016,6:168-175.
[4] YAO J,CHEN Q L,ZHONG G X,et al.Immobilization and characterization of tannase from a metagenomic library and its use for removal of tannins from green tea infusion[J].Journal of Microbiology & Biotechnology,2014,24 (1):80-86.
[5] KOSEKI T,ICHIKAWA K,SASAKI K,et al.Characterization of a novel Aspergillus oryzae tannase expressed in Pichia pastoris[J].Journal of Bioscience and Bioengineering,2018,126(5):553-558.
[6] CAO Q Q,ZOU C,ZHANG Y H,et al.Improving the taste of autumn green tea with tannase[J].Food Chemistry,2019,277:432-437.
[7] GOVINDARAJAN R K,MATHIVANAN K,R RAMESHKUMAR N,et al.Purification,structural characterization and biotechnological potential of tannase enzyme produced by Enterobacter cloacae strain 41[J].Process Biochemistry,2019,77:37-47.
[8] SHARMA N K,BENIWAL V,KUMAR N,et al.Production of tannase under solid-state fermentation and its application in detannification of guava juice[J].Preparative Biochemistry & Biotechnology,2014,44(3):281-290.
[9] YAO J,GUO G S,REN G H,et al.Production,characterization and applications of tannase[J].Journal of Molecular Catalysis B Enzymatic,2014,101:137-147.
[10] 王犁烨,陈新军,卢丕超,等.紫外诱变选育高产酒精及酸的酿酒酵母[J].中国酿造,2019,38(1):104-108.
WANG L Y,CHEN X J,LU P C,et al.Breeding of Saccharomyces cerevisiae with high-yield alcohol and acid by ultraviolet mutation[J].China Brewing,2019,38(1):104-108.
[11] 李玲,南秋利,胡永红.低能N+注入选育利普司他汀高产菌株的研究[J].中国科技论文,2018,13(12):1 372-1 374;1 408.
LI L,NAN Q L,HU Y H.Study on breeding of high yield lipstatin-producing strains by low energy nitrogen ion implantation[J].China Sciencepaper,2018,13(12):1 372-1 374;1 408.
[12] 刘明志,吕镇城,冉梦莲,等.产紫杉醇葡萄座腔菌J11菌株诱变获得高产菌株[J].药物生物技术,2015,22(1):45-48.
LIU M Z,LV Z C,RAN M L,et al.Mutant high-yield paclitaxel strain obtained from paclitaxel-producing endophytic fungus Botryosphaeria dothidea J11[J].Pharmaceutical Biotechnology,2015,22(1):45-48.
[13] ZHANG K P,MOHSIN A,DAI Y C,et al.Combinatorial effect of ARTP mutagenesis and ribosome engineering on an industrial strain of Streptomyces albus S12 for enhanced biosynthesis of salinomycin[J].Frontiers in Bioengineering and Biotechnology,2019,7:212.
[14] 张雪,张晓菲,王立言,等.常压室温等离子体生物诱变育种及其应用研究进展[J].化工学报,2014,65(7):2 676-2 684.
ZHANG X,ZHANG X F,WANG L Y,et al.Recent progress on atmospheric and room temperature plasma mutation breeding technology and its applications[J].CIESC Journal,2014,65(7):2 676-2 684.
[15] LIU K Y,FANG H,CUI F J,et al.ARTP mutation and adaptive laboratory evolution improve probiotic performance of Bacillus coagulans[J].Applied Microbiology and Biotechnology,2020,104(14):6 363-6 373.
[16] 毛斌,徐子文,陈延儒,等.常压室温等离子体诱变技术选育曲霉型豆豉发酵菌种研究[J].中国食品添加剂,2020,31(6):80-87.
MAO B,XU Z W,CHEN Y R,et al.Study on breeding of Aspergillus Dou-Chi fermentation strains by mutation technology of atmospheric pressure room temperature plasma[J].China Food Additives,2020,31(6):80-87.
[17] MONDAL K C,BANERJEE D,JANA M,et al.Colorimetric assay method for determination of the tannin acyl hydrolase (EC 3.1.1.20) activity[J].Analytical Biochemistry,2001,295(2):168-171.
[18] 夏俊芳,王小灵,古丽娜孜,等.递推式ARTP-UV复合诱变筛选高产β-葡萄糖苷酶菌株[J].食品工业科技,2020,41(15):129-134;142.
XIA J F,WANG X L,GULI N Z,et al.Iterative mutagenesis breeding of high-yielding β-glucosidase strains with ARTP-UV[J].Science and Technology of Food Industry,2020,41(15):129-134;142.
[19] 李慧玲,刘永梅.诱变选育高产DHA裂殖壶菌突变株[J].食品科技,2015,40(9):12-16.
LI H L,LIU Y M.A high-DHA production strain of Schizochytrium sp.through mutagenesis[J].Food Science and Technology,2015,40(9):12-16.
[20] KUMAR M,SINGH A,BENIWAL V,et al.Improved production of tannase by Klebsiella pneumoniae using Indian gooseberry leaves under submerged fermentation using Taguchi approach[J].AMB Express,2016,6(1):46.
[21] 周罗娜,吴鑫颖,邱树毅,等.常压室温等离子体快速诱变选育单宁酶高产黑曲霉菌株[J].食品科技,2016,41(7):14-19.
ZHOU L N,WU X Y,QIU S Y,et al.Screening of mutants of higher tannase activity strain of Aspergillus niger by atmospheric and room temperature plasmas[J].Food Science and Technology,2016,41(7):14-19.
[22] 朱运平,褚文丹,黎芳,等.黑曲霉1504产葡萄糖氧化酶的ARTP诱变、产酶条件优化及改良面粉品质研究[J].中国食品学报,2019,19(2):90-97.
ZHU Y P,CHU W D,LI F,et al.Studies on the ARTP mutation,enzyme producing condition and improving flour quality of glucose oxidase by Aspergillus niger 150[J].Journal of Chinese Institute of Food Science and Technology,2019,19(2):90-97.
[23] 张珂,魏明,崔晓峰,等.ARTP诱变选育亚油酸异构酶高产菌株及其发酵条件优化[J].徐州工程学院学报(自然科学版),2018,33(4):55-59.
ZHANG K,WEI M,CUI X F,et al.Breeding of linoleic acid isomerase-producing strain and optimization of fermentative conditions[J].Journal of Xuzhou Institute of Technology (Natural Sciences Edition),2018,33(4):55-59.
[24] 李盼盼,黄铸敏,崔莹,等.诱导物的添加时间对菌株Beta proteobacterium T1壳聚糖酶产量的影响[J].食品科技,2013,38(8):34-37.
LI P P,HUANG Z M,CUI Y,et al.The effects of adding inducer in different times on the production of chitosanase of the strain Beta proteobacterium T1[J].Food Science and Technology,2013,38(8):34-37.