大豆蛋白是优质植物蛋白的代表,兼具高营养价值和多种功能性质,在食品中的应用十分广泛[1]。大豆蛋白在市场上有3种常见形式,即大豆粉、大豆浓缩蛋白、大豆分离蛋白。其中大豆分离蛋白(soy protein isolate,SPI)是以低温脱脂豆粕为原料,进一步除去非蛋白质成分后得到的、蛋白质含量达90%(干基)以上的一种全价蛋白[2]。在SPI的生产及相关制品应用过程中,热处理是不可避免的环节,通常会出现大豆蛋白结构展开,发生不可逆的热聚集,即热变性现象,引起蛋白功能性质的明显改变,从而影响其应用[3]。陶汝青等[4]研究了热处理对大豆蛋白结构及其凝胶性质的影响,发现处理时间相同的条件下,随着加热温度的升高,SPI的β-折叠含量下降,无规卷曲含量增加,形成凝胶的强度也随之增强。王健等[5]研究了热处理对大豆蛋白柔性和结构的关系,发现对样品的热处理温度>80 ℃时,蛋白的柔性与温度和处理时间呈正相关,其起泡性和乳化性也随着温度的升高和处理时间的延长而提高。齐宝坤等[6]研究了热处理对大豆11S球蛋白溶解性和二级结构的影响,结果表明,80 ℃热处理会导致11S球蛋白的α-螺旋转化为β-折叠和无规卷曲结构,其溶解度明显降低;90和100 ℃热处理后,11S球蛋白会形成可溶性聚集体,其溶解度升高。SIRISON等[7]发现90 ℃处理显著提高了大豆蛋白的溶解度,从42%增加到85%。目前实验室条件下对SPI的热处理主要集中在不高于100 ℃的常压热处理,实际上工业生产中如喷射蒸煮温度最高可达154 ℃,高于154 ℃的高温湿热处理对SPI结构及功能是否会产生影响,相关研究文献报道较少[8]。
本文以SPI为研究对象,选取SPI的2个玻璃化转变温度附近的70与90 ℃[9]以及120、150、170、200 ℃下分别湿热处理30 min,研究高温湿热处理对SPI结构与功能的影响,为大豆蛋白及其制品在生产中的改性应用提供理论依据。
1 材料与方法
1.1 材料与试剂
脱脂豆粕,哈高科大豆食品有限责任公司;1-苯胺基-8-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS)、牛血清白蛋白(bovine serum albumin,BSA),Sigma公司;三羟甲基氨基甲烷(Tris)、福林酚试剂、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、NaOH、Na2HPO4、NaH2PO4、盐酸、异辛烷、异丙醇、甲醇、硫氰酸铵、BaCl2、三氯乙酸等试剂均为分析纯。
1.2 仪器与设备
T18高速分散机、RH Basic I磁力搅拌器,德国IKA公司;聚四氟乙烯高压反应釜(50 mL),郑州博科仪器有限公司;F—7000荧光分光光度计,日本日立公司;Nicolet 5700傅里叶变换红外光谱仪,美国Thermo Fisher公司;Mini-PROTEAN电泳仪,美国伯乐公司;新世纪T6紫外-可见光分光光度计,北京普析通用仪器有限公司;Zetasizer Nano粒度电位仪,英国马尔文公司;Synergy H1酶标仪,美国BioTek公司。
1.3 实验方法
1.3.1 SPI的制备
SPI的制备采用碱提酸沉法[8]并稍作改动。称取适量脱脂大豆粉,按料液比1∶10(g∶mL)加入去离子水,用1 mol/L NaOH溶液调pH至8.0,室温下机械搅拌2 h,离心(8 000×g,20 min),重复提取残渣1次,合并上清液待用。用2 mol/L 的HCl溶液将上清液pH调至4.5,静置0.5 h后再次离心(5 000×g,20 min),所得沉淀经水洗2次后,再次离心(5 000×g,20 min),向所得残渣中加入适量去离子水,所得分散体在去离子水中透析24 h(透析袋截留分子质量:8 k~14 kDa),隔6 h换1次水。经冷冻干燥后,置于-18 ℃冰箱保存备用。样品经凯氏定氮仪测定大豆蛋白纯度为95%(干基,N%×6.25)。
1.3.2 高温湿热处理
配制质量浓度为1 g/100 mL的SPI溶液,用1 mol/L HCl溶液及1 mol/L NaOH溶液调节pH至7.0,取10 mL样品置于50 mL聚四氟乙烯高压反应釜中,分别在70、90、120、150、170、200 ℃条件下处理30 min,样品分别命名为SPI-70、SPI-90、SPI-120、SPI-150、SPI-170、SPI-200,未经处理的样品命名为Native作为对照。取出后立即冰浴,冷却至室温后冷冻干燥待用。
1.3.3 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)
参考文献[10-11]的方法稍作修改。样品溶解于含二硫苏糖醇(DTT)的上样缓冲液(2 mg/mL),沸水浴10 min后离心(8 000×g)10 min。上样量为10 μL,采用5%的浓缩胶和12%的分离胶,并在恒定电流条件下进行电泳,浓缩胶电流为20 mA,分离胶电流为25 mA。结束电泳后采用质量分数0.25%的考马斯亮蓝R-250染色液染色1 h,再采用含有甲醇和乙酸的混合液[V(甲醇)∶V(乙酸)∶V(水)=50∶75∶875]脱色12 h。
1.3.4 色氨酸荧光光谱测定
称取适量处理前后的SPI样品分散于0.01 mol/L,pH 7.0磷酸盐缓冲溶液中,配制成浓度为1 mg/mL的蛋白溶液。采用荧光分光光度计在激发波长为290 nm条件下,以20 nm/s的扫描速度得到300~400 nm的发射光谱。其中激发狭缝和发射狭缝宽均为5 nm。
1.3.5 傅里叶红外(Fourier transform infrared spectroscopy,FTIR)光谱测定
将冻干的SPI样品与KBr进行干燥处理,取5 mg样品粉末与200 mg KBr混合,研磨均匀,然后压片,通过FTIR记录每个样品在4 000~400 cm-1的透过率光谱图,分辨率 4 cm-1,扫描32次。谱图采用Omnic 8.0和Peakfit 4.12软件进行分析,包括在酰胺Ι带(1 700~1 600 cm-1)范围内进行两点基线校正、平滑处理、去卷积、作二阶导数同时采用Gaussian法进行多次曲线拟合,使残差R2最小;最后将拟合出的子峰归属给蛋白的4种二级结构,并通过计算各子峰面积百分比推导蛋白样品的二级结构组成。各子峰与二级结构对应关系:1 660~1 650 cm-1为α-螺旋;1 640~1 610 cm-1为β-折叠;1 700~1 661 cm-1为β-转角;1 650~1 640 cm-1为无规卷曲[6]。
1.3.6 表面疏水性测定
参考KATO等[12]的方法采用ANS荧光探针法测定蛋白的表面疏水性,稍作修改。将未处理和湿热处理后的SPI样品溶解于0.01 mol/L,pH为7.0的磷酸盐缓冲液中,最终质量浓度范围为0.1~2.0 mg/mL。取样品液2 mL,加入50 μL,8 mmol/L的ANS溶液振荡,黑暗处静置5 min。设定激发波长为360 nm,通过荧光分光光度计记录在480 nm处的荧光强度,其中激发和发射狭缝宽度均为5 nm。通过荧光强度对蛋白质浓度作线性回归分析,曲线初始阶段的斜率即为蛋白质的表面疏水性指数。
1.3.7 溶解度的测定
蛋白质溶解度依照ZHAO等[13]的方法,稍作修改。常温下,取0.2 g样品分散在20 mL去离子水中,搅拌30 min后调节pH至中性,再搅拌30 min,离心(5 000×g,10 min)后取适量上清液稀释,以BSA为标准蛋白,用Lowry法测定上清液中蛋白质量。按公式(1)计算溶解度:
溶解度![]()
(1)
1.3.8 粒径及电位的测定
采用粒度电位仪对SPI样品进行粒径及Zeta电位测定。材料折射率为1.450,分散介质设定为水。用去离子水将样品稀释至1 mg/mL,在25 ℃下平衡120 s后开始测试。
1.3.9 浊度的测定
参考LIU等[14]的方法测定样品浊度,略作改动。用去离子水将样品稀释为5 mg/mL,将200 μL待测样品滴加到96孔板中,利用酶标仪在波长600 nm下测定吸光度值,用去离子水作为空白对照。A600值即为浊度值。
1.3.10 乳化性及乳化稳定性的测定
采用比浊法测定乳化性及乳化稳定性。在圆底离心管中加入16 mL蛋白质量浓度为1 mg/mL的样品溶液和4 mL大豆油,用高速分散机以12 000 r/min高速剪切1 min,随即从距底部0.5 cm处取50 μL乳状液,加入5 mL SDS(1 g/L)溶液进行稀释,涡旋振荡混匀。采用紫外分光光度计在500 nm处测定吸光值A0,10 min后再次移取50 μL混匀的乳状液,用SDS溶液稀释后测定其吸光值A10,同时做空白。按公式(2)、(3)计算乳化性及乳化稳定性:
乳化性![]()
(2)
乳化稳定性![]()
(3)
式中:ρ,形成溶液前样品溶液质量浓度,g/mL;D,稀释倍数;φ,油相所占体积分数,0.20。
1.3.11 统计分析
样品测试均进行3组平行实验。结果以“平均值±标准偏差”表示,采用OriginPro 2020软件作图及ANOVA Tukey分析实验数据,图表中不同字母表示显著性差异(P<0.05)。
2 结果与分析
2.1 SDS-PAGE分析
7S球蛋白和11S球蛋白占比超过大豆蛋白总量的80%,是其重要组成部分。7S球蛋白由3个亚基通过非共价作用组成,α亚基(67 kDa),α′亚基(71 kDa)和β亚基(50 kDa)。11S球蛋白是由6个不同亚基组成的六聚体,每个亚基由1个分子质量约为35 kDa的酸性亚基A(酸性pI)和1个分子质量约为20 kDa的碱性亚基B(碱性pI)通过二硫键连接而成[1]。
图1为经过不同温度湿热处理后的SPI电泳图。电泳图谱显示,热处理温度超过90 ℃,分离胶条带,尤其是低分子质量条带(75 k、63 k、48 k、35 kDa)的颜色逐渐加深,浓缩胶和分离胶交界处的聚集体的量也随之增加。当热处理温度>150 ℃时,观察到各亚基的条带颜色较浅,与文献观察到的结果一致[15],说明热处理后亚基可能参与聚集体的形成,其中可溶性聚集物形成与酸性亚基A、α亚基和α′亚基相互作用有关,不可溶聚集物与碱性亚基B和β亚基有关[7]。除此之外,SPI的亚基组成无显著变化,说明不同温度的处理对SPI的一级结构影响较小,这与射频加热得到的结果类似[16]。
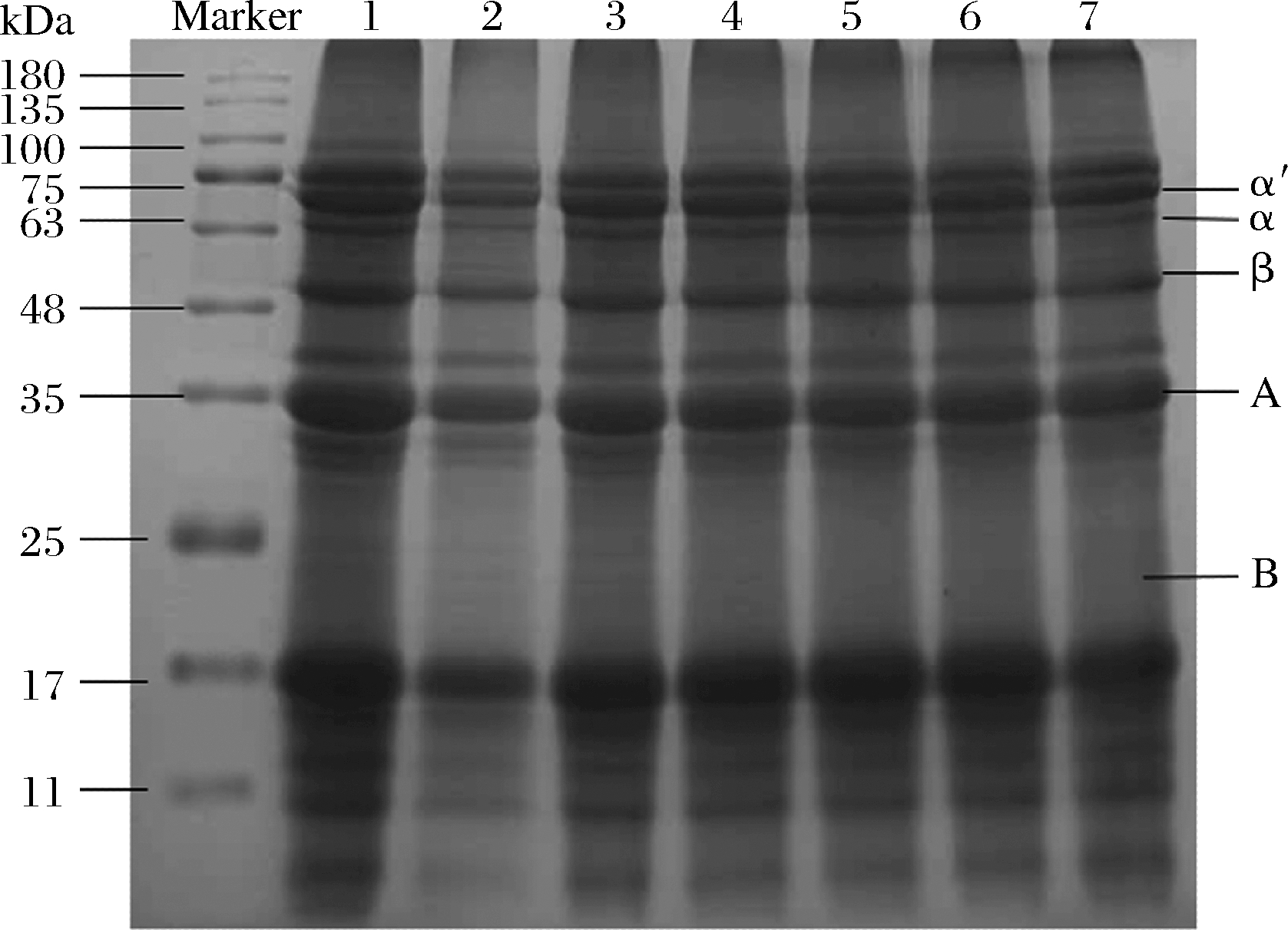
1-未经处理的样品Native;2-SPI-70;3-SPI-90;4-SPI-120;5-SPI-150;6-SPI-170;7-SPI-200
图1 不同高温湿热条件处理的SPI凝胶电泳图
Fig.1 SDS-PAGE of SPI under different high temperature hydrothermal treatment
2.2 色氨酸荧光光谱分析
色氨酸(Trp)残基对微环境的变化十分敏感,因此蛋白质的内源荧光光谱通常用于研究蛋白分子三级结构的变化及蛋白质间的相互作用。激发波长290 nm下,SPI发射的内源荧光主要来自于Trp[17]。高温湿热处理对SPI内源荧光的影响如图2所示,高温湿热处理导致SPI的最大荧光发射强度显著降低,最大发射波长(λmax)从337 nm红移至351.8 nm,其中200 ℃高温湿热处理的红移程度远大于其他温度,表明SPI在此条件下三级结构发生明显变化。未处理的SPI最大发射波长(λmax)在337.8 nm处且荧光强度最大,表明色氨酸残基位于SPI的内部疏水区域,这与DUFOUR等[18]的研究结果一致。随着温度的提高,蛋白质的变性程度愈大,暴露在表面的Trp残基愈多,发色团电子跃迁所需能量减少,荧光量子产率降低,导致荧光强度的降低。高温湿热处理使Trp残基从蛋白内部疏水区域转移至亲水区域,暴露在极性的微环境中,从而发射波长λmax发生红移[19]。

图2 不同高温湿热条件处理的SPI内源荧光光谱图
Fig.2 Intrinsic fluorescence spectra of SPI under different high temperature hydrothermal treatment
2.3 傅里叶红外光谱分析
图3为高温湿热处理前后SPI的FTIR图谱。3 600~3 300 cm-1位置的峰强度通常可以表示SPI分子内部及其分子间氢键、O—H、C—H键伸缩振动的强度[20]。随着温度不断升高,在2 932 cm-1位置的峰几乎没有变化,这说明高温湿热处理对SPI分子内的C—H键产生的影响较小[21]。

图3 不同高温湿热条件处理的SPI红外光谱图
Fig.3 FTIR spectra of SPI under different high temperature hydrothermal treatment
蛋白质的酰胺Ⅰ带(1 700~1 600 cm-1)包含了C![]() O键和C—N键的伸缩振动及微弱的N—H面内弯曲振动,并对主要由氢键维持的二级结构变化敏感,因此常用于分析蛋白质的二级结构。表1为通过红外光谱分析得到的高温湿热处理前后蛋白的二级结构组成的结果。数据表明,SPI的二级结构主要是以β-折叠为主,这与PLEITZ等[3]和MARCONE等[22]研究结果一致。经过不同高温湿热处理后的蛋白二级结构中的各组成的含量发生明显变化。与未处理的样品相比,经过高温湿热处理的SPI β-折叠结构含量降低,α-螺旋及β-转角结构含量增加,无规则卷曲含量无明显变化,表明β-折叠结构转化成α-螺旋及β-转角结构。李杨等[23]研究较低温度(70、90 ℃)处理SPI的二级结构也有类似发现。90 ℃处理后的样品,7S球蛋白和11S球蛋白均完全变性,其他二级结构转变为β-转角和β-反平行结构。其中β-折叠结构含量最低,而β-折叠结构含量反映了蛋白疏水位点的暴露程度。120、150、200 ℃高温湿热处理的样品β-折叠结构含量逐渐增加,可能与形成可溶性聚集体有关[6]。
O键和C—N键的伸缩振动及微弱的N—H面内弯曲振动,并对主要由氢键维持的二级结构变化敏感,因此常用于分析蛋白质的二级结构。表1为通过红外光谱分析得到的高温湿热处理前后蛋白的二级结构组成的结果。数据表明,SPI的二级结构主要是以β-折叠为主,这与PLEITZ等[3]和MARCONE等[22]研究结果一致。经过不同高温湿热处理后的蛋白二级结构中的各组成的含量发生明显变化。与未处理的样品相比,经过高温湿热处理的SPI β-折叠结构含量降低,α-螺旋及β-转角结构含量增加,无规则卷曲含量无明显变化,表明β-折叠结构转化成α-螺旋及β-转角结构。李杨等[23]研究较低温度(70、90 ℃)处理SPI的二级结构也有类似发现。90 ℃处理后的样品,7S球蛋白和11S球蛋白均完全变性,其他二级结构转变为β-转角和β-反平行结构。其中β-折叠结构含量最低,而β-折叠结构含量反映了蛋白疏水位点的暴露程度。120、150、200 ℃高温湿热处理的样品β-折叠结构含量逐渐增加,可能与形成可溶性聚集体有关[6]。
表1 通过红外光谱结果计算的高温湿热处理的和未经过处理的SPI的二级结构含量 单位:%
Table 1 Contents of secondary structure in treated and untreated SPI calculated by infrared spectrum

样品名称α-螺旋β-折叠β-转角β-反平行无规则卷曲Native20.2934.3814.557.5823.20SPI-7021.9129.0516.539.0923.42SPI-9021.8528.5216.779.7823.08SPI-12021.2130.3515.989.3923.07SPI-15021.7430.8516.377.9223.12SPI-17021.8229.9316.218.9823.06SPI-20022.0330.1716.188.4623.16
2.4 表面疏水性
高温湿热处理对SPI的表面疏水性有明显的影响,如图4所示。未经处理的SPI的表面疏水性为96.74,当处理温度为70~90 ℃时,SPI的疏水性逐渐增强,在90 ℃时达到最大,与顾龙建等[24]的研究结果一致。β-折叠结构易存在于蛋白质聚集体的内部[25],由二级结构含量可知,此温度下样品的β-折叠结构含量最低,表明热处理温度的提高加剧了蛋白质的变性,更多的疏水基团暴露,从而导致表面疏水性的提高。随着加热温度进一步上升至200 ℃,SPI基团中的亚基间形成更多的聚集体,疏水基团被隐藏至蛋白内部,导致表面疏水性发生一定程度的下降[6]。200 ℃高温湿热处理和未处理样品的疏水性无显著性差异。

图4 不同高温湿热条件对SPI表面疏水性的影响
Fig.4 The effect of high temperature hydrothermal treatment on the surface hydrophobicity of SPI
2.5 溶解度
溶解度是蛋白质功能性质的一个重要指标,同时决定了蛋白众多其他功能特性如乳化性等。高温湿热处理对SPI溶解性的影响如图5所示。未处理的蛋白溶解性为70%,SPI被高温湿热处理后,其溶解性得到了显著的提升,且在90 ℃时达到最高为86%。这可能是由于当SPI受热时,不溶的蛋白聚集体发生解聚,使得溶解性增加,或者是由于加热处理使得蛋白多肽链展开,肽链间形成了可溶性的聚集[26-27]。凝胶电泳结果中低分子质量条带的加深和荧光结果色氨酸微环境极性的增加都表明了高温热处理引起蛋白构象的变化,引起溶解性的变化。当处理温度升至120 ℃时,其溶解度约为59.67%,溶解度明显降低,过高的加热温度使蛋白发生变性,导致蛋白质的聚集和疏水作用提高,从而导致溶解度下降,这与WENG等[26]的研究结果一致。

图5 不同高温湿热条件处理对SPI溶解度的影响
Fig.5 The effect of high temperature hydrothermal treatment on the solubility of SPI
处理温度进一步提高至200 ℃,其溶解度快速升高;在高温处理样品时,可以发现溶液呈均一状,且无聚集体析出,可能的原因是高温下SPI内部的7S和11S球蛋白发生结构重组,2类蛋白亚基间发生相互作用形成可溶性聚集体,从而保持较好的溶解性[28]。以上结果表明,SPI的溶解度受温度影响较大。
2.6 电位
图6是不同高温湿热条件处理后SPI的Zeta电位。SPI是典型的两性电解质,在中性pH值时,所有SPI样品的Zeta电位均为负值,说明蛋白质表面存在净负电荷[29]。随着湿热处理温度的升高,SPI的Zeta电位绝对值呈减小趋势。这表明SPI表面的带负电残基随着高温湿热处理逐渐掩埋,静电排斥减少,溶液稳定性降低,这将有利于体系中蛋白分子形成聚集体。

图6 不同高温湿热条件处理的SPI的Zeta电位图
Fig.6 Zeta potential of SPI under different high temperature hydrothermal treatment
2.7 粒径
图7是不同高温湿热处理下SPI的平均粒径,高温湿热处理会对SPI平均粒径产生显著影响(P<0.05)。70~150 ℃高温湿热处理显著降低SPI的平均粒径,另一方面,170~200 ℃高温湿热处理显著增大SPI的平均粒径。周麟依等[30]认为蛋白质粒径的变化主要与蛋白质分子的交联与聚集有关,蛋白的平均粒径较大说明蛋白分子之间相互聚集形成较多聚集体,反之则蛋白间形成较少聚集体。
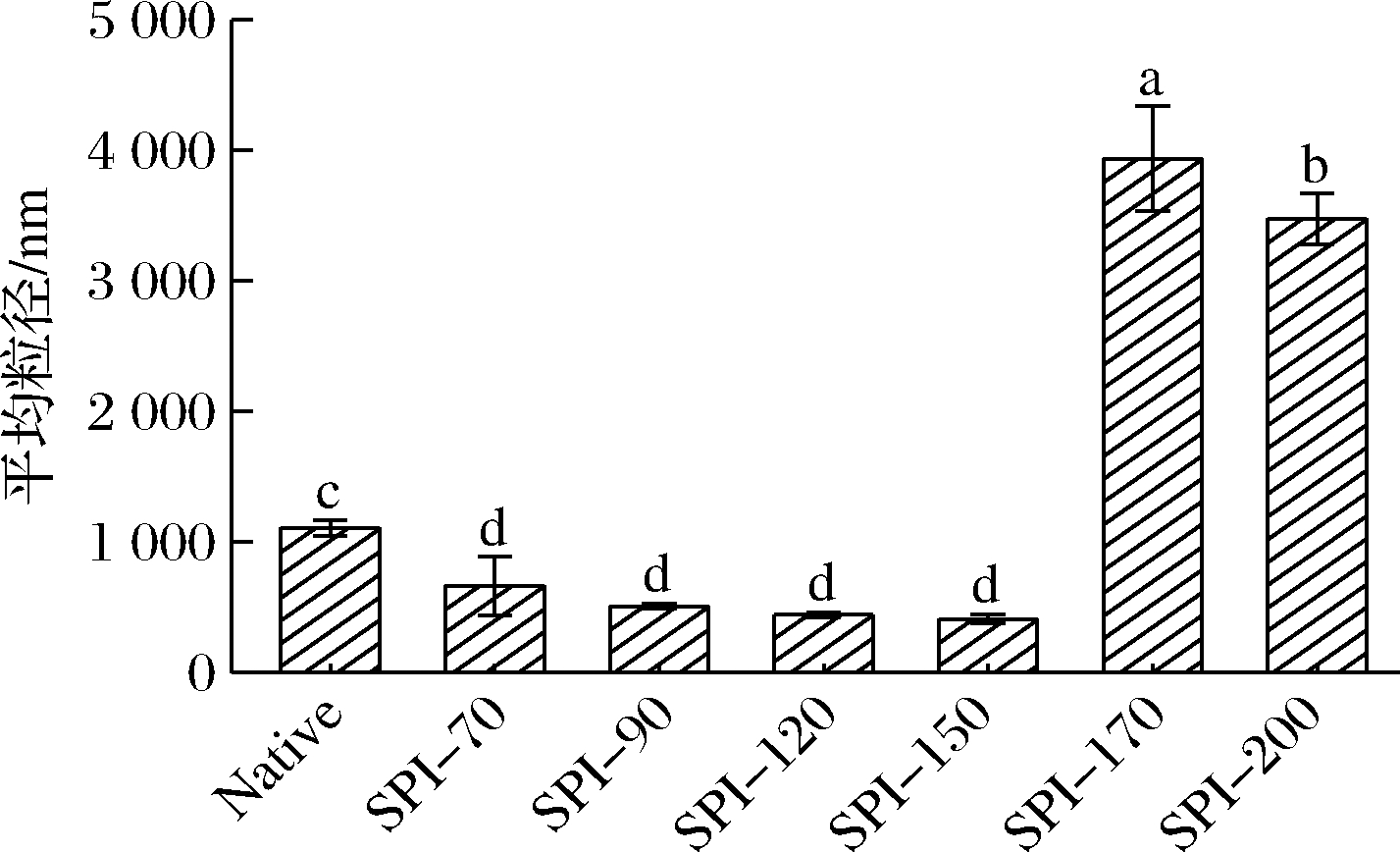
图7 不同高温湿热条件处理的SPI平均粒径图
Fig.7 The average particle size of soy protein isolate under different high temperature hydrothermal treatment
170、190 ℃高温湿热处理形成了3 500~4 000 nm左右的聚集体(P<0.05),表明在较高温度的湿热处理下体系发生了明显的聚集,与在这2个温度下SPI浊度明显更高的结果一致。
2.8 浊度
浊度是表征蛋白质聚集程度的关键指标,能够侧面反映蛋白在溶液中的分散状态[31]。图8是不同高温湿热处理后SPI的浊度。由测定结果可知,70~150 ℃高温湿热处理对SPI浊度无显著影响,而170~200 ℃高温湿热处理后的样品浊度显著增大,CROMWELL等[32]认为浊度的增加和蛋白分子聚集体形成有关。SPI-170、SPI-200浊度的显著增加与其粒径显著增大的结果相互验证,表明SPI经高温湿热处理后形成了聚集体。另一方面,溶解度的测试结果表明在这2个温度湿热处理下SPI的可溶性仍然高达80%,这表明形成的聚集体是可溶的。

图8 不同高温湿热处理对SPI浊度(A600)的影响
Fig.8 The effect of high temperature hydrothermal treatment on the turbidity (A600) of SPI
2.9 乳化性及乳化稳定性
高温湿热处理后的SPI溶液乳化性及乳化稳定性如图9所示。由图9-a可知,随着处理温度的升高,SPI溶液的乳化性呈现出先上升后下降的趋势,90 ℃时乳化性最大。这是由于适当的温度处理可使SPI发生热变性,蛋白的结构展开,β-折叠结构被破坏,含量降低,逐渐转化为α-螺旋和β-转角结构,故增加了SPI的柔性[5],更多的疏水性位点被暴露,从而促进其在界面的展开,进而增大了其乳化性。热处理温度为120、150、170、200 ℃时,分子热运动加剧,相互作用的几率增大,致使其乳化性降低[33]。

a-乳化性;b-乳化稳定性
图9 高温湿热处理前后的SPI的乳化性及乳化稳定性
Fig.9 EAI and ESI of SPI before and after high temperature hydrothermal treatment
另一方面,高温处理蛋白质使其结构过度展开,更多的疏水基团暴露,增强了分子间的相互作用,导致乳化性降低。
图9-b显示,随着处理温度的升高,大豆分离蛋白的乳化稳定性逐渐升高,这是由于热处理使得蛋白质分子逐渐展开,分子形态逐渐松散,更多的疏水基团暴露,界面蛋白间疏水作用增强,界面膜厚度增加,油滴间比较稳定,从而增加了体系的乳化稳定性[34],200 ℃高温湿热处理的样品乳化稳定性最强。这表明高温湿热处理有利于改善大豆分离蛋白的乳化稳定性。
3 结论
高温湿热处理对SPI的结构和功能特性影响显著。高温湿热处理后的SPI一级结构组分无较大的变化;经过热处理后的SPI结构展开,发色团暴露出来,导致最大吸收波长发生红移;相较于未处理的样品,高温处理的蛋白二级结构中的各个组分的含量发生显著变化,具体表现为β-折叠含量减少,α-螺旋含量增加。70~90 ℃处理SPI,其溶解度随温度升高而增大;SPI-90溶解度最大,SPI-120溶解度最小;SPI经170~200 ℃高温湿热处理,溶解度又随温度的增高而增大;相较于其他样品,SPI-170、SPI-200的平均粒径及浊度显著增大,SPI聚集程度较大,电位绝对值明显降低。SPI的表面疏水性和乳化性呈先增加后降低趋势,处理温度为90 ℃时达到最大,而乳化稳定性和温度呈正相关。
[1] NISHINARI K,FANG Y,GUO S,et al.Soy proteins:A review on composition,aggregation and emulsification[J].Food Hydrocolloids,2014,39:301-318.
[2] KOSHY R R,MARY S K,THOMAS S,et al.Environment friendly green composites based on soy protein isolate—a review[J].Food Hydrocolloids,2015,50:174-192.
[3] PLIETZ P,DAMASCHUN G.The structure of the 11S seed globulins from various plant species:Comparative investigations by physical methods[J].Studia Biophysica,1986,116(3):153-173.
[4] 陶汝青, 夏宁,滕建文.热处理对大豆分离蛋白结构和凝胶性的影响[J].食品科学,2018,39(9):60-66.
TAO R Q,XIA N,TENG J W.Effect of heat treatment on the secondary structure and gel property of soybean protein isolate[J].Food Science,2018,39(9):60-66.
[5] 王健, 徐晔晔,于洁,等.不同热处理大豆蛋白柔性与结构的关系[J].食品科学,2018,39(7):85-90.
WANG J,XU Y Y,YU J,et al.Effect of heat treatments on the relationship between flexibility and structure of soy protein[J].Food Science,2018,39(7):85-90.
[6] 齐宝坤, 赵城彬,李杨,等.热处理对大豆11S球蛋白溶解性和二级结构的影响[J].食品科学,2018,39(22):39-44.
QI B K,ZHAO C B,LI Y,et al.Effect of heat treatment on solubility and secondary structure of soybean 11S glycinin[J].Food Science,2018,39(22):39-44
[7] SIRISON J,MATSUMIYA K,SAMOTO M,et al.Solubility of soy lipophilic proteins:Comparison with other soy protein fractions[J].Bioscience Biotechnology and Biochemistry,2017,81(4):790-802.
[8] 袁德保. 大豆蛋白热聚集行为及其机理研究[D].广州:华南理工大学,2010.
YUAN D B.Heat-induced aggregation of soy proteins and its mechanism[D].Guangzhou:South China University of Technology,2019.
[9] 安然. 大豆分离蛋白可溶性热聚集行为及其超声调控研究[D].哈尔滨:东北农业大学,2019.
AN R.Study on soluble thermal aggregates of soybean protein isolate and its ultrasonic regulation[D].Harbin:Northeast Agricultural University,2019.
[10] LAEMMLI U K.Cleavage of structural proteins during assembly of head of Bacteriophage-T4[J].Nature,1970,227(5 259):680-685.
[11] MORI T,NAKAMURA T,UTSUMI S.Gelation mechanism of soybean 11S globulin:Formation of soluble aggregates as transient intermediates[J].Journal of Food Science,1982,47(1):26-30.
[12] KATO A,SASAKI Y,FURUTA R.Functional protein-polysaccharide conjugate prepared by controlled dry-heating of ovalbumin-dextran mixtures[J].Agricultural and Biological Chemistry,2014,54(1):107-112.
[13] ZHAO Q,SELOMULYA C,XIONG H,et al.Comparison of functional and structural properties of native and industrial process-modified proteins from long-grain indica rice[J].Journal of Cereal Science,2012,56(3):568-575.
[14] LIU D S,ZHOU P,NICOLAI T.Effect of Kappa carrageenan on acid-induced gelation of whey protein aggregates.Part I:Potentiometric titration,rheology and turbidity[J].Food Hydrocolloids,2020,102:105 589.
[15] 王雅卉, 邢霁云,徐婧婷,等.高温热处理对大豆蛋白消化利用效果的影响[J].食品科学,2019,40(15):92-99.
WANG Y H,XING J Y,XU J T,et al.Effect of high-temperature heat treatment on digestibility of soybean protein[J].Food Science,2019,40(15):92-99.
[16] 郭超凡. 射频加热处理对大豆分离蛋白功能特性及结构的影响[D].杨陵:西北农林科技大学,2017.
GUO C F.Effects of radio frequency heating treatment on functional properties and structure changes of soy protein isolate[D].Yangling:Northwest A&F University,2017.
[17] MA L,LI B,HAN F X,et al.Evaluation of the chemical quality traits of soybean seeds,as related to sensory attributes of soymilk[J].Food Chemistry,2015,173:694-701.
[18] DUFOUR E,HOA G H B,HAERTLÉ T.High-pressure effects on beta-lactoglobulin interactions with ligands studied by fluorescence[J].Biochimica Et Biophysica Acta,1994,1 206(2):166-172.
[19] LIANG H N,TANG C H.Emulsifying and interfacial properties of vicilins:Role of conformational flexibility at quaternary and/or tertiary levels[J].Journal of Agricultural & Food Chemistry,2013,61(46):11 140-11 150.
[20] SCHMIDT V,GIACOMELLI C,SOLDI V.Thermal stability of films formed by soy protein isolate-sodium dodecyl sulfate[J].Polymer Degradation and Stability,2005,87(1):25-31.
[21] MONSOOR M A.Effect of drying methods on the functional properties of soy hull pectin[J].Carbohydrate Polymers,2005,61(3):362-367.
[22] MARCONE M F,BONDI M C,YADA R Y.Isolation of soybean 11S globulin by isoelectric precipitation and sephacryl S-300 gel filtration chromatography:A new purification technique[J].Bioscience,Biotechnology,and Biochemistry,1994,58(2):413-415.
[23] 李杨, 王中江,王瑞,等.不同热处理条件下大豆分离蛋白的红外光谱分析[J].食品工业科技,2016,37(8):104-109.
LI Y,WANG Z J,WANG R,et al.Fourier transform infrared spectroscopic analysis of soybean isolate protein at different heat treatment conditions[J].Science and Technology of Food Industry,2016,37(8):104-109.
[24] 顾龙建, 源博恩,赵强忠,等.pH调控-热处理改善大豆蛋白中间组分乳化特性研究[J].食品与发酵工业,2011,37(5):12-16.
GU L J,YUAN B E,ZHAO Q Z,et al.Effect of pH & heat treatment on emulsifying capacity of intermediate of soybean protein[J].Food and Fermentation Industries,2011,37(5):12-16.
[25] 赵城彬, 尹欢欢,鄢健楠,等.不同热处理条件下大豆蛋白体外模拟消化产物结构和分子质量分布[J].中国食品学报,2020,20(5):59-65.
ZHAO C B,YIN H H,YAN J N,et al.Structure and molecular weight distribution in vitro digestion products of soybean protein at different heat treatment conditions[J].Journal of Chinese Institute of Food Science and Technology,2020,20(5):59-65.
[26] WENG J Y,QI J R,YIN S W,et al.Fractionation and characterization of soy β-conglycinin-dextran conjugates via macromolecular crowding environment and dry heating[J].Food Chemistry,2016,196:1 264-1 271.
[27] 耿蕊, 卢岩,孔保华,等.pH偏移结合加热处理对大豆分离蛋白乳化特性的影响[J].中国食品报,2016,16(1):173-180.
GENG R,LU Y,KONG B H,et al.The influence of emulsify properties of soybean protein isolate induced by pH-shifting combined with heating treatment[J].Journal of Chinese Institute of Food Science and Technology,2016,16(1):173-180.
[28] 李倩如, 熊瑶,叶倩,等.大豆分离蛋白聚集体及凝胶制品的研究进展[J].农产品加工,2019(8):71-74.
LI Q R,XIONG Y,YE Q,et al.Reviews in soy protein isolate aggregates and gel products[J].Farm Products Processing,2019(8):71-74.
[29] LIANG G J,CHEN W P,QIE X J,et al.Modification of soy protein isolates using combined pre-heat treatment and controlled enzymatic hydrolysis for improving foaming properties[J].Food Hydrocolloids,2020,105:105 764.
[30] 周麟依, 孙玉凤,吴非.丙二醛氧化对米糠蛋白结构及功能性质的影响[J].食品科学,2019,40(12):98-107.
ZHOU L Y,SUN Y F,WU F.Effects of oxidation by malondialdehyde on the structure and function of rice bran protein[J].Food Science,2019,40(12):98-107.
[31] 齐宝坤, 李杨,王中江,等.不同品种大豆分离蛋白Zeta电位和粒径分布与表面疏水性的关系[J].食品科学,2017,38(3):114-118.
QI B K,LI Y,WANG Z J,et a1.Relationship between surface hydrophobicity and zeta potential as well as particle size distribution of soybean protein isolates from different varieties[J].Food Science,2017,38(3):114-118.
[32] CROMWELL M E M,HILARIO E,JACOBSON F.Protein aggregation and bioprocessing[J].AAPS Journal,2006,8(3):E572-E579.
[33] 王冬梅, 范志军,安然,等.大豆蛋白热聚集体的溶液行为表征[J].现代食品,2020(7):182-184.
WANG D M,FAN Z J,AN R,et al.Characterization of solution behavior of soybean protein thermal aggregates[J].Modern Food,2020(7):182-184.
[34] INGRASSIA R,PALAZOLO G PALAZZOLO,WAGNER J R,et al.Heat treatments of defatted soy flour:Impact on protein structure,aggregation,and cold-set gelation properties[J].Food Structure,2019,22:100 130.