兰州百合(Lilium davidii var unicolor Salisb)为川百合的变种,在药用的同时,也是兰州地区常见的蔬菜之一。经研究发现由百合鳞茎提取出的百合多糖(lily polysaccharicle,LPS)是其具有抗氧化、抗肿瘤、降血糖、调节免疫等药用价值的重要原因,百合多糖清除自由基的能力使其成为一种较有前景的抗氧化剂[1],尤其是多糖作为一种天然产物副作用小、无毒性而被认为是合成抗氧化剂的替代品[2-4]。在食品领域中,多糖被广泛应用于食品、饲料、医药和制药工业,其中,百合多糖也是受到广泛研究的多糖之一。由于许多食品在生产和加工过程中多以液态形式存在,多糖在不同条件下独特的流变性使其在食品领域中得到了广泛的应用,许多天然多糖被用作胶凝剂、增稠剂和乳化剂[5-7]。
韩晓霞等[8]研究发现甘肃不同地区百合中的百合多糖的含量不同,为提高实验精准性,本实验选用兰州市七里河区产的本地百合进行多糖提取。不同条件微波辅助提取百合多糖的流变特性以及体外抗氧化方面的研究尚未有明确报道,本实验旨在探究不同功率、时间和温度的微波辅助热水浸提法提取百合多糖及其相关特性。
1 材料与方法
1.1 材料与试剂
兰州百合,兰州市七里河区市场。百合鳞片清洗晾干表面水分备用。
1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH),美国Sigma公司;其他试剂均为国产分析纯。
1.2 仪器与设备
JRA-6数显磁力搅拌水浴锅,金坛市杰瑞尔电器有限公司;MCR301流变仪,奥地利安东帕有限公司;EU-2600D紫外分光光度计,上海昂拉仪器有限公司;KQ-250DE数控超声波清洗器,昆山市超声仪器有限公司;RE-52旋转蒸发仪,上海亚荣生化仪器厂;SHB-Ⅲ循环水式多用真空泵,郑州长城工贸有限公司;MG08S-2B微波实验仪,南京汇研微波系统工程有限公司;Nicolet iS10红外光谱仪,美国Thermo公司;SCIENTZ-10 N冷冻干燥机,宁波新芝生物科技股份有限公司。
1.3 研究方法
1.3.1 微波辅助法提取百合多糖
准确称取新鲜百合100 g打浆,按照料液比1∶4(g∶mL)加入蒸馏水,60 ℃热水浸提2 h,将提取液10 000 r/min离心5 min,收集上清液,在一定时间、功率、温度下进行微波提取,于65 ℃旋转蒸发浓缩,无水乙醇沉淀多糖,离心收集沉淀,Sevag法除蛋白,再醇沉后离心收集沉淀,冷冻干燥后即得到百合多糖[9-11]。
1.3.2 单因素试验
选取时间、温度、微波功率为考察因素。设定温度为50 ℃,微波功率为400 W,提取时间为5、15、25 min;设定温度为50 ℃,时间为25 min,微波功率为400、600、800 W;设定提取时间为25 min,微波功率为600 W,提取温度为50、60、70 ℃进行微波处理。未经微波处理的百合多糖提取液作为空白对照,每组单因素实验做3组平行。浓缩后冷冻干燥,共得到8种百合多糖样品。
1.3.3 傅里叶红外光谱(Fourier transform infrared spectroscopy,FT-IR)表征
采用红外光谱仪对不同微波条件处理的百合多糖的分子结构进行分析。准确称取干燥的百合多糖2 mg,加入200 mg烘干至恒重的KBr,置玛瑙研钵中研磨均匀,压片,在4 000~400 cm-1范围内进行红外扫描。
1.3.4 流变学表征
在(25.0±0.1)℃下,使用流变仪的平板PP50系统,板间距1 mm,研究流变学特性(包括流动性能与触变性能测定)。每次测定时,将2 mL 20 mg/mL的百合多糖溶液转移到板上,室温孵育10 min。
1.3.4.1 流动性能测定
采用流变仪的平板PP50系统,测量百合多糖的黏度随剪切速率的变化趋势,剪切速率范围设置为0.01~100 s-1。
1.3.4.2 触变性能测定
采用流变仪的平板PP50系统,旋转模式下设定3段参数,第1段:剪切速率以3.12 s-1为增速从0 s-1升高到100 s-1;第2段:以100 s-1作为剪切速率维持50 s;第3段:以3.12 s-1为减速从100 s-1降低到0 s-1[12]。
1.3.5 百合多糖的体外抗氧化能力的测定
百合多糖用蒸馏水分别配制成7个浓度梯度0.02、0.06、0.1、0.2、0.6、1和2 mg/mL,其中未经微波处理的百合多糖提取液作为阴性对照。再以维生素C作为阳性对照,用蒸馏水分别配制成与百合多糖相同的浓度梯度。
1.3.5.1 DPPH自由基清除能力测定
以无水乙醇作为溶剂,将DPPH自由基配制成浓度为 0.1 mmol/L DPPH储备液,且DPPH溶液现配现用。
测定方法:准确吸取1 mL不同浓度的百合多糖溶液分别加入到3 mL 0.1 mmol/L的DPPH储备液中,室温避光反应30 min,每组设置3个平行,测定混合溶液在517 nm处的吸光度A1,超纯水做空白组,在相同条件下测定吸光值A0[13]。DPPH 自由基清除率计算如公式(1)所示:
DPPH自由基清除率![]()
(1)
1.3.5.2 羟基自由基(·OH)清除能力测定
测定方法:准确吸取不同浓度的百合多糖溶液各1 mL,依次加入1 mL 9 mmol/L FeSO4溶液、1 mL 9 mmol/L水杨酸溶液和1 mL 8.8 mmol/L H2O2溶液,摇匀后于37 ℃水浴30 min,测定混合溶液在510 nm处的吸光度Ai,用蒸馏水代替水杨酸测定吸光值Aj,以超纯水做空白对照A0[14]。·OH清除率按公式(2)计算:
·OH清除率![]()
(2)
1.3.5.3 铁离子还原能力(ferric reducing antioxidant potential,FRAP)测定
准确吸取不同浓度的百合多糖溶液各0.4 mL,依次加入0.2 mol/L,pH 6.6磷酸盐缓冲液1 mL和体积分数1%铁氰化钾溶液1 mL充分混合,在 50 ℃下水浴30 min,冰浴快速冷却后加入1 mL 体积分数10%三氯乙酸溶液充分混匀,10 000 r/min离心5 min,吸取上清液1 mL,再加入1 mL蒸馏水和1 g/L FeCl3溶液0.2 mL,充分摇匀反应10 min,每组设置3个平行,在700 nm处测定混合溶液的吸光度,以超纯水做空白组,在相同条件下测定吸光值[15]。
1.4 数据与分析
流变学实验数据通过流变仪自带的软件所得。所有测试重复3次取平均值,用 Origin 9.0 软件对所有数据进行处理并作图。
2 结果与分析
2.1 百合多糖红外光谱分析
有报道表明,不同工艺提取的多糖具有不同的结构特征,其生理活性受糖苷键等结构特征的影响[16],图1为不同微波辅助提取条件对百合多糖结构的影响,可以看出在3 344 cm-1附近有较宽的吸收峰,为多糖分子结构中O—H的伸缩振动[17]。2 928 cm-1附近的吸收峰是C—H伸缩振动。1 730 cm-1附近的弱吸收峰是由于羰基C![]() O伸缩振动引起的。1 636和1 415 cm-1附近较强吸收峰分别是羧酸或羧酸盐离子COO—和羰基C—O伸缩振动,这证实了糖醛酸的存在,表明百合多糖是酸性多糖[18-19]。在1 252 cm-1附近的吸收峰是由于糖环中的C—O—C伸缩振动,1 060和802 cm-1附近的吸收峰分别为C—H可变角振动和C—H弯曲振动,证实了百合多糖具有吡喃糖环的构象。
O伸缩振动引起的。1 636和1 415 cm-1附近较强吸收峰分别是羧酸或羧酸盐离子COO—和羰基C—O伸缩振动,这证实了糖醛酸的存在,表明百合多糖是酸性多糖[18-19]。在1 252 cm-1附近的吸收峰是由于糖环中的C—O—C伸缩振动,1 060和802 cm-1附近的吸收峰分别为C—H可变角振动和C—H弯曲振动,证实了百合多糖具有吡喃糖环的构象。
图1中不同微波条件提取的百合多糖红外光谱峰形和峰位置基本一致,但峰强度有差异。由图1-a可知,微波提取时间为5 min时多糖结构与空白对照组相似,随着时间延长,多糖的特征吸收峰越弱,说明多糖逐渐水解,大分子链断裂;由图1-b可知,微波提取功率达到600和800 W时,对百合多糖结构产生较小影响,可能是由于功率达到600 W时百合多糖大分子链已经解开,而功率达到800 W时对多糖的结构影响不大;图1-c可以观察到微波提取温度越高,百合多糖结构与空白对照组越相似,可能是百合多糖大分子随着温度升高,其大分子链发生解开与缠结不平衡引起其结构改变。

a-不同时间处理;b-不同功率处理;c-不同温度处理
图1 不同时间、功率、温度处理的百合多糖红外图谱
Fig.1 FT-IR of LPS processed with different times,powers,and temperatures
2.2 百合多糖的流变学特性分析
2.2.1 流动性分析
多糖具有优良的流变性能,在增稠剂、胶凝剂和乳化剂等方面有广泛的应用[20],而多糖的流变学行为受外界因素的影响[4]。图2考察了剪切速率对百合多糖黏度的影响。在低剪切速率下可以观察到典型的剪切变稀行为,随着剪切速率的增加,黏度随之降低,为假塑性流体;百合多糖在高剪切速率下易受到更大的剪切力,黏度几乎保持不变,表明百合多糖长链的缠结结构在高剪切速率的影响下发生重新排列。
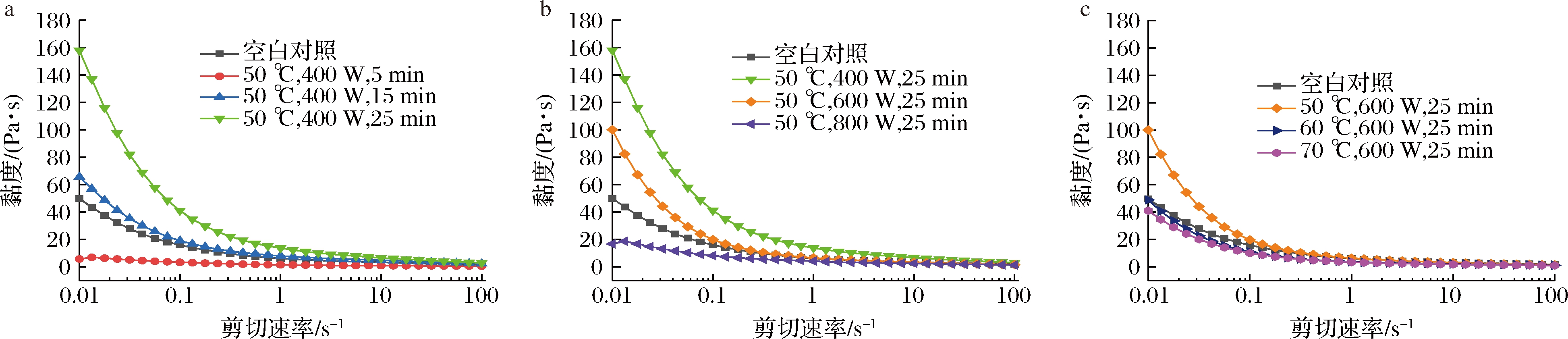
a-不同时间处理;b-不同功率处理;c-不同温度处理
图2 剪切速率对不同时间、功率、温度处理的百合多糖溶液的稳定剪切黏度的影响
Fig.2 The effect of shear rate on the steady shear viscosity of LPS solution treated with different times,powers and temperatures
如图2-a所示,在温度和微波功率相同的条件下,微波处理时间越长,百合多糖的零剪切黏度越大,可能是由于随着微波处理时间的延长促进了多糖分子链的解开,多糖分子之间的交联网状结构逐渐被破坏,因此黏度下降速率更快。在图2-b中,温度和时间固定的条件下,功率越大,多糖的零剪切黏度越小;图2-c中,在功率和时间相同的条件下,温度升高,多糖的零剪切黏度减小,即黏度下降速率逐渐减慢,多糖溶液表现出近似于牛顿流体的特性,以上2种情况可能是由于多糖分解成小分子的糖,聚合度降低,因此其零剪切黏度较低。不同微波辅助提取百合多糖的零剪切黏度见表1。
表1 不同微波辅助提取百合多糖的零剪切黏度
Table 1 Zero shear viscosity for LPS with different microwave-assisted extraction
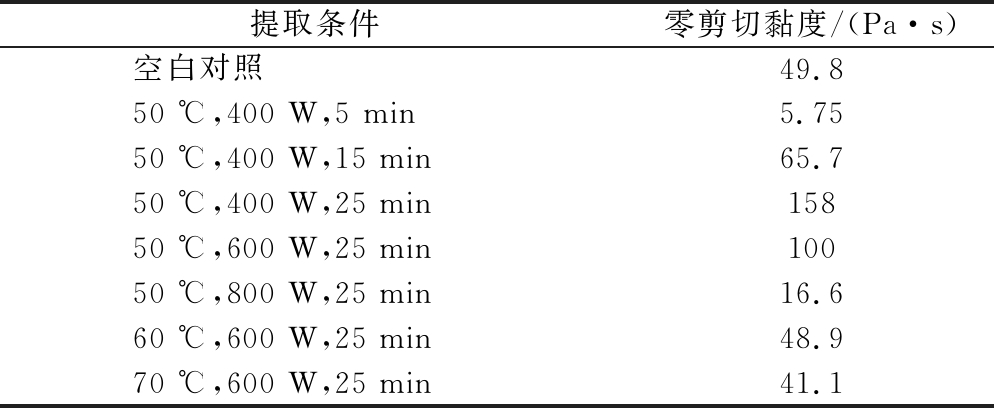
提取条件零剪切黏度/(Pa·s)空白对照49.850 ℃,400 W,5 min5.75 50 ℃,400 W,15 min65.7 50 ℃,400 W,25 min15850 ℃,600 W,25 min100 50 ℃,800 W,25 min16.6 60 ℃,600 W,25 min48.9 70 ℃,600 W,25 min41.1
利用 Herschel-Bulkley模型对百合多糖的流动曲线进行拟合,其方程式如公式(3)所示:
τ=τy+k n
n
(3)
式中:τ,剪切应力,Pa;τy,剪切屈服应力,Pa; ,剪切速率,s-1;k,稠度系数,Pa/s;n,非牛顿指数,其中n=1 牛顿流体;n<1 剪切稀化;n>1 剪切增稠[21]。
,剪切速率,s-1;k,稠度系数,Pa/s;n,非牛顿指数,其中n=1 牛顿流体;n<1 剪切稀化;n>1 剪切增稠[21]。
由表2可知,百合多糖的流动行为与Herschel-Bulkley模型拟合度较高,R2>0.9953。此特性的多糖可以作为性增稠剂或稳定剂。
表2 不同微波辅助提取百合多糖的Herschel-Bulkley模型拟合参数
Table 2 Fitting parameters of Herschel-Bulkley model for LPS with different microwave-assisted extraction

提取条件Herschel-Bulkley模型拟合参数τ/Pak/(Pa·s-1)nR2空白对照0.347 466.118 30.731 840.998 750 ℃,400 W,5 min0.020 6021.573 50.738 970.995 350 ℃,400 W,15 min0.474 837.871 10.754 320.995 450 ℃,400 W,25 min1.198 613.0730.680 980.998 950 ℃,600 W,25 min0.863 355.711 30.717 890.998 350 ℃,800 W,25 min0.063 7714.078 10.741 570.998 160 ℃,600 W,25 min0.445 673.4980.773 280.998 670 ℃,600 W,25 min0.356 13.2820.741 90.998 9
2.2.2 触变性分析
多糖的触变性是指在非破坏或剪切的条件下,多糖的形变对剪切应力的响应[22]。剪切速率随时间延长达到最大值,剪切速率降低再次回到初始值,形成的曲线呈现上下闭合状态(图3)。根据公式(4)计算不同微波条件提取百合多糖的触变环面积,结果见表3。
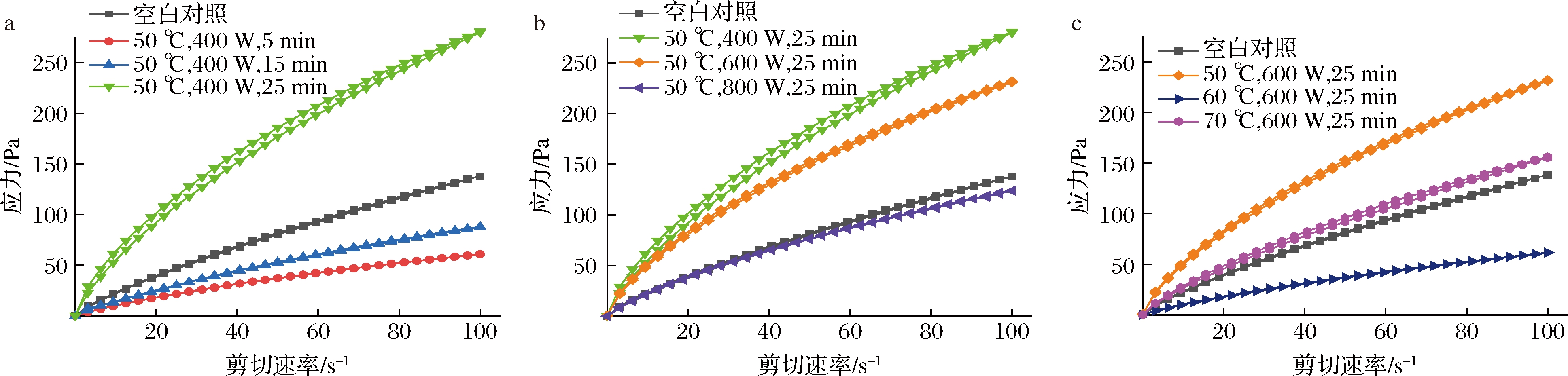
a-不同时间处理;b-不同功率处理;c-不同温度处理
图3 剪切速度对不同时间、功率、温度处理的百合多糖溶液的应力的影响
Fig.3 The effect of shear rate on the stress of LPS solution treated with different times,powers and temperatures
表3 不同微波辅助提取百合多糖的触变环面积
Table 3 Hysteresis loops areas for LPS with different microwave-assisted extraction

提取条件触变环面积/(Pa·s-1)空白对照125.11 50 ℃,400 W,5 min21.80 50 ℃,400 W,15 min54.28 50 ℃,400 W,25 min739.92 50 ℃,600 W,25 min221.68 50 ℃,800 W,25 min66.27 60 ℃,600 W,25 min44.18 70 ℃,600 W,25 min23.96
触变环面积/(Pa·s-1)=![]() k1(γ)n1-
k1(γ)n1-![]() k2(γ)n2
k2(γ)n2
(4)
式中:γ1 和 γ2为剪切速率,s-1;k1、k2为正向流动指数,Pa/s;n1和n2分别为流动幂指数。
由表3中可知,不同微波辅助条件下提取的百合多糖都具有一定的触变性。温度和功率一定时,提取时间越长,百合多糖的大分子长链逐渐解开,触变环面积越大,因此触变性也随之增大;温度和时间一定时,多糖的触变环面积随着功率的增大而减小;功率和时间一定时,提取温度越高,多糖的触变环面积越小,这2种现象可能是由于微波功率过大,温度越高,百合多糖大分子的缠结结构发生变化所致。
2.3 百合多糖的体外抗氧化活性
2.3.1 DPPH自由基清除能力测定
DPPH是一种很稳定的自由基[23],其最大吸收波长在517 nm 处。DPPH易与抗氧化剂发生电子转移反应,从而使自身被清除,吸光值减弱[24]。如图4所示,当百合多糖质量浓度<0.6 mg/mL时,多糖清除DPPH自由基的能力随着浓度升高而上升,在质量浓度>1.0 mg/mL时,变化趋于平缓,此现象是由于氢键的增加所引起的。图4-a中随着提取时间的延长,多糖清除DPPH自由基的能力逐渐减弱,可能是由于多糖分子随着提取时间延长,结构链解开,空气中被氧化的部分也增多,影响其整体的抗氧化活性;如图4-b所示,随着提取功率增大,清除DPPH自由基能力逐渐增强,可能是由于多糖链随着功率增大更快速地释放出来,为自由基提供电子,因此清除自由基能力增强;如图4-c所示,随着温度升高促进了多糖分子运动,分子间的相互作用增强,可能是多糖大分子结构链先解缠结再重新缠结,因此其清除DPPH自由基能力越来越接近阴性对照组。通过图1红外分析百合多糖的结构得知,在1 636和1 415 cm-1附近的较强吸收峰证实了糖醛酸的存在,有文献报道,多糖的结构中糖醛酸含量越高,其自由基清除能力越强[17,25]。

a-不同时间处理;b-不同功率处理;c-不同温度处理
图4 不同时间、功率、温度处理对百合多糖清除DPPH自由基能力的影响
Fig.4 The effect of different times,powers and temperatures on LPS scavenging activity of DPPH radicals
2.3.2 羟基自由基(·OH)清除能力测定分析
在体内自由基中活性最强的是·OH。抗氧化剂是通过把电子或质子传递给自由基来清除自由基。由图5可知,微波辅助提取对百合多糖清除·OH的影响随浓度的增大而略微增强,正相关趋势没有维生素C清除DPPH自由基的能力明显。如图5-a所示,随着时间的延长,多糖清除·OH的能力逐渐减弱,可能是由于微波提取会改变多糖构象,进而影响了对·OH的清除能力。图5-b和5-c可知,随着功率的增大与温度的升高,百合多糖清除·OH能力逐渐增强,可能是由于多糖链的卷曲结构得到伸展,通过观察图1-b和图1-c中羟基峰,推测多糖链水解后暴露出的羟基提供更多质子,终止了自由基的链式反应。

a-不同时间处理;b-不同功率处理;c-不同温度处理
图5 不同时间、功率、温度处理对百合多糖·OH清除能力的影响
Fig.5 The effect of different times,powers and temperatures on LPS scavenging activity of ·OH
2.3.3 铁离子还原能力
体外抗氧化实验通常采用还原铁氰化钾的能力来判断还原力的大小,由于百合多糖的抗氧化活性与其还原力有直接联系,抗氧化剂可将Fe3+还原成Fe2+,百合多糖还原力越强就证明抗氧化性越强。图6是不同微波辅助提取条件下百合多糖的还原力的变化,可以发现随着维生素C或百合多糖浓度的增大,吸光度也会逐渐增大。通过图6-a观察,当微波处理时间从5 min延长到25 min,多糖的还原力先增强后减弱,植物多糖的抗氧化能力可能是多种因素的相互作用或反作用,不仅与糖醛酸质量分数相关,还与单糖组成、取代基、糖残基和链构象等因素相关[19],因此百合多糖抗氧化活性还需要进一步研究;图6-b是不同功率的微波处理后百合多糖的还原力,随着功率的增大多糖还原力逐渐增强;图6-c显示随着温度的升高百合多糖的还原力逐渐增强,但是阴性对照始终还原能力最弱,这种现象可能是微波辐射改变了多糖分子的交联网状结构,其结构链的解缠结和重新缠结之间不平衡,进而影响了多糖的还原能力。

a-不同时间处理;b-不同功率处理;c-不同温度处理
图6 不同时间、功率、温度处理对百合多糖还原铁离子能力的影响
Fig.6 The effect of different times,powers and temperatures on FRAP of LPS
3 结论
通过改变时间,功率和温度等微波条件提取百合多糖,红外光谱初步表征确定了7种不同的条件提取出的百合多糖均有多糖特征吸收峰;流变特性分析出百合多糖具有剪切变稀行为,随着剪切速率的增加,黏度随之降低,为假塑性流体,其流动曲线符合流变学Herschel-Bulkley模型,具有这种显著剪切稀化效应的多糖可以作为性能优良的增稠剂或稳定剂,可应用于饮料工业中。同时微波提取的百合多糖还具有一定的触变性,随着时间延长或温度的升高,百合多糖的触变环面积增大,即触变性增大,随着微波功率的增大,百合多糖的触变性环面积减小,触变性降低,因此百合多糖具有良好的流变特性,在食品加工中可替代食用胶。
通过体外抗氧化实验可知,百合多糖与阳性对照维生素C相比抗氧化活性普遍偏低,多糖是一种大分子化合物,在相同浓度下抗氧化活性低于抗氧化剂维生素C属于正常情况。不同微波条件提取的百合多糖在一定浓度下清除DPPH自由基、·OH以及还原三价铁离子的能力均与处理时间呈负相关,与功率和温度呈正相关,经过红外光谱分析百合多糖的结构可以猜测多糖的体外抗氧化能力与其糖醛酸含量、单糖组成、糖残基及大分子链构象等有关,因此在提取百合多糖时应注意适当缩短处理时间以保护多糖的结构,使其具有较好的抗氧化特性,可作为一种抗氧化、抗衰老的功能食品。
[1] 宋硕.兰州百合多糖的结构鉴定及其抗氧化活性研究[J].现代食品,2020(16):176-179.
SONG S.Study on the structure identification and antioxidant activity of Lanzhou lily polysaccharide[J].Modern Food,2020(16):176-179.
[2] SONG Q Q,XIE J H,YU Y,et al.Biological activities and pharmaceutical applications of polysaccharide from natural resources:A review[J].Carbohydrate Polymers:Scientific and Technological Aspects of Industrially Important Polysaccharides,2018,183:91-101.
[3] LIU J,STEFAN W,XU C L.A review of bioactive plant polysaccharides:biological activities,functionalization,and biomedical applications[J].Bioactive Carbohydrates and Dietary Fibre,2015,5(1):31-61.
[4] XU Y Q,LIU N Y,FU X T,et al.Structural characteristics,biological,rheological and thermal properties of the polysaccharide and the degraded polysaccharide from raspberry fruits[J].International Journal of Biological Macromolecules,2019,132:109-118.
[5] XU X J,XU J,ZHANG Y Y,et al.Rheology of triple helical Lentinan in solution:steady shear viscosity and dynamic oscillatory behavior[J].Food Hydrocolloids,2007,22(5):735-741.
[6] FLORINA D,PAULINA M,MARGARIDA M M,et al.Novel mango bars using gellan gum as gelling agent:rheological and microstructural studies[J].LWT-Food Science and Technology,2015,62(1):576-583.
[7] YAKINDRA P T,RAJU A,STEFAN K,et al.Rheological and microstructural properties of the chia seed polysaccharide[J].International Journal of Biological Macromolecules,2015,81:991-999.
[8] 韩晓霞, 李洁,邱国玉,等.不同产地兰州百合中多糖的含量测定[J].甘肃科技,2020,36(2):55-57.
HAN X X,LI J,QIU G Y,et al.Determination of polysaccharides in Lilium davidii var.unicolor Salisb.from different places[J].Gansu Science and Technology,2020,36(2):55-57.
[9] 朱泉. 百合多糖分离纯化、结构鉴定及其生物活性研究[D].南京:南京农业大学,2012.
ZHU Q.Isolation,purification,structure determination and biological activities of polysaccharides from bulb of Lily (Lilium lancifolium Thunb)[D].Nanjing:Nanjing Agricultural University,2012.
[10] 刘成梅, 万茵,涂宗财,等.百合多糖脱蛋白方法的研究[J].食品科学,2002,23(1):89-90.
LIU C M,WAN Y,TU Z C,et al.Study on methods to remove protein from lily-polysaccharides[J].Food Science,2002,23(1):89-90.
[11] 黄玉龙, 高清雅,全婷,等.不同提取方法对兰州百合多糖结构及抗氧化活性的影响[J].现代食品科技,2018,34(11):126-131;94.
HUANG Y L,GAO Q Y,QUAN T,et al.Effects of different extraction methods on the composition and antioxidant activity of the polysaccharides in Lilium davidii var.unicolor Salisb[J].Modern Food Science & Technology,2018,34(11):126-131;94.
[12] WEI Y X,LIN Y B,XIE R,et al.The flow behavior,thixotropy and dynamical viscoelasticity of fenugreek gum[J].Journal of Food Engineering,2015,166:21-28.
[13] 和法涛, 刘光鹏,朱风涛,等.微波超声波组合提取猴头菇多糖工艺优化及其抗氧化活性[J].食品与生物技术学报,2019,38(1):74-82.
HE F T,LIU G P,ZHU F T,et al.Optimization of microwave-ultrasonic assisted extraction of polysaccharides from Hericium erinaceus antioxidant activity in vitro[J].Journal of Food Science and Biotechnology,2019,38(1):74-82.
[14] 顾欣, 高涛,刘梦雅,等.梁平柚柚皮多糖的提取工艺优化、结构解析及抗氧化能力研究[J].食品与发酵工业,2021,47(7):138-146.
GU X,GAO T,LIU M Y,et al.Optimization of extraction technology,structure analysis and antioxidant activity of polysaccharides from Liangping pomelo peel[J].Food and Fermentation Industries,2021,47(7):138-146.
[15] 王晗, 朱华平,李文钊,等.越橘提取物中花青素分析及其体外抗氧化活性[J].食品工业科技,2019,40(23):60-65.
WANG H,ZHU H P,LI W Z,et al.Analysis of anthocyanin in Bilberry extract and its antioxidant activity in vitro[J].Science and Technology of Food Industry,2019,40(23):60-65.
[16] GAO J,LIN L Z,SUN B G,et al.A comparison study on polysaccharides extracted from Laminaria japonica using different methods:Structural characterization and bile acid-binding capacity[J].Food & Function,2017,8(9):3 043-3 052.
[17] SUN Y X,LIU J C,JOHN F K.Purification,composition analysis and antioxidant activity of different polysaccharide conjugates (APPs) from the fruiting bodies of Auricularia polytricha[J].Carbohydrate Polymers,2010,82(2):299-304.
[18]杨嘉丹, 刘婷婷,张闪闪,等.微波辅助提取银耳多糖工艺优化及其流变、凝胶特性[J].食品科学,2019,40(14):289-295.
YANG J D,LIU T T,ZHANG S S,et al.Optimization of microwave-assisted extraction and rheological and gelling properties of polysaccharide from Tremella fuciformis[J].Food Science,2019,40(14):289-295.
[19] YE H,YAN Y H,JABBAR S,et al.Extraction optimization,characterization and antioxidant activity in vitro of polysaccharides from mulberry (Morus alba L.) leaves[J].Carbohydrate Polymers:Scientific and Technological Aspects of Industrially Important Polysaccharides,2015,128:52-62.
[20] 李秀秀, 尚静,杨曦,等.多糖的增稠、胶凝及乳化特性研究进展[J/OL].食品科学:1-12[2020-11-12].http://kns.cnki.net/kcms/detail/11.2206.TS.20200924.1454.046.html.
LI X X,SHANG J,YANG X,et al.Rheology of food polysaccharides-thickening,gelling and emulsifying properties[J].Food Science:1-12[2020-11-12].http://kns.cnki.net/kcms/detail/11.2206.TS.20200924.1454.046.html.
[21] LIN L H,SHEN M Y,LIU S C,et al.An acidic heteropolysaccharide from Mesona chinensis:rheological properties,gelling behavior and texture characteristics[J].International Journal of Biological Macromolecules,2018,107:1 591-1 598.
[22] 丁玲, 焦彩珍,陈乐乐,等.驴乳的系统流变学性质研究[J].食品工业科技,2020,41(1):69-72;78.
DING L,JIAO C Z,CHEN L L,et al.Study on systematic rheological properties of Donkey milk[J].Science and Technology of Food Industry,2020,41(1):69-72;78.
[23] 江飞凤, 谭晓辉,胡鹏刚,等.超声-微波协同提取柚子皮多糖工艺优化及单糖组成、结构和抗氧化活性分析[J].食品与发酵工业,2012,47(2):196-204.
JIANG F F,TAN X H,HU P G,et al.Optimization of ultrasonic-microwave extraction process of pomelo peel polysaccharide and analysis of monosaccharide composition,structure and antioxidant activity[J].Food and Fermentation Industries,2012,47(2):196-204.
[24] 杨燕敏,郑振佳,高琳,等.红枣多糖超声波提取、结构表征及抗氧化活性评价[J].食品与发酵工业,2021,47(5):120-126.
YANG Y M,ZHENG Z J,GAO L,et al.Ultrasonic extraction technology,structure characterization and antioxidant activity evaluation of jujube polysaccharide[J].Food and Fermentation Industries,2021,47(5):120-126.
[25] CHEN H X,QU Z S,ZHANG M,et al.Antioxidant activities of different fractions of polysaccharide conjugates from green tea (Camellia sinensis)[J].Food Chemistry,2008,106(2):559-563.