随着消费者对动植物保护、生态环境和营养健康的关注,植物基素食,植物基创新性食品愈趋多样化,受到广大消费者的青睐[1-3]。植物基素食是利用植物类食品原料模拟天然荤类食品的营养、形状、质地、色泽、风味等制成的仿生食品或模拟食品,其绿色环保、营养均衡、口感独特[4-5]。近年来,消费者对仿生食品-凝胶素食的关注由营养和外形提升到兼顾色泽与口感的层次,色泽鲜艳的凝胶素食更能满足消费者的感官需求。目前市场上的凝胶素食多是以魔芋葡甘聚糖(konjac glucomannan,KGM)为基材制备的多糖凝胶[6],色泽单一且难赋色。因此如何制备出色泽鲜艳稳定且质构性能良好的魔芋凝胶素食是现今凝胶素食领域亟待解决的关键问题。
目前对魔芋凝胶进行赋色主要是通过直接添加色素物质[7]或者利用蛋白质易与色素等小分子物质相结合的性质与蛋白质复配,对魔芋凝胶进行赋色[8]。因魔芋凝胶是水溶性体系,色素不易直接与凝胶体系相结合,致使凝胶赋色难。大豆分离蛋白(soybean protein isolate,SPI)是一种可替代动物蛋白的高营养优质植物蛋白[9-10],也是植物基食品的优质原料[11]。已有研究表明利用大豆分离蛋白凝胶特性与多孔空间网状结构,可结合或包埋姜黄素[12]、花青素[13]、茶多酚[14]等色素及营养物质小分子。辣椒红色素(capsanthin,CAP)是目前在仿生食品领域使用最广泛的天然色素之一[15],其色泽鲜艳,着色力强,保色效果好,具有一定的营养价值和保健功能[16]。目前对魔芋凝胶体系中添加CAP的研究仅限于CAP的微胶囊包埋研究[17-18],而魔芋凝胶制备过程中KGM、SPI、加碱量各组分对凝胶混合体系的色素稳定性及其质构性能的研究较少。
基于此,本研究拟将KGM、SPI与CAP进行复配,通过单因素试验和响应面试验,探究并优化KGM/SPI/CAP复合有色凝胶的制备工艺条件,并利用质构、傅里叶转换红外光谱(Fourier-transform infrared spectroscopy,FT-IR)和扫描电子显微镜(scanning electron microscope,SEM)等技术手段对复合有色凝胶的质构性能和微观结构进行研究,探究KGM和SPI这2种生物大分子复配形成的网络结构对CAP的包埋效果,以期为多彩凝胶素食、赋味、赋营养物质的新型复合凝胶的生产开发提供理论和技术指导,增加产品多样性,满足市场对植物基凝胶素食产品的需求。
1 材料与方法
1.1 材料与试剂
魔芋精粉(食品级),浙江上方生物科技有限公司;大豆分离蛋白(食品级),北京索莱宝科技有限公司;丙酮(分析纯),重庆川东化工公司;氢氧化钙(食品级),上海优乐滋食品配料有限公司;KBr(分析纯),成都市科隆化学品有限公司。
1.2 仪器与设备
JJ-1精密增力电动搅拌器,金坛市城东新瑞仪器厂;HH-2数显恒温水浴锅,常州奥华仪器有限公司;SL602 N高精显电子天平,上海民桥精密科学仪器有限公司;TA.XT Plus质构仪,英国Stable Micro System公司;SF-756P紫外可见分光光度计,上海光谱仪器有限公司;Spectrun100傅里叶变换红外光谱仪,美国PerkinElmer公司;Phenom Pro扫描电子显微镜,荷兰Phenom World公司;Avanti J-30I真空冷冻干燥机,美国贝克曼有限公司。
1.3 实验方法
1.3.1 KGM/SPI/CAP复合有色凝胶的制备
将一定量的SPI和CAP溶于水中,待溶解完全后缓慢加入称量好的KGM,充分搅拌使KGM完全分散到SPI和CAP分散液中,加入凝固剂氢氧化钙搅拌混合均匀,充分溶胀并反应4 h,平整表面,在90 ℃下恒温水浴40 min,立即冷却至室温并存放于4 ℃过夜待测。
1.3.2 KGM/SPI/CAP复合有色凝胶的质构特性
参照徐晓萍等[19]的方法测定复合有色凝胶的质构特性。质构测试条件为压缩模式,探头:P/0.5,测前速率:2.0 mm/s,测试速率:1.0 mm/s,测后速率:5 mm/s,形变量:60%,触发力:0.05 N,数据采集速率:200 pps。每个试样重复测定6次。
1.3.3 KGM/SPI/CAP复合有色凝胶的色素保留率
参照文献的方法测定复合有色凝胶的色素保留率并有所改进[18,20]。准确称取一定量试样于试管中,加入10 mL丙酮,室温下超声处理直至CAP被完全提取出来。取1 mL提取液用丙酮稀释5倍,以丙酮作参比液,用分光光度计在460 nm波长处测定其吸光度。
吸光度460 nm,按公式(1)计算:
(1)
式中:A,实测试样溶液的吸光度;f,稀释倍数;m,试样质量,g;100,换算系数。
色素保留率![]()
(2)
1.3.4 KGM/SPI/CAP复合有色凝胶的FT-IR光谱
将制备的KGM/SPI/CAP复合有色凝胶预冷冻24 h,放入真空冷冻干燥机冷冻干燥48 h,按1∶100的质量比与KBr混匀并在玛瑙研钵中研碎,压片,用傅里叶红外光谱仪以4 cm-1的速率在4 000~400 cm-1波长范围内扫描测定。
1.3.5 KGM/SPI/CAP复合有色凝胶的SEM观察
将制备的KGM/SPI/CAP复合有色凝胶预冷冻24 h,放入真空冷冻干燥机干燥48 h,将干燥好的样品保存待用。扫描电镜前,将样品块用固定胶黏于样品铜台,在真空度10-2~10-3 Pa,溅射电压1.1 k~1.2 kV,镀膜时间2~3 min条件下镀金,放置10 min,送入电镜观察,选择有代表性的区域拍摄[21]。
1.3.6 试验设计
1.3.6.1 单因素试验设计
选取对试验影响较大的因素:经前期预实验,选择KGM质量分数(5%、5.5%、6%、6.5%、7%、7.5%)、SPI质量分数(0.05%、0.1%、0.2%、0.3%、0.4%)、氢氧化钙质量分数(0.05%、0.1%、0.15%、0.2%、0.25%),研究各因素对色素保留率和凝胶强度的影响。
1.3.6.2 响应面试验设计
在单因素试验结果的基础上,以KGM质量分数(6%、6.5%、7%)、SPI质量分数(0.1%、0.2%、0.3%)、氢氧化钙质量分数(0.1%、0.15%、0.2%)为响应因素,以色素保留率和凝胶强度为响应值,设计3因素3水平的响应面试验。
1.4 数据统计与分析
采用Origin 2019与Design-Expert处理分析实验数据,每组试验重复3次,试验结果以“平均值±标准差”的形式表示。
2 结果与分析
2.1 单因素试验
2.1.1 KGM质量分数对复合有色凝胶色素保留率和凝胶强度的影响
KGM质量分数对复合有色凝胶的色素保留率和凝胶强度的影响如图1所示。随着KGM质量分数的增加,复合凝胶的色素保留率呈先上升再稳定后降低趋势。在质量分数为6.0%时色素保留率达到最大值,显著提高了16.34%(P<0.05),在7.0%~7.5%显著降低(P<0.05)。而凝胶强度随着KGM质量分数的增加呈先上升后稳定趋势。在7.0%达到最大值,显著提高了73.94%(P<0.05),在7.0%~7.5%保持稳定。

图1 KGM质量分数对复合有色凝胶色素保留率和凝胶强度的影响
Fig.1 Effect of KGM on pigment retention rate and gel strength of KGM/SPI/CAP composite gel
当KGM质量分数较低时,KGM与SPI两者相互作用较弱,形成的凝胶网络结构不够致密,结构松散;而随着KGM质量分数的增加,SPI分子在水溶液中结构伸展,与KGM分子通过氢键作用结合,产生一定的协同作用[21],两者相互作用加强,形成结构致密的网络结构,更易截留色素小分子,因此色素保留率逐渐升高,凝胶强度增大。而在7.0%~7.5%时,可能是因为KGM含量太高,KGM分子成团现象比较严重,不能充分溶解,相互结合不紧密,致使形成的网络结构不均匀[18,23],色素小分子不易被包埋在网络结构中,因而色素保留率降低,且凝胶强度不能进一步提高。因此,综合考虑选取,KGM质量分数在6.0%~7.0%可满足KGM/SPI/CAP复合有色凝胶的制备要求。
2.1.2 SPI质量分数对复合有色凝胶色素保留率和凝胶强度的影响
SPI质量分数对复合有色凝胶色素保留率和凝胶强度的影响如图2所示。随着质量分数的增加,复合凝胶的色素保留率和凝胶强度均呈先上升后降低趋势。当SPI质量分数达到0.2%时,色素保留率和凝胶强度均达到最大值,分别显著增大了19.32%,20.01%(P<0.05)。
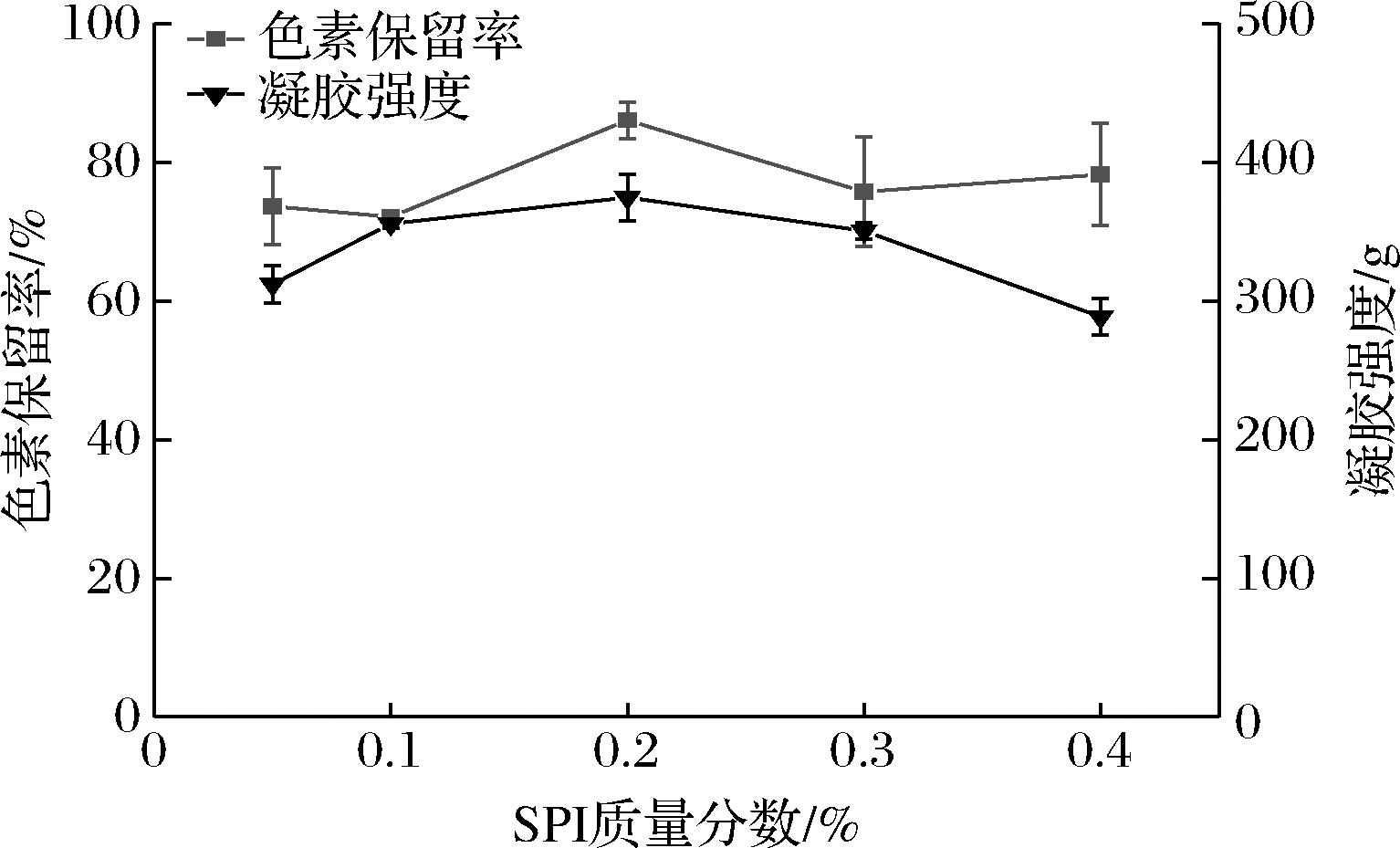
图2 SPI质量分数对复合有色凝胶色素保留率和凝胶强度的影响
Fig.2 Effect of SPI on pigment retention rate and gel strength of KGM/SPI/CAP composite gel
当SPI质量分数较低时,KGM与SPI两者相互作用形成的凝胶网络结构不够致密,结构稀疏多孔,使得色素小分子不能稳定结合在凝胶内部,因此色素保留率较低;随着SPI质量分数的增加,SPI分子伸展,与KGM分子间的氢键互补作用加强,在一定程度上产生协同增效作用,可能对色素小分子有更强的包埋作用,因此色素保留率提高,凝胶强度上升;当SPI含量进一步增加,凝胶网络结构变得疏松,致密度大大降低,导致色素保留率和凝胶强度的降低[24]。因此,综合考虑选取SPI质量分数在0.1%~0.3%时可满足KGM/SPI/CAP复合有色凝胶制备要求。
2.1.3 氢氧化钙质量分数对复合有色凝胶色素保留率和凝胶强度的影响
氢氧化钙质量分数对复合有色凝胶色素保留率和凝胶强度的影响如图3所示。随着氢氧化钙质量分数的增加,色素保留率呈先稳定后降低趋势,凝胶强度呈先上升后降低趋势。在0.05%~0.15%,色素保留率保持稳定,凝胶强度显著增大了179.55%并达到最大值(P<0.05);在0.20%~0.25%,色素保留率和凝胶强度均显著降低(P<0.05)。

图3 Ca(OH)2质量分数对复合有色凝胶色素保留率和凝胶强度的影响
Fig.3 Effect of Ca(OH)2 on pigment retention rate and gel strength of KGM/SPI/CAP composite gel
氢氧化钙对复合有色凝胶的作用主要体现在OH-离子对共聚物分子之间相互作用形成网络结构产生影响[25]。在碱性条件下加热,KGM分子发生脱乙酰,在一定的范围内,加碱量越大,脱乙酰程度愈高,部分分子间相互交联缠绕,相互作用增强,促进凝胶网络结构的形成,因此对CAP有一定的包埋作用,且凝胶强度也不断增加[26-28];当氢氧化钙添加量过多,KGM发生部分降解,复合凝胶的胶溶作用大于凝胶形成作用,不能形成稳定的空间网络结构,同时CAP属于天然色素,当体系碱性太强,CAP在体系中可能不稳定,因而色素保留率和凝胶强度降低[29]。且当氢氧化钙添加量过多,复合有色凝胶有明显的碱味和腥臭味,依据实际食品的酸碱性要求,综合考虑选取氢氧化钙质量分数在0.1%~0.2%制备 KGM/SPI/CAP复合有色凝胶。
2.2 响应面试验设计及结果验证
2.2.1 响应面试验优化
在单因素试验的基础上,以KGM质量分数、SPI质量分数、氢氧化钙质量分数为响应因素,色素保留率和凝胶强度为响应值进行试验,试验设计及结果如表1所示。
表1 响应面试验设计与结果
Table 1 Experimental design and results of response surface design

试验号A(KGM)/%B(SPI)/%C(Ca(OH)2)/%色素保留率/%凝胶强度/g16.50.10.163.872295.22426.50.10.256.197310.77736.00.10.1563.818292.27946.50.30.180.259310.47857.00.30.1563.683394.34566.00.20.251.926280.83276.50.30.263.163364.46486.50.20.1583.809378.4396.50.20.1585.467374.605106.00.30.1565.059280.525117.00.10.1555.834338.257126.00.20.181.178235.108137.00.20.156.697319.082146.50.20.1585.62370.531156.50.20.1585.05382.505166.50.20.1581.33377.186177.00.20.260.35337.252
2.2.2 响应面分析
各因素间交互作用对色素保留率的影响如图4所示,KGM质量分数、氢氧化钙质量分数与SPI质量分数交互作用不显著,KGM与氢氧化钙质量分数间交互作用显著;各因素间交互作用对凝胶强度的影响如图5所示,KGM质量分数、SPI质量分数和氢氧化钙质量分数3者间交互作用显著。
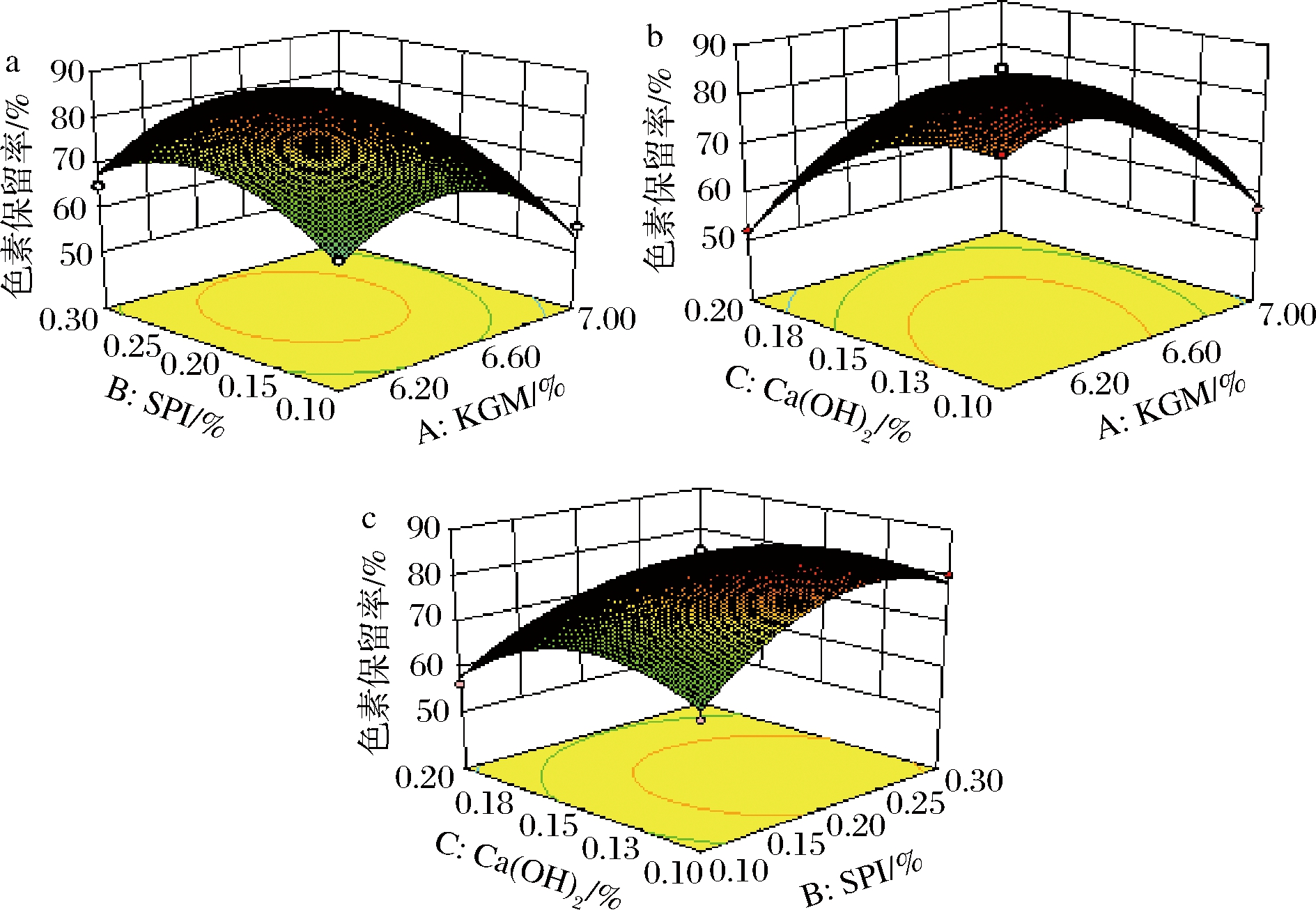
a-KGM与SPI交互作用;b-KGM与Ca(OH)2交互作用;c-SPI与Ca(OH)2交互作用
图4 各因素交互作用对KGM/SPI/CAP复合凝胶的色素保留率的影响
Fig.4 Effects of various factors on the pigment retention rate of KGM/SPI/CAP composite gel

a-KGM与SPI交互作用;b-KGM与Ca(OH)2交互作用;c-SPI与Ca(OH)2交互作用
图5 各因素交互作用对KGM/SPI/CAP复合有色凝胶的凝胶强度的影响
Fig.5 Effects of various factors on the gel strength of KGM/SPI/CAP composite gel
经软件分析,最佳制备工艺条件:KGM质量分数为6.57%,SPI质量分数为0.22%,氢氧化钙质量分数为0.14%,在此条件下复合有色凝胶的色素保留率理论上可达到84.68%,凝胶强度382.19 g。为验证实验结果是否与真实情况相一致,将最佳工艺条件修正为KGM质量分数为6.5%,SPI质量分数为0.2%,氢氧化钙质量分数为0.15%,此条件下复合凝胶的色素保留率为84.26%,凝胶强度为376.65 g,与预测值相近,可见回归模型能很好地预测混合凝胶的性能,指导复合有色凝胶的制备。
2.3 KGM/SPI/CAP复合有色凝胶的质构性能分析
选取KGM质量分数为5.5%,SPI质量分数为0.1%,氢氧化钙质量分数为0.2%的配比制备的复合有色凝胶与优化制备后的复合有色凝胶进行质构性能对比,结果如表2所示。结果发现:优化制备前后复合有色凝胶的凝胶强度、硬度、咀嚼性差异比较明显;优化制备后复合凝胶的凝胶强度、硬度、咀嚼性分别提高了约91.09%、6.09%和24.83%,均显著高于优化制备前,此结果与徐晓萍等[19]对魔芋葡甘聚糖-大豆分离蛋白混合凝胶质构性能的研究结果基本一致,原因是优化制备的条件下,KGM和SPI两者之间相互作用加强,产生一定的协同作用[21],形成结构致密的网络结构,使得复合有色凝胶质构性能得到一定程度的改善,具有更高的弹性和韧性,口感更独特。
表2 KGM/SPI/CAP 复合有色凝胶的质构性能分析
Table 2 Texture properties of KGM/SPI/CAP composite gel

组别凝胶强度/g硬度/g弹性黏聚性咀嚼性/g恢复性优化制备前197.11±1.20628.98±25.390.97±0.020.71±0.02453.80±11.200.36±0.02优化制备后376.65±3.41667.29±18.170.97±0.020.77±0.03566.50±11.360.37±0.02
2.4 KGM/SPI/CAP复合有色凝胶的FT-IR分析
如图6所示,优化制备前后KGM/SPI/CAP复合有色凝胶的谱线基本一致,未出现新的吸收峰。在3 200~3 650 cm-1附近处是-OH的伸缩振动峰,复合凝胶中-OH的吸收峰都出现在3 435 cm-1,为多糖的特征峰[5];在2 800~3 000 cm-1出现吸收峰表明存在-CH键伸缩振动,在1 650~1 900 cm-1表明分子间存在C=O双键的伸缩振动;在1 725 cm-1左右未出现明显吸收峰,而该处吸收峰属于乙酰基上羰基的伸缩振动峰,表明复合有色凝胶脱乙酰;1 630 cm-1附近是氢键的吸收峰,优化制备前后复合凝胶在1 638 cm-1出现吸收峰,表明复合有色凝胶分子间存在氢键作用;有研究表明KGM与SPI两者间的相互作用以氢键为主,主要是因为KGM为非离子多糖,亲水性极强,且SPI和KGM分子链上含有大量的羟基、氨基、羰基等基团,从而促进氢键的形成[30];在1 000~1 250 cm-1范围内代表C-O单键的伸缩振动;877 cm-1、812 cm-1左右处是KGM中甘露糖的特征吸收峰[31-32]。在复合凝胶的红外光谱曲线中,这一系列特征峰的伸缩振动表明优化制备前后复合有色凝胶中未产生新的功能基团,复合物的功能基团和化学键未发生明显变化,且分子间存在氢键等相互作用力。

图6 KGM/SPI/CAP复合有色凝胶的FTIR图
Fig.6 FTIR spectra of KGM/SPI/CAP composite gel
2.5 KGM/SPI/CAP复合有色凝胶的SEM分析
如图7所示,各物质不同配比所形成的凝胶体系的微观结构差异较大。优化制备前的复合有色凝胶结构疏松,呈无规则多孔结构,空洞间的连接部分粗细不均,孔隙较大,分布不均匀,“空穴”度大,且结构不连续,断裂现象严重(图7-a);而优化制备后的复合有色凝胶可以明显观察到均匀的内部孔隙,且结构连续有序,似“蜂窝状”,呈现致密的多孔网络结构(图7-b),此结论与龚加顺等对魔芋葡苷聚糖与大豆分离蛋白混合凝胶体系的研究结果类似[24]。主要原因是复合凝胶的网络结构主要由KGM形成的致密网络结构为主,SPI所形成的网络结构为辅,在适当比例下两者结构相互叠加,相互作用加强,形成致密稳定的网络结构[33-34]。优化制备后复合有色凝胶体系内部相互作用加强,稳定性提高,可能更易于色素小分子的吸附或结合,使得优化制备后的复合凝胶呈现良好的色泽,具有更高的色素保留率和凝胶强度,与之前对复合有色凝胶的质构性能分析结果一致。因此,优化制备后的工艺条件有效地改善复合凝胶的结构和性能。
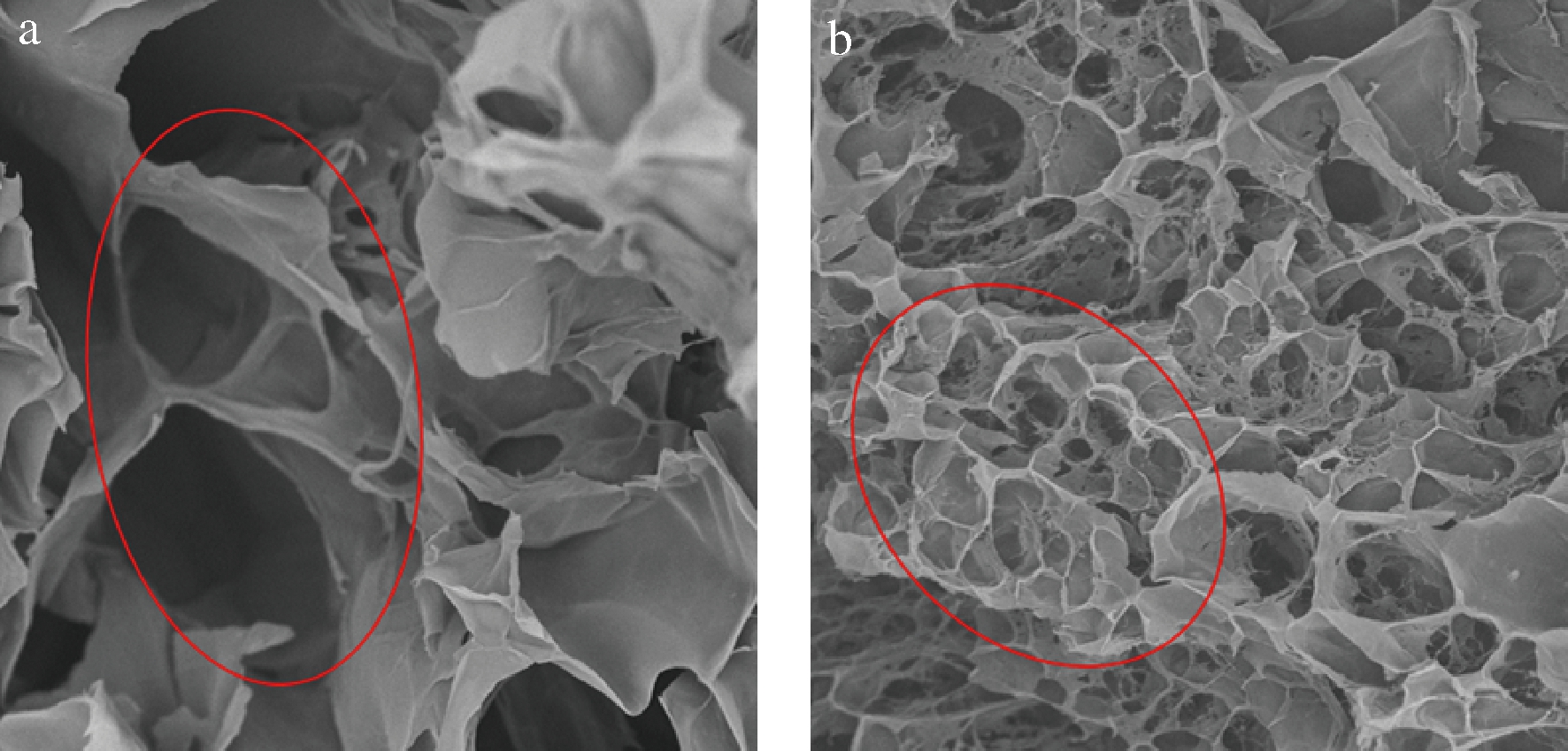
a-优化制备前的复合有色凝胶;b-优化制备后的复合有色凝胶
图7 KGM/SPI/CAP复合有色凝胶的扫描电镜照片(×4 000)
Fig.7 SEM images of KGM/SPI/CAP composite gels
3 结论
优化制备的KGM/SPI/CAP复合有色凝胶具有较好的色素保留率和凝胶强度,其色泽鲜艳稳定,改善了魔芋凝胶难赋色现状。此外对复合有色凝胶的质构特性和微观结构表征发现优化制备的复合有色凝胶质构性能提高,三维网状结构更致密且连续均匀,进一步证实优化制备的复合有色凝胶具有更好的赋色和质构性能。因此可利用KGM及SPI这2种高分子聚合物分子链组装形成的凝胶网络结构,包埋或截留体系中的色素、风味等小分子或者多酚等营养物质,研发新型功能性食品,拓展植物基凝胶素食发展方向,改善凝胶素食在食品领域的发展前景。
[1] RUBY M B.Vegetarianism.A blossoming field of study[J].Appetite,2012,58(1):141-150.
[2] ROSENFELD D L.The psychology of vegetarianism:Recent advances and future directions[J].Appetite,2018,131:125-138.
[3] 吴元浩, 徐婧婷,刘欣然,等.植物基仿肉原料的应用与加工现状[J].食品安全质量检测学报,2020,11(17):5 955-5 963.
WU Y H,XU J T,LIU X R,et al.Application and processing status of plant-based meat analogue ingredients[J].Journal of Food Safety and Quality,2020,11(17):5 955-5 963.
[4] MORENO H M,HERRANZ B,MATEOS M P,et al.New alternatives in seafood restructured products[J].Critical Reviews in Food Science and Nutrition,2016,56(2):237-248.
[5] SOLO-DE-ZAKD VAR B S,TOVAR C A,BORDER
VAR B S,TOVAR C A,BORDER AS A J,et al.Effect of deacetylation on the glucomannan gelation process for making restructured seafood products[J].Food Hydrocolloids,2014,35:59-68.
AS A J,et al.Effect of deacetylation on the glucomannan gelation process for making restructured seafood products[J].Food Hydrocolloids,2014,35:59-68.
[6] 李崇高, 黄建初,黄泳梅.魔芋多糖仿生食品工艺的研究[J].西南大学学报(自然科学版),2008,30(1):119-125.
LI C G,HUANG J C,HUANG Y M.Studies on technology of konjac polysaccharide simulated food[J].Journal of Southwest University(Natural Science),2008,30(1):119-125.
[7] 汪师帅, 杨金初.辣椒红色素对魔芋葡甘聚糖凝胶性质的影响[J].食品研究与开发,2018,39(17):21-25.
WANG S S,YANG J C.Effect of capsanthin on properties of konjac glucomannan gels[J].Food Research and Development,2018,39(17):21-25.
[8] HENG L,VAN KONINGSVELD G.A,GRUPPEN H,et al.Protein-flavour interactions in relation to development of novel protein foods[J].Trends in Food Science & Technology,2004,15(3):217-224.
[9] ZHENG L,WANG Z J,KONG Y,et al.Different commercial soy protein isolates and the characteristics of Chiba tofu[J].Food Hydrocolloids,2020,110:106 115.
[10] ZHAO C B,CHU Z J,MIAO Z C,et al.Ultrasound heat treatment effects on structure and acid-induced cold set gel properties of soybean protein isolate[J].Food Bioscience,2021,39:100 827.
[11] 郭顺堂, 徐婧婷,刘欣然,等.我国植物蛋白资源高效利用途径与技术创新[J].食品科学技术学报,2019,37(6):8-15.
GUO S T,XU J J,LIU X R,et al.Efficient utilization and technological innovation of plant-based protein resources in China[J].Journal of Food Science and Technology,2019,37(6):8-15.
[12] TAPAL A,TIKU P K.Complexation of curcumin with soy protein isolate and its implications on solubility and stability of curcumin[J].Food Chemistry,2012,130(4):960-965.
[13] CHEN Z Q,WANG C,GAO X D,et al.Interaction characterization of preheated soy protein isolate with cyanidin-3-O-glucoside and their effects on the stability of black soybean seed coat anthocyanins extracts[J].Food Chemistry,2019,271:266-273.
[14] CHEN G,WANG S T,FENG B,et al.Interaction between soybean protein and tea polyphenols under high pressure[J].Food Chemistry,2019,277:632-638.
[15] 黎智华, 王恬.辣椒红素的生物利用度、生理功能及机制研究进展[J].食品科学,2020,41(11):259-266.
LI Z H,WANG T.Progress in understanding the bioavailability,physiological functions and mechanisms of action of capsanthin[J].Food Science,2020,41(11):259-266.
[16] 陈菁, 黄明.影响辣椒红色素稳定性的因素研究[J].食品工业科技,2014,35(4):287-290.
CHEN J,HUANG M.Study on factors affecting the stability of Capsicum red pigment[J].Science and Technology of Food Industry,2014,35(4):287-290.
[17] 马嫄, 付晓,孟晓,等.辣椒红色素微胶囊化的工艺研究[J].食品科技,2010,35(4):228-231.
MA Y,FU X,MENG X,et al.Study on the capsanthin microencapsulation technology[J].Food Science and Technology,2010,35(4):228-231.
[18] 唐永富, 査勇,李积华,等.微胶囊化辣椒红色素工艺研究[J].食品科学,2009,30(20):207-210.
TANG Y F,ZHA Y,LI J H,et al.Optimization of microencapsulation of paprika oleoresin[J].Food Science,2009,30(20):207-210.
[19] 徐晓萍, 张亚宁,樊巧,等.响应面法优化制备魔芋葡甘聚糖-大豆分离蛋白混合凝胶[J].食品科学,2016,37(4):44-50.
XU X P,ZHANG Y N,FAN Q,et al.Optimization of the formulation of konjac glucomannan-soybean protein isolate mixed gel by response surface methodology[J].Food Science,2016,37(4):44-50.
[20] 陈洁, 林华庆,余楚钦,等.辣椒红色素色价与含量的关系及提高稳定性的方法[J].安徽农业科学,2015,43(10):16-18.
CHEN J,LIN H Q,YU C Q,et al.Relationship of color value of capsanthin and content and method to improve stability[J].Journal of Anhui Agricultural Sciences,2015,43(10):16-18.
[21] ZHANG Y T,TAN C,ABBAS S,et al.The effect of soy protein structural modification on emulsion properties and oxidative stability of fish oil microcapsules[J].Colloids and Surfaces B:Biointerfaces,2014,120:63-70.
[22] NIETO T V N,WANG Y X,OZIMEK L,et al.Improved thermal gelation of oat protein with the formation of controlled phase-separated networks using dextrin and carrageenan polysaccharides[J].Food Research International,2016,82:95-103.
[23] 杨莉莉, 熊善柏,孙建清.制备条件对鱼肉-魔芋胶复合凝胶品质的影响[J].食品科学,2010,31(3):55-59.
YANG L L,XIONG S B,SUN J Q.Effect of processing technology on properties of surimi-konjac compound gel[J].Food Science,2010,31(3):55-59.
[24] 龚加顺, 幸治梅,彭春秀,等.高浓度魔芋葡苷聚糖与大豆分离蛋白混合凝胶质地特性研究[J].食品科学,2005,26(7):35-39.
GONG J S,XING Z M,PENG C X,et al.Study on the textural properties of the gel formed with mixtures of konjac glucomannan and soybean isolate protein at high concentration[J].Food Science,2005,26(7):35-39.
[25] 田学智, 龙昌洲,王子宇,等.高静压处理对魔芋葡甘聚糖/大豆分离蛋白复合溶胶特性的影响[J].食品与发酵工业,2017,43(11):153-158.
TIAN X Z,LONG C Z,WANG Z Y,et al.Effect of high hydrostatic pressure treatment on the functional properties of konjac glucomannan/soybean protein composite sol[J].Food and Fermentation Industries,2017,43(11):153-158.
[26] LIU J J,ZHU K K,YE T,et al.Influence of konjac glucomannan on gelling properties and water state in egg white protein gel[J].Food Research International,2013,51(2):437-443.
[27] LUO X G,HE P,LIN X Y.The mechanism of sodium hydroxide solution promoting the gelation of konjac glucomannan (KGM)[J].Food Hydrocolloids,2013,30(1):92-99.
[28] DU X Z,LI J,CHEN J,et al.Effect of degree of deacetylation on physicochemical and gelation properties of konjac glucomannan[J].Food Research International,2012,46(1):270-278.
[29] WILLIAMS M A K,FOSTER T J,MARTIN D R,et al.A molecular description of the gelation mechanism of konjac mannan[J].Biomacromolecules,2000,1(3):440-450.
[30] WANG L,XIAO M,DAI S H,et al.Interactions between carboxymethyl konjac glucomannan and soy protein isolate in blended films[J].Carbohydrate Polymers,2014,101:136-145.
[31] TANG R P,DU Y M,ZHENG H,et al.Preparation and characterization of soy protein isolate-carboxymethylated konjac glucomannan blend films[J].Journal of Applied Polymer Science,2003,88(5):1 095-1 099.
[32] CHEN Z J,WANG S S,SHANG L C,et al.An efficient and simple approach for the controlled preparation of partially degraded konjac glucomannan[J].Food Hydrocolloids,2020,108:106 017.
[33] 朱建华, 邹秀容,刘日斌,等.超声对蔗糖共溶质场中大豆分离蛋白/魔芋胶共混体系流变及凝胶性质的影响[J].中国粮油学报,2019,34(9):46-52.
ZHU J H,ZOU X R,LIU R B,et al.Effects of ultrasonication on the rheological and gel properties of soybean isolated protein/konjac gum blend under sucrose cosolute environment[J].Journal of the Chinese Cereals and Oils Association,2019,34(9):46-52.
[34] CAKIR E,KHAN S A,FOEGEDING E A.The effect of pH on gel structures produced using protein-polysaccharide phase separation and network inversion[J].International Dairy Journal,2012,27(1-2):99-102.