饼干越来越频繁地出现在消费者的视野中,随着饼干的消费量不断上升,营养单一的普通饼干已经不能满足消费者的需求,将酵母应用到饼干制作过程中来进行营养品质强化是一种很好的方法[1]。目前酵母发酵主要用于面包、馒头等面制品中,经酵母发酵后的产品不仅具有浓郁的风味特征,而且还可以改善终产品的质地、货架期及营养特性。同时,酵母发酵还可以使大分子物质降解为小分子物质,有利于机体吸收利用,提高产品中营养物质的利用率。
淀粉是日常饮食的主要成分之一,也是补充体内能量的重要成分。淀粉在小肠中的消化程度和消化率对机体的健康有很大的影响。研究发现淀粉消化性与许多疾病密切相关[2],其中,淀粉类食品的消化性与肠胃消化障碍以及低血糖等问题的关联性引起了人们对食品和健康领域的兴趣。经酵母发酵后,不仅使面制品形成特有的香味,而且酵母发酵产生气体物质,使面制品的网络空间増大,相关酶类更容易和淀粉作用,增加消化率[3]。小分子氨基酸不仅对食品的风味、色泽产生重要影响,同时还具有免疫调节、营养补给、维持机体正常代谢等作用[4]。此外,在谷物制品生产中发酵还具有提高营养价值,降低谷蛋白含量,稳定和提高矿物质的生物利用率等效果[5]。
本文以太平梳打饼干(本文中统称为发酵饼干)的发酵工艺为基础,以其发酵产品为研究对象,探究酵母发酵对面团pH和总酸度(total titrable acid,TTA)以及饼干淀粉消化性的影响,分析酵母发酵饼干中糖类、游离氨基酸、维生素和矿物质等营养物质及元素的变化,为开发功能性饼干提供理论参考。
1 材料与方法
1.1 材料与试剂
小麦粉、全麦粉、麦芽提取物、鲜酵母、起酥油、白砂糖、食用盐、全脂乳粉、太平梳打饼干,均由亿滋食品企业管理(上海)有限公司提供。淀粉葡萄糖苷酶(A7095,≥260 U/mL)、胰酶(P7545,8×USP)、胃蛋白酶(P7000,≥250 U/mg),美国 Sigma 公司;苯并戊三酮(茚三酮)、盐酸、氯化钾、醋酸钠、硫酸铜、硫酸钾、浓硫酸、氢氧化钠、95%乙醇、石油醚、碘、酒石酸钾钠、葡萄糖、盐酸、溴甲酚绿、甲基红、亚铁氰化钾、氯化钙、醋酸、三氯乙酸,A.R,国药集团化学试剂有限公司。
1.2 仪器与设备
ARM-01 全齿轮传动搅拌机,福建德霸食品机械有限公司;DF-101S集热式恒温加热磁力搅拌器,巩义市予华仪器责任有限公司;HPLC-1525 高效液相色谱,美国 Waters 公司;TDL-5-A 型低速台式大容量离心机,上海安亭科学仪器厂;EL20 型 pH 计,上海梅特勒-托利多仪器有限公司;AL204 型电子天平,梅特勒-托利多仪器(上海)有限公司;GENIUS-3 型漩涡震荡仪,德国 IKA 公司。
1.3 实验方法
1.3.1 发酵面团的制备
发酵面团配方如表1所示。
表1 发酵面团制作配方
Table 1 Recipes of fermented dough

注:含量均为质量分数
原辅料酵母发酵面团/%未加酵母发酵面团/%小麦粉100100起酥油1010奶粉1.51.5食用盐1.21.2膨松剂0.450.45酵母0.80无菌水26.526.5
按照表1将酵母发酵面团所需各原料按比例称量。预先将酵母加入40 ℃温水中溶解,起酥油在60 ℃加热融化。用ARM-01搅拌机在一速下搅拌 15 min,待搅拌器停止,将搅拌器及搅拌缸上黏着的面团用刮板刀刮下,将搅拌完成的面块取出,放在35 ℃以及相对湿度为80%的发酵箱内发酵9 h。
使用未加酵母的面团作为对照。按照发酵面团的制作配方(表1),将未加酵母发酵面团所需各原料按照其比例称量好,采用与实验组完全相同的工艺条件。
1.3.2 面团发酵过程中 pH、TTA 的测定
参考张庆[6]的方法,稍加修改。用10.00 g不同时间点的发酵面块,与90 mL无菌水搅拌混匀20 min左右,待混合液静置后测定混合液的pH;用0.1 mol/L NaOH 进行滴定,最终 pH 为8.1,所使用的NaOH的量为面团的TTA。
1.3.3 发酵饼干的制备
酵母发酵饼干配方表1所示。
(1) 将搅拌完成的面块取出,放在温度为35 ℃、相对湿度为80%的发酵箱中发酵9 h。
(2) 发酵结束后,把面团用酥皮机压成 1 mm 厚,并切割为 5 cm×5 cm 的面片,在上火和下火均为 250 ℃的焙烤箱中烘烤 6 min,冷却后即为发酵饼干。
1.3.4 淀粉体外消化率的测定
根据 YU[7] 方法进行测定饼干样品的消化性,略作修改。准确称500.0 mg饼干粉于 50 mL 带盖玻璃瓶中,加3 mL胃蛋白酶溶液(7 mg/mL,酶活力250 U/mg,用 0.5 mol/L,pH 1.5 的盐酸-氯化钾溶液配制),37 ℃ 恒温水浴搅拌 60 min。加入 2 mL 胰酶溶液(8 mg/mL,酶活力8×USP,用 0.5 mol/L,pH 5.2 醋酸-醋酸钠缓冲溶液配制),0.065 mL 淀粉葡萄糖苷酶(其酶活为260 U/mL),37 ℃恒温水浴。在消化反应 0、10、20、60、120 min分别取样 0.2 mL于已加入1.8 mL 无水乙醇的离心管中。振荡摇匀后,10 000 r/min条件下离5 min,将上清液使用葡萄糖试剂盒进行葡萄糖(C6H12O6)含量测定试验。特定时刻C6H12O6生成量乘以0.9后与原样品中总淀粉量的比值即为消化率,其中,快消化淀粉(rapidly digestible starch,RDS):代表20 min内被人体消化吸收的淀粉;慢消化淀粉(slowly digestible starch,SDS):代表在20~120 min内被机体消化吸收但速度缓慢的淀粉;抗性淀粉(resistant starch,RS):代表无法被消化利用的淀粉[8]。
(1)
(2)
RRS/%=(1-RRDS-RSDS)×100
(3)
式中:m0,酶解前饼干样品游离的葡萄糖质量,mg;m20,酶水解 20 min时葡萄糖的生成质量,mg;m120,酶水解 120 min后葡萄糖的生成质量,mg;ms,饼干样品中总淀粉质量,mg。
1.3.5 糖类含量的测定
按照张庆[6]的提取方法,略作修改。准确称5.0 g饼干样品,加45 mL去离子水,放入转子搅拌使溶液均质。用1 mol/L NaOH溶液使溶液的pH 达8.2,之后将溶液放在45 ℃恒温水浴锅中保温40 min,并不间断搅拌使还原糖浸出完全,之后溶液定容至100 mL,于4 000 r/min 离心10 min,收集上清液,上清液采用 HPLC测定糖含量。
色谱条件:色谱柱为 Waters Sugar Pak I,流动相为重蒸水,流速 0.4 mL/min,柱温为 90 ℃,进样量为 10 μL,检测器为 Waters 2414 示差折光检测器,所用的仪器为 Waters 1525高效液相色谱仪。
1.3.6 游离氨基酸的测定
准确称 1.000 g 饼干粉倒入 25 mL 容量瓶内,用质量浓度为 50 g/L 三氯乙酸溶液定容,混匀后于300 W的功率超声波超声 1 h,过滤之后在10 000 r/min 下,将滤液离心振荡 30 min,取上清液并用0.22 μm 水膜过滤于色谱进样瓶中,使用 Agilent 1260 液相色谱仪进行分析[9]。
HPLC 条件:ODS Hypersil 色谱柱(250 mm×4.6 mm,5 μm,美国赛默飞世尔),柱温:40 ℃;流动相:V(醋酸钠)∶V(甲醇)∶V(乙腈)=1∶2∶2,流速1.0 mL/min;紫外检测器检测波长338 nm。
1.3.7 维生素B1和维生素B2的测定
维生素B1参考国标GB 5009.84—2016进行测定[10]。维生素B2参考国标GB 5009.85—2016进行测定[11]。
1.3.8 矿物质含量的测定
参考国标GB5009.268—2016进行测定[12]。
1.4 数据处理
每组实验重复3次,采用 Origin 8.5 软件分析作图。采用 SPSS 16.0 软件处理分析实验数据,结果以 x±SD 表示,显著性分析以 Duncan’tests 进行方差分析(ANOVA),P<0.05 被认为存在显著性差异。相关性分析采用双变量Pearson检验,P<0.05 为差异有统计学意义。
2 结果与分析
2.1 面团发酵过程中 pH、TTA变化
饼干面团在发酵过程中,会产生气体物质如二氧化碳等,使面团变得疏松。微生物通过发酵会产生有机酸等酸性物质,有机酸的产生不仅使面制品具有更多风味,而且会降低发酵面团的pH值[3]。低pH值的发酵面团,有利于饼干面团中蛋白质和相关酶类之间的作用,最终产品具有良好的质构特性。
发酵过程中pH和TTA的变化情况如图1所示。两种面团pH值均有所降低,其中,酵母发酵面团的pH下降的较明显。
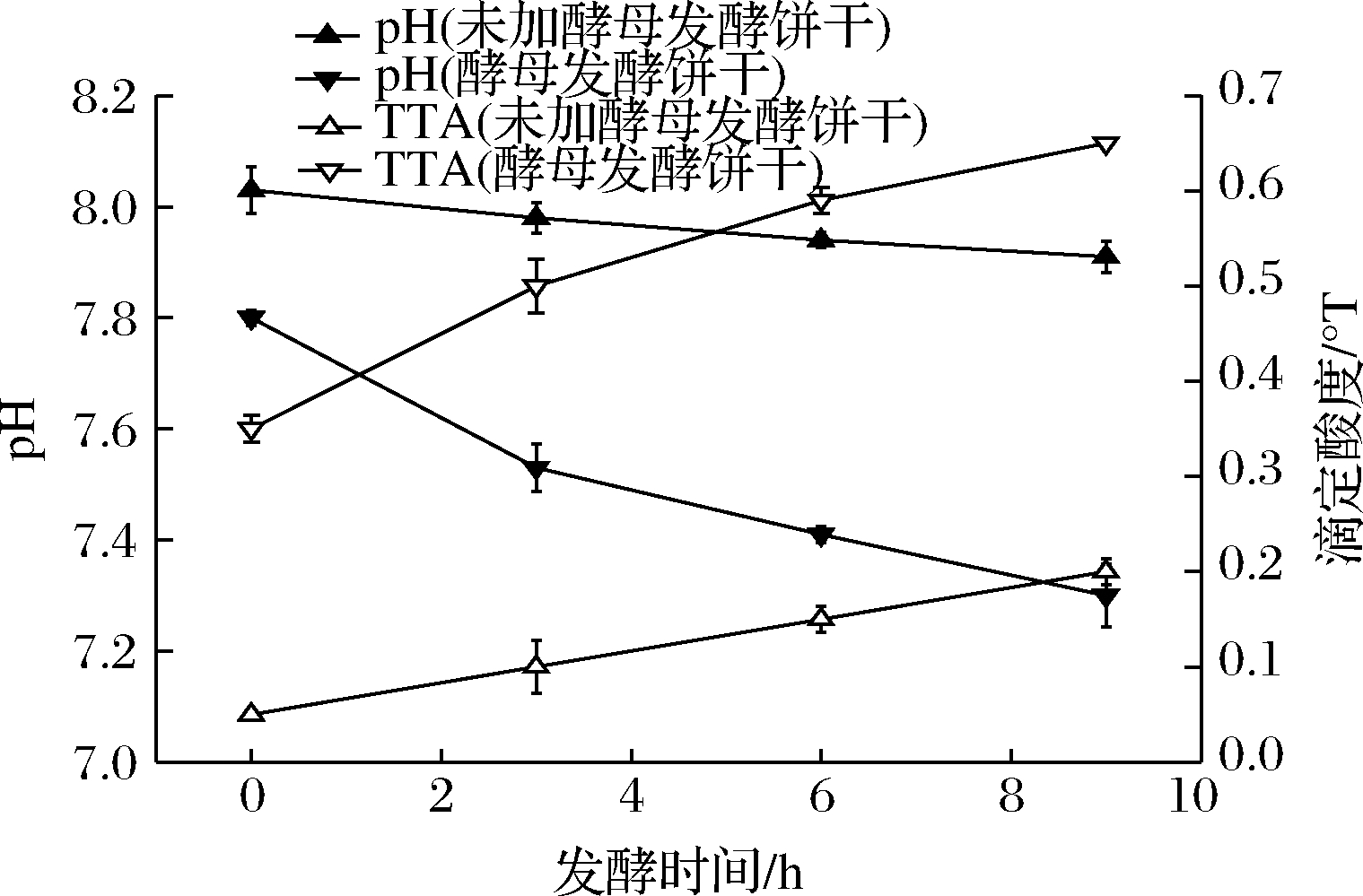
图1 面团发酵过程中pH和TTA的变化
Fig.1 pH and TTA profiles of fermented dough
最终,酵母发酵面团pH值稳定在7.30左右,未加酵母发酵面团 pH 值稳定在7.90左右。同时,两种面团TTA的变化趋势与pH值变化都呈负相关。随发酵的不断进行,面团pH出现下降的原因可能是由于酵母发酵产生的CO2溶解在面制品中引起的,或是由于面粉中的乳酸菌发酵少量产酸引起的[13]。
2.2 酵母对发酵饼干中淀粉消化率的影响
淀粉类食物从口腔进入胃肠阶段进行消化时,可以被体内的相关酶类水解,形成小分子物质,进而被体内快速吸收利用。淀粉体外消化率越高,表明越易被机体消化。
淀粉消化率用来表征淀粉在体内消化吸收的速率[14]。比较了酵母发酵饼干和未加酵母发酵饼干的体外淀粉消化特性。分析图2,饼干的淀粉消化趋势大体一致,在消化的前60 min,淀粉水解率均呈快速升高趋势。0~20 min时,淀粉消化速率升高最快。20~60 min时,消化速率逐渐变得缓慢,60~120 min时,消化速率逐渐趋于平缓。其中,酵母发酵饼干的RDS含量为70.21%,未发酵饼干的RDS含量为66.93%,原因可能是酵母发酵产生的气体物质使面团孔径变大,淀粉酶容易进入其内部与淀粉发生作用所致。慢消化淀粉能够在小肠内被完全消化吸收,并且淀粉的消化速率较为缓慢,具有维持饱腹感和血糖水平稳定、持续释放能量等优点。与未加酵母发酵饼干相比,酵母发酵饼干的SDS略高。在60~120 min的消化过程中,水解速率逐渐变缓并趋于平缓,其中酵母发酵饼干的淀粉消化进程明显较高,酵母发酵饼干和未加酵母发酵饼干的最终淀粉消化率分别是93.68%和89.39%。相比于未加酵母发酵饼干,酵母发酵饼干呈现较高的淀粉水解率。
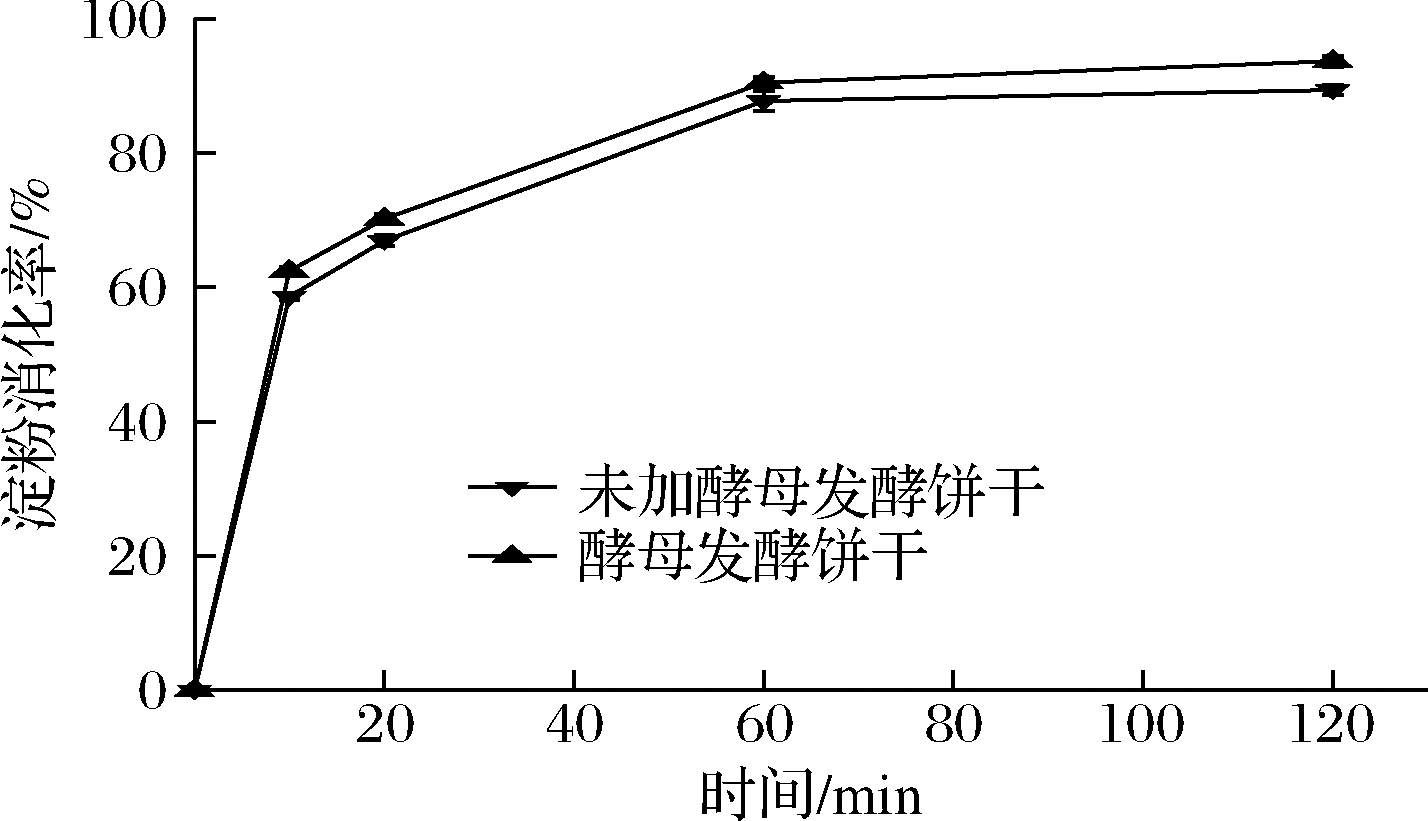
图2 不同时间点饼干样品的体外淀粉消化率
Fig.2 In vitro starch digestibility of crackers
可利用淀粉代表在胃阶段和肠阶段可以被消化的淀粉,其含量为RDS、SDS之和。如表2所示,发酵饼干中可利用淀粉含量为93.68%,未发酵饼干中可利用淀粉含量为89.39%。酵母菌发酵后,其中饼干中可利用淀粉含量比未加酵母发酵饼干高约4%。辛全伟[2]等人通过研究发现酵母发酵后,与未加酵母发酵面包相比,发酵后面包中快消化淀粉含量有所增加。原因是加入酵母后,酵母自身含有一些成分会提高淀粉颗粒对相关酶类的敏感性,增加酶的反应活性,从而提高了淀粉消化速率。也可能由于酵母在面团发酵过程中,产生了二氧化碳等气体使得面团的孔洞变大,更容易使酶进去与淀粉发生作用,所以淀粉消化率有所增加。
表2 饼干样品RDS、SDS、RS含量统计表
Table 2 RDS、SDS and RS fractions of crackers

注:不同字母标示的同一行间具有显著性差异(P<0.05)
样品可利用淀粉/%RDS/%SDS/%RS/%未加酵母发酵饼干89.39±1.62b66.93±0.81b22.46±0.81b5.51±0.84b酵母发酵饼干93.68±1.60a70.21±0.78a23.47±0.82a3.35±0.85a
2.3 酵母对发酵饼干中糖类含量的影响
在发酵过程中,酵母会利用单糖作为能源物质,且对各种糖类的利用顺序不一样。当多种糖同时存在时,酵母菌会优先用葡萄糖作为能源物质,之后会将蔗糖转变成单糖后进行利用[15]。
由图3可知,与未加酵母发酵饼干相比,酵母发酵饼干中果糖、葡萄糖的含量下降较多,其中葡萄糖的含量降低了72.30%,果糖的含量降低了96.51%,半乳糖的含量相差不大。LI等[16]通过研究发现酵母发酵后葡萄糖和麦芽糖的大量消耗,可能由于这两种糖是酵母生长代谢的主要碳源。图3结果表明,在发酵时酵母菌为满足自身生长需求,会大量利用葡萄糖、果糖等作为能源物资,因此在发酵过程中果糖和葡萄糖的含量会有明显的降低。

图3 饼干样品中糖类含量变化
Fig.3 The content of carbohydrates in fermented crackers
与不加酵母的饼干相比,加入酵母发酵的饼干中乳糖的含量降低了11.88%。雷雅男等[17]研究结果表明酵母菌不发酵乳糖,但是乳酸菌可以利用乳糖,使乳糖含量降低。原因是面团在长时间发酵过程中,空气中的微生物的作用,使乳糖部分分解所致,也有可能是面粉自身中微生物,使得面团在发酵过程中乳糖含量有所减少。
2.4 酵母对发酵饼干中游离氨基酸的影响
在发酵面团中氨基酸对微生物代谢、营养需求和蛋白水解活性等起着重要作用[18]。同时,氨基酸也是食品风味前体的重要来源[19]。在面团发酵过程中,酵母等微生物会对氨基酸产生强烈的需求,来满足自身生长繁殖[20]。氨基酸分析是研究蛋白质特性与其营养价值的重要手段,本研究采用氨基酸分析仪测定所有饼干样品中17种氨基酸以及γ-GABA。
COLLAR等[21]研究发现酵母菌选择性吸收面团中的部分氨基酸,产生其他氨基酸。本研究测定了酵母发酵和未发酵的饼干中必需氨基酸和非必需氨基酸以及氨基丁酸的含量,结果见表3,谷氨酸、苏氨酸、精氨酸、赖氨酸、缬氨酸、异亮氨酸、亮氨酸等氨基酸被酵母菌迅速吸收。此外,蛋氨酸、半胱氨酸、丝氨酸、苯丙氨酸和天冬氨酸也被酵母菌利用,而甘氨酸、酪氨酸、脯氨酸和组氨酸含量无明显变化,酵母发酵后,饼干中总氨基酸质量分数减少了31.2 mg/100 g。这一结果与COLLAR等[21]所得结论相一致,相比于未加酵母发酵的饼干,酵母发酵后会降低饼干中总氨基酸含量。原因是由于在发酵过程酵母为满足自身生长需求会利用氨基酸作为能源物质,而面团中的蛋白质或多肽降解为氨基酸的速率较低。因此酵母发酵后饼干中总氨基酸含量有所降低。
表3 饼干样品氨基酸含量统计表
Table 3 The amino acid content of crackers

游离氨基酸未加酵母发酵饼干/[mg·(100 g)-1]酵母发酵饼干/[mg·(100 g)-1]Asp18.61±0.38a12.54±0.10bGlu21.85±1.33a19.68±0.11aSer1.73±0.06a0.93±0.07bHis3.82±0.05a2.66±0.03bGly3.22±0.01a2.76±0.08bThr4.49±0.27a2.89±0.06bArg6.07±0.12a1.56±0.03bAla7.82±0.11a2.89±0.06bTyr0.31±0.02a2.04±0.00bCys-S1.09±0.03a0.21±0.04bVal4.12±0.01a2.45±0.01bMet1.11±0.03a0.33±0.00bPhe3.41±0.02a1.89±0.07bIle2.32±0.04a0.84±0.04bLeu2.58±0.10a0.78±0.04bLys2.51±0.07a1.67±0.04bPro32.57±1.39a33.04±0.24aγ-GABA5.41±0.10b2.64±0.10b总氨基酸含量123.04±2.64a91.80±0.17b
2.5 酵母对发酵饼干中维生素和矿物质的影响
维生素B1和维生素B2是维持人体正常机能与代谢活动非常重要的水溶性维生素,人体自身无法自行合成,必须额外补充[22]。发酵会增加维生素B的含量,可能是由于酵母可以作为一种可食用的营养物质,营养价值较高。
本实验测定了未发酵饼干和酵母菌发酵饼干中维生素B1、维生素B2的含量,如图4所示,经酵母菌发酵能升高饼干中维生素B1、维生素B2的含量,分别增加了75.19% 和27.69%。可能是因为经酵母长时间的发酵能够降低烘焙产品中维生素B1和维生素B2的损失所致。矿物质同维生素B1、维生素B2一样,均是人体所必需的,且需通过外界摄取,人体每天需要从外界来摄取以满足自身矿物质需求[23]。如表4所示,本研究测定了10种矿物质元素,包括Fe、Mn、Zn、Cu、Mo、Ni、Na、Mg、K、Ca。与未发酵饼干相比,发酵饼干中部分矿物质元素有轻微的增加。
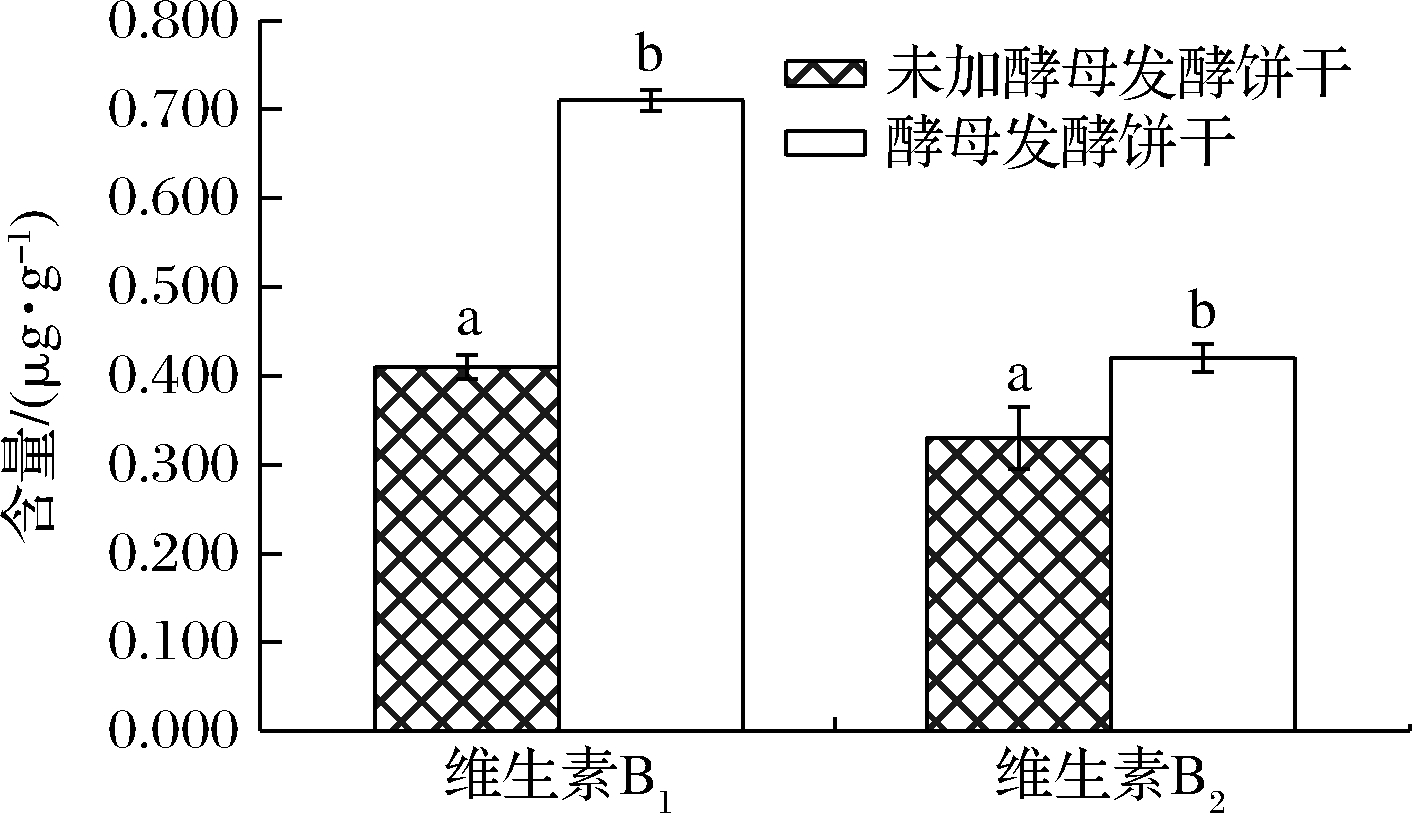
图4 饼干样品维生素B1、维生素B2含量
Fig.4 The vitamin B1 and vitamin B2 content of crackers
表4 饼干样品矿物质含量统计表 单位:μg/g
Table 4 The mineral content of crackers

样品FeMnZnCuMoNiNaMgKCa酵母发酵饼干6.49±0.09a0.92±0.01a0.85±0.01a0.17±0.00a1.99±0.00a0.02±0.00a714.27±1.35a64.56±0.63a289.87±0.38a610.02±1.11a未加酵母发酵饼干6.51±0.02a0.87±0.02a0.87±0.00b0.17±0.00a2.33±0.01b0.02±0.00a705.52±0.99b62.52±0.69b276.49±0.00b582.50±1.22b
由Pearson检验结果显示(表5),其中,维生素B1、K、Ca与酵母发酵、未加酵母发酵饼干呈正相关(P<0.01),Mo与酵母发酵、未加酵母发酵饼干呈负相关(P<0.01),而维生素B2、Fe、Mn、Zn、Cu、Ni、Na、Mg与酵母发酵、未加酵母发酵饼干不相关。
表5 营养素变化与发酵、未发酵饼干之间的相关性分析
Table 5 Correlation analysis between nutrient changes and fermented and non-fermented crackers
注:*和**分别表示在P<0.05水平显著相关和P<0.01水平极显著相关
项目维生素B1维生素B2FeMnZnCuMoNiNaMgKCa是否加酵母发酵0.998**0.919-0.2480.867-0.935-0.594-0.999**0.079-0.5690.9101.000**0.998**
3 结论
本文以太平梳打饼干的发酵工艺为基础,探究酵母对发酵饼干淀粉消化性和营养特性的影响。研究结果表明,经酵母发酵后太平梳打饼干的淀粉消化率有所升高,其中SDS含量升高较为明显,说明酵母发酵饼干更容易被机体消化。与未加酵母发酵饼干相比,酵母发酵饼干中葡萄糖、果糖的含量有明显降低。小分子游离氨基酸中精氨酸、赖氨酸、缬氨酸、亮氨酸等氨基酸会被酵母大量吸收利用,酵母发酵饼干中这些氨基酸的含量有明显降低。经酵母发酵后,发酵饼干中维生素B1、维生素B2含量以及部分矿物质的含量会有所增加。综上所述,酵母发酵后的饼干可以作为肠道消化不良人群的一种膳食选择。
[1] 罗昆, 曹伟超,马子琳,等.高产植酸酶乳酸菌发酵对黑豆面包蛋白质品质及烘焙特性的影响[J].食品科学,2021,42(6):111-117.
LUO K,CAO W C,MA Z L,et al.Effect of fermentation of high-yield phytase lactobacillus on the protein quality and baking characteristics of black soy bread[J].Food Science,2021,42(6):111-117.
[2] 辛全伟. 面粉中破损淀粉对面包中丙烯酰胺生成及淀粉消化性影响的研究[D].天津:天津科技大学,2016.
XIN Q W.Study on the effect of broken starch in flour on the formation of acrylamide and starch digestibility in bread[D].Tianjin:Tianjin University of Science and Technology,2016.
[3] 张思佳. 酸面团乳酸菌发酵荞麦面包品质的研究[D].无锡:江南大学,2015.
ZHANG S J.Study on the quality of sourdough lactic acid bacteria fermented buckwheat bread[D].Wuxi:Jiangnan University,2015.
[4] 王金水, 杨森,贾峰,等.酸面团发酵过程中蛋白质分解及多肽形成的变化规律[J].现代食品科技,2015,31(10):69-73.
WANG J S,YANG S,JIA F.Changes in protein decomposition and peptide formation during fermentation of sourdough dough[J].Modern Food Science and Technology,2015,31(10):69-73.
[5] 杨森. 酸面团发酵过程中蛋白质降解规律的研究[D].郑州:河南工业大学,2015.
YANG S.Study on the law of protein degradation during the fermentation of sourdough[D].Zhengzhou:Henan University of Technology,2015.
[6] 张庆. 植物乳杆菌燕麦酸面团发酵过程及其面包烘焙特性研究[D].无锡:江南大学,2012.
ZHANG Q.Study on the fermentation process of Lactobacillus plantarum oat sourdough and its bread baking characteristics[D].Wuxi:Jiangnan University,2012.
[7] YU MEIHUI,LIU BO,ZHONG FANG,et al.Interactions between caffeic acid and corn starch with varying amylose content and their effects on starch digestion[J].Food Hydrocolloids,2021:114-123.
[8] 杨翠红. 乳清分离蛋白对淀粉消化特性的影响及其作用机制研究[D].无锡:江南大学,2019.
YANG C H.Study on the effect of whey protein isolate on starch digestibility and its mechanism[D].Wuxi:Jiangnan University,2019.
[9] XIANHUI C,XINGYI H,XIAOYU T,et al.Dynamic characteristics of dough during the fermentation process of Chinese steamed bread[J].Food Chemistry,2019,312:229-238.
[10] GB 5009.84—2016,食品中维生素B1的测定[S].北京:中国标准出版社,2017.
GB 5009.84—2016,Determination of Vitamin B1 in Food[S].Beijing:China Standard Press,2017.
[11] GB 5009.85—2016,食品中维生素B2的测定[S].北京:中国标准出版社,2017.
GB 5009.85—2016,Determination of Vitamin B2 in Food[S].Beijing:China Standard Press,2017.
[12] GB 5009.268—2016,食品中多元素的测定[S].北京:中国标准出版社,2017.
GB 5009.268—2016,Determination of multi-element in food[S].Beijing:China Standard Press,2017.
[13] MANLEY D.Yeast and enzymes as biscuit ingredients[J].Manley’s Technology of Biscuits Crackers & Cookies,2011,42(51):209-215.
[14] 张腾. 不同消化方法对淀粉体外消化性影响的研究[D].天津:天津科技大学,2018.
ZHANG T.Study on the effect of different digestion methods on the in vitro digestibility of starch[D].Tianjin:Tianjin University of Science and Technology,2018.
[15] 岳清华, 李利民,郑学玲,等.发酵时间和方式对面团中酵母代谢产物的影响[J].食品与发酵工业,2020,46(8):27-33.
YUE Q H,LI L M,ZHENG X L,et al.The effect of fermentation time and method on yeast metabolites in dough[J].Food and Fermentation Industry,2020,46(8):27-33.
[16] LI Z,SONG K,LI H,et al.Effect of mixed Saccharomyces cerevisiae Y10 and Torulaspora delbrueckii Y22 on dough fermentation for steamed bread making[J].International Journal of Food Microbiology,2019,303:58-64.
[17] JURATE S,AISTE K,DALIA S.Application of fermented soya as a bacterial starter for production of fermented milk[J].Czech Journal of Food Sciences,2019,37(6):403-408.
[18] DI C R,DE A M,LAVERMICOCCA P,et al.Proteolysis by sourdough lactic acid bacteria:Effects on wheat flour protein fractions and gliadin peptides involved in human cereal intolerance[J].Applied and Environmental Microbiology,2002,68(2):623-633.
[19] DONGDONG Z,JINGLAN L,TIEMIN J,et al.Influence of Kluyveromyces marxianus on proteins,peptides,and amino acids in lactobacillus-fermented milk[J].Food Science and Biotechnology,2017,26(3):739-748.
[20] MOHAMMAD N,VINAY B,KEVIN J,et al.The impact of yeast fermentation on dough matrix properties[J].Journal of the Science of Food and Agriculture,2016,96(11):3 741-3 748.
[21] CONCEPCI N C,ARTURO F M,BARBER C B.Amino acid metabolism by yeasts and lactic acid bacteria during bread dough fermentation[J].Journal of Food Science,2010,57(6):1 423-1 427.
N C,ARTURO F M,BARBER C B.Amino acid metabolism by yeasts and lactic acid bacteria during bread dough fermentation[J].Journal of Food Science,2010,57(6):1 423-1 427.
[22] YANJUN W,SUYUN L,WEIJING W,et al.Associations of dietary vitamin B1,vitamin B2,niacin,vitamin B6,vitamin B12 and folate equivalent intakes with metabolic syndrome[J].International Journal of Food Sciences and Nutrition,2020,71(6):738-749.
[23] J.L.FERNANDEZ-TURIEL,J.F.LLORENS,F.LOPEZ-VERA,et al.Strategy for water analysis using ICP-MS[J].Fresenius’ Journal of Analytical Chemistry,2000,368(6):601-606.