嗜热链球菌胞外多糖(exopolysaccharides,EPS)是嗜热链球菌(Streptococcus thermophilus)在生长代谢过程中向细胞壁外分泌的一种糖类化合物[1]。EPS可以改善发酵乳制品的流变性、质构、持水性等品质[2-4],还具有抗氧化和抗菌[5-6]、抗肿瘤[7]、修复肠道生理屏障[8]等生理活性。EPS的功能与结构密切相关,对其结构的阐明是研究其功能性的基础。单糖组成分析是解析碳水化合物结构的重要过程之一。然而,嗜热链球菌EPS产量低(50~400 mg/L)[9],结构复杂且难与培养基、菌体等分离,直接测定难度较大,通常需进行分离纯化处理,其中,除蛋白是纯化EPS的基础。目前,反复冻融法、三氯乙酸(trichloroacetic acid,TCA)法和酶法是除蛋白的常用方法[10]。
现有研究表明,嗜热链球菌EPS是由不同单糖组成的杂多糖,单糖的主要类型包括葡萄糖、半乳糖和鼠李糖,此外,还发现有岩藻糖、核糖、葡萄糖醛酸、N-乙酰半乳糖胺、N-乙酰氨基葡萄糖等[1,3]。因此,嗜热链球菌EPS单糖组成的分析,需要实现多种单糖同时在线检测。高效阴离子交换色谱(high performance anion exchange chromatography,HPAEC)法具有无需衍生、高灵敏度、线性范围宽、色谱柱分离高效等特点,并可实现多种单糖同时在线检测[11],因此被越来越多地应用于复杂多糖的单糖组成分析。如乐胜锋等[12]考察了色谱柱和淋洗液梯度,建立了芦荟多糖中岩藻糖、鼠李糖、阿拉伯糖、半乳糖、葡萄糖、甘露糖和木糖的测定方法;FELZ等[13]通过HPAEC法实现了对组成好氧污泥颗粒中EPS的单糖组成的分析。
HPAEC法通常以NaOH溶液为淋洗液,不同阴离子与OH-竞争固定相的结合位点的能力不同,导致保留时间不同,从而得到分离。糖类化合物在阴离子交换分离柱上的保留主要取决于糖类化合物所带的电荷数、分子大小、组成和结构[14]。目前,已有许多文献报道了HPAEC测定单糖组成的优化条件,主要集中在多糖样品水解条件(酸的种类和浓度、水解时间、水解温度等)[12,15-16]、色谱分析条件等[12,16-17]的优化。本实验通过优化淋洗液的浓度,试图实现12种单糖同时在线检测;在此基础上,比较了反复冻融法、TCA法和酶法除蛋白对嗜热链球菌EPS的单糖组成分析的影响,以期建立稳定可靠的嗜热链球菌发酵液中EPS单糖组成的分析方法。
1 材料与方法
1.1 材料与试剂
菌株:嗜热链球菌AR333,上海理工大学上海食品微生物工程技术研究中心(专利保藏号:CGMCC 10262);嗜热链球菌JMCC0003,君乐宝乳业;嗜热链球菌YZST072,扬大康源乳业;嗜热链球菌CN,光明乳业,4株菌分别标记为S1、S2、S3、S4。
LM17液体培养基:胰蛋白胨5 g、大豆蛋白胨5 g、牛肉浸出粉5 g、酵母浸出粉2.5 g、β-磷酸甘油二钠19 g、MgSO4·7H2O 0.25 g、乳糖20 g,加蒸馏水至1 000 mL,115 ℃灭菌20 min,所用试剂购于上海源叶生物科技有限公司。
单糖标准品:L-岩藻糖(Fuc)、D-半乳糖胺(GalN)、L-鼠李糖(Rha)、D-阿拉伯糖(Ara)、D-葡糖胺(GlcN)、D-半乳糖(Gal)、D-葡萄糖(Glc)、D-木糖(Xyl)、D-甘露糖(Man)、D-核糖(Rib)、D-半乳糖醛酸(GalA)、D-葡萄糖醛酸(GlcA),Sigma-Aldrich化学公司;质量分数为50%的NaOH溶液、无水乙酸钠(纯度>99.9%),美国Thermo公司;TCA(AR级),上海展云化工有限公司;木瓜蛋白酶(酶活力≥ 6 000 U/mg),国药集团化学试剂有限公司;实验用水均为超纯水。
1.2 仪器与设备
Avanti JXN-26高速冷冻离心机,美国贝克曼库尔特有限公司;752型紫外可见分光光度计,上海光谱仪器有限公司;ICS-5000+离子交换色谱系统,美国Thermo公司。
1.3 实验方法
1.3.1 色谱分析条件
高效阴离子交换色谱串联脉冲安培检测器系统:串联有CarboPac PA20保护柱(3 mm×30 mm)和CarboPac PA20分析柱(3 mm×150 mm);工作电极为Au,参比电极为Ag/AgCl;淋洗液:A.H2O、B.25 mmol/L NaOH溶液、C.1 mol/L NaOAc溶液、D.200 mmol/L NaOH溶液,通过改变不同淋洗液的比例,优化多种单糖同时在线检测的洗脱程序,实现最佳分离效果;流速 0.5 mL/min;进样体积 25 μL;柱温 30 ℃。
以分离度评价色谱峰之间的分离效果,通过公式(1)计算分离度:
分离度![]()
(1)
式中:t1和w1、t2和w2分别为相邻色谱峰的保留时间(min)和峰宽(min)。
1.3.2 单糖标准溶液配制
单标配制:分别准确称取约10 mg各种单糖标品,加超纯水充分溶解后,转移至10 mL容量瓶定容,配制成质量浓度约为1 mg/mL的单糖标准储备液。
混标配制:分别移取适量各单糖标准储备液于100 mL容量瓶中,超纯水定容,得到混合标准溶液,其中Fuc、GalN、Rha、Ara、GlcN、Gal、Glc、Xyl、Man、Rib、GalA、GlcA的质量浓度分别为14.56、8.40、42.18、19.04、9.20、26.88、29.16、29.50、70.20、15.90、9.00、7.84 mg/L。上述混合标准溶液再稀释成系列质量浓度的混合标准溶液。
1.3.3 胞外多糖样品的制备
将活化后的S1、S2、S3和S4以体积分数为3%的接菌量分别接种于LM17培养基,40 ℃厌氧培养24 h。EPS的提取参考REN等[18]的方法。将发酵液沸水浴10 min,冷却至室温后于4 ℃离心(10 000×g,20 min),在上清液中缓慢加入3倍体积无水乙醇,4 ℃静置12 h后离心(10 000×g,20 min),用适量无水乙醇洗涤沉淀2次后,挥发乙醇,加适量去离子水复溶,8 k~14 kDa截留分子质量的透析袋透析3 d,离心后冻干上清液得到粗EPS。
选用S1菌株产EPS的样品(BS1),研究不同脱蛋白方法对EPS的影响。用适量超纯水溶解BS1,配成4 mg/mL的溶液,分别采用下列方法处理多糖溶液:
(1)反复冻融法:将多糖溶液于-20 ℃冷冻24 h后,于常温解冻,4 ℃下10 000×g离心20 min去除沉淀,重复上述过程7次,将最后一次离心后的上清液冻干,得到样品FS1;
(2)TCA法:加800 g/L的TCA溶液至终质量浓度为40 g/L,边加边搅拌,4 ℃放置7 h后,10 000×g离心20 min,上清液用1.0 mmol/L NaOH溶液调节pH至6.0,透析(8 k~14 kDa截留分子质量)、冻干,得到样品TS1;
(3)酶法:用适量超纯水溶解木瓜蛋白酶,配成6 000 U/mL的溶液,在多糖溶液中加入木瓜蛋白酶溶液使酶的终浓度为60 U/mL,于40 ℃下反应1 h后,煮沸10 min,于4 ℃下10 000×g离心20 min,上清液透析(8 k~14 kDa截留分子质量)、冻干,得到样品ES1。
1.3.4 脱蛋白效果评价
采用苯酚-硫酸法[19]测定多糖样品BS1、FS1、TS1和ES1的总糖含量(以D-葡萄糖为标准),考马斯亮蓝法[20]测定蛋白含量(以牛血清白蛋白为标准),并通过公式(2)、(3)、(4)分别计算总糖含量提高率、总糖质量损失率和蛋白含量脱除率,并评价3种方法的脱蛋白效果:
总糖含量提高率![]()
(2)
总糖质量损失率![]()
(3)
蛋白含量脱除率![]()
(4)
式中:p1,BS1中总糖的质量分数,%;q1,BS1中蛋白的质量分数,%; m1,BS1质量,mg;p2,脱蛋白后样品中总糖的质量分数,%;q2,脱蛋白后样品中蛋白的质量分数,%;m2,脱蛋白后样品质量,mg。
1.3.5 多糖样品水解液的制备
分别称取各多糖样品约10 mg,冰浴条件下加0.5 mL 12 mol/L H2SO4溶液,室温下搅拌反应30 min,缓慢向其中加水,将H2SO4溶液稀释至2 mol/L,混匀后于100 ℃的油浴中水解2 h,取出迅速冷水冷却,水解液经超纯水适当稀释后,用0.22 μm微孔膜过滤,进样分析。
1.3.6 数据分析
所有实验平行测量3次,数据采用均值±标准差表示。采用SPSS statistics 17.0软件进行单因素方差分析及多重比较分析,P<0.05为差异显著,有统计学意义。应用Origin 8.0软件作图。
2 结果与分析
2.1 淋洗液浓度的优化
常见单糖的电离常数(pKa)为12~14,HPAEC法依据pKa值的细微差异,采用阴离子交换色谱柱,以碱性溶液为淋洗液对不同单糖进行分离[21]。然而,部分单糖pKa值相近,需要优化色谱柱和淋洗液浓度来实现有效分离。
本研究通过改变淋洗液的NaOH浓度,优化了12种单糖(Fuc、GalN、Rha、Ara、GlcN、Gal、Glc、Xyl、Man、Rib、GalA、GlcA)的洗脱条件,并通过分离度评价色谱峰之间的分离效果,分离度>1.5时,色谱峰的分离程度达到99.7%,认为基线分离。从图1可知,NaOH浓度为1~5 mmol/L时,Fuc、GlcN、Gal、Glc、Rib、GalA和GlcA均可得到基线分离,NaOH浓度的变化对其无显著影响。而GalN和Rha 较难分离,NaOH浓度为5 mmol/L时完全重合,降低NaOH浓度,GalN和Rha的分离度先增大后减小,在NaOH浓度为1.75 mmol/L时,GalN和Rha的分离效果最好,分离度为0.9。Rha和Ara的分离度随着NaOH浓度的增大而增大,NaOH浓度为5 mmol/L时,Rha和Ara的分离度>1.5,实现基线分离。Xyl和Man的pKa值相近,分别为12.15和12.08[11],NaOH浓度越大,Xyl和Man的分离效果越差,在NaOH浓度为3.75 mmol/L时完全重合。综合考虑12种单糖的分离,最终确定最适NaOH浓度为1.75 mmol/L,梯度洗脱程序见表1。

a-5 mmol/L NaOH;b-3.75 mmol/L NaOH;c-3 mmol/L NaOH;d-1.75 mmol/L NaOH;e-1 mmol/L NaOH
图1 12种单糖混合物在不同NaOH浓度洗脱下的色谱分离图(a)和不同洗脱条件下GalN-Rha、Rha-Ara、Xyl-Man对应的分离度(b)
Fig.1 The HPAEC chromatogram of 12 mixed monosaccharide standards (a) and resolutions of GalN-Rha,Rha-Ara and Xyl-Man (b) at different elution conditions
表1 优化后的HPAEC梯度洗脱程序
Table 1 Optimized HPAEC gradient elution program
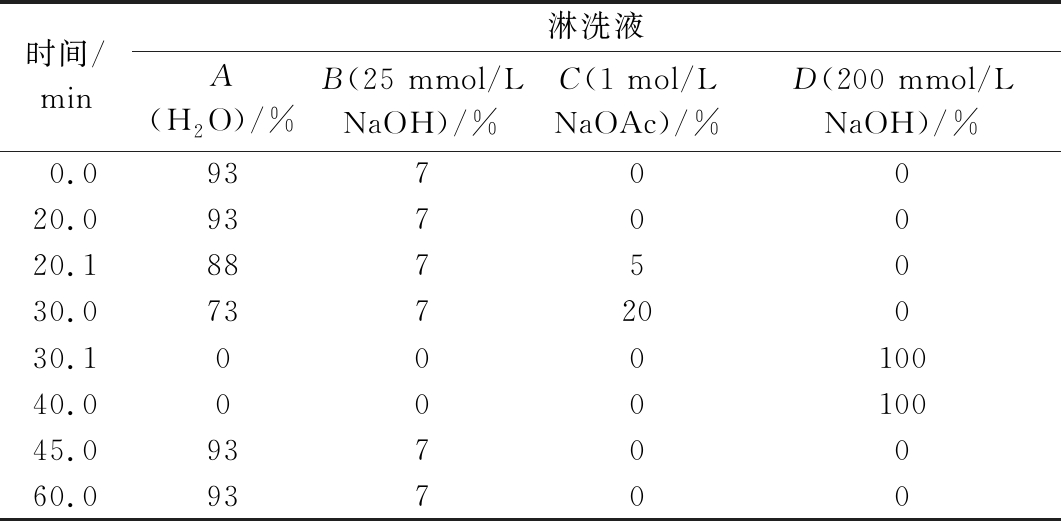
时间/min淋洗液A(H2O)/%B(25 mmol/L NaOH)/%C(1 mol/L NaOAc)/%D(200 mmol/L NaOH)/%0.09370020.09370020.18875030.073720030.100010040.000010045.09370060.093700
2.2 不同单糖的线性、检出限和定量限分析
在优化的洗脱条件下,考察12种单糖浓度与峰面积的线性关系,建立峰面积(nC·min)-单糖标品质量浓度(mg/L)校准曲线,并使用最小二乘法对所得曲线进行线性回归。表2显示回归方程和相关系数,12种单糖成分的标准曲线线性关系良好,相关系数均>0.99。分别以3倍和10倍信噪比(S/N)时的质量浓度计算检出限和定量限,结果列于表2。
表2 HPAEC测定不同单糖的线性、检出限及定量限结果
Table 2 Linearity,limits of detection and limits of quantitation of different monosaccharides in HPAEC

注:y和x分别代表单糖标品的峰面积和质量浓度(mg/L)
单糖保留时间/min线性范围/(mg·L-1)线性方程R2检出限/(μg·L-1)定量限/(μg·L-1)Fuc3.8670.29~4.37y=1.662x+0.2800.9973.814.1GalN7.4590.42~5.04y=3.109x+2.6360.9912.59.3Rha7.9250.84~12.65y=0.732x+0.2750.99812.647.3Ara8.2840.38~5.71y=2.058x+0.3110.9985.119.3GlcN9.4840.18~2.76y=6.272x+0.8160.9962.59.5Gal10.4670.54~13.44y=1.361x+1.2080.9977.728.8Glc12.0170.58~8.75y=1.451x+1.8040.9909.636.0Xyl14.0900.59~8.85y=1.649x+0.8150.9948.732.5Man14.7451.40~21.06y=0.787x+0.8330.99621.179.1Rib18.4190.32~9.54y=1.939x+0.0810.9999.535.6GalA27.0090.18~5.40y=1.269x-0.0140.9993.011.3GlcA28.0000.16~4.70y=1.551x+0.0180.9993.212.1
2种氨基糖(GalN和GlcN)的检出限结果均最低,为2.5 μg/L,GlcN的检测线性范围较窄,为0.18~2.76 mg/L;2种糖醛酸(GalA和GlcA)在NaOH-NaOAc淋洗液中洗脱,检测线性范围、检出限和定量限结果相近,质量浓度约为3 μg/L时即可被检出,低于刘晓莹等[15]和ALYASSIN等[22]的测定结果;Man的检测线性范围宽,为1.40~21.06 mg/L,而检出限和定量限较高,需在较高浓度范围才能被检测;其余中性糖的检出限为3.8~12.6 μg/L,定量限为14.1~47.3 μg/L,其中Ara、Gal、Glc和Xyl的检出限和定量限均低于ALYASSIN等[22]和DE SOUZA等[23]的测定结果。以上结果表明该法有效提高了12种单糖的检测灵敏度,扩大样品检测浓度范围,有利于微量样品的分析。但是,随着样品检测浓度的降低,受样品杂质干扰愈加明显,故需要保证样品较高的纯度,避免杂质对目标分析物信号的干扰。
2.3 不同单糖的加标回收率、精密度及重现性分析
回收率可用于评估方法的准确性,将3种已知质量浓度的单糖混合标准溶液添加到样品溶液中,对加标样品进行定量分析,通过计算得到每种单糖的平均回收率,确定该色谱方法的测定结果与真实值(加入量)的差异,从而确认该方法是否可以获得准确的测试结果。表3结果表明,12种单糖的平均回收率在77.3%~118.5%,其中2种糖醛酸(GalA和GlcA)的加标回收率接近100%,GlcN的回收率最低为77.3%,Rha、Ara和Xyl较难得到基线分离,但其加标回收率仍在78.2%~86.6%。
表3 HPAEC测定不同单糖的加标回收率和精密度结果
Table 3 Spiked recoveries and precisions of different monosaccharides in HPAEC
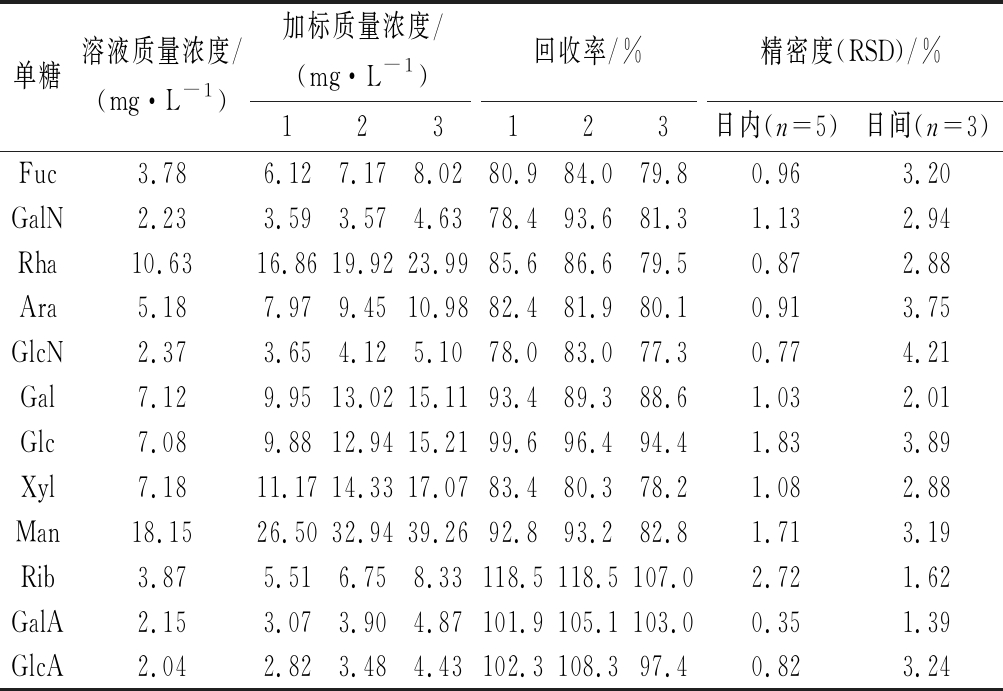
单糖溶液质量浓度/(mg·L-1)加标质量浓度/(mg·L-1)回收率/%精密度(RSD)/%123123日内(n=5)日间(n=3)Fuc3.786.127.178.0280.984.079.80.963.20GalN2.233.593.574.6378.493.681.31.132.94Rha10.6316.8619.9223.9985.686.679.50.872.88Ara5.187.979.4510.9882.481.980.10.913.75GlcN2.373.654.125.1078.083.077.30.774.21Gal7.129.9513.0215.1193.489.388.61.032.01Glc7.089.8812.9415.2199.696.494.41.833.89Xyl7.1811.1714.3317.0783.480.378.21.082.88Man18.1526.5032.9439.2692.893.282.81.713.19Rib3.875.516.758.33118.5118.5107.02.721.62GalA2.153.073.904.87101.9105.1103.00.351.39GlcA2.042.823.484.43102.3108.397.40.823.24
表3结果说明该法测得的结果准确性较好,满足方法学的定量要求。精密度实验参照XIE等[24]方法,通过测定混合标准溶液中每种单糖的峰面积的重复性(日内变化和日间变化)来确定方法的精密度。方法的精确度计算为每种单糖连续3次进样的变异系数,并用相对标准偏差(relative standard deviation,RSD)表示,日内精度在同一天以4 h为间隔执行,日间精度在连续3 d内执行,结果如表3所示。Rib的日内峰面积的RSD最大,GalA的日内峰面积的RSD最小为0.35%;Xyl的日间峰面积的RSD最大,GlcN的日间峰面积的RSD最小,为1.39%;12种单糖日内峰面积的RSD<2.72%,日间峰面积的RSD<4.21%。表明该方法重现性良好,可满足单糖组成的定性和定量分析要求。
2.4 嗜热链球菌EPS脱蛋白方法的优化
通常,微生物的EPS在培养基中发酵提取获得,而培养基或菌体本身均会对提取的EPS造成污染,如酵母提取物中的甘露糖蛋白残留会造成测定的Man偏高,牛肉浸粉中的糖原也会对EPS的测定造成影响[25]。因此,微生物EPS研究过程中,需对其纯化处理,排除其他物质的干扰。本研究分别通过反复冻融法、TCA法和酶法处理BS1,得到样品FS1、TS1和ES1,不同脱蛋白方法的结果列于表4。结果表明:与脱蛋白处理前相比,3种方法处理后样品的总糖含量均显著提高,蛋白含量显著降低。其中,TS1样品的总糖含量提高率和蛋白含量脱除率最高,分别为34.21%和57.41%,说明相比于反复冻融法和酶法,TCA法可更有效地去除嗜热链球菌EPS的杂质蛋白。此外,还发现脱蛋白处理会对粗EPS的总糖质量造成损失,TCA法最为显著,总糖质量损失率高达16.84%,原因可能是TCA法使部分EPS与蛋白质共沉淀[26]。反复冻融法和酶法处理较为温和,但也造成了约8.00%的总糖质量损失。同时考虑蛋白脱除和总糖损失情况,TCA法的蛋白含量脱除率/总糖质量损失率为3.14,显著高于反复冻融法和酶法,因此,选择TCA法为嗜热链球菌EPS的最佳脱蛋白方法。
表4 不同脱蛋白方法处理对EPS性质的影响
Table 4 Effects of different deproteinization methods on the EPS properties

样品总糖含量提高率/%蛋白含量脱除率/%总糖质量损失率/%蛋白含量脱除率/总糖质量损失率FS110.94±1.40a17.23±1.54a7.63±0.44a2.26±0.16aTS134.21±0.99c57.41±1.98c16.84±0.8b3.41±0.22cES114.29±1.10b21.96±1.86b8.00±0.77a2.75±0.18b
采用优化后的单糖组成分析色谱条件,对TCA法脱蛋白样品TS1进行单糖组成分析,并与未脱蛋白的样品BS1比较,考察脱蛋白前后EPS的单糖组成,结果见图2。结果表明:BS1样品中的中性糖保留时间较TS1的前移,蛋白质酸水解产物(如精氨酸、赖氨酸、组氨酸)的竞争性保留[27]可能是导致单糖保留时间变化的主要原因;在TCA法脱蛋白处理前后的多糖样品中均检测到GalN、Rha、GlcN、Gal、Glc、Man、GalA和GlcA,且8种单糖均可得到分离,TS1中GlcN和Gal的分离度为1.47,显著高于BS1(分离度为1.00),因此,TS1水解后单糖的分离效果更好。与TS1的色谱分离结果相比,BS1在Man的色谱峰后,有较多未知的杂峰干扰,并且在溶剂峰左右出现更多未分离的色谱峰。除此之外,由于BS1的总糖含量显著低于TS1,需水解更多质量的粗EPS达到与TS1相同的响应度结果,但同时考虑随着粗EPS质量的增大,可能导致水解不完全,不利于单糖组成的定量分析。综上所述,通过HPAEC法对嗜热链球菌EPS进行单糖组成分析前,需要对提取的粗多糖进行脱蛋白处理,以获得更加可靠的定性及定量结果。
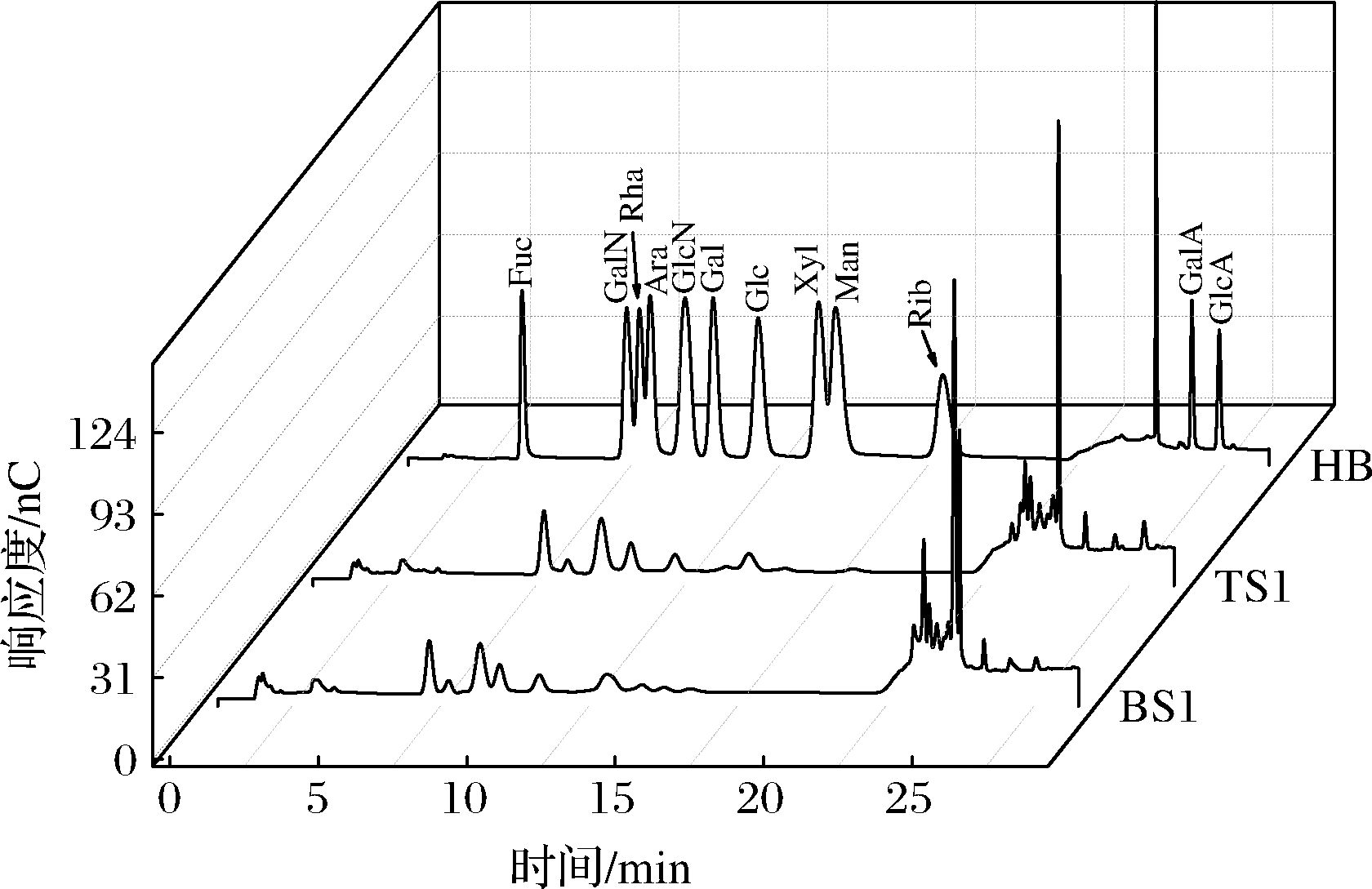
图2 单糖混合标准品(HB)及样品BS1、TS1的单糖组成色谱分离图
Fig.2 The HPAEC chromatograms of mixed monosaccharide standards (HB) and samples of BS1 and TS1
2.5 样品测定
为进一步验证本研究建立的针对嗜热链球菌EPS的单糖组成分析的方法,对4株嗜热链球菌产的粗EPS进行TCA法脱蛋白处理后,通过优化的HPAEC条件分析单糖组成,结果如图3和表5所示。

图3 不同菌株胞外多糖的单糖组成结果
Fig.3 The monosaccharide composition of EPSs from different strains
图3结果表明,各单糖组分分离效果较好,4种EPS均检出GalN、Rha、GlcN、Gal、Glc、Man及糖醛酸成分,不同EPS的单糖含量结果列于表5,表明嗜热链球菌EPS是一种成分复杂的杂多糖。根据已有文献,李嘉文等[26]报道嗜热链球菌NMG 115产的EPS主要由Ara、Gal、Glc、Man组成;XU等[4]报道嗜热链球菌S-3产的EPS主要由GalN、Gal、Glc组成。本研究表明S1、S2和S3产的EPS中GalN、Gal、Glc和Man含量较高,这与文献报道相符,不同的是,在S1和S2 产的EPS中还检出较多GlcA,S3产的EPS中检出较多GalA。此外,S4产的EPS中GalN、Rha、Glc、Man和GalA含量较高,PACHEKREPAPOL等[3]在嗜热链球菌DGCC 7698产的EPS中同样检出较多的Rha。值得注意的是,S1菌株的EPS中GalN、Gal、Glc的摩尔比约为1.3∶1.6∶1.0,与之前的研究相比,嗜热链球菌AR333在改良脱脂乳培养基中发酵产生的EPS中GalN、Gal、Glc的摩尔比约为1∶3∶2[28],说明不同培养基可能会影响嗜热链球菌产生EPS的单糖组成,在后续研究中将对此展开系统分析。
表5 不同菌株胞外多糖样品单糖组成及含量测定结果
Table 5 Monosaccharide composition and content of EPSs from different strains

样品单糖质量分数/%GalNRhaGlcNGalGlcManGalAGlcAS115.00±0.05c1.78±0.13a6.98±0.02d18.67±0.04c11.99±0.01a21.75±0.09b3.72±0.06a14.30±0.03dS214.91±0.12c3.50±0.20b4.01±0.02b23.05±0.17d17.88±0.09d12.38±0.11a5.20±0.11b11.24±0.04cS312.12±0.10b6.59±0.21c4.84±0.02c17.76±0.12b17.14±0.11c23.27±0.11c9.54±0.18c2.39±0.08aS47.48±0.01a21.38±0.01d3.28±0.01a10.13±0.01a13.85±0.00b21.61±0.02b13.31±0.01d8.95±0.01b
3 结论
本研究优化了NaOH溶液作为淋洗液的浓度,确定最佳的洗脱程序。Fuc、GlcN、Gal、Glc、Rib、GalA和GlcA 7种单糖可实现基线分离。同时,GalN、Rha和Ara,Xyl和Man也可达到较好的分离效果。通过方法学验证证明所建立的HPAEC-PAD法对于12种单糖的同时在线分离可以实现良好的线性,且这种方法准确性和重复性好、灵敏度高。在此基础上,通过比较反复冻融法、TCA法和酶法,最终确定了TCA法为嗜热链球菌EPS最佳的脱蛋白方法。该法操作简单、快速,可实现57.41%的蛋白脱除率,使样品达到阴离子交换色谱进样分析的要求。将优化后的色谱条件及样品处理方法应用于4株嗜热链球菌EPS的单糖组成定性及定量分析,发现不同菌株产EPS的单糖组成种类相似,但比例差异较大,与前人研究比较,发现EPS的单糖组成可能会受培养基的影响,但具体还需进一步研究。综上,本研究提供了一种可靠的分析嗜热链球菌胞外多糖单糖组成的方法,并可将其应用于其他微生物胞外多糖的研究中。
[1] CUI Y H,JIANG X,HAO M Y,et al.New advances in exopolysaccharides production of Streptococcus thermophilus[J].Archives of Microbiology,2017,199(6):799-809.
[2] CHE H Q,ZHANG H,TIAN Y J,et al.Exopolysaccharide from Streptococcus thermophilus as stabilizer in fermented dairy:Binding kinetics and interactions with casein of milk[J].International Journal of Biological Macromolecules,2019,140:1 018-1 025.
[3] PACHEKREPAPOL U,LUCEY J A,GONG Y,et al.Characterization of the chemical structures and physical properties of exopolysaccharides produced by various Streptococcus thermophilus strains[J].Journal of Dairy Science,2017,100(5):3 424-3 435.
[4] XU Z Y,GUO Q B,ZHANG H,et al.Exopolysaccharide produced by Streptococcus thermophiles S-3:Molecular,partial structural and rheological properties[J].Carbohydrate Polymers,2018,194:132-138.
[5] LI S Q,SHAH N P.Antioxidant and antibacterial activities of sulphated polysaccharides from Pleurotus eryngii and Streptococcus thermophilus ASCC 1275[J].Food Chemistry,2014,165:262-270.
[6] ZHANG J,CAO Y Q,WANG J,et al.Physicochemical characteristics and bioactivities of the exopolysaccharide and its sulphated polymer from Streptococcus thermophilus GST-6[J].Carbohydrate Polymers,2016,146:368-375.
[7] SUN N X,LIU H P,LIU S J,et al.Purification,preliminary structure and antitumor activity of exopolysaccharide produced by Streptococcus thermophilus CH9[J].Molecules,2018,23(11):e2898.
[8] DEL PIANO M,BALZARINI M,CARMAGNOLA S,et al.Assessment of the capability of a gelling complex made of Tara gum and the exopolysaccharides produced by the microorganism Streptococcus thermophilus ST10 to prospectively restore the gut physiological barrier:A pilot study[J].Journal of Clinical Gastroenterology,2014,48:S56-S61.
[9] SVENSSON M,WAAK E,SVENSSON U,et al.Metabolically improved exopolysaccharide production by Streptococcus thermophilus and its influence on the rheological properties of fermented milk[J].Applied and Environmental Microbiology,2005,71(10):6 398-6 400.
[10] TANG W,LIU D,YIN J Y,et al.Consecutive and progressive purification of food-derived natural polysaccharide:Based on material,extraction process and crude polysaccharide[J].Trends in Food Science & Technology,2020,99:76-87.
[11] 李仁勇,梁立娜,牟世芬.高效阴离子交换色谱-脉冲安培检测食品中糖的应用进展[J].食品与发酵工业,2010,36(7):97-101.
LI R Y,LIANG L N,MOU S F.Application advance in analysis of food carbohydrates with high performance anion exchange chromatography-pulsed amperometric detection[J].Food and Fermentation Industries,2010,36(7):97-101.
[12] 乐胜锋, 王尉,王雅萱,等.离子色谱-脉冲安培法测定芦荟多糖中7种单糖的含量[J].色谱,2019,37(3):319-324.
LE S F,WANG W,WANG Y X,et al.Determination of seven monosaccharides in Aloe polysaccharide using ion chromatography with pulsed amperometric detector[J].Chinese Journal of Chromatography,2019,37(3):319-324.
[13] FELZ S,VERMEULEN P,VAN LOOSDRECHT M C M,et al.Chemical characterization methods for the analysis of structural extracellular polymeric substances (EPS)[J].Water Research,2019,157:201-208.
[14] MAGER D M,THOMAS A D.Extracellular polysaccharides from cyanobacterial soil crusts:A review of their role in dryland soil processes[J].Journal of Arid Environments,2011,75(2):91-97.
[15] 刘晓莹,马璐瑶,王力,等.基于高效阴离子色谱-脉冲安培法优化阿拉伯木聚糖单糖组成分析[J].分析化学,2017,45(3):416-422.
LIU X Y,MA L Y,WANG L,et al.Monosaccharide composition analysis of arabinoxylan by high performance anion exchange chromatography with pulsed amperometric detection[J].Chinese Journal of Analytical Chemistry,2017,45(3):416-422.
[16] 李静, 李仁勇,梁立娜.毛细管型离子色谱-脉冲安培法检测枸杞多糖的单糖组成[J].分析化学,2012,40(9):1 415-1 420.
LI J,LI R Y,LIANG L N.Determination of monosaccharide constituents in Lycium barbarum polysaccharide using capillary ion chromatography with pulsed amperometric detection[J].Chinese Journal of Analytical Chemistry,2012,40(09):1 415-1 420.
[17] ZHANG Z Q,KHAN N M,NUNEZ K M,et al.Complete monosaccharide analysis by high-performance anion-exchange chromatography with pulsed amperometric detection[J].Analytical Chemistry,2012,84(9):4 104-4 110.
[18] REN W,XIA Y J,WANG G Q,et al.Bioactive exopolysaccharides from a S.thermophilus strain:Screening,purification and characterization[J].International Journal of Biological Macromolecules,2016,86:402-407.
[19] DUBOIS M,GILLES K A,HAMILTON J K,et al.Colorimetric method for determination of sugars and related substances[J].Analytical Chemistry,1956,28(3):350-356.
[20] BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry,1976,72(1-2):248-254.
[21] WU D T,GUO H,LIN S,et al.Review of the structural characterization,quality evaluation,and industrial application of Lycium barbarum polysaccharides[J].Trends in Food Science & Technology,2018,79:171-183.
[22] ALYASSIN M,CAMPBELL G M,MASEY O’NEILL H,et al.Simultaneous determination of cereal monosaccharides,xylo-and arabinoxylo-oligosaccharides and uronic acids using HPAEC-PAD[J].Food Chemistry,2020,315.DOI:10.1016/j.foodchem.2020.126221.
[23] DE SOUZA M F,PEREIRA D S,FREITAS S P,et al.Neutral sugars determination in Chlorella:Use of a one-step dilute sulfuric acid hydrolysis with reduced sample size followed by HPAEC analysis[J].Algal Research,2017,24:130-137.
[24] XIE J H,SHEN M Y,NIE S P,et al.Analysis of monosaccharide composition of Cyclocarya paliurus polysaccharide with anion exchange chromatography[J].Carbohydrate Polymers,2013,98(1):976-981.
[25] PINTADO A I E,FERREIRA J A,PINTADO M M E,et al.Eficiency of purification methods on the recovery of exopolysaccharides from fermentation media[J].Carbohydrate Polymers,2020,231.DOI:10.1016/j.carbpol.2019.115703.
[26] 李嘉文, 刘达,刘党生,等.乳酸菌胞外多糖产生菌的筛选与初步研究[J].中国微生态学杂志,2019,31(9):1 027-1 033.
LI J W,LIU D,LIU D S,et al.Screening of and preliminary research on exopolysaccharides producing strain[J].Chinese Journal of Microecology,2019,31(9):1 027-1 033.
[27] NIE S P,ZHANG H,LI W J,et al.Current development of polysaccharides from Ganoderma:Isolation,structure and bioactivities[J].Bioactive Carbohydrates and Dietary Fibre,2013,1(1):10-20.
[28] ZHANG H,REN W,GUO Q B,et al.Characterization of a yogurt-quality improving exopolysaccharide from Streptococcus thermophilus AR333[J].Food Hydrocolloids,2018,81:220-228.