淀粉通常由线性的直链淀粉和分叉状的支链淀粉组成,高直链淀粉通常指直链淀粉含量超过50%的特殊淀粉[1]。相比普通淀粉,高直链淀粉具有良好的成膜性及较高含量的抗性淀粉,被广泛应用于生物降解材料和健康食品领域[2]。
淀粉的糊化是淀粉最重要的理化性质,决定着淀粉的加工和使用。快速黏度分析仪(rapid viscosity analyzer,RVA)是淀粉糊化特性最常用的表征仪器[3],具有操作简单、快速升温或冷却、准确调节搅拌器转速等特点[4]。RVA的作用是将淀粉与水的悬浮液在加热的条件下通过搅拌桨做恒定剪切,悬浮液的黏度随扭矩变化,以此建立淀粉随温度和时间变化的糊化曲线[5-6],通过RVA测定样品后得到峰值黏度、低谷黏度、崩解值、最终黏度、回生值等糊化参数,可用于淀粉样品的加工特性研究[7]。
常规RVA测定样品通常在95 ℃下进行,而高直链淀粉的起始糊化温度较高[7-8],糊化温度高于100 ℃。本实验采用高温RVA,设置了一个耐高压的密闭测试环境,可以密封和自我加压,最高加热温度可达140 ℃,测定了高直链玉米淀粉在95、110、120、130和140 ℃下的糊化性能,并利用流变仪、质构仪、扫描电镜来研究淀粉经过高温处理后的流变行为和凝胶结构的变化。
1 材料与方法
1.1 材料与仪器
高直链玉米淀粉Gelose 50(G50,直链淀粉含量50%),荃银祥玉(北京)生物科技有限公司。
RVA4800快速黏度分析仪,珀金埃尔默公司;MCR 302流变仪,奥地利安东帕公司;TA.XT II plus质构仪,英国Stable Micro System公司;TM-3000扫描电镜,日本日立公司。
1.2 试验方法
1.2.1 基于不同加热温度的RVA测试
采用RVA标准程序测定了G50淀粉样品的糊化特性,在铝罐中称量25.43 g蒸馏水,并向其中添加淀粉2.57 g。配制成质量分数约为8% 的样品悬浮液,将装入铝罐放入RVA中,加热至50 ℃,同时以960 r/min搅拌10 s,然后将转速降至160 r/min继续试验。50 ℃下保持1 min,以6 ℃/min的速率升温至95、110、120、130、140 ℃等 5种不同的温度,在相应温度下保持5 min,以6 ℃/min的速率冷却至50 ℃[10-11],最后在50 ℃下保持4 min。通过软件TCW3得到其糊化温度、峰值时间、峰值黏度、最终黏度、低谷黏度、崩解值和回生值等糊化参数,并用毫帕秒(mPa·s)记录。
1.2.2 基于不同升温速率的RVA测试
采用RVA的标准程序对G50淀粉进行精确测定。在铝罐中称取25.43 g蒸馏水,加入2.57 g样品,配制的淀粉悬浮液,质量分数为8%,在140 ℃下进行RVA测试。将装有悬浮液的铝罐放入RVA中,加热至50 ℃,同时以960 r/min搅拌10 s,然后将转速降至160 r/min,继续试验。在50 ℃下保持1 min,分别以2、10、15、20 ℃/min的速率升温至140 ℃,在140 ℃下保持5 min,以6 ℃/min的速率冷却至50 ℃,并在50 ℃下保持4 min。
1.2.3 基于不同浓度的RVA测试
采用RVA的标准程序对G50淀粉进行精确测定。直接称取27.03 g蒸馏水于铝罐中,加入0.97 g样品,进行RVA测试。按1.2.1实验方法制备样品,将悬浮液在140 ℃下进行检测。本实验方法测定不同质量分数的淀粉,分别为3%、5%、7%、9%。
1.2.4 流变行为测定
将1.2.1实验方法制备的G50淀粉凝胶样品放置在平行板上(d=50 mm),采用小振幅振荡剪切进行测试[12],间隙尺寸1 mm,测试温度25 ℃,频率扫描范围0.1~100 r/s,应变为1%。储能模量(G′)、损耗模量(G″)、损耗角正切(tan q=G′/G″)和复合黏度(η*)被记录为频率(ω)的函数。
1.2.5 质构测定
将1.2.1实验方法制备的样品倒入塑料罐(内径=33.0 mm,高度=38.0 mm)[13],盖上盖子,在4 ℃下保存24 h以进行凝胶化。使用质构仪进行分析,探头P6(d =10 mm),其他测试参数为[15]:触发力为5 g;测试速度为2.0 mm/s;压缩深度为10.0 mm。
1.2.6 微观结构观察
将1.2.1实验方法制备的样品进行快速冷冻,然后在-50 ℃下冻干48 h。用溅射技术在冻干的淀粉凝胶上涂金,在15 kV、×2 000倍率的条件下用场发射扫描电子显微镜观察[14-15]得到淀粉凝胶的图像。
1.3 数据分析
所有测量至少进行2次。使用Origin 8.5进行作图,显著性差异检验使用SPSS 22进行分析。
2 结果与分析
2.1 高直链玉米淀粉在不同温度下的糊化特性
图1是RVA对淀粉加热后得到的曲线图(RVA谱),淀粉黏度随着温度的变化,呈现有规律上升(峰值黏度)、下降(低谷黏度)、再上升(最终黏度),其中峰值黏度是指淀粉颗粒糊化时的最高黏度;低谷黏度(最低黏度)指恒温阶段结束时的黏度;峰值黏度与低谷黏度的差为崩解值,用来衡量膨胀的淀粉颗粒被破坏的难易程度;最终黏度与低谷黏度的差称为回生值,用来表征淀粉的回生(老化)程度[16-17]。
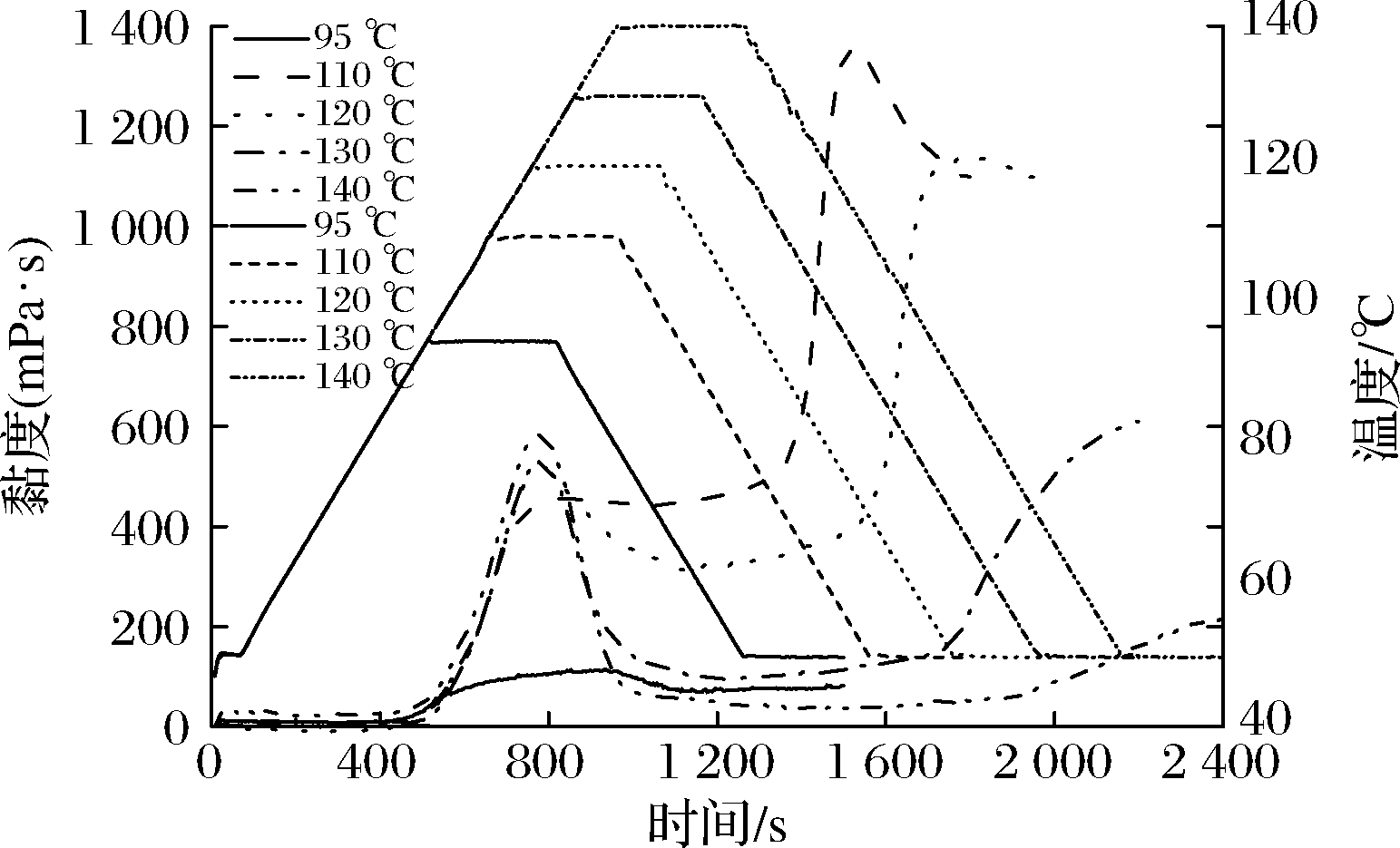
图1 不同加热温度下G50黏度变化
Fig.1 Pasting properties of G50 analyzed at heating temperatures of 95, 110, 120, 130 and 140 ℃
由图1和表1可知,高直链玉米淀粉G50经过95 ℃加热后,其峰值黏度较低,为111 mPa·s,这可能是由于淀粉在该温度下(低于糊化温度),颗粒膨胀程度较小[18-19];当温度从110 ℃加热到140 ℃时,峰值黏度从455 mPa·s增加到550.5 mPa·s,这可能是由于淀粉在较高的加热温度下发生糊化,淀粉颗粒进一步膨胀,黏度随之增高。而高直链淀粉G50的低谷黏度、最终黏度、回生值与温度升高的趋势不一致:G50的最终黏度分别从95 ℃的76.5 mPa·s上升到120 ℃的1 095.5 mPa·s,然后下降到140 ℃的192.5 mPa·s;出现这样的变化部分原因是冷却过程中G50形成了淀粉脂质复合物[20],淀粉脂质复合物可以限制淀粉颗粒在加热过程中的膨胀,并保持膨胀颗粒的完整性[18],因此,淀粉分子之间并没有表现出很强的再关联,导致最终黏度较高。淀粉加热到110、120 ℃时黏度的上升是形成的淀粉-脂质复合物发生沉淀引起的;当淀粉样品加热到130、140 ℃时,表现出更低的黏度是由于淀粉颗粒结构被破坏引起的,在这2个温度下直链淀粉游离出来,形成更多的相互作用,与文献中报道一致[21]。
表1 高直链玉米淀粉G50不同加热温度下特征值分析
Table 1 Pasting properties of G50 analyzed at heating temperatures of 95,110,120,130 and 140 ℃
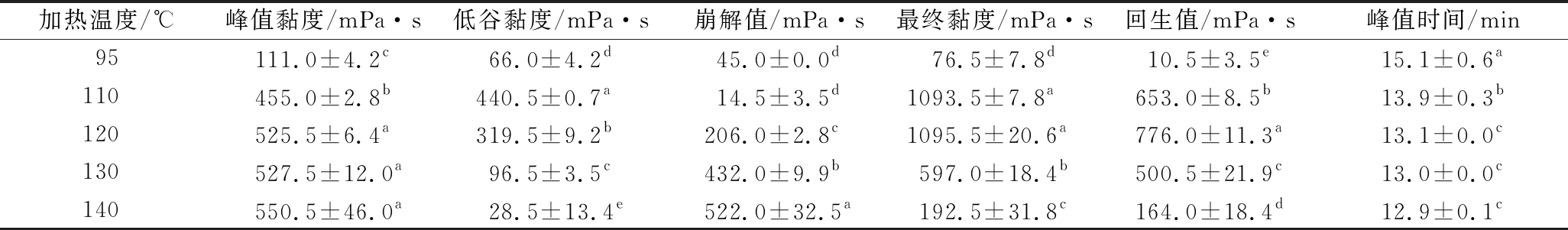
加热温度/℃峰值黏度/mPa·s低谷黏度/mPa·s崩解值/mPa·s最终黏度/mPa·s回生值/mPa·s峰值时间/min95111.0±4.2c66.0±4.2d45.0±0.0d76.5±7.8d10.5±3.5e15.1±0.6a110455.0±2.8b440.5±0.7a14.5±3.5d1093.5±7.8a653.0±8.5b13.9±0.3b120525.5±6.4a319.5±9.2b206.0±2.8c1095.5±20.6a776.0±11.3a13.1±0.0c130527.5±12.0a96.5±3.5c432.0±9.9b597.0±18.4b500.5±21.9c13.0±0.0c140550.5±46.0a28.5±13.4e522.0±32.5a192.5±31.8c164.0±18.4d12.9±0.1c
2.2 高直链淀粉在140 ℃下不同升温速率的糊化性能
由图2和表2可知,质量分数为8%的高直链玉米淀粉升温速率为2 ℃/min时,峰值黏度低,约为431 mPa·s;当升温速率20 ℃/min时,其最终黏度最高,为231.5 mPa·s。G50的低谷黏度、最终黏度随升温速率变化不明显,糊化时间与升温速率呈负相关,升温速率越小,其到达糊化时间越长。淀粉峰值黏度随速率的降低而降低,该现象是因为淀粉在低升温速率下,与水充分混合,糊化比较彻底,有效降低仪器冲温的影响。
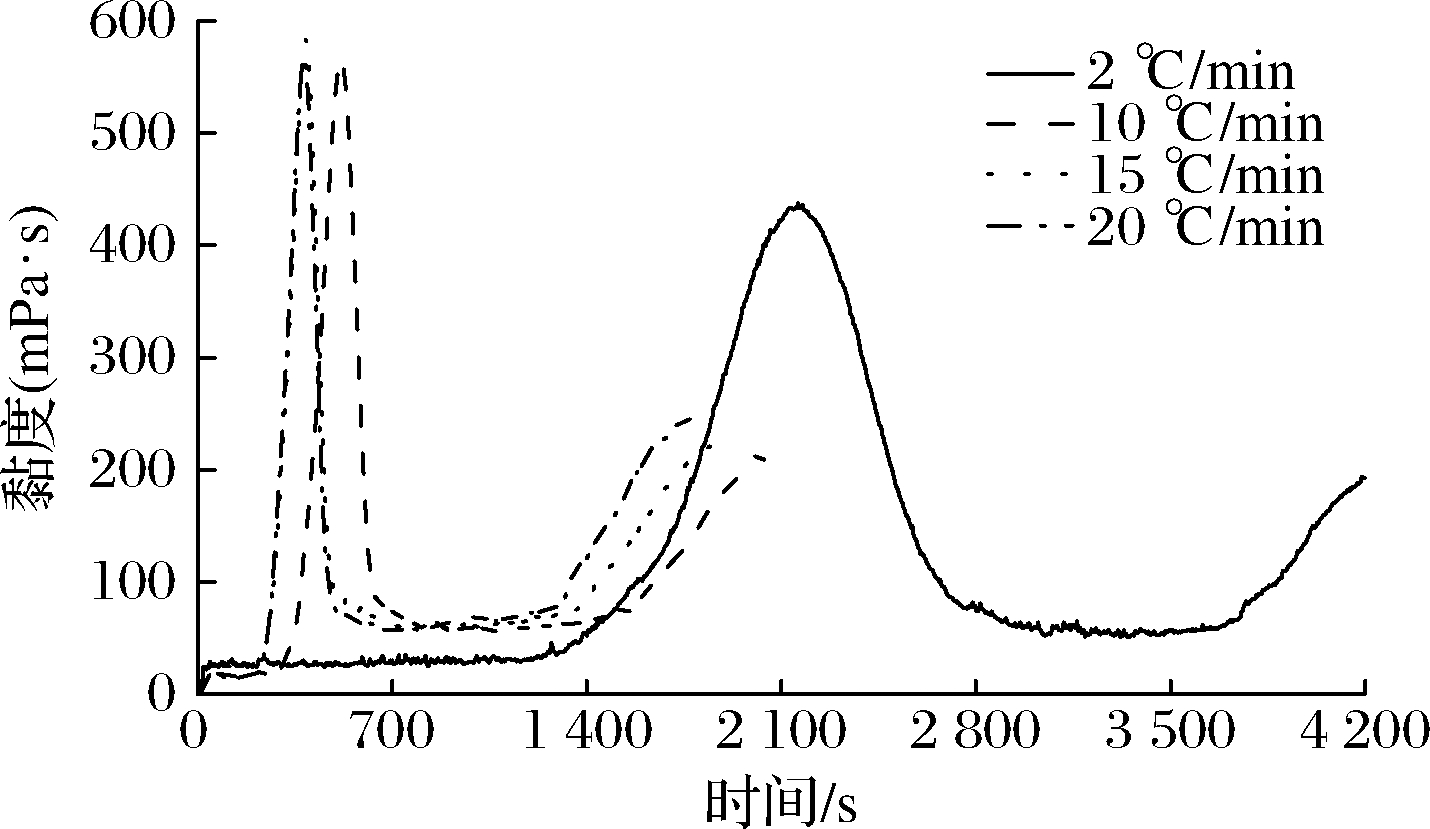
图2 G50在140 ℃下不同升温速率的黏度变化
Fig.2 Pasting properties of G50 analyzed at different heating rates of 140 ℃
表2 G50在140 ℃下不同升温速率特征值分析
Table 2 Pasting properties of G50 analyzed at different heating rates of 140 ℃

升温速率峰值黏度/mPa·s低谷黏度/mPa·s崩解值/mPa·s最终黏度/mPa·s回生值/mPa·s峰值时间/min2 ℃/min431.0±9.9b33.5±24.7a397.5±14.8b179.0±19.8a145.5±4.9b35.9±0.2a10 ℃/min555.5±16.3a44.5±12.0a511.0±4.2a194.0±21.2a149.5±9.2b8.6±0.0b15 ℃/min585.0±4.2a44.0±21.2a541.0±25.5a194.5±37.5a150.5±16.3b6.4±0.0c20 ℃/min555.5±14.8a43.0±18.4a512.5±3.5a231.5±19.1a188.5±0.7a6.3±0.0c
2.3 玉米淀粉在140 ℃下不同浓度的糊化性能
淀粉质量分数为3%、5%、7%、9%的RVA曲线图如图3所示,由表3可知,G50的峰值黏度、低谷黏度和最终黏度随着淀粉质量分数的增加而增大。回生值和崩解值也均增大。回生值越大,则淀粉糊的稳定性就越差,凝胶性增强。以上现象是因为浓度越大,对淀粉胶体黏度和稳定性贡献越大所致[22]。
表3 玉米淀粉G50在140 ℃下不同浓度特征值分析
Table 3 Pasting properties of G50 analyzed at different concentrations of 140 ℃

淀粉质量分数峰值黏度/mPa·s低谷黏度/mPa·s崩解值/mPa·s最终黏度/mPa·s回生值/mPa·s峰值时间/min3%19.0±7.1d-27.0±5.7d12.5±7.8d20.5±6.4d13.8±0.1a5%95.5±4.9c18.0±2.8c77.5±7.8c56.0±2.8c38.0±5.7c13.9±0.2a7%335.5±12.0b31.0±1.4b304.5±13.4b131.5±0.7b100.5±2.1b13.3±0.1b9%874.5±16.3a59.0±5.7a815.5±21.9a369.0±7.0a310.0±1.4a12.8±0.0c
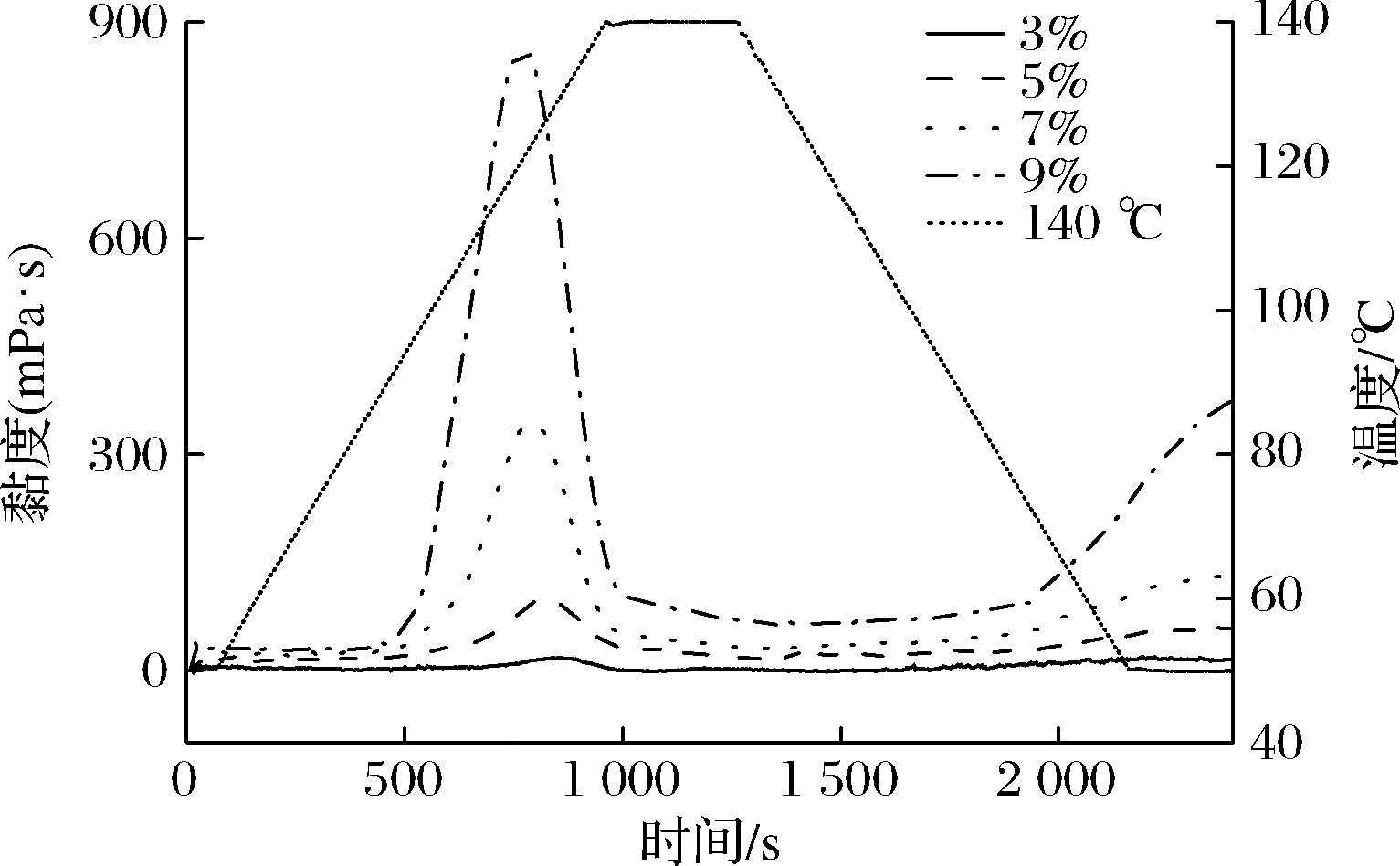
图3 G50在140 ℃下不同质量分数的黏度变化
Fig.3 Pasting properties of G50 analyzed at differentmass fraction of 140 ℃
2.4 高直链玉米淀粉不同温度处理后的流变性能
由图4可知,G50胶体的G′和复合黏度随加热温度的升高而变大,主要原因可能是高直链玉米淀粉经过不同温度加热,有更多的直链淀粉分子游离出来,直链淀粉分子发生缠结,和支链淀粉一起形成较强的网络,“弹性”属性更强[23]。G50样品的G′在140 ℃时最高,其物理性能最好。结果表明,G50试样的G′明显高于G″,其损耗的正切值<1,由此可以推断G50是以弹性为主的。
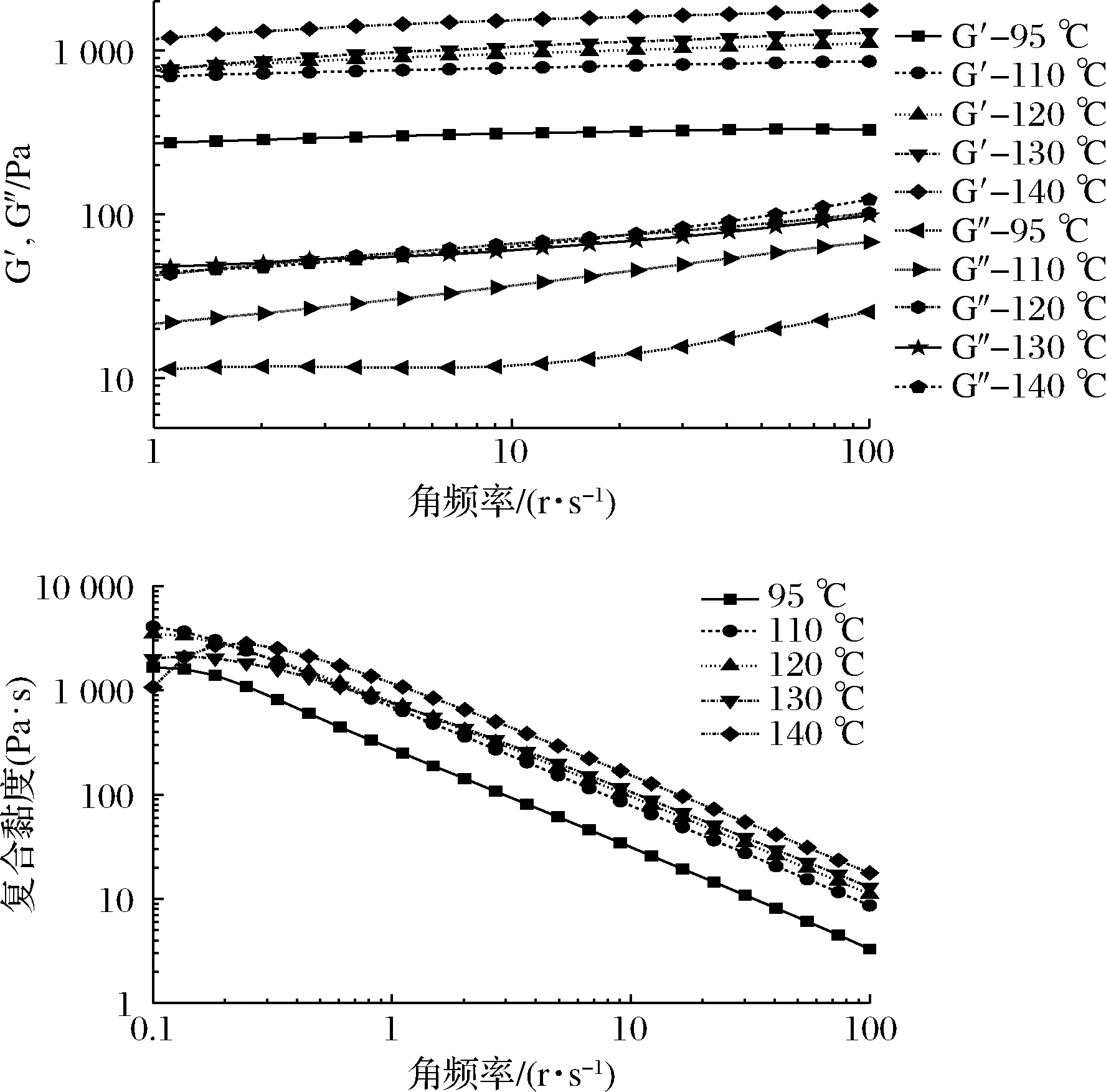
图4 不同加热温度处理后G50的流变性
Fig.4 Rheological properties of G50 analyzed at different heating temperatures
2.5 玉米淀粉不同温度处理后的质构性能
淀粉凝胶硬度的变化与淀粉胶体的结构有关,由表4可知,随着温度的升高,G50淀粉凝胶的硬度逐渐提高,这是由于淀粉在RVA罐中加热的温度越高,其淀粉膨胀和糊化越充分[25],更多直链淀粉分子游离出来,形成坚硬的凝胶。因此高直链淀粉糊化程度越大,淀粉颗粒越膨胀并逐渐分散。高直链淀粉在加热后游离出来的直链淀粉分子,冷却后快速老化形成一个紧密的凝胶网络,与文献报道一致[20]。脆性、胶着性、咀嚼性的变化趋势与硬度趋势相同。
表4 不同加热温度处理后G50的质构性能 单位:g
Fig.4 Texture properties of G50 analyzed at different heating temperatures
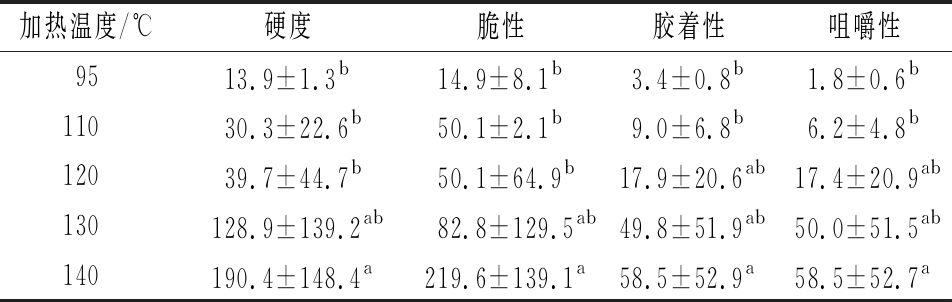
加热温度/℃硬度脆性胶着性咀嚼性9513.9±1.3b14.9±8.1b3.4±0.8b1.8±0.6b11030.3±22.6b50.1±2.1b9.0±6.8b6.2±4.8b12039.7±44.7b50.1±64.9b17.9±20.6ab17.4±20.9ab130128.9±139.2ab82.8±129.5ab49.8±51.9ab50.0±51.5ab140190.4±148.4a219.6±139.1a58.5±52.9a58.5±52.7a
2.6 微观结构
由图5可知,温度越高,淀粉微观结构的破坏程度越大。G50在95 ℃下呈颗粒状,110 ℃下颗粒状逐渐不明显,到120 ℃时,颗粒状完全消失,在140 ℃下淀粉凝胶已经出现层状结构。出现这样的变化是因为在较高温度下,分散的分子再关联生成非常致密的基质,游离的直链淀粉分子逐渐重新结合,形成紧密的凝胶网络[20]。同时,这也是温度越高,其凝胶硬度越高的原因。

a-95 ℃;b-110 ℃;c-120 ℃;d-130 ℃;e-140 ℃
图5 不同温度处理后G50的微观结构(×2 000)
Fig.5 Microstructure of G50 analyzed at different temperatures (×2 000)
3 结论
综上所述,高直链玉米淀粉在较高的加热温度下糊化程度增加,原因是更多直链淀粉分子从淀粉颗粒中游离出来,高直链淀粉完全糊化后分散的直链淀粉分子形成了强凝胶网络。本研究利用RVA 4800 型快速黏度分析仪对高直链淀粉在95~140 ℃加热温度下的颗粒和分子变化提供了新的认识,并论证了这些变化对淀粉糊化性能、流变性能和质构性能的影响,为高直链玉米淀粉在功能食品与可降解材料中的应用提供理论支持。
[1] ZHONG Y Y,BERTOFT E,LI Z H,et al.Amylopectin starch granule lamellar structure as deduced from unit chain length data[J].Food Hydrocolloids,2020,108:106 053.
[2] 张友松.高直链玉米淀粉//中国淀粉糖(醇)发展战略研讨会论文集[C].厦门:中国发酵工业协会,2008.
ZHANG Y S.High Amylose Corn Starch//Proceedings of the Symposium on the development strategy of starch sugar (alcohol) in China[C].Xiamen:China Fermentation Industry Association,2008.
[3] AI Y F,JANE J L.Gelatinization and rheological properties of starch[J].Starch-Stärke,2015,67(3-4):213-224.
[4] 凌家煜. 快速粘度分析仪及其应用[J].粮油食品科技,2002,10(3):35-38.
LING J Y.Rapid visco analyser(RVA) and its applications[J].Science and Technology of Cereals,Oils and Foods,2002,10(3):35-38.
[5] MARIOTTI M,ZARDI M,LUCISANO M,et al.Influence of the heating rate on the pasting properties of various flours[J].Starch-Stärke,2005,57(11):564-572.
[6] 黄峻榕, 唐晓东,蒲华寅.快速黏度分析仪与旋转流变仪测定淀粉黏度特性的对比[J].陕西科技大学学报(自然科学版),2016,34(2):118-122.
HUANG J R,TANG X D,PU H Y.Comparison of rapid viscosity analyzer and rotational rheometer on starch pasting properties[J].Journal of Shaanxi University of Science & Technology (Natural Science Edition),2016,34(2):118-122.
[7] COZZOLINO D.The use of the rapid visco analyser (RVA) in breeding and selection of cereals[J].Journal of Cereal Science,2016,70:282-290.
[8] XU J C,BLENNOW A,LI X X,et al.Gelatinization dynamics of starch in dependence of its lamellar structure,crystalline polymorphs and amylose content[J].Carbohydrate Polymers,2020,229:115481.
[9] LIU H S,YU L,XIE F W,et al.Gelatinization of cornstarch with different amylose/amylopectin content[J].Carbohydrate Polymers,2006,65(3):357-363.
[10] HASJIM J,LI E P,DHITAL S.Milling of rice grains:Effects of starch/flour structures on gelatinization and pasting properties[J].Carbohydrate Polymers,2013,92(1):682-690.
[11] WANG S J,LUO H Y,ZHANG J,et al.Alkali-induced changes in functional properties and in vitro digestibility of wheat starch:The role of surface proteins and lipids[J].Journal of Agricultural and Food Chemistry,2014,62(16):3 636-3 643.
[12] YE L X,WANG C S,WANG S J,et al.Thermal and rheological properties of brown flour from Indica rice[J].Journal of Cereal Science,2016,70:270-274.
[13] ALISHAHI A,FARAHNAKY A,MAJZOOBI M,et al.Physicochemical and textural properties of corn starch gels:Effect of mixing speed and time[J].Food Hydrocolloids,2015,45:55-62.
[14] LIU S C,XIAO Y H,SHEN M Y,et al.Effect of sodium carbonate on the gelation,rheology,texture and structural properties of maize starch-Mesona chinensis polysaccharide gel[J].Food Hydrocolloids,2019,87:943-951.
[15] WANG S J,ZHANG X,WANG S,et al.Changes of multi-scale structure during mimicked DSC heating reveal the nature of starch gelatinization[J].Scientific Reports,2016,6:28 271.
[16] 尹芳. 小麦RVA曲线拟合模型的建立及应用[D].扬州:扬州大学,2013.
YIN F.Modeling and application of the viscosity curve of wheat flour[D].Yangzhou:Yangzhou University,2013.
[17] 朱平. 稻米淀粉功能特征研究及相关性分析[D].杭州:浙江大学,2015.
ZHU P.Study on functional properties of rice starches and correlation analysis[D].Hangzhou:Zhejiang University,2015.
[18] AI Y F,HASJIM J,JANE J L.Effects of lipids on enzymatic hydrolysis and physical properties of starch[J].Carbohydrate Polymers,2013,92(1):120-127.
[19] DEBET M R,GIDLEY M J.Three classes of starch granule swelling:Influence of surface proteins and lipids[J].Carbohydrate Polymers,2006,64(3):452-465.
[20] LIU S Y,YUAN T Z,WANG X Y,et al.Behaviors of starches evaluated at high heating temperatures using a new model of Rapid Visco Analyzer-RVA 4800[J].Food Hydrocolloids,2019,94:217-228.
[21] PUTSEYS J A,LAMBERTS L,DELCOUR J A.Amylose-inclusion complexes:Formation,identity and physico-chemical properties[J].Journal of Cereal Science,2010,51(3):238-247.
[22] 李娜, 张英华.用RVA仪分析玉米淀粉的糊化特性[J].中国粮油学报,2011,26(6):20-24.
LI N,ZHANG Y H.Analysis on pasting properties of maize starch by RVA[J].Journal of the Chinese Cereals and Oils Association,2011,26(6):20-24.
[23] DICKINSON E.Emulsion gels:The structuring of soft solids with protein-stabilized oil droplets[J].Food Hydrocolloids,2012,28(1):224-241.
[24] HEDAYATI S,NIAKOUSARI M.Microstructure,pasting and textural properties of wheat starch-corn starch citrate composites[J].Food Hydrocolloids,2018,81:1-5.