二氢槲皮素又称花旗松素、紫杉叶素、黄杉素、双氢栎精,是一种重要的二氢黄酮醇类化合物[1-2]。二氢槲皮素最早由日本学者FUKUI从针叶植物Chamaecyparis obtusa叶中分离[3],化学结构如图1所示。由于二氢槲皮素特殊的结构式且含有多个酚羟基,使其具有抗氧化[4-6]、抗炎、抗过敏[7-8]、调节酶活性[9]、缓解心血管系统疾病[10]、抗肿瘤[11-12]等一系列生物活性。
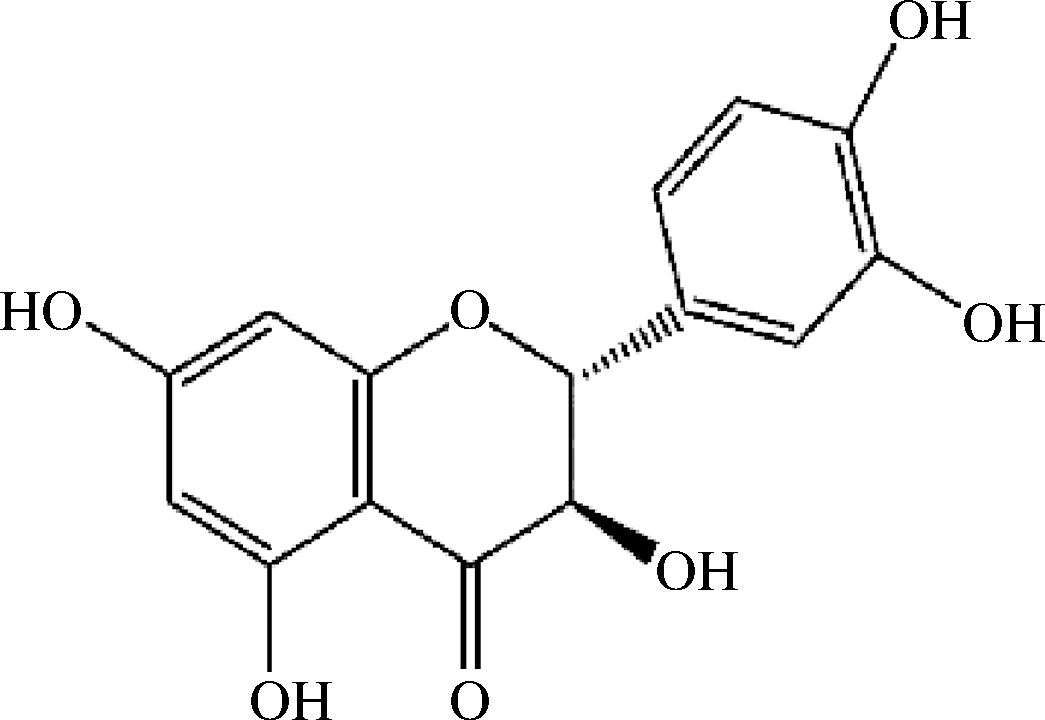
图1 二氢槲皮素的结构
Fig.1 Structure of dihydroquercetin
根据国家食品安全风险评估中心2020年11月12日行政许可征求意见[13],二氢槲皮素作为新的食品原料已通过专家评审委员会技术审查,拟作为新食品原料在食品中使用。欧盟和俄罗斯已批准落叶松来源的二氢槲皮素作为新食品原料。二氢槲皮素推荐食用量为≤100 mg/d,使用范围和最大使用量为:饮料(20 mg/L),发酵乳和风味发酵乳(20 mg/kg),可可制品、巧克力和巧克力制品(70 mg/kg)。目前国内无上述3类食品基质中二氢槲皮素相关的检测方法和检验标准。
二氢槲皮素检测方法主要有分光光度法[14-15]、荧光法[16]、高效液相色谱法[17-21]、高效液相色谱-质谱法[22-24]等。分光光度法存在检测灵敏度低、对食品提取溶液透光性要求高等局限性。荧光法检测灵敏度虽高,但检测准确性和灵敏度受复杂食品基质影响比较大。高效液相色谱-质谱法定性准确、灵敏度高,但在检测过程中易受基质干扰,影响定量结果的准确性,且仪器价格昂贵,普及率低。高效液相色谱法抗干扰能力强、检测灵敏度高、对于目标物分离效果好、定性定量准确,且高效液相色谱仪是分析实验室普遍具备的仪器。因此高效液相色谱法更适合食品中二氢槲皮素的检测。由于食品基质复杂多样,富含糖类、脂肪、蛋白以及各种维生素等物质,因此选择合适的前处理方式十分重要。检测食品中二氢槲皮素时,简单的样品前处理方式无法有效去除杂质,影响后续的定性定量结果。因此本实验以国家允许添加二氢槲皮素的饮料、发酵乳和可可制品3种食品基质为研究对象,对样品前处理、色谱条件进行优化,建立了固相萃取-高效液相色谱法测定食品中二氢槲皮素含量的方法。该方法为企业和监管部门测定二氢槲皮素在食品中的规范使用提供了技术支持。
1 材料与方法
1.1 材料与仪器
二氢槲皮素标准品(CAS:480-18-2),上海安谱公司;甲醇、乙腈,均为色谱纯,德国Merck公司;乙酸铵、乙酸,均为分析纯,国药集团化学试剂有限公司;乙酸,色谱纯,美国Thermo Fisher公司;亲水亲脂平衡(hydrophile-lipophile,HLB)固相萃取柱(6 mL 200 mg),美国Waters公司。
2695型高效液相色谱仪配有二极管阵列检测器,美国Waters公司;N-EVAP型控温型氮吹仪,美国Organomation公司;3-18KS型高速冷冻离心机,德国Sigma公司;24针型固相萃取装置,美国Supelco公司;MS-3型旋涡混合器,德国IKA公司;SB-800DTD型超声波清洗器,宁波新芝生物科技股份有限公司;Milli-Q7000型超纯水机,美国Millipore公司。
1.2 标准溶液制备
称取适量二氢槲皮素标准品,以甲醇配制成1.00 mg/mL的标准储备液,于-18 ℃冰箱保存。用甲醇稀释,得到0.8、1.0、5.0、10.0、50.0、100.0 μg/mL系列标准工作液。
1.3 样品预处理
1.3.1 提取
分别称取2 g(精确到0.01 g)饮料、发酵乳和可可制品于25 mL比色管中,加入20 mL V(甲醇)∶V(2%乙酸水)=1∶1提取液,充分涡旋分散混匀,超声波清洗器中超声提取30 min,冷却至室温后,用V(甲醇)∶V(2%乙酸水)=1∶1提取液定容至25 mL,混合均匀后,转移至50 mL离心管中,8 000 r/min离心5 min,准确移取上清液5 mL至另一个50 mL离心管中,加20 mL超纯水稀释混匀后待净化。
1.3.2 净化
取HLB固相萃取柱,依次用5 mL甲醇、5 mL超纯水活化,再将1.3.1所得待净化液过固相萃取柱,控制流速不超过1 mL/min,待液体流尽后用5 mL超纯水淋洗,将固相萃取柱抽干,再用6 mL甲醇洗脱,收集洗脱液,经45 ℃水浴加热氮吹至近干。用1 mL甲醇复溶,超声10 min后涡旋混合,过0.22 μm微孔有机滤膜,供高效液相色谱分析。
1.4 仪器条件
色谱柱:XBridge C18色谱柱(4.6 mm×150 mm,3.5 μm);柱温35 ℃;流速0.8 mL/min;检测波长290 nm;进样量10 μL。流动相A:0.1%乙酸水溶液,流动相B:甲醇,采用梯度洗脱程序,梯度条件如表1所示。
表1 流动相梯度程序
Table 1 Gradient program of mobile phase

时间/minA/%B/%曲线09282.0928611.05050616.03565616.11090617.01090617.1928620.09286
2 结果与分析
2.1 色谱条件的优化
2.1.1 色谱柱的选择
在最优的梯度洗脱下,本实验考察了Atlantis dC18、XBridge C18、ACE C18、Atlantis T3 C18 4款色谱柱。4款色谱柱分析得到的二氢槲皮素色谱峰除了保留时间不同,在峰形,灵敏度方面并没有显著差异。XBridge C18色谱柱对实际样品分离效果较好,抗干扰能力更强,因此选择XBridge C18色谱柱。
2.1.2 流动相的选择
乙腈的截止波长在190 nm左右,甲醇的截止波长在210 nm左右,由于二氢槲皮素的最大吸收波长在290 nm左右,在二极管阵列检测器下,甲醇和乙腈在基线噪音,减少干扰方面基本没有太大差别。因此,基于经济最优化和环境友好性方面的考虑,选用甲醇作为流动相。
实验考察了超纯水、酸化乙酸铵溶液(20 mmol/L)、乙酸水溶液体系作为流动相时对目标物分析的影响。结果表明:用超纯水进行洗脱时,流动相的洗脱能力明显降低,需要更长的分析时间或者更强的洗脱梯度才能洗脱出目标物,不利于复杂样品分析中目标物与杂质间的分离;酸化乙酸铵溶液(20 mmol/L)和乙酸水溶液区别不大;乙酸水溶液作为流动相,基线较稳定,290 nm波长下产生的波动较小,且相较于酸化乙酸铵溶液更加经济环保。因此,采用乙酸水溶液作为流动相。
对体积分数0.1%、0.5%、2%乙酸水溶液作为流动相产生的实验效果进行比较,3个浓度水平区别并不明显,都能得到很好的峰形和分离效果,因此选择0.1%乙酸水溶液。
2.2 前处理条件的优化
2.2.1 提取
葡萄皮渣、落叶松等基质中检测二氢槲皮素的前处理方法一般有乙醇和热水回流直接提取法[25]、超声-微波交替法[26]等,将该前处理方法应用到食品基质中,发现无法有效去除杂质,并影响后续的定性定量结果,且实验结果回收率偏低。根据二氢槲皮素易溶于乙酸、乙醇、沸水等溶剂的性质特点,实验选用2%乙酸水、甲醇-2%乙酸水(1∶1,体积比)、甲醇分别对样品进行提取。结果发现,食品样品用2%乙酸水提取时回收率仅为39.3%,明显低于甲醇-2%乙酸水、纯甲醇的提取回收率。纯甲醇的提取回收率为59.6%,比甲醇-2%乙酸水提取的回收率100.9%明显低很多。因此,选用甲醇-2%乙酸水作为样品提取剂。
实验进一步考察了不同体积比例甲醇-2%乙酸水的提取效果,体积比分别是0∶1、1∶3、2∶3、1∶1、3∶2、3∶1、1∶0,样品提取回收率见图2,随着提取液中甲醇比例的增加,提取效率不断提高,而甲醇-2%乙酸水(1∶1)提取回收率最高。甲醇占比超过50%,继续加大甲醇比例,提取效率逐渐下降。因此选择体积比1∶1的甲醇-2%乙酸水为提取溶剂。
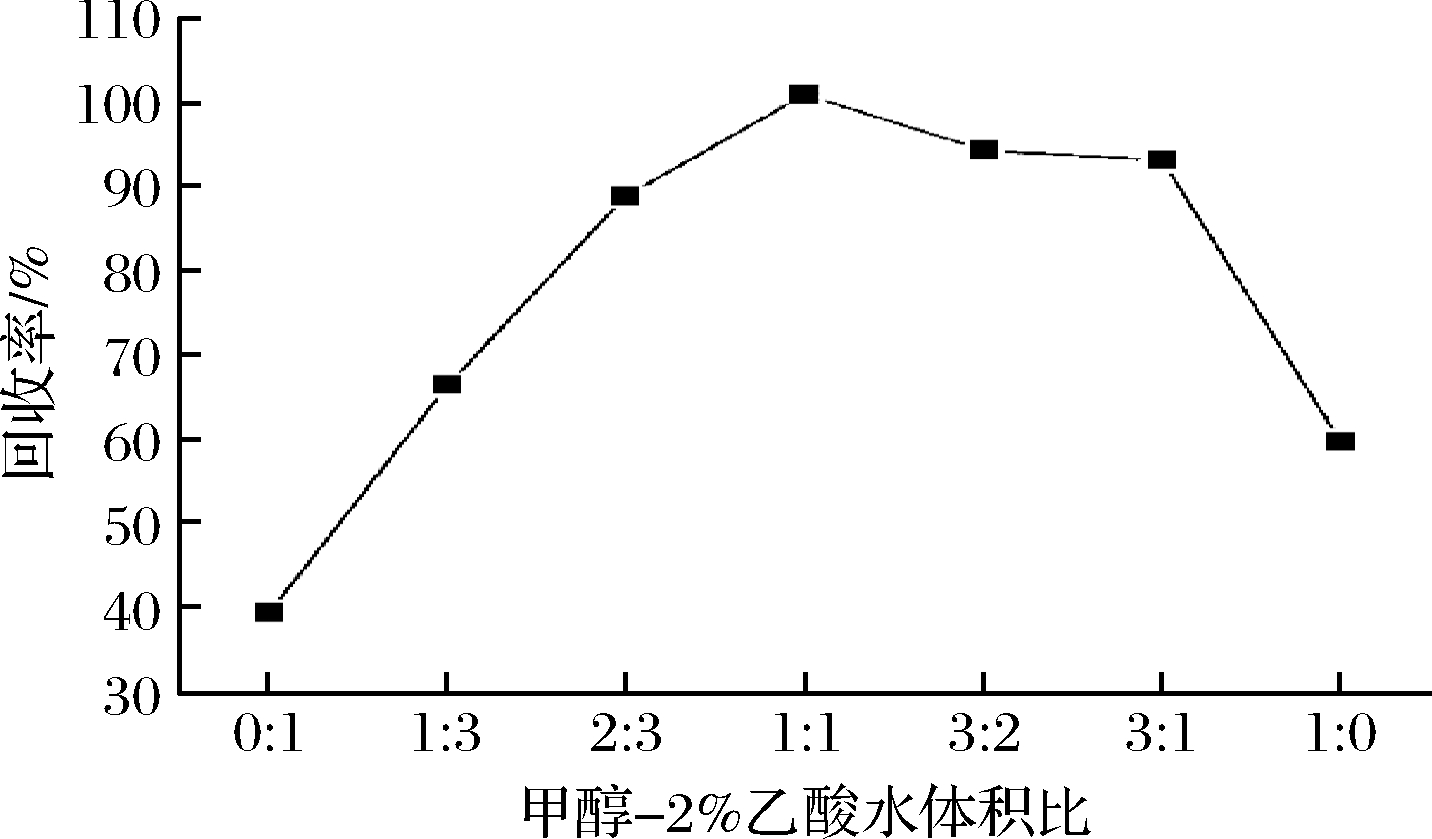
图2 不同提取液对二氢槲皮素提取率的影响
Fig.2 Effect of different extracts on extraction rate of dihydroquercetin
2.2.2 净化方式的选择
固相萃取法具有快速、简便、高效除杂的优点,是目前使用最广泛的净化手段之一。为提高方法的灵敏度和准确性,对Oasis HLB、C18、Oasis PRiME HLB 3种固相萃取柱的净化效果进行了比较,3种固相萃取(solid phase extraction,SPE)的具体操作条件见表2。
表2 三种SPE的净化方法
Table 2 Three SPE purification methods

净化柱活化淋洗洗脱Oasis HLB5 mL甲醇、5 mL水5 mL水8 mL甲醇C185 mL甲醇、5 mL水5 mL水8 mL甲醇Oasis PRiME HLB//上样即接液
经SPE净化后,结果如图3所示。使用Oasis HLB净化时二氢槲皮素回收率较高,而使用PRiME HLB和C18柱时回收率略低,为80%左右。PRiME HLB柱是一种通用型固相萃取柱,能去除磷脂、蛋白等杂质,经分析发现该SPE对目标物有吸附,造成回收率偏低。用C18柱净化后杂质干扰较多,不同基质样品净化效果存在较大差异,回收率精密度较低。Oasis HLB柱的杂质去除效果较好,干扰较少,回收率高,对不同基质样品净化效果均较好,因此,选用Oasis HLB柱净化该类样品,提高了检测的灵敏度和准确性。

图3 二氢槲皮素通过不同SPE柱的回收率
Fig.3 Recovery rate of dihydroquercetin through different SPE columns
2.2.3 净化条件的选择
上样前将提取液用超纯水稀释5倍后上Oasis HLB柱。上样后用5 mL超纯水进行淋洗,洗去更多杂质以提高其净化效率。由于不同化合物之间极性差异,跟Oasis HLB柱填料的结合程度也不同。实验考察了洗脱液甲醇的体积对二氢槲皮素回收率的影响,分别用1、2、4、6、8和10 mL甲醇洗脱目标物,二氢槲皮素回收率如图4所示,当洗脱液体积为6 mL时,目标物能被完全洗脱下来,继续增大洗脱液体积时,回收率变化不明显,且氮吹浓缩时间延长,因此,综合考虑确定洗脱液的体积为6 mL。
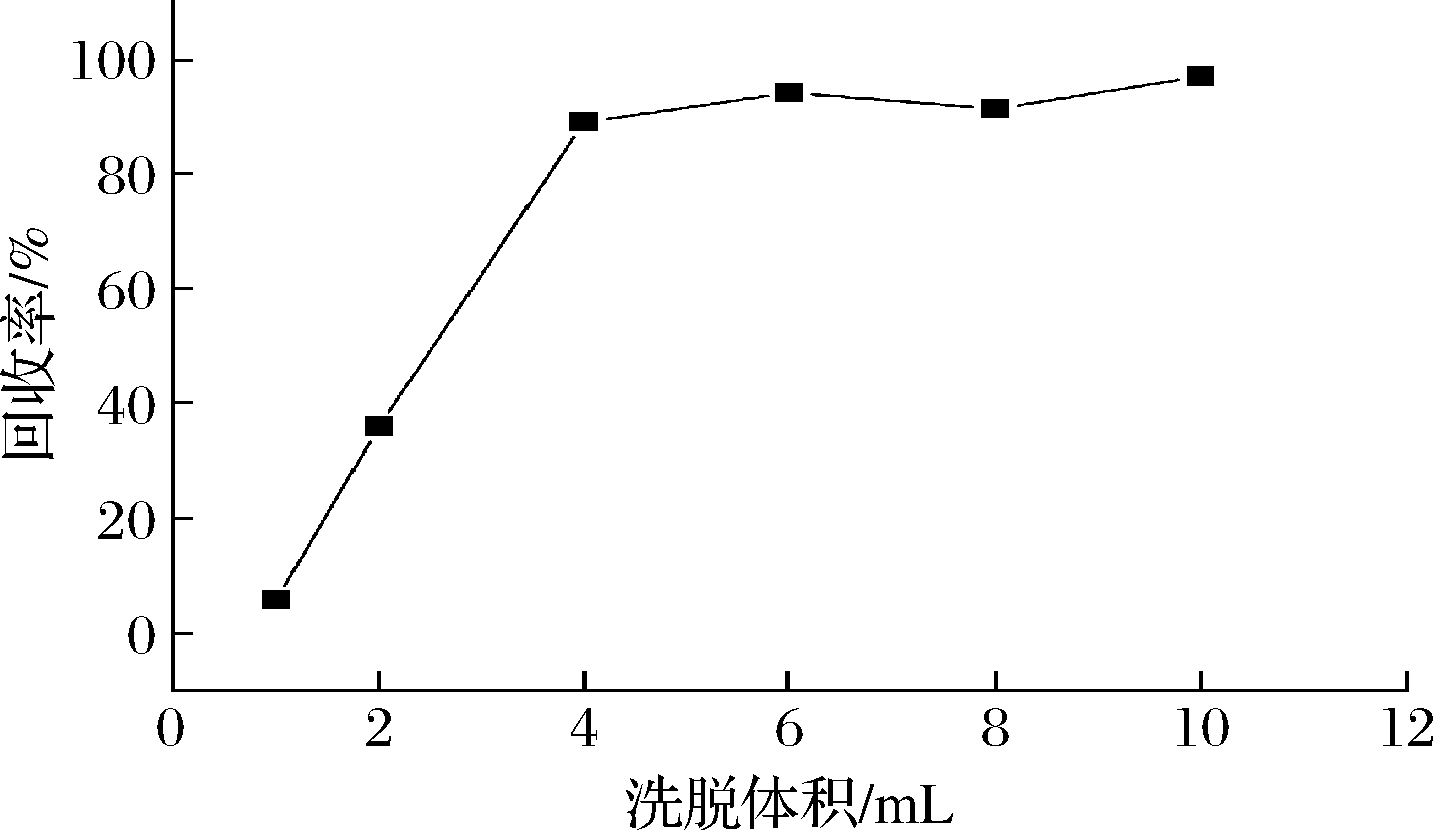
图4 不同体积洗脱液对二氢槲皮素回收率的影响
Fig.4 Effect of different volumes of eluent on recovery rate of dihydroquercetin
2.3 方法学考察
2.3.1 线性范围和检出限
将二氢槲皮素系列标准工作液按质量浓度0.8、1.0、5.0、10.0、50.0和100.0 μg/mL依次经高效液相色谱仪进行分析测定,以二氢槲皮素标准工作液质量浓度(μg/mL)为横坐标,以响应峰面积为纵坐标,绘制二氢槲皮素标准工作曲线,在曲线范围内,回归方程为:Y=4.15×104X-9.29×103,线性相关系数为0.999 9,线性良好。以信噪比S/N≥3计算检出限,结果为0.6 mg/kg。以信噪比S/N≥10计算定量限,结果为2.0 mg/kg。
在本研究的条件下,对二氢槲皮素标准品和实际样品进行分析,色谱图如图5所示,二氢槲皮素标准品色谱峰保留时间为11.814 min,具有良好的峰形和响应值。饮料、发酵乳、可可制品3种食品基质样品中干扰物达到了有效分离,能够较好地分析测定其中的二氢槲皮素。
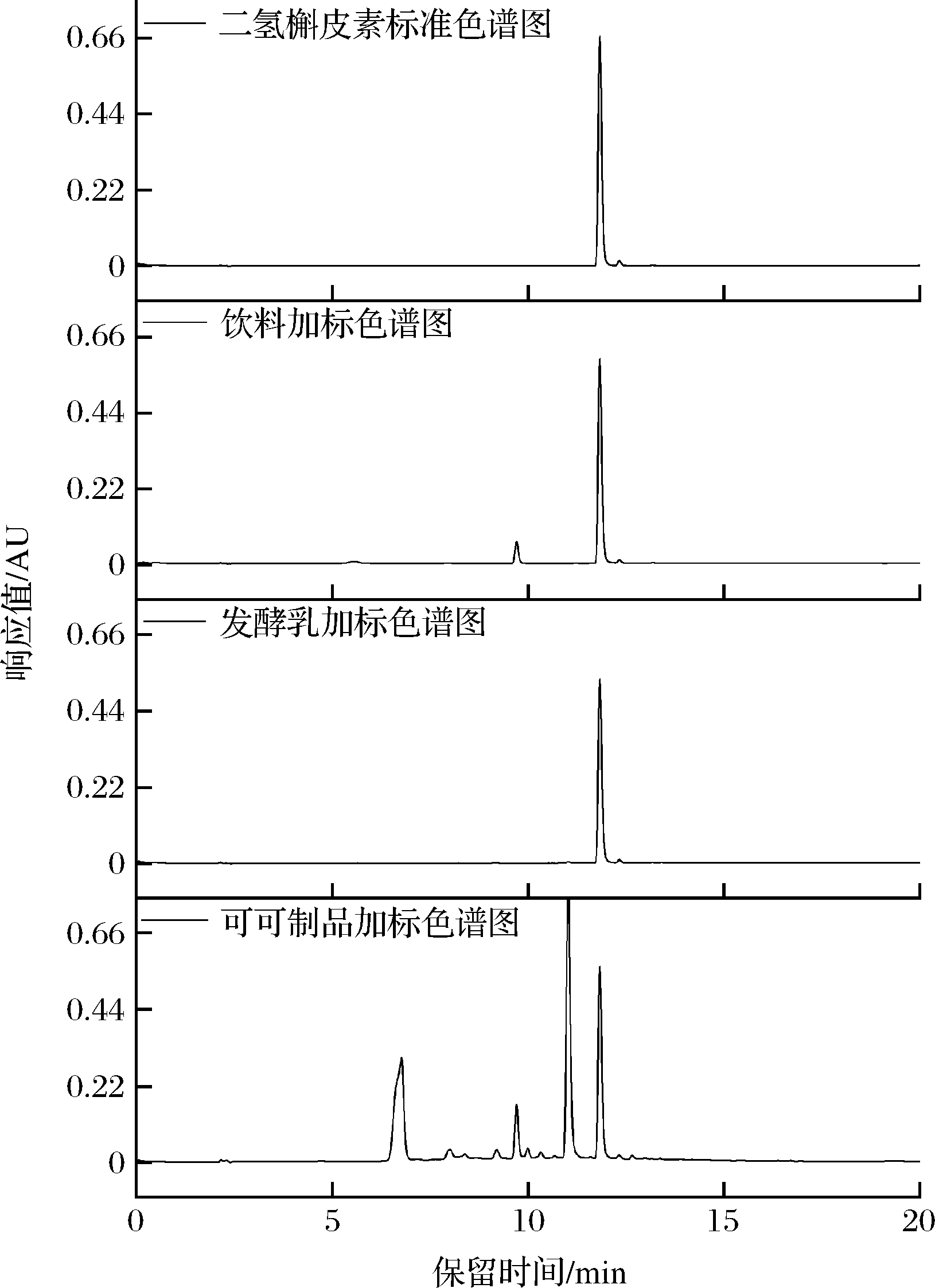
图5 二氢槲皮素标准品(100.0 μg/mL)和实际样品加标(200 mg/kg)色谱图
Fig.5 Chromatograms of dihydroquercetin standard (100.0 μg/mL) and actual samples labeling (200 mg/kg)
2.3.2 回收率和精密度
以饮料、发酵乳、可可制品3种食品基质为研究对象,添加二氢槲皮素质量分数为2、20、200 mg/kg 3个水平,经上述方法处理后,测定样品中的目标物浓度,平行测定6次,进行相对标准偏差(relative standard deviation,RSD)的计算,结果见表3。结果表明,二氢槲皮素的平均回收率在90.3%~102.5%,不同水平的加标样品重复测定6次,RSD为0.45%~1.42%,该方法能够满足实际样品的检测需要。
表3 添加回收率与精密度(n=6)
Table 3 Recovery and precision of addition(n=6)
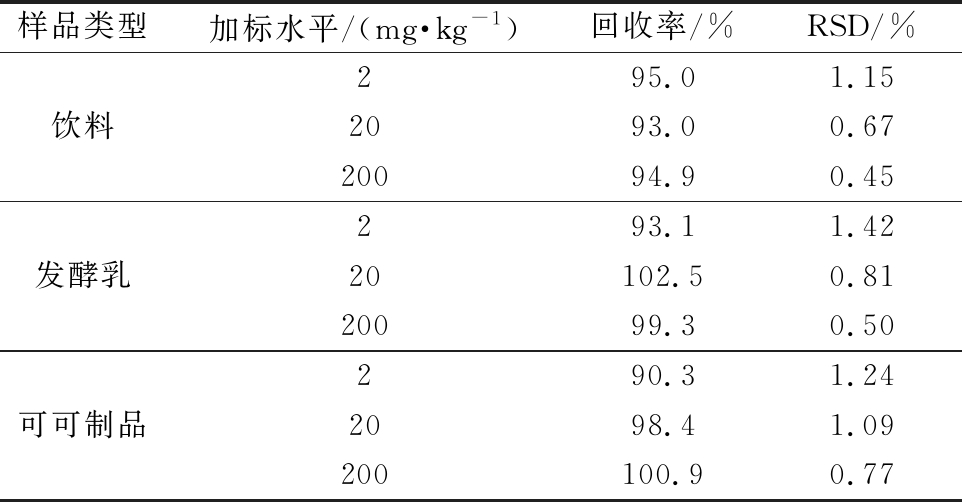
样品类型加标水平/(mg·kg-1)回收率/%RSD/%饮料295.01.152093.00.6720094.90.45发酵乳293.11.4220102.50.8120099.30.50可可制品290.31.242098.41.09200100.90.77
2.3.3 实际样品分析
采用本文建立的方法对30批次市售饮料、发酵乳、可可制品进行二氢槲皮素的检测,30批次产品均未检出二氢槲皮素,可能是由于此前我国未批准二氢槲皮素作为食品原料在食品中使用,因此企业在食品生产过程中,没有添加二氢槲皮素。
3 结论
本文建立了固相萃取-高效液相色谱测定食品中二氢槲皮素含量的方法,该方法前处理净化效果好,液相色谱分析时干扰物明显减少。本方法的灵敏度高,对于二氢槲皮素的定性、定量结果准确可靠,适用于饮料、发酵乳、可可制品等食品中二氢槲皮素含量的测定。
[1] 柳森, 张卫鹏,付警辉,等.二氢槲皮素的提取及含量测定的研究进展[J].吉林农业科技学院学报,2012,21(2):78-80.
LIU S,ZHANG W P,FU J H,et al.Research progression in extraction and content assaying of dihydroquercetin[J].Journal of Jilin Agricultural Science and Technology University,2012,21(2):78-80.
[2] 乔华, 谢鋆,张晓云.花旗松素的生物活性及其应用[J].中草药,2003,34(8):15-17.
QIAO H,XIE Y,ZHANG X Y,Bioactivity and application of semasin[J].Chinese Traditional and Herbal Drugs,2003,34(8):15-17.
[3] FUKUI Y,NAKADOME K,ARIYOSHI H.Studies on the monomer flavonoides of the plants of Coniferae.II.Isolation of a new taxifolin glucoside from the leaves of Chamaecyparis obtusa Endlicher[J].Yakugaku Zasshi,1966,86(3):184-187.
[4] 张晓利, 赵瑞香,姜建福,等.葡萄皮渣中花旗松素提取工艺优化及其抗氧化能力测定[J].食品工业科技,2021,42(5):200-205;220.
ZHANG X L,ZHAO R X,JIAN J F,et al.Optimization of extraction process of taxifolin from grape pomace and determination of its antioxidant capacity[J]. Science and Technology of Food Industry,2021,42(5):200-205;220.
[5] 曾志辉, 王晓莉,叶艳琼,等.花旗松素对H9C2细胞氧化应激保护作用机制研究[J].中国全科医学,2019,22(15):1 794-1 799.
ZENG Z H,WANG X L,YE Y Q,et al.Oxidative stress protection mechanism of taxifolin in H9C2 cells[J].Chinese General Practice,2019,22(15):1 794-1 799.
[6] 周生学, 邵莹,郑毅男.长白落叶松3种黄酮化合物定性、定量分析及其抗氧化活性研究[J].食品工业科技,2019,40(23):66-72.
ZHOU S X,SHAO Y,ZHENG Y N.Qualitative and quantitative analysis of 3 kinds of flavonoids in Larix olgensis var.Koreana extract and their antioxidant activities[J].Science and Technology of Food Industry,2019,40(23):66-72.
[7] 蔡华君, 郑毅男,刘文丛.二氢槲皮素抗炎抗过敏止痒作用的活性研究[J].人参研究,2015,27(3):32-35.
CAI H J,ZHENG Y N,LIU C W.Study on taxifolin’s activities of anti-inflammatory,anti-allergic and relieving itching[J].Ginseng Research,2015,27(3):32-35.
[8] 王佳奇, 陈凯,王月亮,等.二氢槲皮素与二氢杨梅素抗炎活性对比研究[J].中国兽药杂志,2016,50(7):46-52.
WANG J Q,CHEN K,WANG Y L,et al.Comparison of anti-inflammatory activity of dihydroquercetin and dihydromyricetin[J].Chinese Journal of Veterinary Drug,2016,50(7):46-52.
[9] 付警辉, 柴婧,韩佳彤,等.落叶松中花旗松素对酪氨酸酶的抑制作用[J].日用化学工业,2014,44(4):218-221.
FU J H,CHAI J,HAN J T,et al.Inhibitory effect of taxifolin in Larix olgensis on tyrosinase[J].China Surfactant Detergent & Cosmetics,2014,44(4):218-221.
[10] 吴奋飞, 郭晶晶.花旗松素对糖尿病肾病大鼠的作用及机制分析[J].解放军药学学报,2018,34(6):514-516;520.
WU F F,GUO J J.Alleviation of streptozotocin-induced diabetic nephropathy by taxifolin in rats[J].Pharmaceutical Journal of Chinese PLA,2018,34(6):514-516;520.
[11] 王佳奇, 宋明铭,陈凯,等.二氢槲皮素与二氢杨梅素的抗肿瘤活性对比[J].中国免疫学杂志,2016,32(11):1 614-1 620.
WANG J Q,SONG M M,CHEN K,et al.Antitumor activity of dihydroquercetin and dihydromyricetin[J].Chinese Journal of Immunology,2016,32(11):1 614-1 620.
[12] 符小玲, 赵兴丹,张倩,等.花旗松素对人非小细胞肺癌细胞A549的作用及其机制的研究[J].肿瘤药学,2018,8(4):519-523;527.
FU X L,ZHAO X D,ZHANG Q,et al.Effects of taxifolin on human non-small cell lung cancer A549 cells and its mechanism[J].Anti-tumor Pharmacy,2018,8(4):519-523;527.
[13] 国家食品安全风险评估中心.食叶草等3种新食品原料公开征求意见[EB/OL].(2020-11-12)[2021-01-14].https://www.cfsa.net.cn/Article/News.aspx?id=70B958EEF045BA-BB62E6E675E15FCE67685503FE3F240751
China National Center for Food Safety Risk Assessment.Three kinds of new food raw materials such as leafy grass[EB/OL].(2020-11-12)[2021-01-14].https://www.cfsa.net.cn/Article/News.aspx?id=70B958EEF045BABB62E6E675E15FC-E67685503FE3F240751
[14] 刘东, 林书玉,梁戈亮.分光光度法测水红花子中花旗松素含量[J].现代生物医学进展,2008,8(2):331-332;320.
LIU D,LIN S Y,LIANG G L.Determination of the content of taxifolin in princes-feather fruit by spectrophotometry[J].Progress in Modern Biomedicine,2008,8(2):331-332;320.
[15] 王宇, 王遂.分光光度法测定落叶松中的总黄酮含量[J].食品科学,2009,30(22):314-317.
WANG Y,WANG S.Determination of total flavonoids in larch by spectrophotometry[J].Food Science,2009,30(22):314-317.
[16] 樊超, 钟艺青,粟芸,等.荧光猝灭法研究二氢槲皮素和二氢杨梅素与牛血清白蛋白的相互作用[J].安徽医药,2018,22(11):2 088-2 091.
FAN C,ZHONG Y Q,SU Y,et al.An interaction study of bovine serum albumin with dihydroquercetin and dihydromyricetin by fluorescence quenching method[J].Anhui Medical and Pharmaceutical Journal,2018,22(11):2 088-2 091.
[17] 李云静, 何忠梅.HPLC波长切换联合梯度洗脱法同时测定荆防败毒丸中10个成分的含量[J].药物分析杂志,2017,37(3):414-421.
LI Y J,HE Z M.Simultaneous determination of ten components in Jingfang Baidu pills by HPLC method with wavelength switching and gradient elution[J].Chinese Journal of Pharmaceutical Analysis,2017,37(3):414-421.
[18] 樊铁波, 刘红煜,汤青,等.HPLC法测定松针中二氢槲皮素含量[J].中国药师,2009,12(8):1 046-1 048.
FAN T B,LIU H Y,TANG Q,et al.Determination the content of dihydroquercetin in pine needles by HPLC[J].China Pharmacist,2009,12(8):1 046-1 048.
[19] 李俊雅, 李君.RP-HPLC法测定不同产地花生壳中二氢槲皮素的含量[J].河南职工医学院学报,2013,25(2):128-130.
LI J Y,LI J.Determination of dihydroquercetian in peanut hull by RP-HPLC[J].Journal of Henan Medical College for Staff and Workers,2013,25(2):128-130.
[20] 田超, 侯红萍.高效液相色谱同时测定葡萄酒中12种酚含量的研究[J].酿酒科技,2018,289(7):65-69.
TIAN C,HOU H P.Simultaneous determination of 12 kinds of monophenols in grape wine by HPLC[J].Liquor-Making Science & Technology,2018,289(7):65-69.
[21] 闵捷, 饶毅,吕尚,等.HPLC法测定中药穿破石中花旗松素的含量[J].江西中医药大学学报,2017,29(6):79-81.
MIN J,RAO Y,LV S,et al.Content determination of taxifolin in traditional Chinese medicine Chuanposhi by HPLC[J].Journal of Jiangxi University of Traditional Chinese Medicine,2017,29(6):79-81.
[22] 马悦, 赵乐凤,吕子燕,等.高效液相色谱-四极杆-静电场轨道阱高分辨质谱分析桑葚中黄酮类和多酚类物质[J].质谱学报,2017,38(1):45-51.
MA Y,ZHAO L F,LV Z Y,et al.Analysis of flavonoids and polyphenols in mulberry extracts by high-performance liquid chromatography quadrupole-orbitrap mass spectrometry[J].Journal of Chinese Mass Spectrometry Society,2017,38(1):45-51.
[23] 李勇, 林茜,逄涛,等.超高效液相色谱-串联质谱法定量分析烟叶中的12种类黄酮物质[J].色谱,2015,33(7):746-752.
LI Y,LIN Q,PANG T,et al.Determination of 12 flavonoids in tobacco leaves using ultra-high performance liquid chromatography-tandem mass spectrometry[J].Chinese Journal of Chromatography,2015,33(7):746-752.
[24] 丁丽娜, 邱亦亦,束彤,等.超高效液相色谱-质谱联用技术解析沙棘果超临界CO2萃取物中黄酮类天然产物结构[J].食品科学,2019,40(18):273-280.
DING L N,QIU Y Y,SHU T,et al.Determination of flavonoids in the supercritical CO2 extract of sea buckthorn fruit by using ultra-high performance liquid chromatography-mass spectrometry[J].Food Science,2019,40(18):273-280.
[25] 张宇, 苏丹.二氢槲皮素提取方法的比较和优化[J].中医学报,2015,30(10):1 470-1 472.
ZHANG Y,SU D.Comparison and optimization of the extraction technologies of dihydroquercetin[J].China Journal of Chinese Medicine,2015,30(10):1 470-1 472.
[26] 马春慧, 孙震,黄金明,等.超声-微波交替法提取落叶松二氢槲皮素[J].化工进展,2010,29(1):134-139;145.
MA C H,SUN Z,HUANG J M,et al.Extraction of dihydroquercetin from larch wood with ultrasonic-microwave alternant method[J].Chemical Industry and Engineering Progress,2010,29(1):134-139;145.