苋菜红[1-(4′-磺酸基-1′-萘偶氮)-2-萘酚-3,6-二磺酸三钠盐]是一种水溶性偶氮合成染料,与天然染料相比,其具有对光、氧和pH稳定性高,且具有颜色均匀、微生物污染低、生产成本低等优点,已作为食品着色剂在饮料和食品中广泛使用,以增加产品外观和吸引力[1-2]。然而,由于其具有高遗传毒性、细胞毒性、抑制细胞生长的作用,过量食用苋菜红已成为一个有损人体健康的问题[3-5]。出于食品安全考虑,粮农联合组织和世界卫生组织食品添加剂专家委员会建议苋菜红的每日允许摄入量应在0~0.5 mg/kg[6-7],我国《食品添加剂使用卫生标准》(GB 2760—2011)严格规定食品中苋菜红最大使用限量为0.05 g/kg。但是,仍有一些非法商业食品生产商在其产品中添加过量的苋菜红。因此,严格控制食品中苋菜红的含量对人类健康和食品安全至关重要。
迄今为止,已报道了很多苋菜红的检测方法,常用的方法有毛细管电泳法[8-9]、电化学方法[10-11]、分光光度法[12-13]、高效液相色谱法[14-15],薄层色谱法[16]。其中,分光光度法、毛细管电泳法的灵敏度较低、线性范围较窄、检出限较高;高效液相色谱法虽灵敏度高,对含复杂组分的样品分析优势较明显,但样品的前处理时间较长,并且操作者需要具备一定的技术积累,同时所需的仪器价格比较昂贵。因此,发展快速、灵敏、简单、高效的检测苋菜红的方法具有极其重要的意义。
近年来,荧光纳米颗粒由于发光颜色可调、激发波长独立、发射窄、长期光稳定性和高量子产率等一些优良的特性而被用于构建灵敏度高、选择性好、操作简单等优异性能的荧光检测传感器[17-18]。荧光纳米颗粒在生物医学和化学分析领域受到越来越多的关注,常用于金属离子[19]、药物残留[20]和污染物分析[21]等,却鲜见于有关食品安全分析的报道。其中,荧光硅纳米颗粒(silicon nanoparticles,SiNPs)不仅水溶性好、光稳定性强、无毒,且拥有较高的荧光量子产率和丰富的硅源,在分析检测、生物成像和药物传递等领域应用前景广阔[22-26]。
本研究建立一种无毒、快速和灵敏的荧光SiNPs探针检测苋菜红。以3-[2-(2-氨基乙基氨基)乙基氨基]丙基-三甲氧基硅烷为硅源,抗坏血酸为还原剂制备水溶性的荧光SiNPs,所制备的SiNPs热稳定性高,盐稳定性和水溶性良好。建立的测定苋菜红的荧光分析方法具有快速、灵敏、高选择性,并用于测定实际样品中苋菜红的含量。
1 材料与方法
1.1 材料与试剂
碳酸饮料和水果糖购自当地超市;3-[2-(2-氨基乙基氨基)乙基氨基]丙基-三甲氧基硅烷,上海阿拉丁生化科技有限公司;L-抗坏血酸钠、NaCl,天津市大茂化学试剂厂;葡萄糖、苯甲酸钠,天津市光复科技发展有限公司;山梨酸钾,天津市百世化工有限公司;柠檬酸,上海中秦化学试剂有限公司;抗坏血酸、柠檬黄,天津益仁达化工有限公司;苋菜红,上海源叶生物科技有限公司。以上试剂均为分析纯。
1.2 仪器与设备
Tecnai G2F30型透射电子显微镜,FEI公司;FTIR-650型傅里叶红外光谱仪,天津港东科技股份有限公司;F-4700型荧光分光光度计,日立高新技术公司;TU-1810紫外可见分光光度计,北京普析通用仪器有限责任公司;KO-500E超声波清洗器,昆山市超声仪器有限公司;18100摩尔超纯水机,上海摩勒科学仪器有限公司;Smart 140B智能磁力搅拌器,上海司乐仪器有限公司;Nova NanoSem 450型场发射扫描电子显微镜,上海禹重实业有限公司。
1.3 实验方法
1.3.1 SiNPs的制备
SiNPs的制备参考江仁庭等[27]的方法并稍作修改:在4.0 mL去离子水中加入0.3 mL 3-[2-(2-氨基乙基氨基)乙基氨基]丙基-三甲氧基硅烷,50 ℃水浴搅拌5 min,然后加入0.084 g抗坏血酸继续水浴搅拌6 h,形成SiNPs溶液。将所制备的SiNPs溶液透析(分子质量截留:1 000 Da)16 h,然后储存在4 ℃下供后续使用。
1.3.2 荧光测定
分别在2.0 mL pH 6.0的PBS缓冲液中加入1 mL上述SiNPs溶液,再加入不同浓度苋菜红溶液,充分混合后放置90 s,在激发波长390 nm下测定其荧光光谱(激发和发射狭缝宽度均为10 nm)。根据F0/F与苋菜红浓度c绘制工作曲线(F0和F分别代表未加入和加入苋菜红时的荧光强度)。实验均在室温下进行。
1.3.3 条件优化
为了得到更灵敏的SiNPs,采用控制变量法对反应体系的抗坏血酸的量及反应时间和反应温度进行了优化:选择抗坏血酸的质量为0.02、0.042、0.063、0.084、0.105、0.126 mg;反应时间设置为2、4、6、8和10 h;反应温度20、30、50、60、70 ℃。
1.3.4 稳定性测定
制备浓度梯度为0、50、100、200、300、400、500、800和1 000 mmol/L的NaCl溶液,向SiNPs溶液中各加入800 μL上述NaCl溶液,混合均匀后在激发波长390 nm和发射波长500 nm下测定其荧光强度(激发和发射狭缝宽度均为10 nm)。
设置水浴温度为25、35、45、55、65、75、85和95 ℃,SiNPs溶液在各水浴温度中进行水浴15 min达到设置温度后,测定其荧光强度。
配制系列PBS缓冲液pH为2、3、4、5、6、7、8、9、10、11、12,向1 mL SiNPs溶液中分别加入上述2.5 mL PBS缓冲液,混合均匀后测定其荧光强度。
1.3.5 选择性测定
配制18 μg/mL苋菜红和1.8 mg/mL的柠檬酸、苯甲酸钠、山梨酸钾、葡萄糖、抗坏血酸、Mg2+、Ca2+、Na+、K+溶液,各取3 mL加入到含有1 mL SiNPs溶液和2.5 mL pH 6的PBS缓冲液的试管中,摇匀并反应90 s后进行荧光检测。
1.3.6 样品处理及其荧光测定
将饮料加热以除去CO2,水果糖研细。称取水果糖粉8.0 g用热的超纯水溶解,待冷却后加水稀释定容至25.0 mL,并于10 000 r/min下离心10 min,收取上清液备用。取制备好的各样品溶液3.0 mL,加入到含有1 mL SiNPs溶液和2.5 mL pH 6的PBS缓冲液的试管中,摇匀并反应90 s后进行荧光检测。
1.4 数据分析
使用Microsoft Office Excel 2010进行数据的整理,并用Origin 9.0软件作图。
2 结果与讨论
2.1 条件优化
本实验对SiNPs的合成条件包括抗坏血酸质量、反应温度和反应时间进行了优化。图1-a显示了SiNPs的荧光强度随着抗坏血酸用量的变化情况,随着抗坏血酸质量的增加,荧光强度先逐渐增高后基本保持不变,当抗坏血酸质量为0.084 g时,SiNPs溶液的荧光强度最大。如图1-b所示,在2~6 h内,随着反应时间的增加,SiNPs溶液的荧光强度逐渐增强,在6~10 h内,随着反应时间的增加,荧光强度逐渐减弱,当反应时间为6 h时,SiNPs溶液的荧光强度最高。如图1-c所示,SiNPs溶液的荧光强度随反应温度的增加而先增强后减弱,当反应温度为50 ℃时,SiNPs溶液的荧光强度最高。综上所述,本实验选择0.084 g、6 h和50 ℃作为合成SiNPs的最佳还原剂用量、反应时间和反应温度。
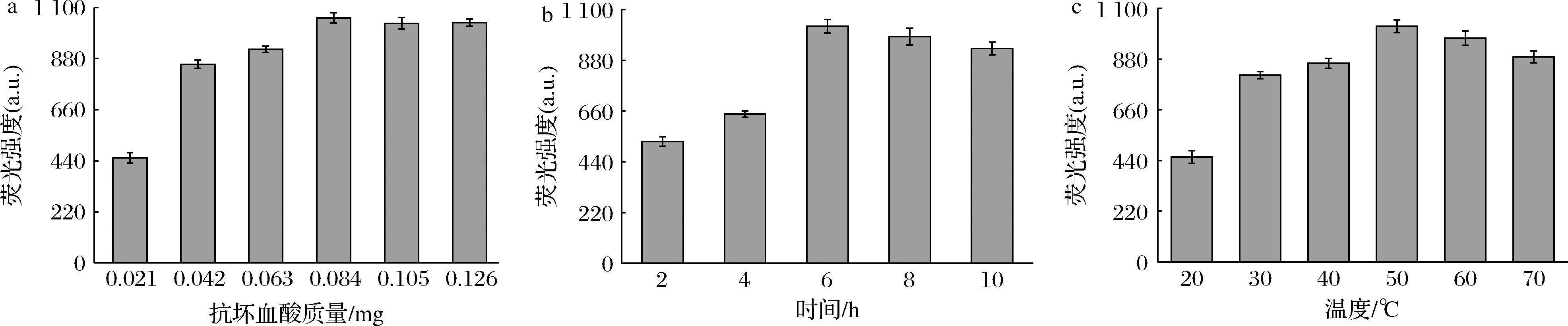
图1 不同抗坏血酸质量(a),不同反应时间(b)和不同反应温度(c)对SiNPs荧光强度的影响
Fig.1 The effect of different ascorbic acid mass (a),reaction time (b) and reaction temperature (c) on the fluorescence intensity of SiNPs
2.2 表征
本实验利用透射电镜图对SiNPs溶液的形态进行了表征。如图2-a所示,实验制备的SiNPs似球形、分散性较好。利用能量色散X射线光谱(energy dispersive X-ray spectroscopy,EDS)对SiNPs进行了元素分析,如图2-b所示,SiNPs含有C、N、O、Si元素。图2-c为SiNPs溶液的红外光谱图,3 002 cm-1处的峰为—OH的伸缩振动峰;1 630 cm-1处的峰为N—H键弯曲振动峰;1 120 cm-1处的峰为Si—O—Si的伸缩振动。结果表明,通过水热法可以简单有效合成粒径较为均一SiNPs,而且SiNPs表面含有大量的氨基基团,这些官能团的存在极大地提高了SiNPs的水溶性。图2-d为SiNPs溶液的紫外可见光谱图和荧光光谱图,由紫外吸收光谱可以看出,SiNPs的最大吸收波长为319 nm,从荧光光谱图可知,当SiNPs的激发波长为390 nm时,发射波长为500 nm。图2-e为SiNPs溶液在不同激发波长时的荧光发射谱图,改变SiNPs的激发波长时荧光发射峰位置基本保持不变,表明SiNPs的荧光发射峰不具有激发波长依赖性[28]。
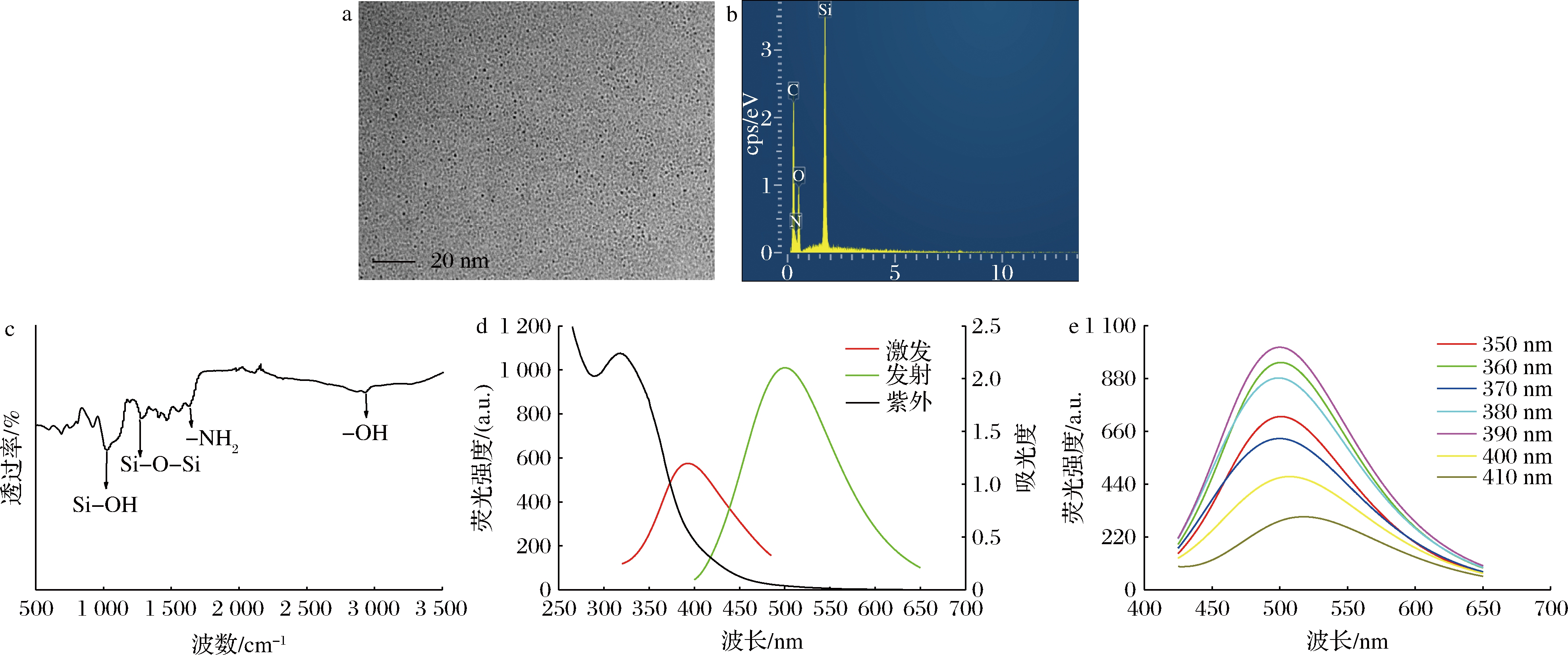
图2 SiNPs透射电镜图(a),EDS图(b),红外光谱图(c),激发、发射和紫外吸收光谱图(d),不同激发波长下的发射谱图(e)
Fig.2 Transmission electron microscopy of SiNPs (a),EDS pattern (b),Fourier infrared image (c),excitation spectrum,emission spectrum and ultraviolet absorption spectrum (d),fluorescence emission spectrum of the SiNPs at various excitation wavelengths (e)
2.3 稳定性
如图3-a所示,由NaCl浓度从0~1 000 mmol/L变化时,SiNPs溶液的荧光强度保持较稳定的状态,表明该SiNPs溶液具有较强的抗盐性能;如图3-b所示,当温度从25 ℃升高到95 ℃时,SiNPs的荧光强度几乎没有变化,这表明SiNPs表现出良好的热稳定性。此外,在图3-c中,随着pH值从2.0增加到6.0,SiNPs的荧光强度逐渐增强,pH值从6.0增加到12.0,SiNPs的荧光强度逐渐减弱。
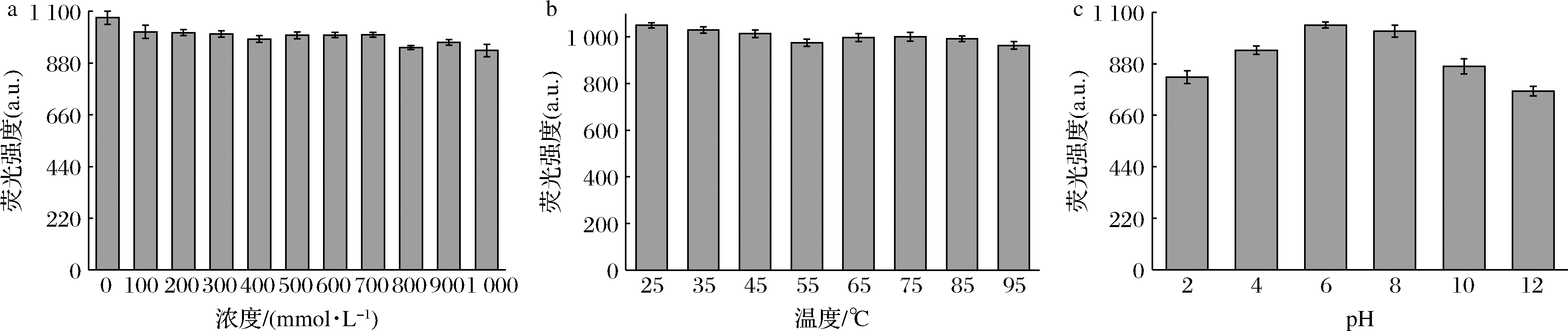
图3 SiNPs在不同浓度的NaCl溶液(a)、不同温度(b)、不同pH(c)下的荧光强度
Fig.3 Fluorescence intensity of SiNPs in different concentrations of NaCl solution (a),different temperature (b),different pH (c)
2.4 SiNPs检测苋菜红
考虑到在实际检测苋菜红时,可能需要在较短的时间并在现场进行,本实验考察了SiNPs对苋菜红的响应时间。如图3-c所示,SiNPs在pH为6.0~8.0时的荧光强度比较稳定。因此,本实验选择在pH为6.0的PBS缓冲溶液中进行。如图4-a所示,SiNPs对苋菜红的响应时间非常短,所以选择90 s为SiNPs和苋菜红的响应时间。如图4-b所示,向SiNPs中加入不同浓度的苋菜红溶液后,SiNPs的荧光强度随苋菜红浓度的增大而逐渐减弱。如图4-c所示,荧光猝灭效率F0/F与苋菜红溶液在2~20 μg/mL范围内呈现出良好的线性关系,其检测限(3σ/k)为0.022 μg/mL,低于食品中苋菜红的允许添加量,说明该方法可用于食品中苋菜红的安全检测。
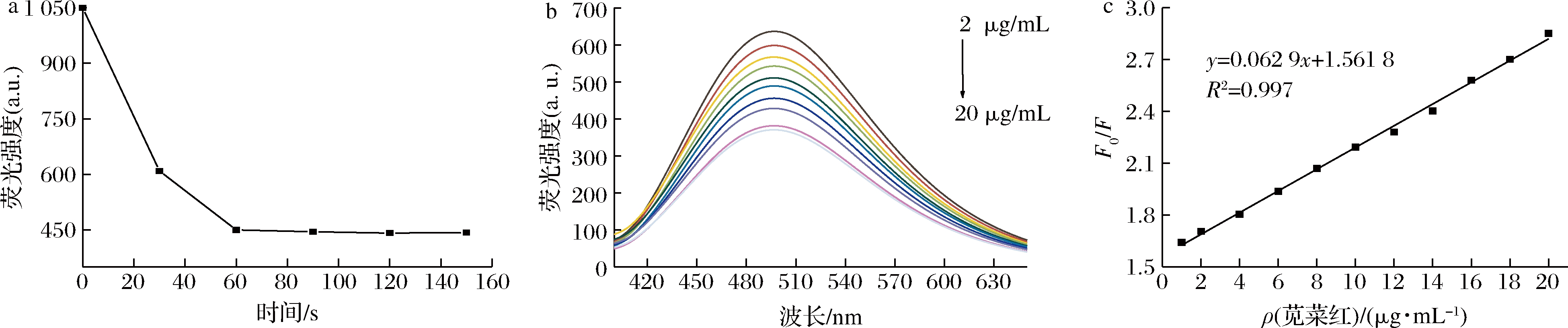
图4 SiNPs与苋菜红的响应时间(a)、不同苋菜红浓度对SiNPs的荧光影响(b)、F0/F与苋菜红浓度的线性关系图(c)
Fig.4 Response time (a) between SiNPs and amaranth,effect of different amaranth concentration on SiNPs fluorescence (b),linear relationship between F0/F and amaranth concentration (c)
2.5 选择性
为了将该荧光猝灭法用于糖果和碳酸饮料中苋菜红含量的测定分析,首先考察了可能的共存物质(山梨酸钾、葡萄糖、苯甲酸钠、抗坏血酸和柠檬酸)和金属离子(K+、Na+、Mg2+和Ca2+)对该反应体系的影响。如图5所示,干扰物质对SiNPs的荧光强度影响较小,而苋菜红对SiNPs的荧光强度影响最大,说明该荧光猝灭方法具有良好的选择。
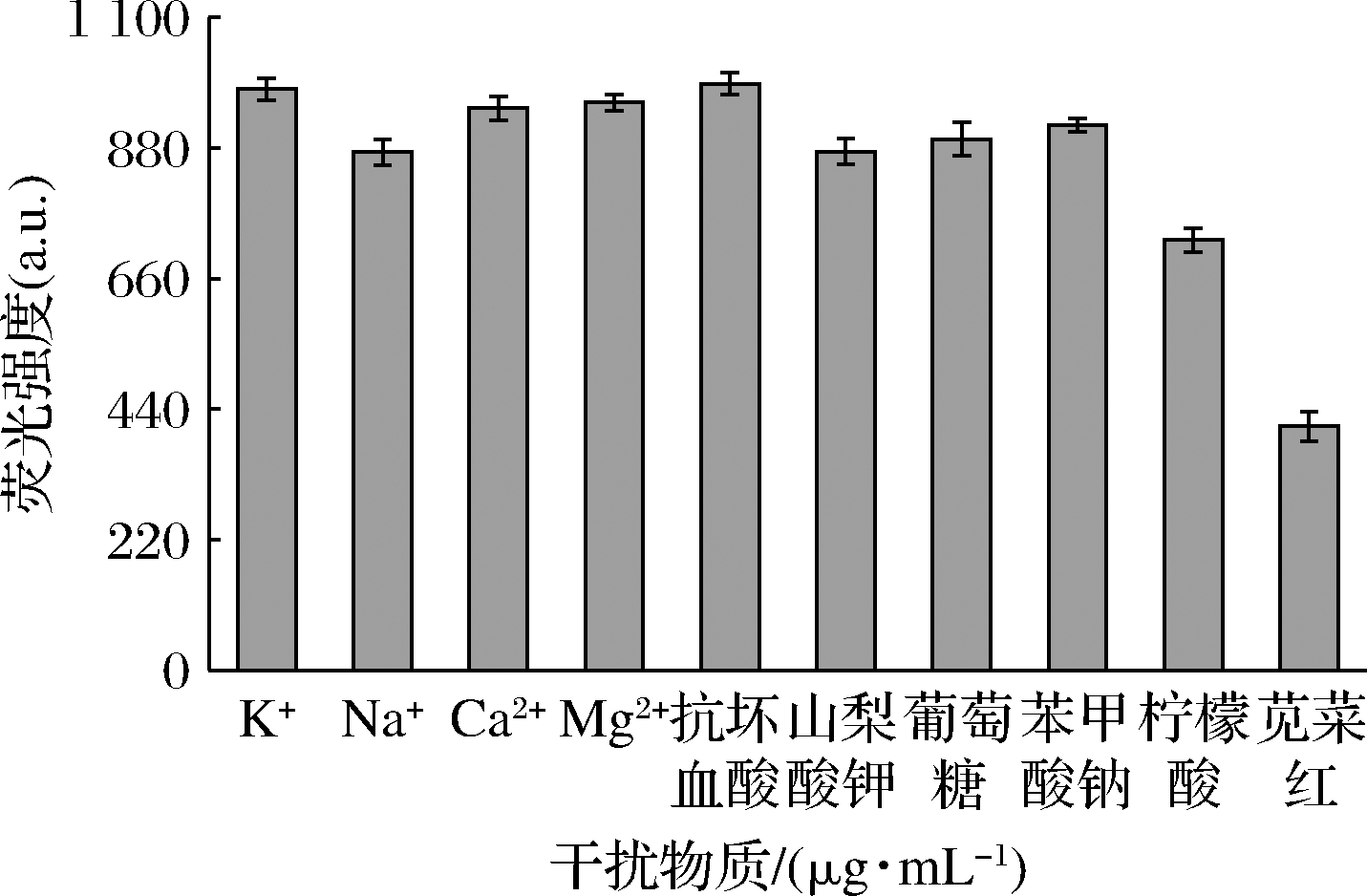
图5 苋菜红和其他干扰物质对SiNPs的荧光强度影响
Fig.5 Effects of amaranth and other interfering substances on the fluorescence intensity of SiNPs
2.6 响应机理
实验对荧光猝灭机理进行了考察。如图6所示,SiNPs的荧光激发光谱和苋菜红的紫外吸收光谱几乎没有有效重叠,表明荧光猝灭机理不是内滤效应[29]。随后对荧光共振能量转移进行了研究。SiNPs的荧光发射光谱和苋菜红的紫外吸收光谱具有较大的重叠面积,表明由苋菜红引起的SiNPs溶液荧光猝灭作用是由于两者间发生了能量转移[30]。
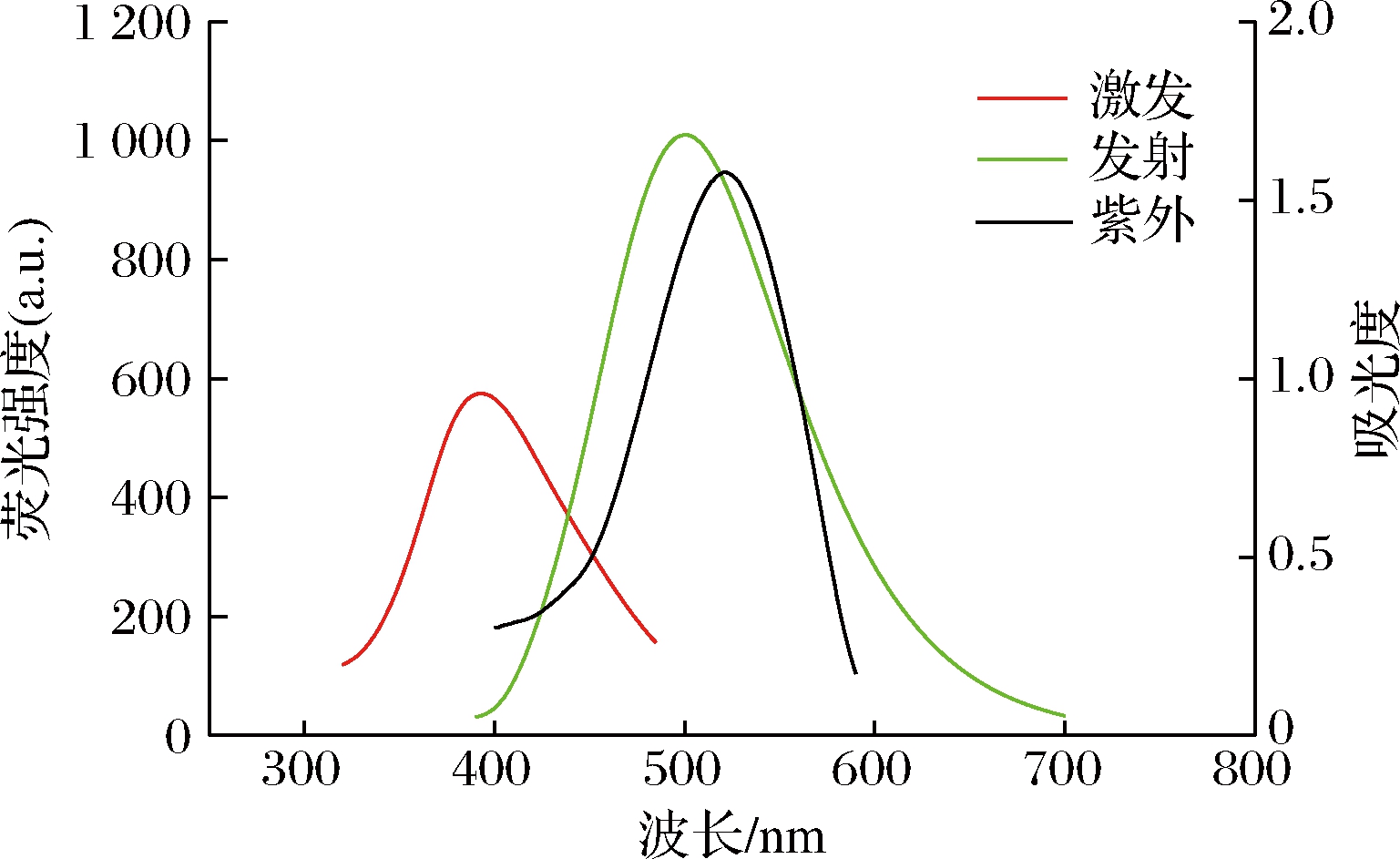
图6 苋菜红的紫外-可见吸收光谱与SiNPs的荧光发射和激发光谱
Fig.6 UV-vis absorption spectra of amaranth and fluorescence emission and excitation spectra of SiNPs
2.7 样品分析
采用标准加入法对碳酸饮料和水果糖中的苋菜红含量进行了测定。结果见表1,样品回收率为92.0%~104.0%,根据实验测得碳酸饮料和水果糖中苋菜红的含量低于GB 2760—2011《食品添加剂使用卫生标准》,表明食品中苋菜红的含量符合食品卫生标准。本方法准确可靠,可以采用此方法来测定食品中苋菜红的含量。
表1 苋菜红的回收率测定
Table 1 Recovery rate of amaranth
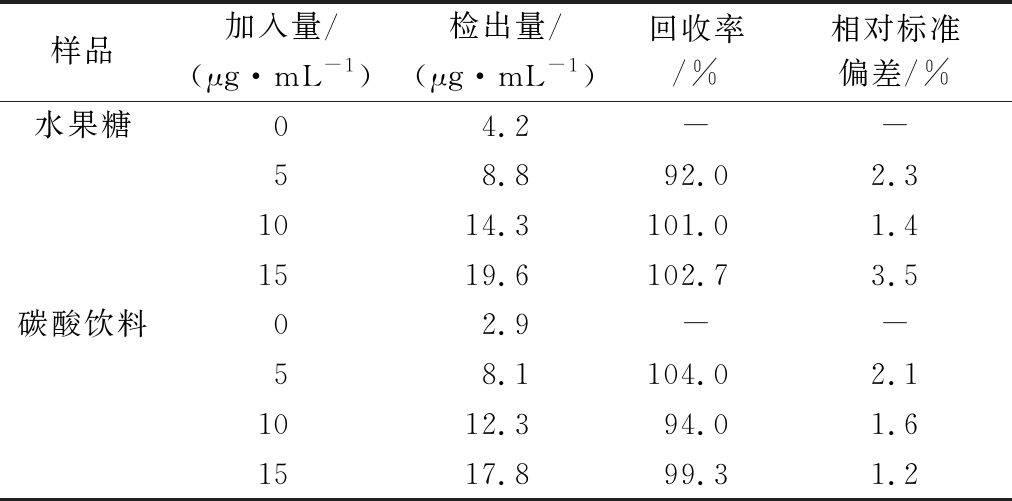
样品加入量/(μg·mL-1)检出量/(μg·mL-1)回收率/%相对标准偏差/%水果糖04.2--58.892.02.31014.3101.01.41519.6102.73.5碳酸饮料02.9--58.1104.02.11012.394.01.61517.899.31.2
3 结论
本实验采用简单的一步法快速合成了水溶性荧光SiNPs,该方法避免了材料的多步合成和耗时的修饰过程。所制备的荧光SiNPs具有良好的热稳定性、优异的耐盐性和pH稳定性。利用SiNPs的优异性能并依据苋菜红能有效猝灭SiNPs荧光,建立了苋菜红荧光检测的快速有效方法,并应用于食品中苋菜红的含量测定。该方法以其优异的选择性和灵敏度为人们在食品安全中检测色素添加剂提供了一种快速简便的手段。基于SiNPs构建的传感器有望在食品安全监测、环境样品分析等方面得到更多应用。
[1] 李凤林, 黄聪亮,余蕾.食品添加剂[M].北京:化学工业出版社,2013.
LI F L,HUANG C L,YU L.Food Additives[M].Beijing:Chemical Industry Press,2013.
[2] 王华丽, 张霁月,张俭波.《食品安全国家标准食品添加剂使用标准》(GB 2760—2011)的修订[J].中国食品卫生杂志,2011,23(6):571-575.
WANG H L,ZHANG J Y,ZHANG J B.Revision on the national food safety standard-standards for uses of food additives (GB 2760—2011)[J].Chinese Journal of Food Hygiene,2011,23(6):571-575.
[3] MPOUNTOUKAS P,PANTAZAKI A,KOSTARELI E,et al.Cytogenetic evaluation and DNA interaction studies of the food colorants amaranth,erythrosine and tartrazine[J].Food & Chemical Toxicology,2010,48(10):2 934-2 944.
[4] SARIKAYA R,SELVI M,ERKOC F.Evaluation of potential genotoxicity of five food dyes using the somatic mutation and recombination test[J].Chemosphere,2012,88:974-979
[5] AMIN K A,ABDEL HAMEID H Ⅱ,ABD ELSTTAR H Ⅱ.Effect of food azo dyes tartrazine and carmoisine on biochemical parameters related to renal,hepatic function and oxidative stress biomarkers in young male rats[J].Food and Chemical Toxicology,2010,48(10):2 994-2 999.
[6] WANG C Q,QIAN J,WANG K et al.Nitrogen-doped graphene quantum dots@SiO2 nanoparticles as electrochemiluminescence and fluorescence signal indicators for magnetically controlled aptasensor with dual detection channels[J].ACS Applied Materials & Interfaces,2015,7(48):26 865-26 873.
[7] 欧洲食品安全局调低食品着色剂苋菜红可接受日摄入量[J].食品与发酵工业,2010,36(9):154.
European Food Safety Agency reduces acceptable daily intake of food colorant amaranth[J].Food and Fermentation Industries,2010,36(9):154.
[8] 杨桂君, 高文惠.毛细管电泳法测定食品中8种添加剂[J].食品科学,2010,31(18):377-380.
YANG G J,GAO W H.Determination of eight food additives in different matrices by capillary electrophoresis[J].Food Science,2010,31(18):377-380
[9] RYVOLVV M,T
M,T BOESKY P,VR
BOESKY P,VR BEL P,et al.Sensitive determination of erythrosine and other red food colorants using capillary electrophoresis with laser-induced fluorescence detection[J].Journal of Chromatography A,2007,1 141(2):206-211.
BEL P,et al.Sensitive determination of erythrosine and other red food colorants using capillary electrophoresis with laser-induced fluorescence detection[J].Journal of Chromatography A,2007,1 141(2):206-211.
[10] 石文秀, 刘晓雪,杜晓燕.石墨烯修饰电极的研究及其电化学检测苋菜红[J].中国卫生检验杂志,2014,24(22):3 208-3 210;3 216.
SHI W X,LIU X X,DU X Y.Study on graphene modifying electrode and its application for determination of amaranth in food[J].Chinese Journal of Health Laboratory Technology,2014,24(22):3 208-3 210;3 216.
[11] GAO Y,WANG L,ZHANG Y,et al.Electrochemical behavior of amaranth and its sensitive determination based on Pd-doped polyelectrolyte functionalized graphene modified electrode[J].Talanta,2017,168:146-151.
[12] 李紫薇, 袁阳,贾风勤.分光光度法同时测定饮料中的苋菜红和柠檬黄[J].伊犁师范学院学报,2010,4(4):30-32.
LI Z W,YUAN Y,JIA F Q.Spectrophotometric determination of amaranth and tartrazine in drinks[J].Journal of Yili Normal University,2010,4(4):30-32.
[13] POURREZA N,ELHAMI S.Cloud point extraction and spectrophotometric determination of amaranth in food samples using nonionic surfactant triton X-100 and tetrabutylammonium hydrogen sulfate[J].Journal of the Iranian Chemical Society,2009,6(4):784-788.
[14] 刘惠霞, 邓树强.药用胶囊中6种合成色素高效液相色谱法的测定及不确定度[J].中国药物经济学,2020,15(2):41-46.
LIU H X,DENG S Q.Determination of 6 synthetic pigments in medical capsules by HPLC and evaluation of uncertainty[J].China Journal of Pharmaceutical Economics,2020,15(2):41-46.
[15] CHAI W B,WANG H J,ZHANG Y,et al.Preparation of polydopamine-coated magnetic nanoparticles for dispersive solid-phase extraction of water-soluble synthetic colorants in beverage samples with HPLC analysis[J].Talanta,2016,149:13-20.
[16] TANG T X,XU X J,WANG D M,et al.A rapid and green limit test method for five synthetic colorants in foods using polyamide thin-layer chromatography[J].Food Analytical Methods,2015,8(2):459-466.
[17] ZHANG X D,CHEN X K,YANG J J,et al.Quaternized silicon nanoparticles with polarity-sensitive fluorescence for selectively imaging and killing gram-positive bacteria[J].Advanced Functional Materials,2016,26(33):5 958-5 970.
[18] LI Y Q,SUN L,QIAN J,et al.Fluorescent “on-off-on” switching sensor based on CdTe quantum dots coupled with multiwalled carbon nanotubes @graphene oxide nanoribbons for simultaneous monitoring of dual foreign DNAs in transgenic soybean[J].Biosensors & Bioelectronics,2017,92:26-32.
[19] SANTOS C I M,OLIVEIRA E,FERN DEZ-LODEIRO J,et al.Corrole and corrole functionalized silica nanoparticles as new metal ion chemosensors:A case of silver satellite nanoparticles formation[J].Inorganic Chemistry,2013,52(15):8 564-8 572.
DEZ-LODEIRO J,et al.Corrole and corrole functionalized silica nanoparticles as new metal ion chemosensors:A case of silver satellite nanoparticles formation[J].Inorganic Chemistry,2013,52(15):8 564-8 572.
[20] WEI W,HE J,WANG Y Y,et al.Ratiometric method based on silicon nanodots and Eu3+ system for highly-sensitive detection of tetracyclines[J].Talanta,2019,204:491-498.
[21] HAN Y X,FENG J,CHEN X G,et al.One-pot synthesis of fluorescent silicon nanoparticles for sensitive and selective determination of 2,4,6-trinitrophenol in aqueous solution[J].Analytical Chemistry,2017,89(5):3 001-3 008.
[22] ZHONG Y L,PENG F,BAO F,et al.Large-scale aqueous synthesis of fluorescent and biocompatible silicon nanoparticles and their use as highly photostable biological probes[J].Journal of the American Chemical Society,2013,135(22):8 350-8 356.
[23] WU S C,ZHONG Y L,ZHOU Y F,et al.Biomimetic preparation and dual-color bioimaging of fluorescent silicon nanoparticles[J].Journal of the American Chemical Society,2015,137(46):14 726-14 732.
[24] WANG J J,LI R Y,LONG X H,et al.Synthesis of imidazole-functionalized silicon quantum dots as “off-on” fluorescence probe for highly selective and sensitive detection of l-histidine[J].Sensors and Actuators B:Chemical.2016,237:740-748.
[25] YI Y H,ZHU G B,LIU C,et al.A label-free silicon quantum dots-based photoluminescence sensor for ultrasensitive detection of pesticides[J].Analytical Chemistry,2013,85(23):11 464-11 470.
[26] TANG M M,JI X Y,XU H,et al.Photostable and biocompatible fluorescent silicon nanoparticles-based theranostic probes for simultaneous imaging and treatment of ocular neovascularization[J].Analytical Chemistry,2018,90(13):8 188-8 195.
[27] 江仁庭, 任欢欢,竺敏,等.一种新型量子点胶束的制备及其细胞成像研究[J].中南药学,2020,18(7),1 094-1 098.
JIANG R T,REN H H,ZHU M,et al.Preparation of quantum dot-based micelles and their application in cell imaging[J].Central South Pharmacy,2020,18(7),1 094-1 098
[28] LIU J,CHEN,WANG W,et al.Effective synthesis of highly fluorescent nitrogen doped carbon nanoparticles for selective sensing of Hg2+ in food and cosmetics samples[J].RSC Advances,2016,6(92):89 916-89 924.
[29] YE H L,CAI S J,LI S,et al.One-pot microwave synthesis of water-dispersible,high fluorescence silicon nanoparticles and their imaging applications in vitro and in vivo[J].Analytical Chemistry,2016,88(23):11 631-11 638.
[30] WANG X,SHENG P T,ZHOU L P,et al.Fluorescence immunoassay of octachlorostyrene based on Forster resonance energy transfer between CdTe quantum dots and rhodamine B[J].Biosensors & Bioelectronics,2014,60:52-56.