我国海域辽阔,总面积达473 km2,海洋生物资源极为丰富。其中,我国的藻类养殖业规模目前已是全球第一,其中尤以经济藻类养殖最为典型[1]。据《2019中国渔业统计年鉴》记录,2018年我国海水藻类总产量达234.4万t。因此,对藻类资源的深度开发利用对我国海洋经济的发展有着至关重要的意义。
褐藻胶是从海带、昆布、马尾藻等褐藻纲植物的细胞壁及细胞间质中提取得到的一种线性多糖,由β-D-甘露糖醛酸及其C5差向异构体α-L-古罗糖醛酸通过α/β-1,4糖苷键随机排列而成,这两种糖单元相互聚合形成三种不同的结构单元,分别是聚甘露糖醛酸(PolyM)、聚古罗糖醛酸(PolyG)及M和G随机组合形成的杂聚物(PolyMG)[2]。褐藻胶的降解产物褐藻寡糖在医药、食品、农业等领域都具有巨大的利用潜力。褐藻寡糖在抗氧化[3]、抗肿瘤[4]、抗凝血[5]、抗真菌[6]、神经保护[7]、肠道消化吸收[8]及植物的生长及保鲜[9]等方面具有良好的生物活性。
相比于酸碱化学降解法、电离辐射和高温高压物理降解法等传统褐藻寡糖制备方法,利用褐藻胶裂解酶制备褐藻寡糖的生物酶解法具有反应条件温和、降解效率高、产物分离容易等优势。而目前已报道的产褐藻胶裂解酶菌株相对较少,因此筛选生长周期短、产酶量高、酶学性质稳定的产褐藻胶裂解酶菌株并对其酶学性质等展开深入研究,具有很好的工业应用价值[10]。
目前已知的产褐藻胶裂解酶菌株主要来源于海水、土壤和海洋藻类等环境中[11]。此外,在皱纹盘鲍、黑斑海兔等主要以褐藻和红藻为食的海生动物的各种消化器官中也发现有褐藻胶裂解酶的存在[12-14]。螺类作为海洋生态系统中的一类庞大的群体,主要以藻类为食,因此其肠道中理论上有可能存在具有良好生理性质的产褐藻胶裂解酶菌株。单齿螺(Monodonta labio)是一种大量生活在我国南北潮间带的经济螺类,常年以褐藻为食,具有较强的耐受环境变化的能力[15]。本研究从单齿螺的肠道中筛选得到了一株生长周期短、性质稳定,且产生热稳定性较好的褐藻胶裂解酶的海生弧菌,并对其酶学性质及应用情况进行了分析。
1 材料与方法
1.1 实验材料
1.1.1 实验材料及主要试剂
本实验所研究的单齿螺(Monodonta labio)来自山东省青岛市某渔场。
2216E培养基:海藻酸钠5 g,硫酸铵5 g,人工海水1 L,用于菌株的富集、种子液和发酵液的培养。在2216E培养基中加琼脂粉15 g即为2216E固体培养基,用于菌株的筛选。
我妻氏血琼脂平板,青岛高科技工业园海博生物技术有限公司。
酶解反应底物:海藻酸钠,上海源叶生物科技有限公司。5 g/L海藻酸钠,溶于10 mmol/L Tris-HCl缓冲液。
1.1.2 主要仪器
超净工作台,苏州净化设备有限公司;电热恒温水浴锅,北京市永光明医疗仪器厂;普通冰箱,TCL集团;UV-3200紫外可见分光光度计,上海美谱达仪器有限公司。
1.2 实验方法
1.2.1 产褐藻胶裂解酶菌株的富集培养
在无菌条件下,用小锤将单齿螺外壳敲碎,取出螺体,用剪子挑出肠道部分,短暂浸入75%的乙醇中将表面消毒,喷洒无菌水去除表面残留乙醇,加入装有100 mL 2216E培养基的三角瓶中,28 ℃培养48 h。
1.2.2 产褐藻胶裂解酶菌株的筛选
将富集后的样品梯度稀释至10-7,分别取各梯度下的样品100 μL均匀涂布至以海藻酸钠为唯一碳源的2216E培养平板上,28 ℃培养48 h。用95%的乙醇处理10 min显示透明圈,挑取其中具有明显凹陷透明圈的菌落,以透明圈直径与菌落直径的比值(D/d)为标准,初步筛选得到可产褐藻胶裂解酶的目标菌株。为了分离得到单一的菌落,将初筛的菌落在2216E平板上进行划线分离纯化3次,观察菌落生长状况及菌落形态,并将得到的目标菌株进行编号整理。并进一步通过革兰氏染色法和扫描电子显微镜观察菌株的生长形态。
1.2.3 褐藻胶裂解酶活性的检测
将1.2.2中纯化后的单菌落点接种于以海藻酸钠为唯一碳源的2216E培养平板上,30 ℃培养48 h,观察透明圈大小。
将纯化后的单菌落分别接种于2216E种子培养基中30 ℃培养12 h,再将种子液以1%(体积分数)的接种量接种于2216E发酵培养基中,在30 ℃条件下培养24 h。将菌液在4 ℃条件下8 000 r/min离心30 min后,取上清液作为粗酶液,通过3,5-二硝基水杨酸法(3,5-dinitrosalicylic acid,DNS法)测定粗酶活力。
本实验所使用的酶活力测定体系为:在400 μL含15 g/L NaCl的5 g/L的海藻酸钠溶液(溶剂为10 mmol/L Tris-HCl缓冲液)中,加入100 μL粗酶液,在40 ℃条件下振荡反应20 min,加入500 μL DNS终止液终止酶学反应,混匀,沸水浴10 min,流水冷却,在540 nm处检测光吸收值,测定还原糖的生成量。以加入100 μL热失活酶液为对照组,每个实验组重复3次。酶活力单位(U)定义为:在一定的温度下,单位时间内将底物降解生成1 μg还原糖所需的酶量。
1.2.4 16S rDNA序列分析法鉴定菌种种属来源
采用菌落PCR的方法对目标菌株16S rDNA进行验证,取40 μL裂解液加入10 μL菌液,沸水浴15 min,混匀,以此为模板进行PCR扩增。以正向引物27(5′-AGAGTTTGATCCTGGCTCAG-3′)和反向引物1492R(5′-GGTTACCTTGTTAGGACTT-3′)为引物,反应条件为:94 ℃预变性1 min,95 ℃变性45 s,56 ℃下退火1 min,72 ℃延伸1 min,共进行30个循环;再在72 ℃下延伸10 min。将扩增成功的PCR产物测序后拼接得到DNA序列,使用NCBI的BLAST在线软件对序列进行比对分析。使用MEGA 7.0软件中的邻接法(neighbor-joining,NJ)建立系统发育树。
1.2.5 神奈川现象试验
将在发酵培养基中培养12 h的目标菌株点种于我妻氏血琼脂平板,在37 ℃培养18 h,通过观察平板是否出现β溶血现象,判断目标菌株是否具有溶血性。
1.2.6 实验菌株单因素发酵优化
将菌株活化后以1%(体积分数)的接种量接种于不同条件的2216E液体培养基中,30 ℃,220 r/min培养12 h,在单因素试验中,控制单一变量,研究不同的碳源(海藻酸钠、葡萄糖、蔗糖、淀粉、木糖)、氮源(酵母提取物、胰蛋白胨、(NH4)2SO4、NH4Cl)、培养温度(15、20、25、30、35、40 ℃)、培养基的初始pH值(5、6、7、8、9)、初始NaCl质量浓度(10、20、30、40、50、60 g/L)等培养条件对菌株生长状况和产酶量的影响。
1.2.7 生长曲线与产酶曲线绘制
在发酵培养基中接种3次传代后的菌株,在最优发酵条件下以1%的接种量培养,在菌株生长过程中每2 h取样测定OD600值及酶活力,绘制菌株生长曲线与产酶曲线。
1.2.8 菌株酶学性质测定
在pH 7.5的条件下,分别在25、30、35、40、45、50、55、60 ℃下研究粗酶液的最适温度。
在40 ℃的条件下,分别在pH 5.5、6.0、6.5、7.0、7.5、8.0、8.5的Tris-HCl缓冲液中确定粗酶液的最适pH。
在pH 7.5,40 ℃的条件下,分别加入5 mmol/L的Na+、K+、Mg2+、Ca2+、Zn2+、Cu2+、Fe2+、Fe3+,对不同金属离子对粗酶液的影响进行测定,对照组为不加金属离子组。
在40、45、50、55 ℃的条件下,分别对粗酶液处理5、15、30、60、90、120 min,研究粗酶液在不同温度下的热稳定性。
1.2.9 褐藻降解效果测定
取新鲜海带和马尾藻,在75%的乙醇中浸泡消毒10 min,用无菌水反复清洗至无乙醇味。分别在100 mL发酵培养基中加入0.5 g海带和马尾藻,在最适菌株生长条件下(加入具体条件)培养72 h,用100目滤网过滤处理后的样品,取残渣,干燥,测定海带和马尾藻的干重变化。对照组分别为未处理组和人工海水处理组。
2 结果与分析
2.1 产褐藻胶裂解酶菌株的筛选
从20个单齿螺样品中共筛选得到165株生长状况良好且在平板上形成明显凹陷透明圈的菌株,通过对其透明圈直径与菌落直径的比值(D/d)的比较,筛选出20株D/d>6的目标菌株进行复筛,在3次纯化后筛选出活性稳定的12株菌株进行单独点接和粗酶活力测定。如图1所示,菌株ML17的D/d值最大同时粗酶活力最高(表1)。
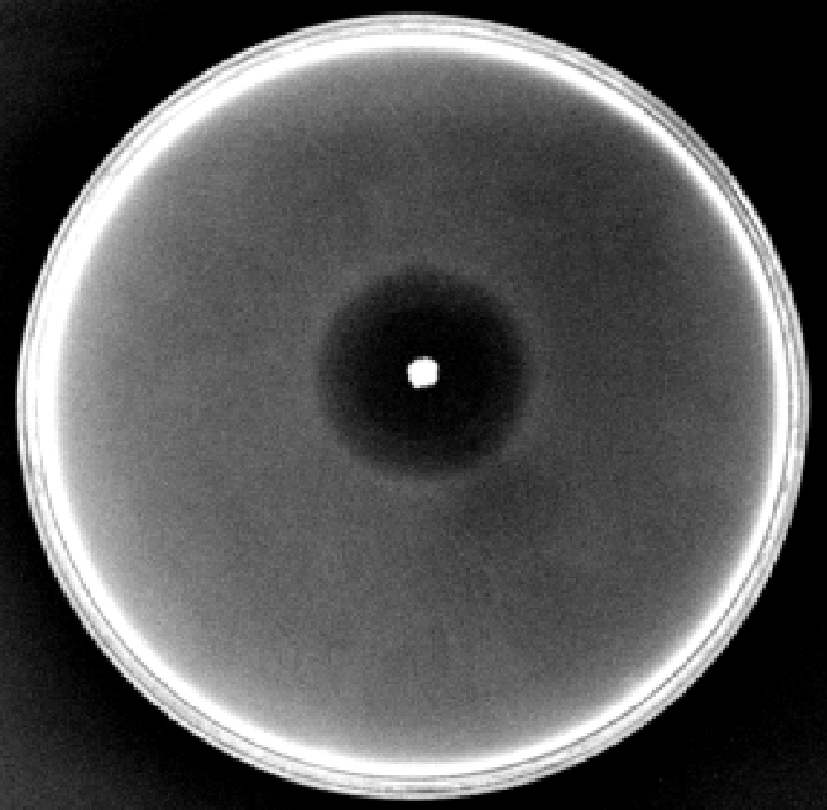
图1 菌株ML17在以海藻酸钠为唯一碳源培养平板上的透明圈情况
Fig.1 The transparent circle of strain ML17 on the culture plate with sodium alginate as the sole carbon source
表1 单齿螺肠道来源的不同菌株的活性比较
Table 1 Comparison of the activity of different strains derived from the intestine of M.labio

菌株粗酶活力/(U·mL-1)菌株粗酶活力/(U·mL-1)ML122.69ML1123.52ML219.06ML1421.34ML515.40ML1618.73ML619.85ML1726.31ML718.70ML1918.01ML1020.18ML2022.46
2.2 菌种的鉴定
将菌株ML17在添加海藻酸钠唯一碳源的2216E培养基上培养24 h,菌落呈白色,不透明,菌落突起,湿润,边缘光滑,有光泽,菌落直径为0.6~0.8 mm,培养基有明显凹陷圈和透明圈,通过光学显微镜下观察,革兰氏染色呈G-,菌体呈近球状。扫描电子显微镜30 000倍观察其细胞形态如图2所示,菌体呈短杆状或椭圆状,两端钝圆。

图2 扫描电子显微镜观察菌株ML17细胞形态(30 000×)
Fig.2 Scanning electron microscope observation of cell morphology of strain ML17 (30 000×)
通过分子生物学手段,测定菌株ML17的16S rDNA序列为1 452 bp,通过BLAST序列比对,发现其16S rDNA与海生弧菌Vibrio maritimus strain KP37A1的相似性达到99.29%。依据16S rRNA序列构建系统发育树聚类分析(图3),并结合菌株的形态学特征,鉴定该菌为弧菌属菌株,并命名为Vibrio sp.ML17,将该菌株保藏于中国普通微生物菌种保藏管理中心,保藏编号为CGMCC No.20377。

图3 菌株ML17的系统发育树
Fig.3 Phylogenetic tree of strain ML17
副溶血性弧菌等一些具有溶血致病性的菌株会在我妻氏血琼脂平板上出现β溶血现象,形成透明溶血圈,这一现象即神奈川现象(Kanagawa phenomenon,KP)。为了确定Vibrio sp. ML17是否也会存在溶血性安全隐患,本研究通过我妻氏血琼脂平板对Vibrio sp. ML17进行培养分析。实验中未观察到β溶血现象的发生,初步表明Vibrio sp. ML17没有溶血致病性,具有较好的安全性。
2.3 菌种生长条件优化
对不同碳源、氮源、生长温度、pH、NaCl浓度的生长条件下的相对生物量和相对酶活力进行测定。在质量浓度均为5 g/L的海藻酸钠、葡萄糖、蔗糖、淀粉、木糖5种不同的碳源条件下,将Vibrio sp. ML17在30 ℃培养12 h,海藻酸钠是Vibrio sp.ML17的生长和产酶的最佳碳源,但基本无法利用木糖作为碳源(图4-a)。而在质量浓度均为5 g/L的酵母提取物、胰蛋白胨、(NH4)2SO4、NH4Cl 四种不同的氮源条件下,Vibrio sp. ML17对复合氮源的利用率要优于单一的无机氮源,其中在胰蛋白胨的条件下生长和产酶最佳(图4-b)。
在15、20、25、30、35、40 ℃不同温度的条件下,Vibrio sp.ML17在发酵培养基中培养12 h后,结果显示(图4-c):Vibrio sp.ML17在30 ℃生长能力和产酶量最佳。菌株超过30 ℃时生长能力会迅速下降,在40 ℃时基本已无法生长。将Vibrio sp. ML17分别置于pH 5、6、7、8、9的发酵培养基中培养12 h后,结果显示(图4-d),Vibrio sp.ML17在pH 7的条件下酶活力最高,而在pH 8时生长状态最佳。在pH 5、6、9的条件下菌株生长状态和产酶量均较低。由于Vibrio sp. ML17来源于海洋生物体内,因此在含NaCl的条件下可能有利于其生长,对Vibrio sp.ML17在含NaCl 10、20、30、40、50、60 g/L的发酵培养基中培养12 h后,结果显示(图4-e):Vibrio sp. ML17在30 g/L的NaCl质量浓度条件下生长状态和产酶量达到最佳。当NaCl质量浓度达到60 g/L时菌株基本无法生长。
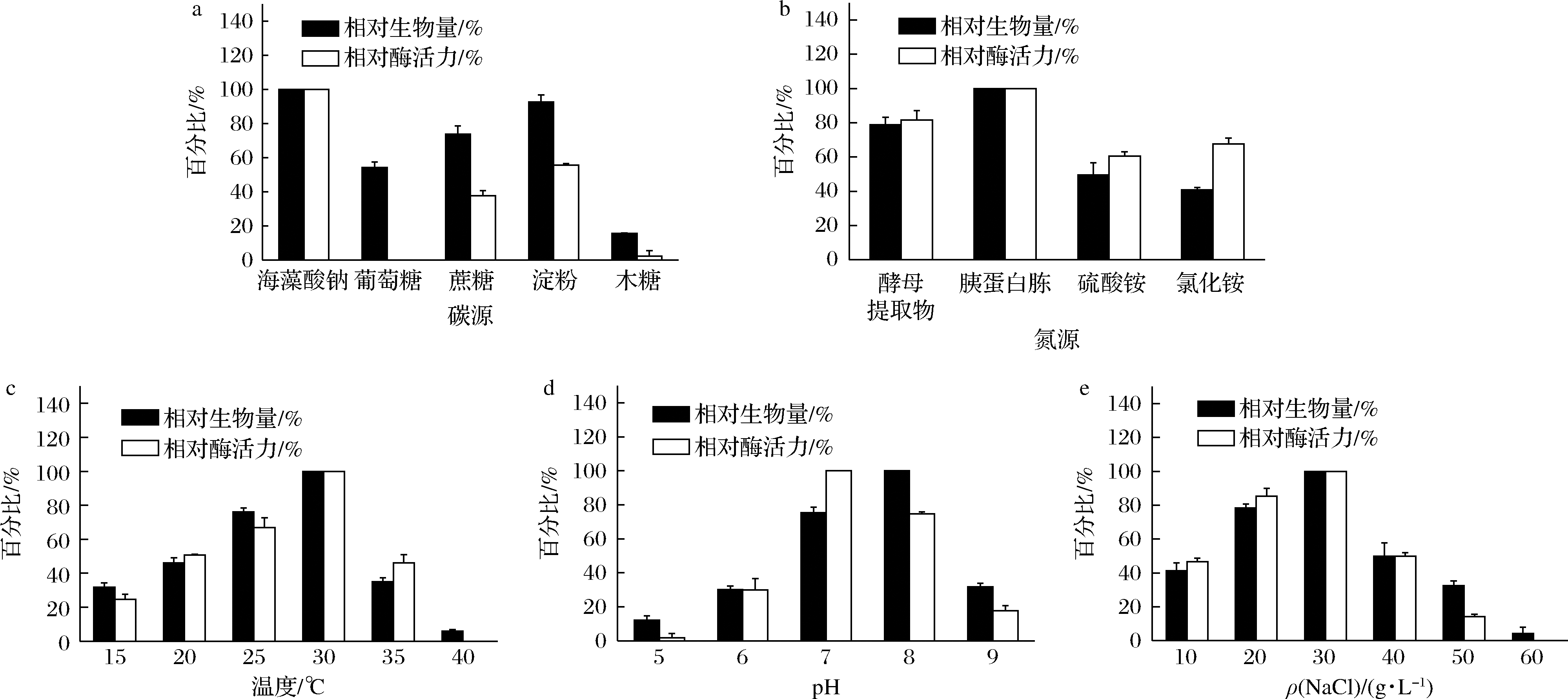
a-碳源;b-氮源;c-温度;d-pH;e-NaCl质量浓度
图4 不同生长条件对Vibrio sp.ML17生长和产酶的影响
Fig.4 The effect of different growth conditions on the growth and enzyme production of Vibrio sp.ML17
2.4 菌株生长及产酶情况
通过对Vibrio sp.ML17的生长曲线及产酶曲线的分析表明,在最适生长条件下,菌株在10 h即可达到平台期,在14 h达到最高产酶量(图5)。这一结果证明Vibrio sp.ML17具有较快的生长速度,发酵周期短,有利于工业生产应用。

图5 Vibrio sp.ML17的生长曲线和产酶曲线
Fig.5 Growth curve and enzyme production curve of Vibrio sp. ML17
2.5 褐藻胶裂解酶酶学性质分析
2.5.1 褐藻胶裂解酶的最适反应温度和热稳定性
对不同温度下Vibrio sp.M17所产褐藻胶裂解酶的活性测定结果显示(图6-a):在25~40 ℃时,酶活力逐渐上升,40 ℃达到最大值,在45和50 ℃仍能保持90%和70%以上活性,从50 ℃之后开始迅速下降,60 ℃基本失活。将粗酶液在40、45、50、55 ℃分别处理5、15、30、60、90、120 min后测定活性,发现粗酶液在40和45 ℃具有良好的热稳定性,如图6-b所示。
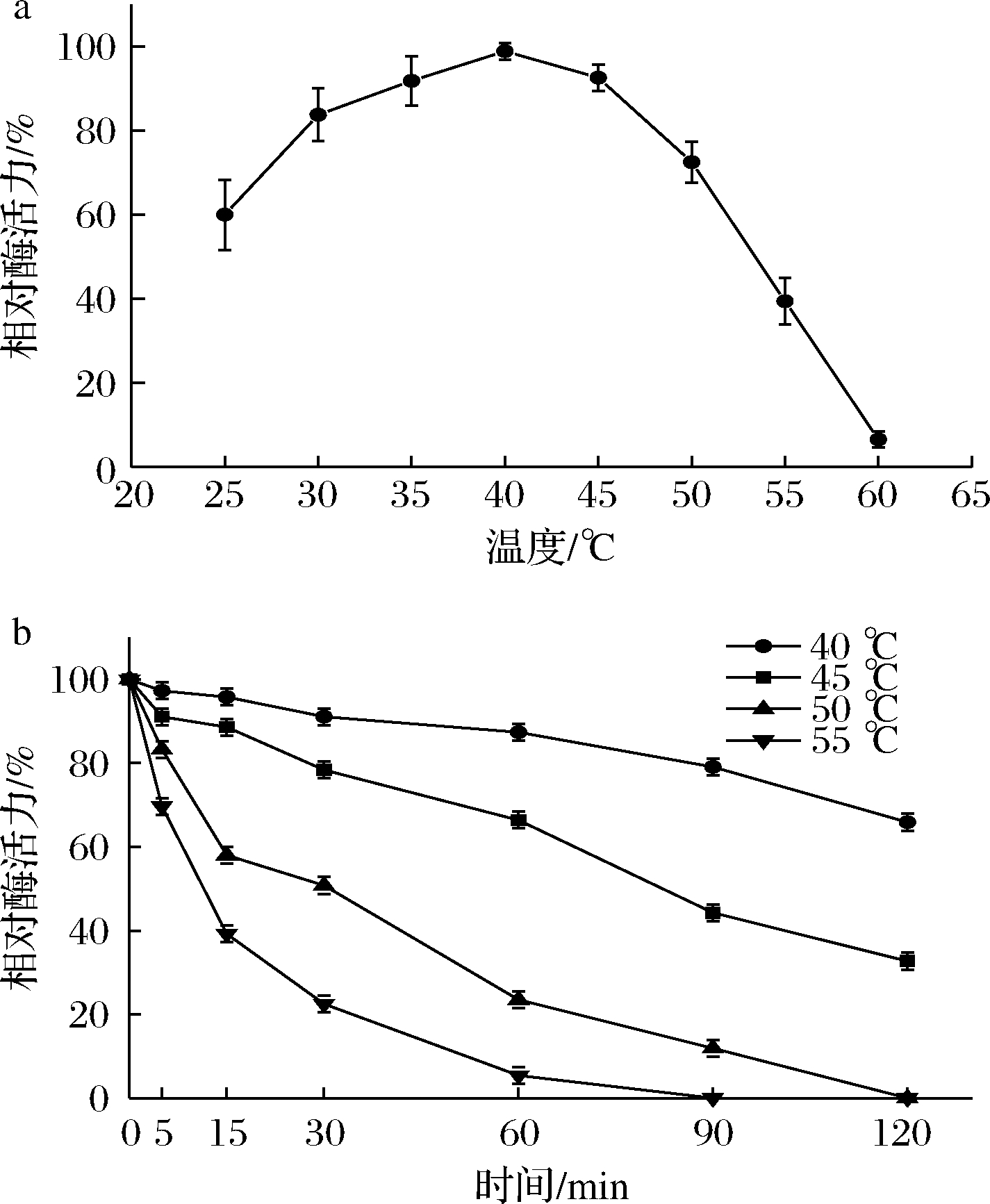
图6 褐藻胶裂解酶最适反应温度与热稳定性
Fig.6 Optimum reaction temperature and thermal stability of alginate lyase
在40和45 ℃条件下处理60 min后活性分别剩余87.4%和66.4%,处理120 min后活性分别剩余65.9%和32.7%。
2.5.2 褐藻胶裂解酶的最适pH
对不同pH环境下Vibrio sp. M17所产褐藻胶裂解酶活性的检测结果表明(图7),该菌株所产褐藻胶裂解酶最适pH值为7.5,在pH 6.5~8.0的偏酸和偏碱条件下均能保持80%以上的活性,过酸和过碱条件都会导致酶活力迅速下降。

图7 褐藻胶裂解酶最适反应pH
Fig.7 Optimal reaction pH of alginate lyase
2.5.3 金属离子对褐藻胶裂解酶的影响
对多种金属离子的作用研究如图8所示。Na+、K+、Ca2+对酶活力都有促进作用,其中Na+、Ca2+最为显著,分别可以提高39.4%和32.6%。Cu2+、Zn2+、Fe2+、Fe3+有抑制作用,其中Zn2+、Cu2+、Fe2+可完全抑制活性。Mg2+对酶活力无明显影响。由于褐藻胶裂解酶主要来源于海洋当中,所以海水中含量较高的Na+、K+、Ca2+等离子都会对其活性产生促进效果。
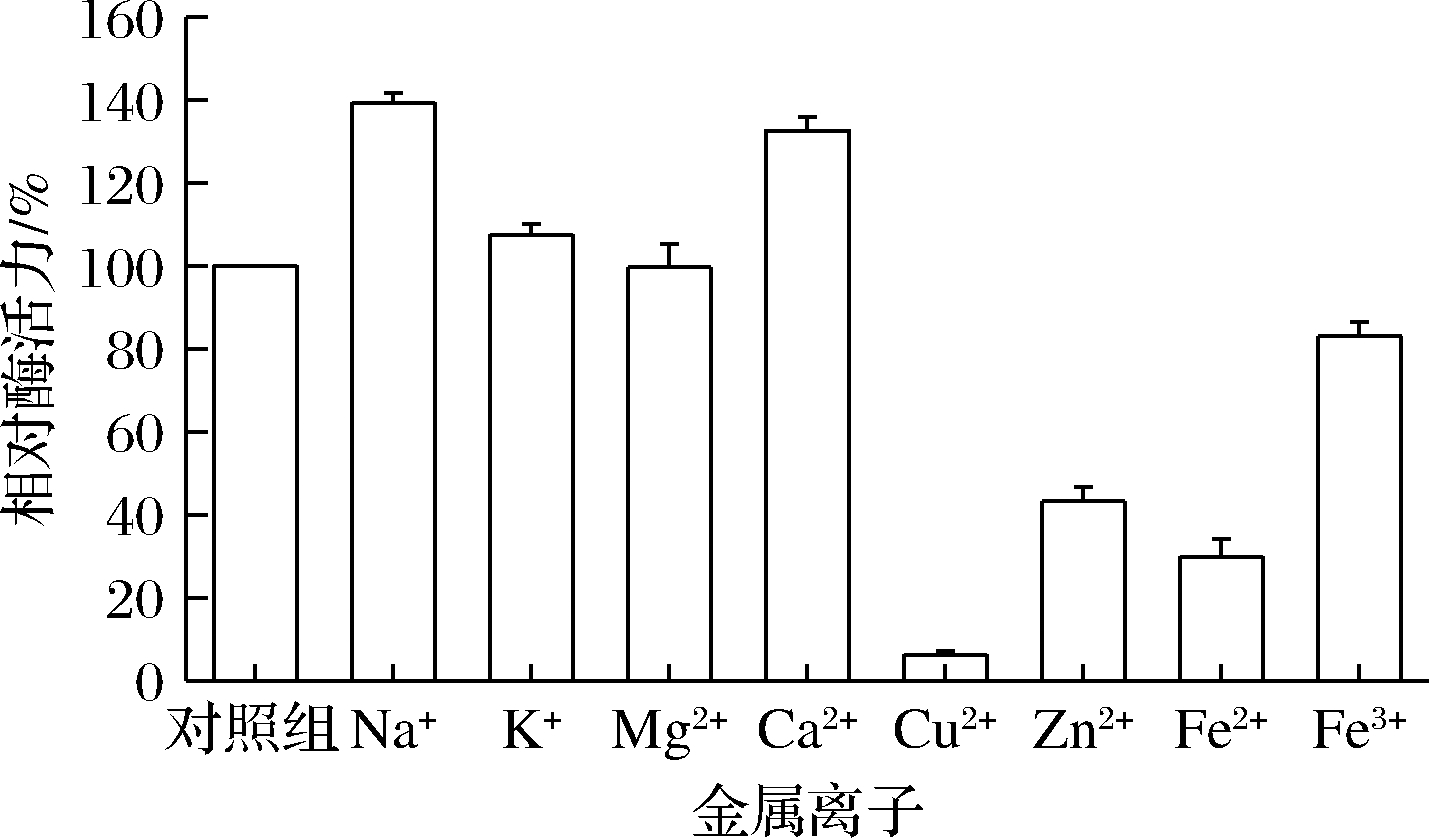
图8 不同金属离子对褐藻胶裂解酶的影响
Fig.8 Effects of different metal ions on alginate lyase
2.6 菌株Vibrio sp.ML17对褐藻属植物的降解作用
海带和马尾藻均属于典型的褐藻门植物,褐藻胶是其细胞壁的主要成分之一。通过对2种不同纲的褐藻降解作用的测定,结果显示(图9),与未经处理或仅用单纯人工海水处理后的样品组相比,经Vibrio sp. ML17处理72 h后,海带和马尾藻干重分别减少了44.0%和38.9%,证明Vibrio sp. ML17可有效实现对褐藻植物的降解作用。
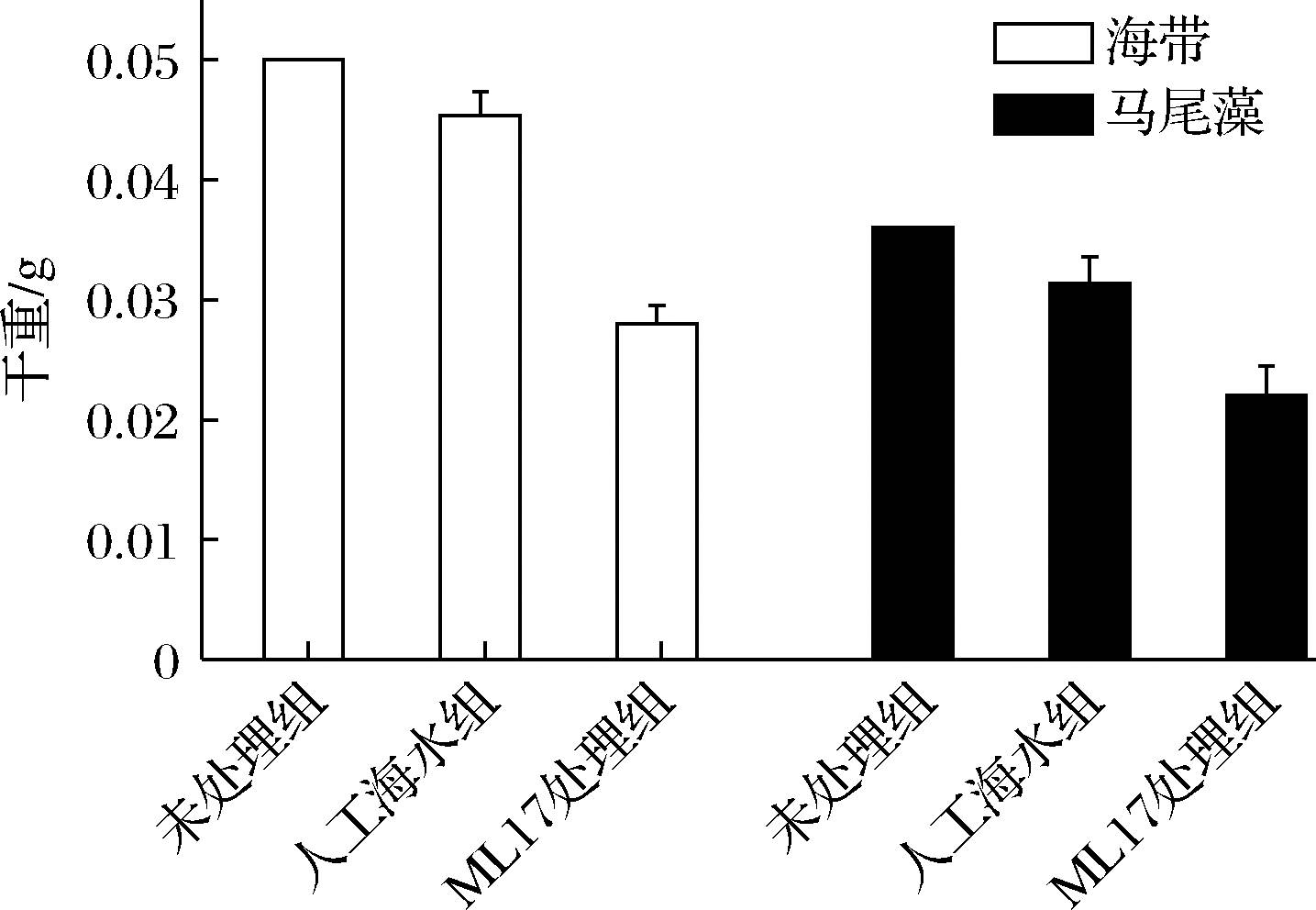
图9 褐藻胶裂解酶对不同褐藻的降解效果
Fig.9 Degradation effect of alginate lyase on different brown algae
3 讨论
与其他来源的褐藻胶裂解酶相比,来源于微生物的褐藻胶裂解酶存在多种优势,如酶产量高、相对酶活力较高、专一性强、反应条件温和等[16]。在之前的报道中,MICHIHIRO等[17]通过改变海螺和海兔的饲料构成,在肠道内筛选得到了多种可降解褐藻胶的菌株。本研究从生活在我国南北潮间带的单齿螺的肠道中发现了1株具有较高褐藻胶裂解酶活性的弧菌Vibrio sp.ML17。受单齿螺长期的生存高盐海洋环境影响,Vibrio sp.ML17对抵御不利环境具有一定优势。
目前已报道的大多数产褐藻胶裂解酶的菌株,由于活力低、发酵周期长等不足[18],导致其无法应用于实际工业生产中,例如源自Hydrogenopahaga sp.的褐藻胶裂解酶在40 ℃处理30 min后只能残留10%活性[19],源自皱纹盘鲍的海洋弧菌褐藻胶裂解酶在40 ℃处理2 h后活性低于40%[20]。而本研究中,Vibrio sp.ML17的褐藻胶裂解酶活性具有较好的热稳定性,在40和45 ℃处理2 h后相对活力仍能保持65.9%和32.7%。同时,不同的金属离子也会对褐藻胶裂解酶的活性产生影响,研究表明Na+、K+对本研究中的褐藻胶裂解酶酶活性有促进作用,且Na+产生影响最大,这一结果与李云涛等[20]研究中褐藻胶裂解酶性质相似,这可能与相关金属离子参与褐藻胶裂解酶催化位点的结合及原本的生存环境有关[21]。
有文献报道部分弧菌在水产养殖领域有一定的生物防治作用,可改良水质,防控疾病等。李学智[22]通过蛭弧菌在草鱼池塘的应用性试验发现其对草鱼烂鳃病、肠炎病等细菌性病害有一定的预防作用。同时,姚艳艳等[23]还通过无溶血性及具有蛋白酶和淀粉酶活性推断其从鲍鱼肠道筛得的弧菌属菌株YY7为潜在的益生菌。之前研究表明弧菌的致病力与毒力因子溶血素相关[24],而本研究筛选得到的菌株并无β溶血现象发生,不具有潜在致病性,可用于水产养殖等方面。
4 结论
本文以海藻酸钠为唯一碳源对海洋螺类单齿螺的肠道菌进行筛选,获得1株具有较高褐藻胶裂解酶活性的菌株Vibrio sp.ML17(CGMCC NO.20377)。该菌株具有生长发酵周期短、菌种安全的特点,同时其分泌的胞外褐藻胶裂解酶具有较高的热稳定性,应用试验表明其可以对褐藻进行有效的降解,在72 h对海带和马尾藻的降解率分别达44.0%和38.9%,综合上述研究表明Vibrio sp.ML17在褐藻寡糖制备、水产养殖中的褐藻防治去除等领域具有良好工业应用前景。
[1] 李杰,张睿,张勇,等.藻类养殖产业发展及其碳汇评估研究[J].江西农业,2019(8):124.
LI J,ZHANG R,ZHANG Y,et al.Research on the development of algae culture industry and its carbon sink assessment[J].Jiangxi Agriculture,2019(8):124.
[2] BALDURSDOTTIR S G,KJONIKSEN A L,KARLSEN J,et al.Riboflavin-photosensitized changes in aqueous solutions of alginate.Rheological studies[J].Biomacromolecules,2003,4(2):429-36.
[3] FALKEBORG M,CHEONG L Z,GIANFICO C,et al.Alginate oligosaccharides:Enzymatic preparation and antioxidant property evaluation[J].Food Chem,2014,164:185-94.
[4] YANG Y,MA Z ,YANG G,et al.Alginate oligosaccharide indirectly affects toll-like receptor signaling via the inhibition of micro RNA-29b in aneurysm patients after endovascular aortic repair[J].Drug Design,Development and Therapy,2017(11):2 565-2 579.
[5] WU J,ZHANG M,ZHAGN Y,et al.Anticoagulant and FGF/FGFR signal activating activities of the heparinoid propylene glycol alginate sodium sulfate and its oligosaccharides[J].Carbohydr Polym,2016.136:641-8.
[6] TONDERVIK A,SLETTA H,KLINKENBERG G,et al.Alginate oligosaccharides inhibit fungal cell growth and potentiate the activity of antifungals against Candida and Aspergillus spp[J].PLoS One,2014.9(11):e112 518.
[7] TAMOSAITYTE S,GALLI R,UCKERMANN O,et al.Biochemical monitoring of spinal cord injury by FT-IR spectroscopy—Effects of therapeutic alginate implant in rat models[J].PLoS One,2015,10(11):e0 142 660.
[8] KIHARA M,SAKATA T.Influences of incubation temperature and various saccharides on the production of organic acids and gases by gut microbes of rainbow trout Oncorhynchus mykiss in a micro-scale batch culture[J].Journal of Comparative Physiology B:Biochemical,Systemic,and Environmental Physiology,2001,171(6):441-447.
[9] BOSE S K,HOWLADER P,JIA X,et al.Alginate oligosaccharide postharvest treatment preserve fruit quality and increase storage life via Abscisic acid signaling in strawberry[J].Food Chem,2019,283:665-674.
[10] ZHU B,YIN H,Alginate lyase:Review of major sources and classification,properties,structure-function analysis and applications[J].Bioengineered,2015,6(3):125-31.
[11] WONG T Y,PRESTON L A,SCHILLER N L,ALGINATE LYASE:Review of major sources and enzyme characteristics,structure-function analysis,biological roles,and applications[J].Annu Rev Microbiol,2000,54:289-340.
[12] SUZUKI H,SUZUKI K,INOUE A,et al.A novel oligoalginate lyase from abalone,Haliotis discus hannai,that releases disaccharide from alginate polymer in an exolytic manner[J].Carbohydr Res,2006,341(11):1809-19.
[13] RAHMAN M M,INOUE A,TANAKA H,et al.Isolation and characterization of two alginate lyase isozymes,AkAly28 and AkAly33,from the common sea hare Aplysia kurodai[J].Comp Biochem Physiol B Biochem Mol Biol,2010,157(4):317-25.
[14] KIM D,BAIK K S,HWANG Y S,et al.Vibrio hemicentroti sp.nov.An alginate lyase-producing bacterium,isolated from the gut microflora of sea urchin (Hemicentrotus pulcherrimus)[J].Int J Syst Evol Microbiol,2013,63(Pt 10):3697-703.
[15] 王一农,曾国权,单齿螺Monodonta labio的实验生态与环境分布[J].海洋科学,1994(3):14-16.
WANG Y N,ZENG G Q,Experimental ecology and environmental distribution of Monodonta labio[J].Marine science,1994(3):14-16.
[16] 刘海超,张健,王共明,等.褐藻胶的降解方法及其产物生物活性研究进展[J].食品工业科技,2020,41(13):350-357;363.
LIU H C,ZHANG J,WANG G M,et al.Research progress on the degradation methods of alginate and the biological activity of its products[J].Food Industry Technology,2020,41(13):350-357;363.
[17] ITO M,K WATANABE K,MARUYAMA T,et al.Enrichment of bacteria and alginate lyase genes potentially involved in brown alga degradation in the gut of marine gastropods[J].Sci Rep,2019,9(1):2 129.
[18] 李双,王碧盈,鲍时翔,等.产褐藻胶裂解酶交替单胞菌的发酵优化及alg2951的外源表达[J].基因组学与应用生物学,2020,39(5):2 088-2 095.
LI S,WANG B Y,BAO S X,et al.Fermentation optimization of Alginate lyase-producing Alternomonas and exogenous expression of alg2951[J].Genomics and Applied Biology,2020,39(5):2 088-2 095.
[19] NARSICO J,INOUE A,OKA S,et al.Production of a novel dimeric 4-deoxy-L-erythro-5-hexoseulose uronic acid by a PL-17 exolytic alginate lyase from Hydrogenophaga sp.UMI-18[J].Biochem Biophys Res Commun,2020,525(4):982-988.
[20] 李云涛,汪立平,张孟,等.鲍鱼来源褐藻胶裂解酶菌株的筛选及发酵条件优化[J].大连海洋大学学报,2017,32(5):574-583.
LI Y T,WANG L P,ZHANG M,et al.Screening of alginate lyase strains from abalone and optimization of fermentation conditions[J].Journal of Dalian Ocean University,2017,32(5):574-583.
[21] DONG S,WEI T D ,CHEN X L,et al.Molecular insight into the role of the N-terminal extension in the maturation,substrate recognition,and catalysis of a bacterial alginate lyase from polysaccharide lyase family 18[J].J Biol Chem,2014,289(43):29 558-29 569.
[22] 李学智.蛭弧菌在草鱼主养池塘应用试验[J].河北渔业,2018(8):41-42;52.
LI X Z.Applicationtest of Budovibrium in grass carp main Pond[J].Hebei Fisheries,2018(8):41-42;52.
[23] 姚艳艳,刘心田,常丽荣,等.鲍鱼肠道海带降解菌株的筛选、鉴定及粗酶学性质研究[J].食品与发酵工业,2019,45(9):61-66.
YAO YY,LIU X T,CHANG L R,et al.Screening,identification and crude enzymatic properties of abalone kelp degrading strains[J].Food and Fermentation Industries,2019,45(9):61-66.
[24] 丁淑妍,侯丽艳,于成勇,等.海洋性弧菌致病机制研究进展[J].职业与健康,2019,35(7):984-989.
DING S Y,HOU L Y,YU C Y,et al.Research progress on pathogenic mechanism of Marine vibrio[J].Occupation andhealth,2019,35(7):984-989.