高级醇是白酒中重要的芳香组分之一,对白酒的风味和饮用舒适度有重要影响[1-2]。适量的高级醇可提高酒的浓厚感并增加酒的协调性[3],但含量过高会引起头痛、头晕等不良反应[4]。高级醇含量是酒类产品卫生标准中的一个限制性指标,白酒中总高级醇的含量应控制在0.2 g/100 mL以内[5]。浓香型白酒中的高级醇主要包括异戊醇、正丙醇、异丁醇和正丁醇[6]。异戊醇、正丙醇、异丁醇的合成主要与酵母菌的氨基酸合成和分解代谢相关,正丁醇的合成则与梭菌的物质代谢有关[6-7]。正丁醇是白酒中高级醇的主要成分之一[1],味苦微涩,浓香型白酒中正丁醇含量大多在70~350 mg/L[8-10],含量过高时会影响饮用口感。
固态混菌发酵状态下的浓香型白酒发酵过程复杂,目前,窖内发酵过程中与正丁醇合成相关的微生物、积累机制以及影响其合成能力的因素尚不完全清楚,这限制了白酒发酵中正丁醇减控技术的发展和应用。浓香型白酒中的正丁醇主要是窖泥中的梭菌通过乙酰辅酶A依赖途径合成[11-14]。目前,调控发酵酒精饮料中高级醇的含量主要通过优化发酵工艺与改造微生物2种手段[15-16]。由于浓香型白酒发酵原料和工艺的特殊性,通过调控白酒发酵工艺(加曲量、加糠量等)和发酵温度等[5,17],可使高级醇总量降低1.42%~14.81%[18]。但这种调控方式于白酒发酵有一定的影响,且不能单独调控某个高级醇的合成。对酵母菌的基因改造虽然能减少由酵母产生的高级醇,但对白酒发酵体系内酵母代谢的影响较小,对体系中正丁醇这类非酵母主要代谢产物合成的调控无效[19]。此外,基因工程菌用于传统发酵食品生产的安全性尚不可预计,尚未见到通过菌株基因改造降低白酒中丁醇含量的报道。利用发酵食品体系中获得性状优良的菌株[16],通过微生物扰动的方式控制微生物代谢产物则是一种安全有效的方法[20]。
本研究拟分离浓香型白酒发酵体系中的梭菌,通过分析它们合成丁醇能力的差异,找到合成丁醇能力较弱的菌株,将其强化到白酒窖内发酵体系中,用于扰动其他梭菌合成丁醇的代谢,以期达到减少浓香型白酒中正丁醇含量的目的。
1 材料与方法
1.1 材料、试剂及仪器
1.1.1 材料
窖泥、入窖酒醅和大曲等样品均由江苏洋河酒厂股份有限公司提供。窖泥和入窖酒醅置于-80 ℃冻存,大曲室温保存。
1.1.2 培养基
胰蛋白胨生理盐水溶液(tryptone saline solution,TPS,g/L):胰化蛋白胨10,酵母提取物5,NaCl 10。
强化梭菌培养基(enhanced Clostridium medium,RCM,g/L):蛋白胨10,牛肉浸粉10,酵母浸粉3,葡萄糖5,可溶性淀粉1,NaCl 5,L-半胱氨酸盐酸盐0.5。
乙酸钠培养基(g/L):乙酸钠5,(NH4)2SO4 0.5,MgSO4 0.2,K2HPO4 0.4,酵母膏1,CaCO3 10,使用前加入体积分数为2%的乙醇。
P2培养基(g/L):葡萄糖60,酵母粉3,KH2PO41,CaCO3 3,MgSO4·7H2O 0.02,FeSO4·7H2O 0.01,NaCl 0.01,对氨基甲苯0.001,维生素B10.001,生物素0.000 01。
丁醇培养基(g/L):葡萄糖60,乙酸铵4,酵母粉3,KH2PO41,K2HPO4 1,CaCO3 3,MgSO4·7H2O 0.2,FeSO4·7H2O 0.02,L-半胱氨酸盐酸盐0.5,对氨基苯甲酸0.003,硫胺0.002。
五粮固体培养基[21]:根据实际生产工艺,将粉碎后的五粮(高粱、大米、玉米、小麦、糯米)按比例混合均匀,按料液比1∶4(g∶mL)添加水,加50 U/kg高温淀粉酶蒸煮糊化1 h,冷却至60 ℃后加入120 U/kg糖化酶处理1 h,121 ℃、灭菌20 min。
1.2 试剂及仪器
正丁醇、叔戊醇、2-辛醇,均为色谱纯,Sigma-Aldrich公司;细菌基因组DNA提取试剂盒,天根生化科技有限公司;其他试剂购自国药集团化学试剂有限公司。
厌氧培养罐及产气袋,日本三菱公司;GC-2010AF气相色谱仪,日本岛津公司;Agilent-1260高效液相色谱仪,安捷伦公司;Pegasus BT气相-高通量飞行时间质谱仪,美国力可公司;PCR仪,Bio-Rad公司。
1.3 方法
1.3.1 产正丁醇菌株的分离
称取10 g窖泥与100 mL TPS缓冲液混合,80 ℃处理10 min以杀死非芽孢状态的菌体及其他营养细胞[22],于室温放置20 min富集菌体,再置于80 ℃热处理10 min,待冷却至30~40 ℃时,以10%的接种量转移至乙酸钠液体培养基,37 ℃厌氧富集培养7 d。取1 mL菌液稀释涂布RCM固体培养基,37 ℃厌氧培养2~5 d。观察培养皿中微生物生长情况,挑取不同形态的菌落划线分离3次及以上,得到各菌株的纯培养物。
采用P2培养基筛选具有合成正丁醇能力的菌株。挑取单菌落接入RCM液体培养基,37 ℃静置厌氧培养24~28 h至OD600为0.9~1.1,以10%接种量接种至P2培养基,于37 ℃厌氧发酵3 d,测定正丁醇含量。
1.3.2 菌株属种鉴定
使用DNA提取试剂盒提取分离到的合成正丁醇细菌的基因组DNA,对获得的总基因组DNA进行16S rDNA的PCR扩增。采用细菌的通用引物:27F(5′-AGAGTTTGATCCTGGCTCAG-3′),1492R(5′-GG-TTACCTTGTTACGACTT-3′)[23]。
PCR扩增体系(25 μL):2×ExTaq酶12.5 μL,ddH2O 11 μL,上下游引物各0.5 μL,模板DNA 0.5 μL。PCR扩增条件:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸90 s,34个循环;72 ℃终延伸5 min。扩增结束后,用1%琼脂糖凝胶电泳检测PCR扩增产物,产物纯化后送至无锡天霖测序公司测序。将测序所得16S rDNA序列提交至GenBank数据库进行BLAST比对,进行细菌的种属鉴定。
1.3.3 减少正丁醇生成菌株的筛选
在P2培养基内通过共培养发酵,寻找可降低正丁醇合成量的微生物。将经种属鉴定菌株的纯培养物分别接入RCM液体培养基,37 ℃厌氧培养24~28 h至OD600为0.9~1.1,将各菌株与正丁醇合成能力最强的微生物(Clostridium beijerinckii 6Y-1)以体积比10∶1的接种比例混合后,以10%接种量接种至P2培养基,37 ℃厌氧发酵3 d。
1.3.4 不同添加比例对丁醇合成的影响
将OD600为1.1的丁醇高产菌C.beijerinckii 6Y-1与减控菌株Clostridium tyrobutyricum ZY-4分别以体积比10∶1、5∶1、1∶1、1∶5、1∶10的接种比例混合均匀,按10%的接种量接入200 g五粮培养基内,混合均匀后置于37 ℃厌氧培养3 d。
1.3.5 梭菌合成各代谢产物的发酵培养
在丁醇培养基体系,按10%的接种量分别接入OD600为1.1的C.beijerinckii 6Y-1、C.tyrobutyricum ZY-4以及两者体积比为1∶10的混合物,37 ℃厌氧培养3 d。
1.3.6 模拟白酒窖内发酵
以窖泥+酒醅+大曲+强化菌为考查体系,模拟浓香型白酒窖内发酵过程,实验流程及装置如图1所示。为排除酒醅中其他微生物对实验结果的干扰,取200 g酒醅在121 ℃下灭菌20 min,向酒醅添加质量分数6.25%的大曲混匀后置于30 ℃发酵48 h。而后将窖泥均匀涂抹在发酵装置内侧作为空白对照,分别向窖泥中添加1.0×105 CFU/g丁醇高产菌C.beijerinckii 6Y-1、1.0×106 CFU/g减控菌株C.tyrobutyricum ZY-4以及两者混合物,置于37 ℃厌氧发酵48 h,定时取样。

图1 模拟白酒发酵的发酵流程(a)及装置(b)
Fig.1 Fermentation process (a) and device (b) for simulating liquor fermentation
1.4 分析检测
固态样品处理方法:准确称取10 g发酵酒醅,加入20 mL超纯水,冰浴超声混匀,4 ℃下10 000 r/min离心5 min,取上清液用于检测分析[21]。
1.4.1 正丁醇含量测定
待测样品中加入终浓度为10 mg/L的叔戊醇,采用顶空-气相色谱-氢离子火焰检测器检测正丁醇含量[24]。色谱柱为DB-Wax(30.0 m×0.32 mm×0.25 μm),平衡温度70 ℃,平衡时间35 min。进样口温度200 ℃,检测器温度260 ℃,分流比3∶1。升温程序:初始温度40 ℃,保持5 min,然后以10 ℃/min的速度升至180 ℃保持5 min。使用氮气作为载气,流速9 mL/min。
1.4.2 有机酸含量测定
乙酸和丁酸含量采用高效液相色谱法测定[25]。色谱条件:色谱柱为有机酸柱,柱温40 ℃;紫外检测器:检测波长210 nm;流动相为5 mmol/L稀硫酸,洗脱速度0.5 mL/min;进样体积10 μL;分离时间30 min。
1.4.3 丙酮及乙醇含量测定
样品中丙酮和乙醇的含量采用配备有火焰离子化检测器的气相色谱仪测定[26]。色谱条件:色谱柱HP-INNOWAX(30.0 m×0.32 mm×0.25 μm);进样口和检测器的温度保持在250 ℃,升温程序:初始温度50 ℃,保持2 min,然后以10 ℃/min的速度升至130 ℃并保持1 min;使用氮气作为载气,流速为30 mL/min。
1.4.4 挥发性物质含量测定
酒醅中挥发性风味物质采用固相微萃取联合气质联用技术进行测定[27]。测定后将样品质谱图与NIST 2.0标准谱库进行比对鉴定,依据保留指数对挥发性物质进行定性,根据内标2-辛醇(终浓度为0.1 mg/L)与挥发性物质的峰面积之比对含量进行半定量分析。
2 结果与分析
2.1 窖泥中梭菌的分离与产丁醇能力分析
浓香型白酒窖内发酵过程与正丁醇合成相关的细菌主要是窖泥中的梭菌。本研究采用RCM和乙酸钠2种培养基从窖泥中共分离得到19株梭菌,经16S rDNA基因序列鉴定分别属于C.beijerinckii、C.cocleatum、C.pabulibutyricum、C.intestinale、C.tertium、C.butyricum、C.sphenoides、C.tyrobutyricum(表1)。其中C.intestinale和C.tertium是首次从窖泥中分离得到的梭菌种。对所分离得到的梭菌合成正丁醇能力的分析表明,C.tyrobutyricum是所分离到梭菌中产丁醇能力最弱的梭菌种,而C.beijerinckii产丁醇能力最强。在P2培养基中C.beijerinckii合成丁醇能力为8.06 g/L,是其他梭菌正丁醇合成量的1 013~8 956倍(图2)。C.beijerinckii是丁醇工业发酵的主要生产菌种[28]。由此推测,C.beijerinckii可能与浓香型白酒发酵过程丁醇的生成有关。
表1 浓香型白酒窖泥中梭菌的分离与鉴定
Table 1 Isolation and identification of Clostridia from pit mud of luzhou-flavor liquor

菌株数量菌株数量Clostridium beijerinckii1Clostridium tertium6Clostridium cocleatum1Clostridium butyricum4Clostridium pabulibutyr-icum1Clostridium sphenoides1Clostridium intestinale1Clostridium tyrobutyricum4

图2 窖泥梭菌正丁醇合成能力比较
Fig.2 Comparison of n-butanol synthesis capability of Clostridium strains from pit mud
C.bei, C.beijerinckii; C.coc, C.cocleatum;C.pab, C.pabulibutyricum;C.int,C.intestinale; C.ter, C.tertium; C.but, C.butyricum; C.sph, C.sphenoides; C.tyr, C.tyrobutyricum.
2.2 抑制拜氏梭菌合成丁醇菌株的筛选
为了评估产丁醇能力弱的梭菌是否能抑制C.beijerinckii 6Y-1合成丁醇,考察了分离自浓香型白酒窖泥的梭菌与C.beijerinckii 6Y-1共培养时对其合成正丁醇的影响。由图3可知,C.tyrobutyricum 4-5、C.sphenoides 4-7和C.butyricum 7-2能够促进C.beijerinckii 6Y-1合成正丁醇,分别可提高18.48%、11.51%和5.63%,这可能与该梭菌具有高产甲酸、氢气的代谢特性相关[28]。当C.tyrobutyricum 5-15、C.butyricum 6-42、C.cocleatum 4-38、C.intestinale 3-5、C.tertium 3-11与C.beijerinckii 6Y-1共培养,不能抑制其合成正丁醇。C.pabulibutyricum 3-1、C.tertium 3-21、C.tyrobutyricum Z-1和C.tyrobutyricum ZY-4具有减少C.beijerinckii 6Y-1合成正丁醇的能力,其中C.tyrobutyricum ZY-4的抑制效果最显著,达到68.91%。C.tyrobutyricum的4个菌株对C.beijerinckii 6Y-1合成正丁醇能力的减控作用存在差异,这可能是由不同菌株代谢特性的多样性导致[2]。
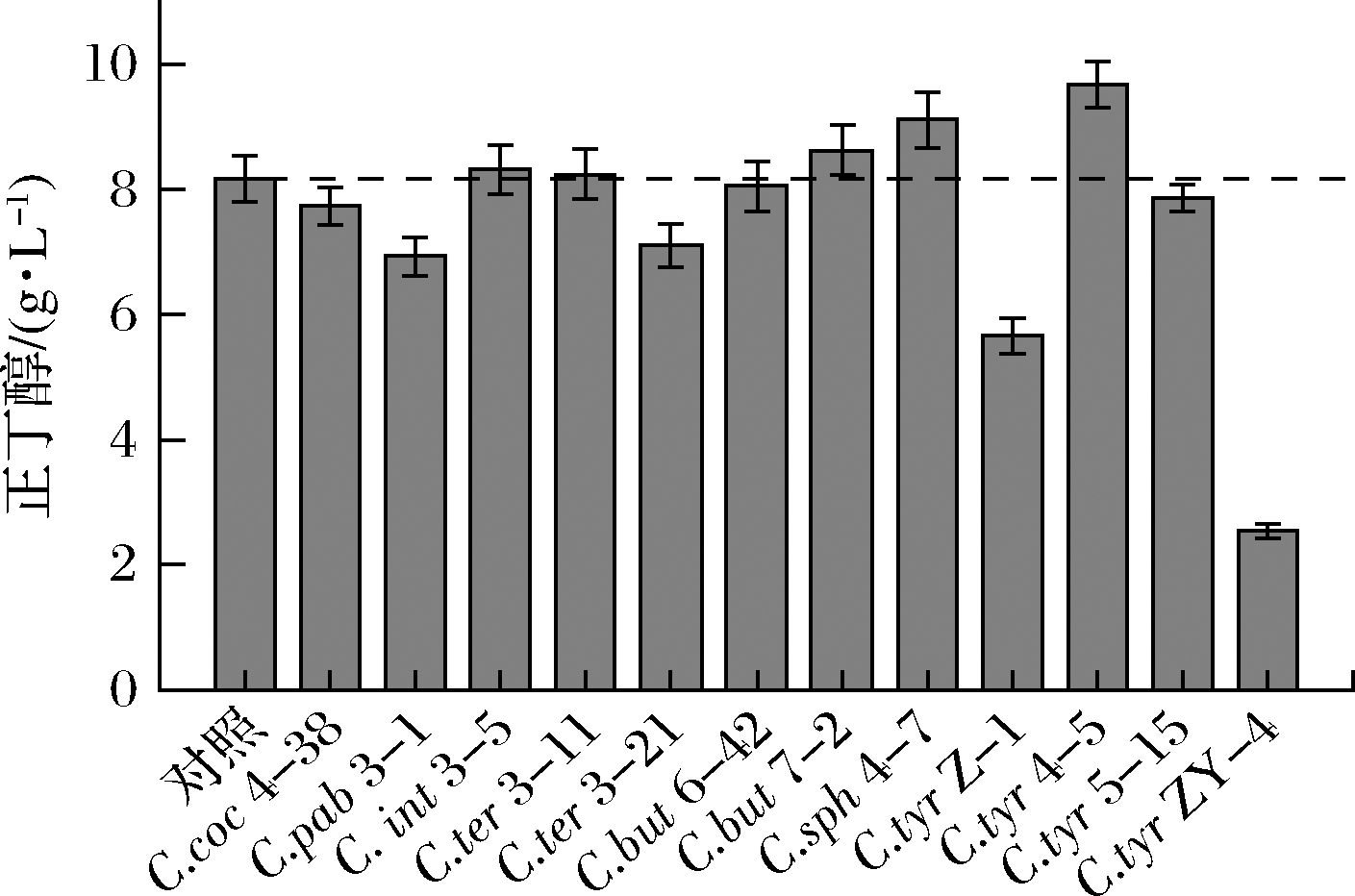
图3 抑制C.beijerinckii合成丁醇菌株的筛选
Fig.3 Screening of strains that inhibit the synthesis of butanol by C.beijerinckii
为了确定抑制C.beijerinckii 6Y-1合成丁醇的最适条件,分析了初始接种比例对C.beijerinckii 6Y-1合成丁醇的影响。通过考察五粮固体培养基中正丁醇的生成量,为将P2培养基体系中减控丁醇能力最显著的C.tyrobutyricum ZY-4应用于实际白酒酿造过程提供基础。由图4可知,C.beijerinckii 6Y-1在五粮固体培养基中产正丁醇的量随C.tyrobutyricum ZY-4添加量的增加而减少,这表明通过调整C.tyrobutyricum ZY-4的添加比例,可以将正丁醇的含量控制在一定范围内。当C.beijerinckii 6Y-1与C.tyrobutyricum ZY-4以1∶10的接种比例混匀后添加至五粮培养基中,对正丁醇含量的降低效果最好。与只接种C.beijerinckii 6Y-1的对照相比,添加C.tyrobutyricum ZY-4最多可使五粮固体培养基中正丁醇的含量减少81.61%。

图4 C.tyrobutyricum ZY-4添加比例对C.beijerinckii 6Y-1合成丁醇的影响
Fig.4 Effect of adding ratio of C.tyrobutyricum ZY-4 on C.beijerinckii 6Y-1 synthesis of butanol
2.3 酪丁酸梭菌ZY-4减控丁醇合成机制的初步分析
梭菌合成正丁醇的代谢途径如图5所示[13,29]。首先葡萄糖通过糖酵解途径代谢为丙酮酸,然后经由乙酰辅酶A合成丁酰辅酶A,最后生成丁醇。其中乙酰辅酶A和丁酰辅酶A可通过分支途径分别合成乙酸和丁酸。

图5 梭菌合成丁醇的代谢途径
Fig.5 The metabolic pathways of Clostridium for synthesizing butanol
ldh-乳酸脱氢酶;pfor-丙酮酸铁氧还蛋白还原酶;thl-硫解酶;hbd-3-羟基丁酰辅酶A脱氢酶;crt-3-羟基丁酰辅酶A脱水酶;bcd-丁酰辅酶C脱氢酶;adhE-乙醛脱氢酶;bdhAB-丁醇脱氢酶AB;pta-磷酸转乙酰激酶;ak-乙酸激酶;ptb-磷酸转丁酰激酶;buk-丁酸激酶;bdhB-乙醇脱氢酶AB;adc-乙酰乙酸脱羧酶
为解析浓香型白酒发酵窖泥中分离得到的C.tyrobutyricum ZY-4减控C.beijerinckii 6Y-1合成丁醇的机制,分析并比较了2种菌单独培养及丁醇培养基体系共培养时发酵液中的正丁醇和其他代谢产物的含量。由表2可知,除维持生长外,C.beijerinckii 6Y-1通过乙酰辅酶A生成的代谢产物主要为丁醇,而C.tyrobutyricum ZY-4的主要代谢产物为丁酸和乙酸。在共培养体系中,乙酰辅酶A生成的代谢产物为乙酸、丁酸和丁醇。添加ZY-4可使共培养体系内正丁醇的生成量减少(103.08±9.55)mmol/L,与生成的其他代谢产物(乙酸、丁酸、乙醇和丙酮)增加量之和(103.01±10.55)mmol/L相同。这说明ZY-4与6Y-1共培养时,可使乙酰辅酶A生成乙酸、丁酸和丙酮等副产物的代谢量增加,从而减少6Y-1生成正丁醇。
表2 窖泥梭菌代谢产物分析 单位:mmol/L
Table 2 Analysis of metabolites of Clostridium strains isolated from pit mud

菌株丁醇乙酸丁酸乙醇丙酮6Y-1149.56±7.4242.35±2.1211.89±0.510.49±0.021.47±0.06ZY-40.16±0.0137.14±1.73126.66±5.370.71±0.034.36±0.186Y-1+ZY-446.56±2.1397.01±4.1856.50±2.780.79±0.035.00±0.29
2.4 模拟白酒窖内发酵减控丁醇
为验证C.tyrobutyricum ZY-4是否能在模拟白酒发酵体系中减控C.beijerinckii 6Y-1合成正丁醇,分别考察了模拟白酒窖内发酵过程丁醇的含量变化。由图6可知,与对照相比,在窖泥中强化C.beijerinckii 6Y-1使发酵过程酒醅中丁醇含量显著增加,最高可使丁醇含量增加34.85%;而强化C.tyrobutyricum ZY-4则使酒醅中丁醇的生成量显著减少,最多可减少30.05%。如果窖泥中含有丁醇合成能力高的C.beijerinckii 6Y-1,通过强化C.tyrobutyricum ZY-4仍可使正丁醇的生成量减少14.43%~41.62%。以上结果说明,不论窖内发酵过程中丁醇含量处于较高还是高水平(含有产丁醇能力强的C.beijerinckii),均可通过在窖泥中用C.tyrobutyricum ZY-4扰动的方式显著减少白酒发酵过程中丁醇的生成。

图6 C.tyrobutyricum ZY-4扰动对模拟发酵过程酒醅中正丁醇含量的影响
Fig.6 Effects of C.tyrobutyricum ZY-4 disturbance on the content of n-butanol in fermented grains during simulated fermentation process
为评估本研究所用丁醇减控策略是否会影响白酒的风味,比较了窖泥梭菌扰动对酒醅中挥发性风味物质种类和含量的影响。由图7可知,向窖泥单独添加2种梭菌或其混合物,除己酸乙酯、辛酸乙酯等风味物质的含量显著增加外,酒醅中其余主要风味物质的含量基本与对照相同。其中强化C.tyrobutyricum ZY-4,不仅可在发酵过程降低正丁醇的生成,还使浓香型白酒的骨架风味物质己酸乙酯和辛酸乙酯的含量分别增加25.77%和22.22%。窖泥中的梭菌来源于窖泥中人工强化的产丁酸和己酸菌株以及从环境中获得的微生物。有研究证实,梭菌的代谢产物有白酒中的呈香物质或前体,主要是对白酒中己酸、辛酸及其相应乙酯的含量有贡献[30]。这也是强化梭菌对其他主要风味物质含量无显著影响的原因之一。

图7 窖泥梭菌扰动对酒醅中挥发性风味物质的影响
Fig.7 Comparison of the content of main volatiles in fermented grains during simulated fermentation
3 结论与展望
为降低浓香型白酒窖内发酵过程中产生的正丁醇含量,利用微生物之间相互作用,通过强化具有扰动作用抑制高产正丁醇的菌株来降低其合成能力。考虑到添加外源菌株可能会对白酒发酵体系产生干扰,进而对酒体品质引起较大的风险,因此优先从窖泥的重要功能微生物中筛选减控丁醇合成的菌株。从窖泥中共分离得到分属于8个种的19株梭菌,包括首次从窖泥中分离得到C.intestinale和C.tertium,这在一定程度上丰富了窖泥中梭菌物种的多样性。对梭菌产正丁醇能力的研究表明,不同种属梭菌的正丁醇合成能力存在差异,C.beijerinckii 6Y-1可使酒醅中正丁醇生成量显著增加,而C.tyrobutyricum、C.sphenoides和C.butyricum等梭菌属的菌种生成丁醇能力较弱。
本研究筛选到1株适用于调控酒窖内发酵体系中正丁醇生成的酪丁酸梭菌C.tyrobutyricum ZY-4。该菌株能较好地减少浓香型白酒窖内发酵过程酒醅中丁醇的生成,并且能显著减少酒醅中由较强丁醇合成能力菌株C.beijerinckii 生成的丁醇。通过窖泥梭菌扰动的方式,建立了浓香型白酒窖内发酵过程丁醇减控的方法,显著提高了酒醅中己酸乙酯、辛酸乙酯的含量,并对绝大部分主要挥发性风味物质的生成无显著影响。
[1] 孙金旭, 朱会霞,杨晓红,等.酵母添加量对酱香型白酒中杂油醇影响[J].食品研究与开发,2010,31(12):67-70.
SUN J X,ZHU H X,YANG X H,et al.The increase the volume of different yeast inoculum concentration influence study on the Maotai-alcohol liquor in oil[J].Food Research and Development,2010,31(12):67-70.
[2] ZHU J,SHI J L,LU Y,et al.Application of strains of Geotrichum spp.to decrease higher alcohols and to increase esters[J].Journal of the Institute of Brewing and Distilling,2016,122(1):147-155.
[3] ZHOU Z L,NI W,JI Z W,et al.Development of a rapid method for determination of main higher alcohols in fermented alcoholic beverages based on dispersive liquid-liquid microextraction and gas chromatography-mass spectrometry[J].Food Analytical Methods,2020,13(3):591-600.
[4] 格绒泽仁, 皇甫洁,韩兴林,等.浓香型白酒饮后不适感关键高级醇类物质关联性判定新方法[J].食品与发酵工业,2019,45(14):191-195.
GERONG Z R,HUANGFU J,HAN X L,et al.A method for determining associations between drinking discomforts and key higher alcohols in strong-aroma Baijiu[J].Food and Fermentation Industries,2019,45(14):191-195.
[5] 苟静瑜, 贾智勇,闫宗科,等.降低白酒中高级醇含量的研究进展[J].酿酒,2016,43(4):25-29.
GOU J Y,JIA Z Y,YAN Z K,et al.Research progress in decreasing the contents of higher alcohols in Baijiu (liquor)[J].Liquor Making,2016,43(4):25-29.
[6] 游玲, 任羽,王涛,等.酵母对浓香型白酒糟醅中高级醇生成的影响[J].食品与发酵工业,2016,42(2):23-28.
YOU L,REN Y,WANG T,et al.Effects of yeasts on higher alcohols forming in Chinese strong-flavored liquor producing[J].Food and Fermentation Industries,2016,42(2):23-28.
[7] 曾朝珍, 张永茂,康三江,等.发酵酒中高级醇的研究进展[J].中国酿造,2015,34(5):11-15.
ZENG C Z,ZHANG Y M,KANG S J,et al.Research progress of higher alcohols in fermented wine[J].China Brewing,2015,34(5):11-15.
[8] ZHANG W X,WU Z Y,ZHANG Q S,et al.Combination of newly developed high quality Fuqu with traditional Daqu for Luzhou-flavor liquor brewing[J].World Journal of Microbiology and Biotechnology,2009,25(10):1 721-1 726.
[9] 周玮婧, 江小明.气相色谱法测定不同香型白酒中醇类与醛类物质含量[J].中国酿造,2017,36(4):180-183.
ZHOU W J,JIANG X M.Determination of the alcohols and the aldehydes contents in different flavor types of Baijiu (Chinese liquor) by gas chromatography[J].China Brewing,2017,36(4):180-183.
[10] 陈果忠, 李世锋,任列华,等.甘肃地产浓香型白酒香味成分分析与比较研究[J].酿酒科技,2017(4):46-50.
CHEN G Z,LI S F,REN L H,et al.Comparative analysis of flavoring components of Nongxiang Baijiu produced in Gansu[J].Liquor-making Science and Technology,2017(4):46-50.
[11] 杜礼泉, 唐聪,刘玲,等.浓香型大曲酒生产中正丁醇生成量差异的原因[J].酿酒科技,2004(3):47-48.
DU L Q,TANG C,LIU L,et al.Reasons of different content of normal butyl alcohol during the production of Luzhou-flavor Daqu liquor[J].Liquor-making Science and Technology,2004(3):47-48.
[12] ZHANG C,LI T G,HE J Z.Characterization and genome analysis of a butanol-isopropanol-producing Clostridium beijerinckii strain BGS1[J].Biotechnology for Biofuels,2018,11(1):280-291.
[13] LAN E I,LIAO J C.Microbial synthesis of n-butanol,isobutanol,and other higher alcohols from diverse resources[J].Bioresource Technology,2013,135:339-349.
[14] LI S B,HUANG L,KE C Z,et al.Pathway dissection,regulation,engineering and application:Lessons learned from biobutanol production by Solventogenic clostridia[J].Biotechnology for Biofuels,2020,13:39-64.
[15] 陈继良, 蔡林洋.生物发酵法生产丁醇的优化策略[J].中国酿造,2020,39(4):13-18.
CHEN J L,CAI L Y.Optimization strategy for butanol production by biological fermentation[J].China Brewing,2020,39(4):13-18.
[16] 林俊涵, 邱东凤,林晨.丁醇产生菌育种研究进展[J].中国生物工程杂志,2014,34(12):118-128.
LIN J H,QIU D F,LIN C.Development in breeding of butanol producing strain[J].China Biotechnology,2014,34(12):118-128.
[17] 张兴亚, 林玲,蒋予箭.黄酒中高级醇含量控制的研究进展[J].中国酿造,2011,30(10):13-17.
ZHANG X Y,LIN L,JIANG Y J.Research progress of controlling higher alcohols in rice wine[J].China Brewing,2011,30(10):13-17.
[18] 罗惠波, 苟云淩,叶光斌,等.影响白酒中高级醇生成的工艺条件研究[J].中国酿造,2011,30(8):87-90.
LUO H B,GOU Y L,YE G B,et al.Process conditions influencing the formation of higher alcohols in liquor spirit[J].China Brewing,2011,30(8):87-90.
[19] JIANG J,LIU Y C,LI H H,et al.Modeling and regulation of higher alcohol production through the combined effects of the C/N ratio and microbial interaction[J].Journal of Agricultural and Food Chemistry,2019,67(38):10 694-10 701.
[20] ZHANG J R,DU G C,CHEN J,et al.Characterization of a Bacillus amyloliquefaciens strain for reduction of citrulline accumulation during soy sauce fermentation[J].Biotechnology Letters,2016,38(10):1 723-1 730.
[21] 田源, 孔小勇,方芳.浓香型白酒发酵过程微生物合成正丙醇途径解析[J].微生物学报,2020,60(7):1 421-1 432.
TIAN Y,KONG X Y,FANG F.Microbial n-propanol synthesis during Luzhou-flavor liquor fermentation[J].Acta Microbiologica Sinica,2020,60(7):1 421-1 432.
[22] HU X L,DU H,XU Y.Identification and quantification of the caproic acid-producing bacterium Clostridium kluyveri in the fermentation of pit mud used for Chinese strong-aroma type liquor production[J].International Journal of Food Microbiology,2015,214:116-122.
[23] 周金虎, 李良,方尚玲,等.窖泥中高产愈创木酚类功能菌的筛选与鉴定[J].食品与发酵工业,2019,45(3):64-70.
ZHOU J H,LI L,FANG S L,et al.Screening and identification of functional boateria with high yield guaiacol in the mud[J].Food and Fermentation Industries,2019,45(3):64-70.
[24] 芦丽, 宫旭.静态顶空气相色谱法测定保健酒中的高级醇类和酯类[J].中国药师,2019,22(12):2 354-2 358.
LU L,GONG X.Determination of purified alcohols and esters in health wine by static headspace-gas chromatography[J].China Pharmacist,2019,22(12):2 354-2 358.
[25] 马瑞,欧阳嘉,李鑫,等.高效液相色谱法同时测定生物质乳酸发酵液中有机酸及糖类化合物[J].色谱,2012,30(1):62-66.
MA R,OUYANG J,LI X,et al.Simultaneous determination of organic acids and saccharides in lactic acid fermentation broth from biomass using high performance liquid chromatography[J].Chinese Journal of Chromatography,2012,30(1):62-66.
[26] 周智友,许张柯,张庆华,等.丙酮丁醇产生菌的筛选、鉴定及其产丁醇性能优化[J].食品与发酵工业,2019,45(4):31-35;41.
ZHOU Z Y,XU Z K,ZHANG Q H,et al.Screening and identification of acetone butanol-producing strains and process optimization for butanol production[J].Food and Fermentation Industries,2019,45(4):31-35;41.
[27] 刘佳乐,周朝晖,李铁桥,等.酱油发酵过程强化嗜盐四联球菌对酱油品质的影响[J].食品与发酵工业,2020,46(17):96-106.
LIU J L,ZHOU Z H,LI T Q,et al.Effect of Tetragenococcus halophilus on soy sauce quality prepared by fermentation[J].Food and Fermentation Industries,2020,46(17):96-106.
[28] LI L,AI H X,ZHANG S X,et al.Enhanced butanol production by coculture of Clostridium beijerinckii and Clostridium tyrobutyricum[J].Bioresource Technology,2013,143:397-404.
[29] ZHENG Y N,LI L Z,XIAN M,et al.Problems with the microbial production of butanol[J].Journal of Industrial Microbiology and Biotechnology,2009,36(9):1 127-1 138.
[30] 胡晓龙. 浓香型白酒窖泥中梭菌群落多样性与窖泥质量关联性研究[D].无锡:江南大学,2015.
HU X L.Illuminating the correlation between anaerobic clostridial community diversity and quality of pit mud used for the production of Chinese strong-flavor liquor[D].Wuxi:Jiangnan University,2015.