作为我国独特的酒精饮料,白酒生产过程主要包括大曲生产、发酵、蒸馏和贮存与勾兑等主要步骤[1]。大曲,被誉为“酒之骨”,既是后续发酵过程的粗酶和微生物菌剂,又是酿酒过程中必不可少的原料之一[2]。优质大曲为白酒提供重要的呈香物质及风味前体成分。随着对大曲微生物菌群功能的深入了解[3-4],筛选及分离菌株在强化大曲中的应用已是目前关注的热点之一。如LI等[5]将片球菌、酵母菌等不同种属的菌株接种到大曲坯中,提高了成曲的微生物群落丰度,改善了发酵稳定性,接种分离株谢瓦散囊菌(Eurotium chevalieri)强化大曲发酵改善了其风味性能[6],接种短小芽胞杆菌(Bacillus pumilus)则使大曲液化力提高了125%[7]。基于产已酸乙酯能力强的酵母菌株及菌群对大曲群落及代谢组分影响的研究结果表明,菌株及菌群的强化对大曲群落及代谢组分的贡献差异显著[8]。上年陈曲接种在曲坯调控酱、清香型大曲群落及代谢的传统工艺由来已久,但迄今未见陈曲强化浓香型大曲生产的报道。
本文以分离株地衣芽胞杆菌(B.licheniformis)和陈曲强化浓香型大曲为研究对象,对其主要理化性质、微生物群落及挥发性组分的影响规律进行研究,旨在为浓香型大曲的定向调控奠定基础。
1 材料与方法
1.1 微生物及培养基
微生物菌株:Bacillus licheniformis,从泸州老窖浓香型大曲中分离,经形态生理生化及分子生物学鉴定为地衣芽孢杆菌,保藏于本实验室。
种子培养基(g/L):蛋白胨10,牛肉膏3,NaCl 5,pH(7.4±0.2)。
1.2 主要药品与试剂
辛酸甲酯,北京百灵威化学试剂有限公司;其他化学试剂均为分析纯,本地化学商品试剂供应商提供。
1.3 主要仪器和设备
TSQ9000 ΙΙ气相色谱-质谱联用仪,美国赛默飞世尔公司;50/30 μm DVB/CAR/PDMS固相微萃取头,美国Supelco公司。
1.4 实验方法
强化大曲生产:B.licheniformis菌悬液和陈曲粉分别以7.2×106 CFU/g(以菌体湿重记)和1% (质量分数)接种到大曲坯中,在泸州老窖股份有限公司制曲中心发酵。功能菌株强化的大曲样品缩写为C,相应地在同曲房的对照样为B-1;陈曲强化的大曲样品为S,同曲房同批次的对照样为B-2。贮存6个月,按参考文献[9]所述方法取样,送至本实验室保藏于-20 ℃冰箱待分析检测。
1.5 分析检测方法
1.5.1 感官检测
大曲感官评价参照文献[10],在自然光下对曲块的外观、断面和香味由10名专业人士组成的品评小组进行综合评定。
1.5.2 理化参数分析
大曲理化指标的测定:参照QB/T 4257—2011《酿酒大曲通用分析方法》[11]检测,每组样品取3组平行样。
1.5.3 挥发性组分测定
样品的前处理:参考DING等[12]所述方法稍作修改。称取样品1.00 g于25 mL顶空瓶中,加入10 μL的辛酸甲酯(0.0 079 g/100 mL)作为内标。置于恒温搅拌器中500 r/min、(60±1)℃预热平衡15 min,吸附提取50 min。结束后,将SPME纤维插入GC进样口解吸5 min,检测挥发性组分。
GC-MS检测操作条件:40 ℃保持5 min,以4 ℃/min升至100 ℃不保持,再以6 ℃/min升至230 ℃保持10 min,进样口温度为270 ℃。离子源温度为300 ℃,质谱扫描范围为m/z 35~400。
检测质谱数据通过与标准谱库(NIST2017)对照进行组分鉴定,对匹配度大于800的物质予以分析。采用峰面积归一化法确定挥发性组分的相对含量。
1.5.4 大曲微生物群落组成检测
按照Fast DNA SPIN提取试剂盒提得基因组DNA,用1%琼脂糖凝胶电泳测其纯度,取3 μL经NanoDrop ND-1000分光光度计测定A260/A280值,检验是否有RNA和蛋白质污染。用338F和806R对细菌的16S rRNA基因高变区V3~V4区域和真菌的ITS5和ITS1区域进行扩增。扩增的操作条件:25 μL,5×reaction buffer和5×GC buffer 各5 μL,0.25 μL DNA聚合酶(5 U/μL,Q5 High-Fidelity),2 μL dNTPs(2.5 mmol/L),正反引物各1 μL(10 μmol/L),2 μL DNA模板,8.75 μL ddH2O。细菌扩增程序为98 ℃预热2 min,98 ℃变性15 s,55 ℃退火30 s,72 ℃延伸30 s,一共25个循环,最后72 ℃保持5 min。真菌扩增程序:95 ℃预热3 min,95 ℃变性30 s,61 ℃退火30 s,72 ℃延伸45 s,共32个循环,最后72 ℃保持10 min。PCR产物琼脂糖凝胶进行目的片段纯化回收。送派森诺生物科技有限公司在2×300 Illumina Miseq平台上测序。
原始序列使用QIIME pipeline进行处理,依据CAPORASO等[13]描述的方法去除一些低质量序列。最后使用UCLUST把高质量的序列聚成不同的操作性分类单元(operational taxonomic units,OTU)[14]。多样性是指某个群落或生境内部的物种多样性,Chao1和Observed species指数用于反映菌群丰度,Shannon和Simpson指数用于表征菌群多样性。
1.5.5 数据处理
显著性分析:使用IBM SPSS Statistics 19软件对理化和风味数据进行显著性分析,方法采用单因素ANOVA分析的Duncan检验法(P<0.05,n=3)。冗余分析(redundancy analysis,RDA):使用Canoco 5.0软件寻找出微生物群落与特征风味组分之间的关系。
2 结果与分析
2.1 微生物组成的差异
Illumina MiSeq测序结果中高质量有效序列的覆盖度均大于99%,说明测序结果准确可靠。样品间细菌和真菌的微生物多样性指数的差异如表1所示。2种不同强化方式均改变了群落的多样性。纯培强化提高了细菌和真菌的丰富度,细菌的多样性无显著变化,而真菌的多样性增高。陈曲强化提高了大曲细菌的丰富度和多样性,但降低了真菌的丰富度和多样性。强化扰动对细菌群落的丰富度影响更显著,且陈曲强化则对细菌和真菌都有显著的影响。
表1 四种大曲微生物群落α-多样性指数
Table 1 α-Diversity indexes of microbial community in the four Daqu
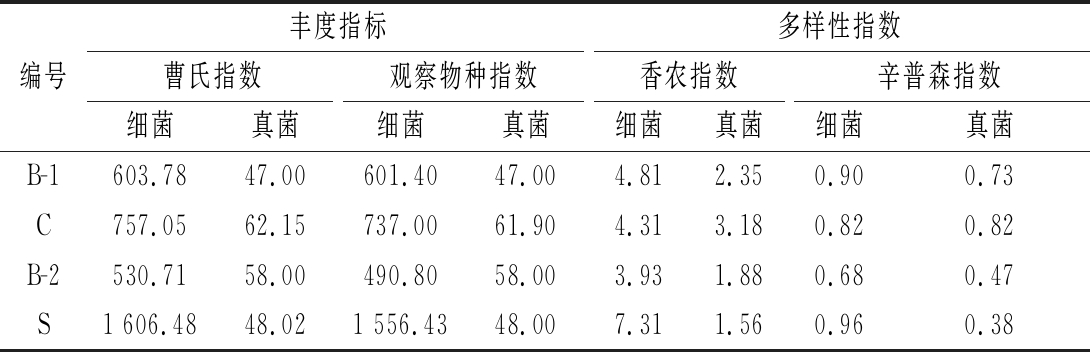
注:C为功能菌株强化的大曲样品;B-1为相应在同曲房的对照样为;S为陈曲强化的大曲样品;B-2为相应同批次的对照样
编号丰度指标多样性指数曹氏指数观察物种指数香农指数辛普森指数细菌真菌细菌真菌细菌真菌细菌真菌B-1603.7847.00601.4047.004.812.350.900.73C757.0562.15737.0061.904.313.180.820.82B-2530.7158.00490.8058.003.931.880.680.47S1 606.4848.021 556.4348.007.311.560.960.38
测序的OTU的细菌和真菌分别归类到106和52个不同属,其中丰富度>0.5%的群落组成轮廓如图1所示。对照大曲(B-1和B-2)聚类在同簇(图1-a),魏氏斯菌属(Weissella)分别是31.34%和75.20%。样品B-1的糖多孢菌属(Saccharopolyspora)、嗜热放线菌属(Thermoactinomyces)分别是23.26%、13.17%。此外,曾报道的是优势细菌的乳酸杆菌属(Lactobacillus)和芽胞杆菌属(Bacillus)在2个样品中比例类似。C曲中Bacillus的丰度是88.28%,而在S曲中Kroppenstedtia、海洋杆菌属(Oceanobacillus)的丰度分别是48.02%和14.76%,曾报道是特香型大曲中的优势细菌[15],且前者在白酒酿造中的作用报道甚少[16]。在古井中温大曲中丰度高达84%的枝芽胞杆菌属(Virgibacillus)[17],在S曲中仅为8.91%。如图1-b所示,散囊菌目(Eurotiales)是对照曲的优势真菌,嗜热子囊菌属(Thermoascus)和毛霉属(Rhizomucor)在B-1中的丰度分别是36.60%和31.68%,而曲霉属(Aspergillus)和毕赤酵母属(Pichia)分别是18.96%和8.62%。在B-2中Aspergillus的相对丰度是78.01%,Thermoascus和Pichia次之。在C曲中曲霉科(Aspergillaceae)的相对丰度是75.73%,而在S曲中Pichia为优势真菌,丰度为82.06%,该菌是赋予独特风味特征的主要贡献者[18],且Hyphopichia(3.34%)与乙酸乙酯呈正相关[19]。
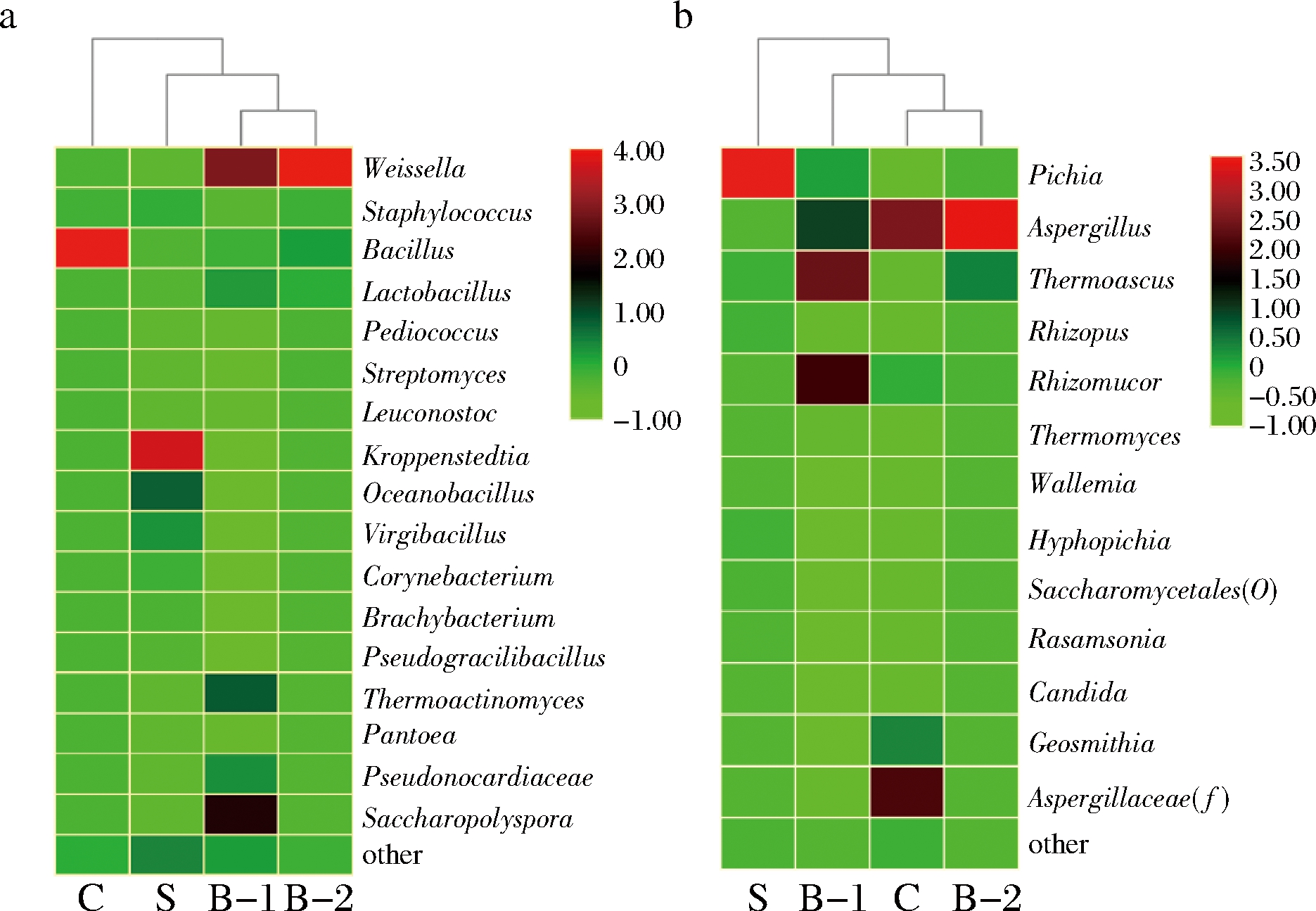
a-细菌;b-真菌C-功能菌株强化的大曲样品;B-1-相应在同曲房的对照样;S-陈曲强化的大曲样品,B-2-相应同批次的对照样
图1 属水平分析大曲中细菌、真菌的群落结构
Fig.1 Relative abundance of prokaryotic and eukaryotic communities in the Daqu at genus level
2.2 强化方式对大曲感官和理化性质的影响
依据大曲相关标准对该实验中的4种大曲从外观、断面和香味3个方面进行评价。传统大曲B-1和B-2类似,菌丝生长较好,只有单纯的曲香味。C曲样有一些杂菌菌斑,酸味重,且有刺鼻的焦香味,这可能与样品中吡嗪类含量高有关。而S曲样的色泽均衡,同时香味浓郁无刺鼻味。
如表3所示,C曲的淀粉酶、糖化酶和酯化酶的活力较对照的低,而S曲与相应的对照无显著的差异,这与S曲样中有更高丰度的高温放线菌科(Thermoactinomycetaceae)有关,有研究报道[20]该菌能产高温淀粉酶能促进原料的糖化和液化。S曲的酯化力显著高于相应的对照,可能与其酯含量及后续白酒中酯类组分含量正相关的作用[21]。C曲的酸度高于相应的对照曲,但S曲则相反,可能与接种的Bacillus降解蛋白质等组分能力较强,并且有益产酸细菌如Lactobacillus、Weissella和明串珠菌属(Leuconostoc)等的繁殖有关[22]。相比对照,强化发酵大曲的发酵力降低,可能与其真菌丰度增高,淀粉等底物水解率减少,且淀粉降解与降解物代谢能力等多边发酵失衡有关[23]。大曲中的发酵力、糖化力和液化力间的平衡关系是维系大曲的酿造学特性的重要参数,较这些参数的高低更能揭示其大曲对白酒产率和品质的贡献[24]。
表2 不同大曲感官特征比较
Table 2 Comparison of sensory characteristics of different Daqu

项目总分B-1CB-2S特征得分特征得分特征得分特征得分外观12呈均匀的灰白色,穿衣好,无明显裂口12红棕色,穿衣略差,无裂口,且表面有杂菌菌斑10表面大部分呈灰白色,穿衣较好,无裂口12表面呈棕黄色,穿衣较好,有轻微裂口11断面14整齐,较泡气,灰白菌丝明显,分布均匀,有少量褐色菌斑12较整齐,死板,有部分呈黑色菌斑,菌丝生长较少9整齐,泡气,呈灰白色,有少量的黄色菌斑,菌丝生长较好11整齐,泡气,呈棕黄色,菌丝生长丰满14香味24曲香味较浓,无明显杂味,曲皮厚约3 mm19曲香不明显,有烘炒后的焦香味,酸味较重,曲皮厚约2 mm17曲香味较单薄,无异味,曲厚1.5 mm左右18曲香较浓,有特殊的香味,无明显怪味,曲厚2 mm20总分5043364145
表3 不同方式强化大曲和传统大曲理化性质表
Table 3 Physicochemical properties of different Daqu

注:C为功能菌株强化的大曲样品;B-1为相应在同曲房的对照样为;S为陈曲强化的大曲样品;B-2为相应同批次的对照样。a-d同一列的不同字母代表显著性差异(P<0.05)
编号水分/%酸度/[mmol·(10 g)-1]液化力/[g绝干·(g·h)-1]糖化力/[mg·(g·h)-1]发酵力/[g CO2·(0.5 g·72 h)-1]酯化力/UB-19.36±0.001a0.78±0.00c1.31±0.01b975.36±3.47c1.76±0.15d632.37±9.99cC9.37±0.002a0.84±0.01d0.89±0.01a902.06±1.93a0.45±0.05b386.70±9.50bB-29.52±0.001a0.69±0.00b1.56±0.01c947.23±1.23b1.05±0.12c807.09±32.98aS10.53±0.001b0.62±0.005a1.54±0.00c997.46±2.45c0.27±0.03a1 077.54±24.19a
2.3 挥发性组成的异同
从这些样品中检出的挥发成分数量与含量因大曲类型不同而异。检出挥发成分在50~90种,C曲的总量为(920 152.11±2 029.47)μg/kg,S曲则为(11 719.55±159.47)μg/kg,相应的对照样品分别是(3 586.40±851.16)μg/kg和(5 185.45±907.95)μg/kg。这些成分根据其化学结构特征分为8类不同组,包括酯、醇、酸、醛、吡嗪、酮、酚和其他类。
接入Bacillus使C曲的醇和吡嗪类显著提高,含量高达14 349.60 μg/kg,占总挥发性的71.21%。吡嗪类中主要由四甲基吡嗪、三甲基吡嗪和2,3-二甲基吡嗪等组分,分别较对照样品增加了5 422.57%、1 042.85%和684.43%,醇类也提高了5.41倍,主要是2,3-丁二醇含量增高所致。该成分具有浓郁的果香[25],赋予白酒入口香甜、绵长的特色[26]。酯类成分则降至(3 692.24±624.63)μg/kg。

C-功能菌株强化的大曲样品;B-1-相应在同曲房的对照样;S-陈曲强化的大曲样品;B-2-相应同批次的对照样
图2 不同方式强化大曲和传统大曲挥发性组分占比及总量图
Fig.2 The volatile component percentage and total amount of different Daqu
注:a-c不同字母代表显著性差异(P<0.05)
接入陈曲强化的S曲样则使酯类成分含量增至(5 111.21±309.76)μg/kg,己酸乙酯增高106.50%。类似C曲,吡嗪类的含量也增高了,四甲基吡嗪高达(2 143.44±321.92)μg/kg,是主要的共献者,该成分可赋予白酒坚果、焦香味等芳香特色[25]。同时,仅在S曲中检出石竹烯和杜香醇,赋予其辛香、樟脑香、木香[27]及桃香味[28]等独特风味。
2.4 挥发性与微生物的相关性
RDA解析群落中优势种属与特征风味组分相关性的结果如图3所示。C曲中吡嗪类、醇类及芳香族组分与Bacillus呈显著的正相关,尤其是四甲基吡嗪、2,3-丁二醇、1,3-二甲基苯和1,2,4-三甲基苯是分离株强化的优势挥发性成分。类似曾报道的结果[29],分离株强化,增高了其丰度,相应的优势成分的含量显著提高。相反地,陈曲强化浓香型大曲的酯、醇、酸等优势组分含量均衡增高,吡嗪的含量也增加。这些组分与根霉属(Rhizopus)[30]、Pichia[15]等丰度呈正相关,如异戊酸和己酸乙酯,这与2个种属的相应的酸的分泌能力和产酯能力较强有关。S曲丰度较高的kroppenstedtia、Oceanobacillus具备产石竹烯和杜香醇等能力,所以与其丰度呈正相关。石竹烯和杜香醇虽在白酒酿造中被检出,但对白酒风味的特征贡献待深入研究[16]。此外,对照曲中的Aspergillus的丰度较高,且与3-辛酮、1-辛烯-3-醇和棕榈酸乙酯呈正相关。

图3 基于微生物群落与风味代谢物的冗余分析
Fig.3 Redundancy analysis based on microbial community and flavor metabolites
3 结论
分离功能菌株和优质陈曲强化大曲发酵,对大曲理化性质、微生物群落多样性及挥发性组分的影响差异显著。分离功能菌株强化提高了细菌和真菌的丰度,但使细菌多样性降低,真菌多样性增高,理化参数降低,显著提高了功能菌的目标产物的含量。优质陈曲强化大曲发酵,提高细菌的丰富度和多样性,但降低了真菌的丰富度和多样性,但理化性质几乎相同,主要挥发成分的组成亦类似,但含量显著提高,且新检出了石竹烯和杜香醇等独特芳香成分。由此可见功能菌强化主要提高了目标代谢组分的含量,改变大曲群落及理化性质,而陈曲强化发酵的大曲理化等各种参数与传统大曲相似性更高,为白酒酿造提供了更多的可能性。
[1] ZHENG X W,HAN B Z.Baijiu (白酒),Chinese liquor:History,classification and manufacture[J].Journal of Ethnic Foods,2016,3(1):19-25.
[2] 王小平, 黄永光,周文美.酱香型白酒大曲细菌菌群结构及功能研究进展[J].中国酿造,2020,39(2):19-25.
WANG X P,HUANG Y G,ZHOU W M.Research progress on structure and function of bacterial community in Moutai-flavor Baijiu Daqu[J].China Brewing,2020,39(2):19-25.
[3] DU H,WANG X S,ZHANG Y H,et al.Exploring the impacts of raw materials and environments on the microbiota in Chinese Daqu starter[J].International Journal of Food Microbiology,2019,297:32-40.
[4] LI H,HUANG J,LIU X,et al.Characterization of interphase microbial community in Luzhou-flavored liquor manufacturing pits of various ages by polyphasic detection methods[J].Journal of Microbiol and Biotechnol,2016,27(1):130-140.
[5] LI P,LIN W F,LIU X,et al.Effect of bioaugmented inoculation on microbiota dynamics during solid-state fermentation of Daqu starter using autochthonous of Bacillus,Pediococcus,Wickerhamomyces and Saccharomycopsis[J].Food Microbiology,2017,61:83-92.
[6] 崔香香, 白飞荣,于学健,等.谢瓦散囊菌CICC 41584产香特性及在浓香型白酒大曲生产中的应用[J].食品与发酵工业,2019,45(21):60-67.
CUI X X,BAI F Y,YU X J,et al.Aroma characteristics of Eurotium chevalieri CICC 41584 and its application in aroma Baijiu Daqu production[J].Food and Fermentation Industries,2019,45(21):60-67.
[7] 冯利芳, 李素琴,刘鹏烩,等.清香大曲中性蛋白酶产生菌的分离鉴定及应用研究[J].食品科技,2018,43(11):1-6.
FENG L F,LI S Q,LIU P H,et al.Isolation,identification and application of bacteria producing neutral protease form light-flavor Daqu[J].Food Science and Technology,2018,43(11):1-6.
[8] Li W,FAN G,FU Z,et al.Effects of fortification of Daqu with various yeasts on microbial community structure and flavor metabolism[J].Food Research International,2019,129:108 837.
[9] 吴秋霞, 黄钧,江东材,等.基于共培强化提高浓香大曲吡嗪类及4-乙基愈创木酚组分含量的研究[J].食品科技,2017,42(5):2-6.
WU Q X,HUANG J,JIANG D C,at al.Exploring the improvement of contents pf pyrazines and 4-EG in Luzhou-flavor Daqu based on fortifying by co-culture[J].Food Science and Technology,2017,42(5):2-6.
[10] 敖宗华, 陕小虎,沈才洪,等.国内主要大曲相关标准及研究进展[J].酿酒科技,2010(2):104-108.
AO Z H,SHAN X H,SHEN C H,at al.Domenstic related quality standards of Daqu & its research progress[J].Liquor-Making Science & Technology,2010(2):104-108.
[11] 中华人民共和国工业和信息化部. QB/T 4 257-2011 酿酒大曲通用分析方法[S].北京:食品发酵标准化中心,2012.
Ministry industry and information Technology of the People’s Republic of China.QB/T 4 257-2011 General methods of analysis for Daqu[S].Beijing:Standardization Center for Food Fermentation,2012.
[12] DING X F,WU C D,HUANG J,et al.Characterization of interphase volatile compounds in Chinese Luzhou-flavor liquor fermentation cellar analyzed by head space-solid phase micro extraction coupled with gas chromatography mass spectrometry (HS-SPME/GC/MS)[J].LWT-Food Science and Technology,2016,66:124-133.
[13] CAPORASO J G,KUCZYNSKI J,STOMBAUGH J,et al.QIIME allows analysis of high-throughput community sequencing data[J].Nature Methods,2010,7:335-336.
[14] EDGAR R C.Search and clustering orders of magnitude faster than BLAST[J].Bioinformatics,2010,26(19):2 460-2 461.
[15] 刘婷, 陈可丹,黄冰静,等.不同生产环境对特香型大曲的影响[J].中国酿造,2019,38(7):80-84.
LIU T,CHEN K D,HUANG B J,et al.Effect of different production environment on Te-flavour Daqu[J].China Brewing,2019,38(7):80-84.
[16] WANG X S,DU H,ZHANG Y,et al.Environmental microbiota drives microbial succession and metabolic profiles during Chinese liquor fermentation[J].Applied and Environmental Microbiology,2018,84(4):e2 369-2 317.
[17] 束莹. 古井贡酒大曲中微生物群落结构的鉴定及分析[D].哈尔滨:哈尔滨工业大学,2013.
SU Y.Identification and analysis of Microbial community structure for Gujing liquor Daqu[D].Harbin:Harbin Institute of Technology,2013.
[18] YAN S B,TONG Q Q,GUANG J Q.Yeast dynamics and changes in volatile compounds during the fermentation of the traditional Chinese strong-flavor Daqu[J].LWT,2019,106:57-63.
[19] 夏屿. 浓香型大曲主发酵阶段微生物群落结构变化及与挥发性化合物的相关性研究[D].自贡:四川轻化工大学,2019.
XIA Y.Correlationship between microbiota and volatile compounds in Luzhou-flavour Daqu of the main fermentation stages[D].Zigong:Sichuan University of Science & Engineering.
[20] 鲜文东, 明红,李文均.高温放线菌科最新研究进展小型综述[J].微生物学报,2015,55(1):1-11.
XIAN W D,MING H,LI W J.The family Thermoactinomycetaceae-A review[J].Journal of Microbiology,2015,55(1):1-11.
[21] WANG P,WU Q,JIANG X,et al.Bacillus licheniformis affects the microbial community and metabolic profile in the spontaneous fermentation of Daqu starter for Chinese liquor making[J].International Journal of Food Microbiology,2017,250:59-67.
[22] 梁晨, 杜海,徐岩.大曲贮存过程中原核微生物群落结构及风味成分演替规律[J].微生物学通报,2017,44(2):384-393.
LIANG C,DU H,XU Y.The succession of procaryotic microbial community and the flavor components in storage process of Daqu[J].Microbiology China,2017,44(2):384-393.
[23] 刘从艾, 穆文斌,汤有宏.大曲糖化力、发酵力最佳量比关系的研究[J].酿酒,2000,27(2):41-43.
LIU C A,MU W B,TANG Y H.Study on optimum quantity ratio of Saccharification power and fermentation power of Daqu[J].Liquor Making,2000,27(2):41-43.
[24] 唐玉明, 沈才洪,任道群,等.酒曲理化品质指标相关性探讨[J].酿酒科技,2006(7):37-41.
TANG Y M,SHENG C H,REN D Q,et al.Investigation on the correlations of physiochemical indexes of starter[J].Liquor-Making Science & Technology,2006(7):37-41.
[25] 范文来, 徐岩.白酒79个风味化合物嗅觉阈值测定[J].酿酒,2011,38(4):80-84.
FAN W L,XU Y.Determination of odor thresholds of volatile aroma compounds in Baijiu by a forced-choice ascending concentration series method of limits[J].Liquor Making,2011,38(4):80-84.
[26] 易琍娟. 白酒中α-联酮类物质的作用及其来源之探讨[J].中国酿造,1983,2(4):14-19.
YI L J.Study on the effects of α-diketones in liquor and their sources[J].China Brewing,1983,2(4):14-19.
[27] WANG H J,QI H Y,ZHANG J S.Analysis of volatile components in black pepper essential oil[J].China Condiment,2017,42(12):138-140;146.
[28] 王超, 张连忠,彭福田.顶空固相微萃取法分析肥桃香气成分[C].西安:中国园艺学会桃分会第三届学术研讨会论文集,2011.
WANG C,ZHANG L Z,PENG F T.Headspace solid phase microextraction was used to analyze the aroma components of fatty peach[C].Xi’an:Proceedings of the Third Symposium of the Peach Branch of the Chinese Horticultural Society,2011.
[29] ZHANG R,WU Q,XU Y.Aroma characteristics of Moutai-flavour liquor produced with Bacillus licheniformis by solid-state fermentation[J].Letters in Applied Microbiology,2013,57(1):11-18.
[30] 龙可, 赵中开,马莹莹,等.酿酒根霉菌研究进展[J].现代食品科技,2013,29(2):443-447.
LONG K,ZHAO Z K,MA Y Y,et al.Progresses of researches on rhizopus for liquor-making[J].Modern Food Science and Technology,2013,29(2):443-447.