啤酒是世界三大古酒之一,以其独特的风味深受消费者的青睐[1]。啤酒中的风味物质对其口感和香气起着极其重要的作用,而乙醛是严重影响啤酒风味及其稳定性的羰基化合物[2]。2~5 mg/L的乙醛使啤酒具有芳香的风味,若乙醛含量高于10 mg/L,不仅易产生腐烂青草味,还会缩短啤酒风味的保鲜期,甚至人体饮用后引起不良反应[3]。近年来,伴随着酒精饮料工业的快速发展,质量安全成为不可忽视的议题。保持品牌特有风味的基础上,如何降低啤酒中的乙醛含量,是生产企业普遍关注的焦点。
迄今为止,学者们相继提出了啤酒中乙醛含量的控制措施[4]。然而,控制生产工艺不具有普遍适用性,构建酵母工程菌不符合食品安全规范,难以彻底解决啤酒风味问题。而啤酒中的乙醛主要来自于酵母的代谢,酵母内的乙醇脱氢酶Ⅰ、Ⅱ和乙醛脱氢酶是代谢乙醛的关键酶,共同作用决定了乙醛的含量[5]。酵母从根本上决定了啤酒中乙醛的形成和积累,选育发酵性能优良的低产乙醛酿酒酵母也成为保持啤酒风味稳定、保障啤酒安全生产的有效途径[6]。然而,前期筛选低产乙醛酵母菌株的研究中,普遍存在筛选周期较长[7]、工作量大[8]、成本高[8]和筛选效率偏低[9]的问题。因此,需要建立一套高效、快速的低产乙醛啤酒酵母菌株筛选策略。
从食品安全及啤酒实际生产的角度出发,结合目前乙醛含量控制方面存在的问题,本研究以Lager型啤酒工业酵母菌株为研究对象,采用多轮常压室温等离子体(atmospheric room temperature plasma,ARTP)诱变育种手段对出发菌株进行改良,利用乙醇-双硫仑抗性平板、高浓度乙醛筛选平板及其对应驯养液对诱变菌株进行平板筛选及液体驯化,形成诱变-筛选-驯化的多轮初筛体系,同时以关键酶活性变化为低产乙醛复筛标准,通过实验室摇瓶水平的啤酒模拟酿造体系,最终获得发酵性能和生物学特性均与出发菌株无显著差异的低产乙醛工业啤酒酵母。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与培养基
Lager型啤酒工业酵母(出发菌株),江南大学生物工程学院生物系统与生物加工研究室保藏。
高浓度乙醛筛选培养基(g/L):乙醛2,酵母粉10,蛋白胨20,葡萄糖20,琼脂粉20,121 ℃灭菌15 min(乙醛以0.45 μm有机滤膜除菌,待培养基灭菌冷却后添加)。
高浓度乙醛驯养液(g/L):乙醛3,酵母粉10,蛋白胨20,葡萄糖20,121 ℃灭菌15 min(乙醛添加方式同上)。
乙醇-双硫仑筛选培养基(g/L):乙醇10,双硫仑(灭菌后添加)0.000 2,(NH4)2SO4 5,KH2PO4 1,NaCl 0.1,MgSO4·7H2O 0.5,CaCl2 0.1,酵母膏0.1,琼脂粉20,115 ℃灭菌20 min。
乙醇-双硫仑驯养液(g/L):乙醇10,双硫仑(灭菌后添加)0.002 0,(NH4)2SO4 5,KH2PO4 1,NaCl 0.1,MgSO4·7H2O 0.5,CaCl2 0.1,酵母膏0.1,115 ℃灭菌20 min。
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose, YPD)培养基(g/L):蛋白胨20,葡萄糖20,酵母浸出粉10,121 ℃灭菌15 min。
1.1.2 试剂与原料
乙醛(99.5%,GC纯度,CAS No. 75-07-0),上海阿拉丁生化科技股份有限公司;3-庚酮(99.0%,GC纯度,CAS No. 106-35-4),上海麦克林生化科技有限公司;加拿大(卡普兰德)皮尔森麦芽、卡斯卡特颗粒酒花(Cascade)、马格努门颗粒酒花(Magnum),均为进口市售。
1.2 仪器与设备
DLEUW22050麦芽粉碎机,Buhler-Miag公司;BGT-8A协定糖化仪,BIOER公司;B00 N-900 N超声波细胞破碎仪,上海般诺生物科技有限公司;GC-2010AF气相色谱仪,日本岛津公司。
1.3 试验方法
1.3.1 麦汁制备
45 ℃时,料水比1∶4(g∶mL)加水投料;升温至48 ℃,保温30 min;升温至65 ℃,保温40 min;升温至72 ℃,保温10 min;升温至78 ℃,保温10 min,糖化结束[10]。趁热过滤,煮沸1 h,添加酒花(0.25‰)。调节麦汁至12°P。
1.3.2 ARTP诱变
将对数期的菌体离心洗涤3次,稀释OD600为1.0。取10 μL菌悬液于无菌金属载片(8 mm),以氦气等离子束对酵母细胞进行诱变处理[11]。保持氦气流速15.0 L/min,输入功率100 W,处理距离2 mm,处理温度<40 ℃。为了获得最佳的诱变条件,设置处理时间为0、50、70、90、110和130 s,将金属载片置于1 mL的无菌生理盐水中,振荡洗涤。将稀释菌液涂布于YPD培养基,30 ℃培养48 h,致死率按公式(1)计算,绘制致死率曲线,并确定最佳照射时间。
致死率![]()
(1)
1.3.3 高浓度乙醛及乙醇-双硫仑平板筛选
将诱变菌液分别涂布于含有2.0 g/L乙醛和10 g/L乙醇、0.2 mg/L双硫仑的抗性平板,30 ℃培养3~4 d后,挑取生长优势菌株进行液体驯化[12-13]。
1.3.4 高浓度乙醛及乙醇-双硫仑液体驯化
挑取2种抗性平板的生长优势菌株,分别置于含有3.0 g/L乙醛和10 g/L乙醇、2.0 mg/L双硫仑的液体培养基中,30 ℃培养2~3 d。
1.3.5 关键酶活力测定
1.3.5.1 粗酶液的制备
离心收集酵母细胞,用磷酸盐缓冲液(pH 8.0,浓度0.05 mol/L)洗涤重悬,超声破碎细胞(破4 s停5 s,共5 min),离心取上清液,4 ℃储藏备用[14]。
1.3.5.2 酶活力测定
乙醇脱氢酶Ⅰ、Ⅱ和乙醛脱氢酶均选用300 μL的酶活反应体系,分别以乙醇和乙醛为反应底物,添加细胞浸出液,采用单池时间扫描,连续5 min内,记录340 nm波长处吸光度值[15]。340 nm下,吸光度值增加0.001为1个活力单位(U)。酶活性以总活力值表示(U/mg)。
1.3.6 啤酒发酵
菌株变温扩培,静置取酵泥,接种于麦汁(1×106 CFU/mL)。扣上发酵栓,液封。12 ℃静置培养8 d,糖度为4°Bx左右时,前酵结束。4 ℃静置发酵7 d,发酵成熟,后酵结束。
1.3.7 乙醛等主要风味物质的测定
乙醛等啤酒中主要风味物质含量采用顶空气相色谱仪进行测定,选取3-庚酮作为内标[16]。
1.3.8 发酵性能的测定
1.3.8.1 酒精度、原麦汁浓度的测定
依据GB/T 4928—2008《啤酒分析方法》及GB 5009.225—2016《食品安全国家标准 酒中乙醇浓度的测定》,检测啤酒发酵液的酒精度和原麦汁浓度[17]。
1.3.8.2 发酵速度的测定
发酵过程中,定期记录发酵液质量变化,以CO2损失质量比较菌株的发酵速度。菌株变温扩培后置于150 mL麦汁中12 ℃发酵培养,定期摇瓶称重,当失重量差值<0.2 g时,终止发酵[18]。绘制发酵醪质量损失与时间曲线,比较各菌株发酵速度的大小。
1.3.9 生物学特性的测定
1.3.9.1 生长性能的测定
活化菌株,以5%的接种量接于YPD培养基中,220 r/min,30 ℃培养。阶段性取样,波长600 nm处测定其吸光度值[19]。
1.3.9.2 絮凝性的测定
相继以0.01 mol/L的EDTA-Na溶液和无菌水洗涤酵泥,弃去上清液,加入250 μL pH 4.5 HAc-NaAc缓冲溶液,立即在波长660 nm处测定OD1,室温静置30 min,取液面顶端50 μL,于波长660 nm处测定OD2。以pH 4.5的HAc-NaAc缓冲溶液为空白[20],絮凝性按公式(2)计算。
絮凝性![]()
(2)
2 结果与分析
2.1 致死率曲线
为获得最佳的诱变条件,对酵母菌液进行不同时间的诱变处理,致死情况见图1。采用ARTP诱变育种时,若致死率偏低,则无法对酿酒酵母进行有效改良;若致死率偏高,易造成菌株性能的大幅改变,从而影响成品啤酒的主体风味。因此应保持菌株致死率80%~90%,即选择最佳诱变时间为90 s。

图1 不同诱变时间下的酵母致死率
Fig.1 Lethality of Lager yeast strains after ARTP
2.2 初筛
2.2.1 高浓度乙醛平板筛选及液体驯化
吸取50 μL诱变菌液(1×103个/mL)涂布于乙醛质量浓度为2.0 g/L的抗性平板,30 ℃培养72 h。吸取1 mL无菌生理盐水于平板表面,吹洗数次,直至洗去所有生长优势菌株。稀释菌液至OD600为5.0,按1%接种于含有3.0 g/L乙醛的液体培养基中驯化,30 ℃培养48 h,洗涤驯养菌株以进行下一轮诱变。
菌体诱变-平板筛选-液体驯养的流程重复3次,此过程中,不断提高平板及驯养液中的乙醛浓度。一轮初筛平板共获得136株突变菌株,二轮和三轮初筛平板分别获得97、43株突变菌株。将第3轮驯养菌液涂布于高浓度乙醛筛选平板,获得14株突变菌株。
2.2.2 乙醇-双硫仑平板筛选及液体驯化
吸取50 μL诱变菌液(1×103个/mL)涂布于以乙醇为唯一碳源,双硫仑质量浓度为0.2 mg/L的抗性平板,30 ℃培养96 h。吸取1 mL无菌生理盐水于平板表面,吹洗数次,直至洗去所有生长优势菌株。稀释菌液至OD600为5.0,按1%接种于含有10 g/L乙醇、2.0 mg/L双硫仑的液体培养基中驯化,30 ℃培养72 h。洗涤驯养菌株以进行下一轮诱变。
菌体诱变-平板筛选-液体驯养的流程重复3次,此过程中,不断提高平板及驯养液中的双硫仑浓度。最终,一轮初筛平板共获得39株突变菌株,二轮和三轮初筛平板分别获得27、9株突变菌株。将第3轮驯养菌液涂布于乙醇-双硫仑筛选平板,获得6株突变菌株。至此,共获得20株初筛菌株。
表1 不同轮次筛选平板中的突变菌株数
Table 1 The number of mutant strains screened in different rounds of selective plates
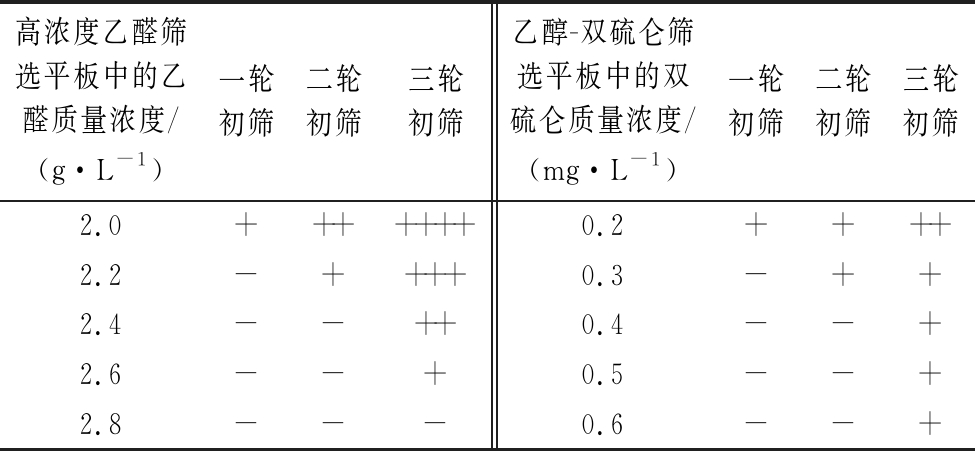
注:菌落数以如下符号表示:++++(≥50)、+++(15~50个)、++(5~15个)、+(0~5个)、-(无)
高浓度乙醛筛选平板中的乙醛质量浓度/(g·L-1)一轮初筛二轮初筛三轮初筛乙醇-双硫仑筛选平板中的双硫仑质量浓度/(mg·L-1)一轮初筛二轮初筛三轮初筛2.0+++++++0.2++++2.2-++++0.3-++2.4--++0.4--+2.6--+0.5--+2.8---0.6--+
2.3 复筛
啤酒发酵过程中,乙醇脱氢酶Ⅰ和乙醛脱氢酶分别促进乙醛转化为乙醇和乙酸,而乙醇脱氢酶Ⅱ主要促进乙醇向乙醛的转化[21]。因此,具有高乙醇脱氢酶Ⅰ、乙醛脱氢酶活性,低乙醇脱氢酶Ⅱ活性是筛选低产乙醛菌株的关键[22]。为此,对初筛所得的20株酵母进行关键酶活的测定。
表2 不同轮次驯养液的菌液吸光值
Table 2 Absorbance in different rounds of domesticating solution
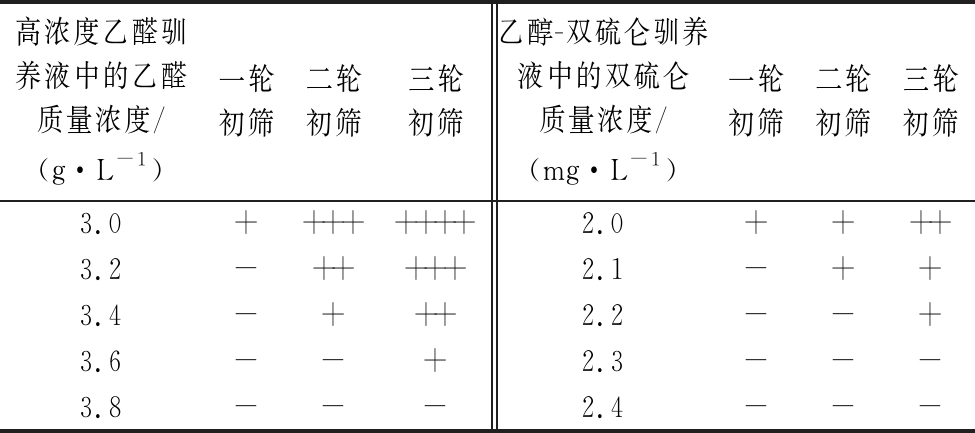
注:菌液吸光值OD600以如下符号表示:++++(≥6.0)、+++(2.0~6.0)、++(0.5~2.0)、+(0~0.5)、-(无)
高浓度乙醛驯养液中的乙醛质量浓度/(g·L-1)一轮初筛二轮初筛三轮初筛乙醇-双硫仑驯养液中的双硫仑质量浓度/(mg·L-1)一轮初筛二轮初筛三轮初筛3.0++++++++2.0++++3.2-+++++2.1-++3.4-+++2.2--+3.6--+2.3---3.8---2.4---
以关键酶活性变化率为筛选指标,由表3可知,初筛菌株的多种关键酶活性正突变率均达70%以上。其中乙醇脱氢酶Ⅰ活性增幅高于50%以上的有3株,分别为Lager-13、Lager-16和Lager-14;乙醇脱氢酶Ⅱ活性降幅高于50%以上的有6株,分别为Lager-1、Lager-12、Lager-5、Lager-16、Lager-19和Lager-13;各菌株乙醛脱氢酶活性增幅普遍不高,仅有Lager-2、Lager-9和Lager-16的增幅高于15%。综合3种关键酶活性变化率,以三者总和为筛选指标,在20株初筛菌株中,选择Lager-12、Lager-13和Lager-16作为复筛菌株。
表3 初筛菌株关键酶活性及变化率
Table 3 The activity and rangeability of key enzymes in the strains in preliminary screening
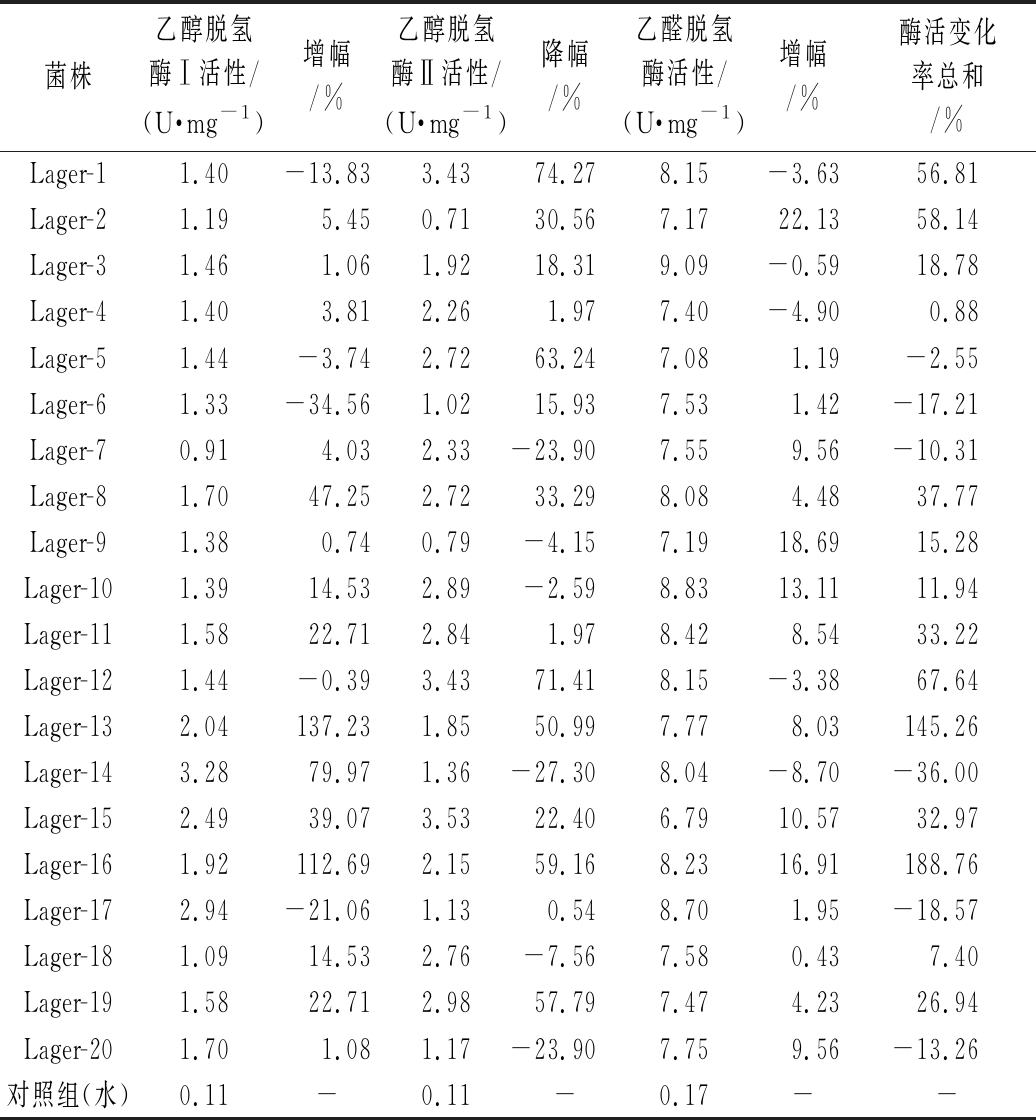
菌株乙醇脱氢酶Ⅰ活性/(U·mg-1)增幅/%乙醇脱氢酶Ⅱ活性/(U·mg-1)降幅/%乙醛脱氢酶活性/(U·mg-1)增幅/%酶活变化率总和/%Lager-11.40-13.833.4374.278.15-3.6356.81Lager-21.195.450.7130.567.1722.1358.14Lager-31.461.061.9218.319.09-0.5918.78Lager-41.403.812.261.977.40-4.900.88Lager-51.44-3.742.7263.247.081.19-2.55Lager-61.33-34.561.0215.937.531.42-17.21Lager-70.914.032.33-23.907.559.56-10.31Lager-81.7047.252.7233.298.084.4837.77Lager-91.380.740.79-4.157.1918.6915.28Lager-101.3914.532.89-2.598.8313.1111.94Lager-111.5822.712.841.978.428.5433.22Lager-121.44-0.393.4371.418.15-3.3867.64Lager-132.04137.231.8550.997.778.03145.26Lager-143.2879.971.36-27.308.04-8.70-36.00Lager-152.4939.073.5322.406.7910.5732.97Lager-161.92112.692.1559.168.2316.91188.76Lager-172.94-21.061.130.548.701.95-18.57Lager-181.0914.532.76-7.567.580.437.40Lager-191.5822.712.9857.797.474.2326.94Lager-201.701.081.17-23.907.759.56-13.26对照组(水)0.11-0.11-0.17--
2.4 发酵验证
2.4.1 乙醛等主要风味物质的测定
乙醛作为啤酒中含量最高的挥发性羰基化合物,直接影响了啤酒风味的协调和稳定性。由表4可知,突变菌株的啤酒发酵液中乙醛含量均显著低于出发菌株。其中,Lager-16和Lager-13的乙醛含量降幅较大,分别为61.63%和61.14%;Lager-12的乙醛含量降幅为55.95%。
表4 出发及突变菌株发酵结束时酒样中的主要风味物质含量 单位:mg/L
Table 4 The concentration of the main aroma substances in beer at the end of fermentation of initial strains and mutants

菌株乙醛乙酸乙酯乙酸异戊酯正丙醇异丁醇异戊醇Lager43.03±10.59.16±0.880.40±0.0214.15±1.2314.97±0.8957.13±3.89Lager-1218.96±3.778.28±0.400.38±0.0112.78±1.0612.62±0.8248.39±3.56Lager-1316.72±4.808.01±1.360.38±0.0213.43±3.5013.11±2.2949.39±6.68Lager-1616.51±0.259.61±0.850.44±0.0315.97±1.7213.80±1.2361.83±4.51
筛选低产乙醛工业啤酒酵母,不仅要精确监测发酵液中的乙醛含量,也需考察其余主要的风味物质,以满足实际生产的需求。除乙醛含量以外,相对出发菌株,Lager-12和Lager-13发酵结束时风味物质中的总醇、总酯含量均出现10%~15%的下降,与出发菌株的整体风味存在一定差异;而Lager-16发酵结束时总醇、总酯含量虽略有增加,但增幅低于6%,与出发菌株在整体风味上无明显差异。
2.4.2 发酵性能的测定
2.4.2.1 酒精度、原麦汁浓度的测定
酒精度、原麦汁浓度是评价啤酒风味和质量的重要指标。酒精度越高,麦汁利用率越高,酒体口感越醇厚[23]。取适量后酵结束的酒样,测定结果如图2-a所示。突变菌株相较出发菌株的酒精度和原麦汁浓度均偏高,其中Lager-13和Lager-16的酒精度增幅更明显,分别为14.29%和8.57%。此现象与复筛结果一致,突变菌株中的乙醇脱氢酶Ⅰ活性增加、乙醇脱氢酶Ⅱ活性降低,直接导致乙醇积累量升高。
2.4.2.2 发酵速度实验
啤酒酵母的发酵速度与菌种有直接的关系。通常酵母的发酵速度越快,发酵周期越短,啤酒的风味更清爽、品质更稳定[24]。由图2-b可知,发酵前2 d,各菌株的发酵速度逐步提升;2 d后,降糖速度迅速减慢,发酵逐步停止。发酵前4 d,各突变菌株的发酵速度较高;5 d后,出发菌株的发酵速度较高。纵观发酵过程,出发菌株与各突变菌株的发酵时长一致,发酵速度无明显差异。
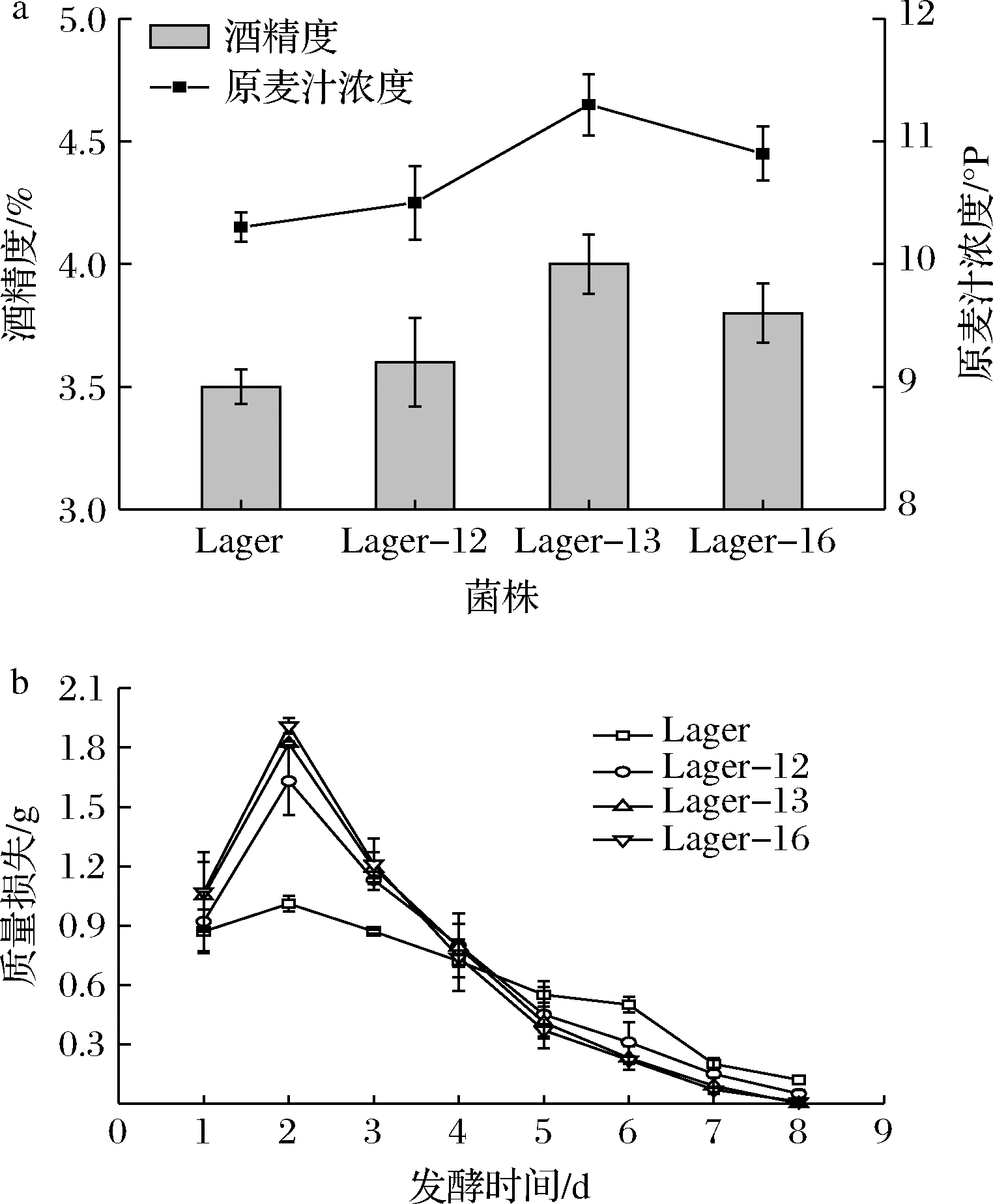
a-酒精度及原麦汁浓度;b-发酵速度
图2 出发及突变菌株的发酵性能
Fig.2 The fermentability of initial strains and mutants
2.4.3 生物学特性的测定
2.4.3.1 生长性能实验
将Lager、Lager-12、Lager-13及Lager-16分别接种于YPD培养基中,于30 ℃,220 r/min条件下培养。发酵前期间隔3 h取样,后期间隔2 h取样,检测其在波长600 nm处的吸光度,结果如图3-a所示。发酵前期各菌株生长性能基本一致,对数中后期各突变菌生长性能较出发菌均有所降低,但彼此间差异不大(≤7.14%)。
2.4.3.2 絮凝性实验
酵母絮凝性在啤酒生产上具有重要意义,其差异会直接影响发酵阶段酵母的回收再利用,进而改变啤酒的风味[22]。因此,对出发菌株及3株突变菌株的絮凝性进行测定。如图3-b所示,突变菌株经多轮诱变、驯养,絮凝性较出发菌株均有小幅提升(≤1.99%),彼此间差异不大。

a-生长曲线;b-絮凝性
图3 出发及突变菌株的生物学特性
Fig.3 The biological characteristics of initial strains and mutants
2.4.4 发酵验证结果
为考察突变株是否具有低产乙醛特性及良好的酿造性能,经啤酒发酵模拟实验,对比了突变菌与出发菌的主要酒体风味、发酵性能和生物学特性。结果表明,3株突变株均表现出良好的低产乙醛性能,其中Lager-16啤酒发酵液中的乙醛含量最低。同时,Lager-16与原始菌株啤酒发酵液中主体风味物质差异更小,酒精度和原麦汁浓度有所提升;发酵速度更快,生长曲线与原始菌株趋势大致相同,絮凝性略有升高(1.30%)。
综上,突变株Lager-16的低产乙醛性能突出,且与出发菌株Lager的主要酒体风味、发酵性能及生物学特性指标存在小范围内的上下波动,无明显差异。因此,选择突变菌株Lager-16作为低产乙醛啤酒工业酵母。
3 结论与讨论
以Lager型啤酒工业酵母菌株为研究对象,采用多轮ARTP诱变育种手段对出发菌株进行改良,利用乙醇-双硫仑抗性平板及高浓度乙醛筛选平板及其驯养液对诱变菌株进行定向筛选及驯化,形成诱变-筛选-驯化的多轮初筛体系,共获得初筛菌株20株;同时以乙醇脱氢酶Ⅰ、Ⅱ和乙醛脱氢酶等关键酶活性变化为低产乙醛酿酒酵母的复筛标准,酶活性正突变率均达70%以上,优选酶活性变化显著的复筛菌株3株;通过实验室摇瓶水平的啤酒模拟酿造体系,验证突变菌株及原始菌株的主要酒体风味、发酵性能和生物学特性是否存在显著差异,最终选择突变菌株Lager-16作为低产乙醛啤酒工业酵母。
通过诱变-筛选-驯化的多轮初筛体系、关键酶活性变化复筛实验和啤酒发酵验证(图4),筛选得到的突变菌株Lager-16发酵成品啤酒中乙醛含量由出发菌株的42.03 mg/L降低至16.51 mg/L,降幅为61.63%。综合菌株生物学特性及各项发酵性能指标,突变株Lager-16满足啤酒酿造要求,具有工业应用前景。

图4 筛选策略流程图
Fig.4 The flow chart of screening strategy
[1] JAEGER S R,WORCH T,PHELPS T,et al.Effects of “craft” vs.“traditional” labels to beer consumers with different flavor preferences:A comprehensive multi-response approach[J].Food Quality and Preference,2021,87:104 043.
[2] KUCHARCZYK K,ZYLA K,TUSZYNSKI T.Simultaneous optimization of acetaldehyde and DMS concentrations for better sensory quality of beer fermented on an industrial scale[J].Foods,2020,9(8):1 043.
[3] SHIN K S,LEE J H.Acetaldehyde contents and quality characteristics of commercial alcoholic beverages[J].Food Science and Biotechnology,2019,28(4):1 027-1 036.
[4] 刘春凤, 赵云,李崎,等.低乙醛Lager型啤酒酵母研究进展[J].菌物学报,2018,37(11):1 411-1 423.
LIU C F,ZHAO Y,LI Q,et al.Research advances in lager brewer’s yeast with low acetaldehyde production[J].Mycosystema,2018,37(11):1 411-1 423.
[5] XU X,NIU C T,LIU C F,et al.Unraveling the mechanisms for low-level acetaldehyde production during alcoholic fermentation in Saccharomyces pastorianus lager yeast[J].Journal of Agricultural and Food Chemistry,2019,67(7):2 020-2 027.
[6] SANCHEZ R G,SOLODOVNIKOVA N,WENDLAND J.Breeding of lager yeast with Saccharomyces cerevisiae improves stress resistance and fermentation performance[J].Yeast,2012,29(8):343-355.
[7] 沈楠. 低产乙醛啤酒酵母的选育[D].无锡:江南大学,2013.
SHEN N.Screening of brewer’s yeast of low acetaldehyde production[D].Wuxi:Jiangnan University,2013.
[8] 张媛媛. 低产乙醛啤酒酵母的选育与研究[D].无锡:江南大学,2011.
ZHANG Y Y.Screening of brewer’s yeast with low acetaldehyde[D].Wuxi:Jiangnan University,2011.
[9] 王君伟. 啤酒酵母乙醛代谢关键酶及低乙醛菌株快速筛选的研究[D].济南:齐鲁工业大学,2016.
WANG J W.Study on the key enzymes of acetaldehyde metabolism of beer yeast and rapid screening of yeast with low acetaldehyde[D].Jinan:Qilu University of Technology,2016.
[10] 曹荣锟, 李佳泰,王金晶,等.大米辅料啤酒中蛋白质疏水性与蛋白质泡沫稳定性的分析[J].食品与发酵工业,2018,44(9):66-70.
CAO R K,LI J T,WANG J J,et al.Hydrophobicity and foaming stability analysis of rice beer protein[J].Food and Fermentation Industries,2018,44(9):66-70.
[11] JIANG G Z,YANG Z M,WANG Y,et al.Enhanced astaxanthin production in yeast via combined mutagenesis and evolution[J].Biochemical Engineering Journal,2020,156:107 519.
[12] 沈楠, 王金晶,刘春凤,等.低产乙醛啤酒酵母的定向驯化筛选[J].食品与发酵工业,2013,39(7):94-97.
SHEN N,WANG J J,LIU C F,et al.Screening of brewer’s yeast with low acetaldehyde by directional domestication[J].Food and Fermentation Industries,2013,39(7):94-97.
[13] 孙传伯, 曹猛,陈存武,等.低产乙醛拉格啤酒酵母的选育[J].皖西学院学报,2020,36(5):64-70.
SUN C B,CAO M,CHEN C W,et al.Screening of lager’s yeast of low acetaldehyde production[J].Journal of West Anhui University,2020,36(5):64-70.
[14] 崔云前, 王君伟,李红,等.啤酒酵母乙醛代谢关键酶相关性研究[J].中国酿造,2016,35(1):29-33.
CUI Y Q,WANG J W,LI H,et al.Correlation of key enzymes of acetaldehyde metabolism in beer yeast[J].China Brewing,2016,35(1):29-33.
[15] SUNG C K,KIM S M,OH C J,et al.Taraxerone enhances alcohol oxidation via increases of alcohol dehyderogenase (ADH) and acetaldehyde dehydrogenase (ALDH) activities and gene expressions[J].Food and Chemical Toxicology,2012,50(7):2 508-2 514.
[16] 郑英训, 郑飞云,朱林江,等.脱胚玉米糁在啤酒酿造中的应用[J].食品与发酵工业,2016,42(10):87-92.
ZHENG Y X,ZHENG F Y,ZHU L J,et al.The application of degermed corn grits as adjunct in beer brewing[J].Food and Fermentation Industries,2016,42(10):87-92.
[17] 朱凤娇, 陈叶福,王希彬,等.上面发酵高粱啤酒的工艺研究[J].现代食品科技,2017,33(9):210-216.
ZHU F J,CHEN Y F,WANG X B,et al.Study on the brewing process of top-fermented sorghum beer[J].Modern Food Science and Technology,2017,33(9):210-216.
[18] SALASPURO M.Local acetaldehyde:Its key role in alcohol-related oropharyngeal cancer[J].Visceral Medicine,2020,36(3):167-173.
[19] VOLCHENKO N N,SAMKOV A A,MALYSHKO V V,et al.Influence of the environmental isotope composition modification on growth and metabolic activity of Rhodococcus and Saccharomyces[J].Biology Bulletin,2020,47(4):339-343.
[20] KREGIEL D,BERLOWSKA J,SZUBZDA B.Novel permittivity test for determination of yeast surface charge and flocculation abilities[J].Journal of Industrial Microbiology & Biotechnology,2012,39(12):1 881-1 886.
[21] XU X,WANG J,BAO M,et al.Reverse metabolic engineering in lager yeast:Impact of the NADH/NAD(+) ratio on acetaldehyde production during the brewing process[J].Applied Microbiology and Biotechnology,2019,103(2):869-880.
[22] STANISLAV K,KABELOVA-FICOVA H,GREGOR T,et al.Preparation of malts for production of special beers[J].Potravinarstvo Slovak Journal of Food Sciences,2017,11(1):441-445.
[23] 王孟祺. 接种量对上面发酵酵母高级醇代谢的影响及机理研究[D].天津:天津科技大学,2019.
WANG M Q.The mechanism of the effect of pitching rate on the metabolism of higher alcohols by top-fermenting yeast[D].Tianjin:Tianjin University of Science & Technology,2019.
[24] PANTELOGLOU A G,SMART K A,COOK D J.Malt-induced premature yeast flocculation:current perspectives[J].Journal of Industrial Microbiology & Biotechnology,2012,39(6):813-822.