龋齿在成人和儿童中是一种常见的慢性口腔疾病,主要表现为口腔细菌利用可发酵碳水化合物产酸导致的牙齿组织的脱钙[1],其中恒牙龋齿最为常见[2]。根据第4次全国3~5岁儿童口腔健康调查,显示龋齿患病率分别为50.8%、63.6%和71.9%[3]。由多种细菌、真菌和这些微生物分泌的黏性高分子聚合物组成的牙菌斑是自然界最复杂的生物膜系统之一,其覆盖于牙齿表面,是导致龋齿发生的主要诱因[4]。
研究表明,变异链球菌(Streptococcus mutans)是一种重要的口腔致龋细菌[5-6]。在蔗糖存在的情况下,S.mutans可以合成一种不溶性胞外多糖,这种不溶性胞外多糖可作为牙菌斑扩展的支持性框架[7-9]。其除了保护所嵌入的微生物细胞外,还被认为具有促进其他微生物黏附于牙釉表面的作用等[10]。
乳杆菌是口腔微生物群的重要组成部分,与个体的口腔健康状况有关[11];它们约占可培养口腔微生物群的1%,从口腔微生物群中分离的最常见的乳杆菌包括干酪乳杆菌、副干酪乳杆菌、植物乳杆菌、鼠李糖乳杆菌、发酵乳杆菌、嗜酸乳杆菌和唾液乳杆菌[12]。与从活动性龋齿个体口腔分离的菌株相比,从无龋齿个体口腔中分离的乳杆菌菌株具有显著抑制S.mutans生长的能力[13-14]。
益生菌被定义为“以活菌形式摄入足够量后,对宿主健康具有明确的促进作用(WHO/FAO,2001)”。将益生菌作为膏剂或漱口液输送到牙齿,可使益生菌集中在牙齿生物膜区域,从而消除或减少致病菌[15]。益生菌改善口腔健康的作用被认为与病原体争夺生态位和营养有关,但大多数菌株的作用机制尚不明确,可能包括生产乳酸、过氧化物、细菌类抗菌物质以及调节宿主的免疫应答等[16]。姚沛琳等[17]从多个样本中分离出97株乳酸菌,研究其对S.mutans生物膜各种结构的变化,最终发现1株韩国魏斯氏菌表现出潜在的预防龋齿的作用。有研究从四川泡菜中分离得到5株具有抑菌作用的植物乳杆菌,并综合选育出植物乳杆菌K41,观察K41与致病菌作用前后生物膜质构以及活菌数的变化,并进行动物实验验证了此菌对龋齿具有预防作用[18]。
在体外试验中,发酵乳杆菌B44 (Limosilactobacillus fermentum CGMCC 17321)、植物乳杆菌ST-III (Lactiplantiacillus plantarum CGMCC 0847)、干酪乳杆菌LC2W (Lacticaseibacillus casei CGMCC 0828)和鼠李糖乳杆菌B6 (Lacticaseibacillus rhamnosus CGMCC 13310)表现出抑制S.mutans生长的能力。本文通过细胞表面特性、自聚及与S.mutans共聚作用、对溶菌酶的耐受性、抑制S.mutans生长和生物膜形成等指标的测试,分析了这4株乳杆菌作为口腔益生菌的潜力。
1 材料与方法
1.1 实验材料
1.1.1 实验菌种及培养基
变异链球菌(Streptococcus mutans CGMCC 12499),中国普通微生物保藏中心;发酵乳杆菌B44 (Limosilactobacillus fermentum CGMCC 17321)、植物乳杆菌ST-III (Lactiplantiacillus plantarum CGMCC 0847)、干酪乳杆菌LC2W (Lacticaseibacillus casei CGMCC 0828)、鼠李糖乳杆菌B6 (Lacticaseibacillus rhamnosus CGMCC 13310),乳业生物技术国家重点实验室提供;保加利亚乳杆菌LB340(Lactobacillus delbrueckii subsp.bulgaricus LB340),丹麦汉森公司;MRS培养基,德国Merck公司;BHI培养基,Oxoid公司。
1.1.2 主要仪器与设备
Spectra M5型酶标仪,美国Molecular Devices公司;SPECORD分光光度计,德国耶拿分析仪器股份公司;Bioscreen C型全自动生长曲线分析仪,芬兰OY Growth Curves公司;BX60荧光显微镜,日本OLYMPUS公司;NOVA NanoSEM 230低真空超高分辨场发射扫描电子显微镜,美国FEI公司。
1.2 实验方法
1.2.1 乳杆菌菌落形态和电镜观察
将L.fermentum B44、L.plantarum ST-III、L.casei LC2W和L.rhamnosus B6分别划线接种于MRS固体培养基上,37 ℃厌氧培养24 h。挑取单菌落,收集菌体,用pH 7.0无菌磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤3次后,再用体积分数为2.5%的戊二醛置于4 ℃固定8 h以上,PBS洗涤3次,随后用体积分数为50%、75%、95%和无水乙醇分级脱水后,进行临界点干燥和扫描电镜的观察[19]。
1.2.2 不同乳杆菌菌体的制备
将新活化的4株乳杆菌和S.mutans CGMCC 12499分别接种于新鲜的MRS和BHI液体培养基中,37 ℃静置培养24 h,在4 ℃、10 000 r/min条件下离心10 min后收集菌体,用无菌PBS洗涤3次,最后将菌体悬浮于少量PBS中,备用。
1.2.3 不同乳杆菌细胞表面疏水性和酸碱电荷的测定
细胞表面疏水性的测定采用SAMOT等[20]的方法,并稍作修改。乳杆菌过夜培养24 h后,于4 ℃、10 000 r/min下离心10 min后收集菌体,将菌体悬浮于pH 7.0的PBS中,在波长600 nm下调节吸光度为(0.6±0.2),记做A0,将1 mL二甲苯加入到上述已经调节过浓度的3 mL菌液中,在室温下预先培养10 min后,振荡2 min,再在室温下孵育20 min后测定水相的OD600,记做A1。按公式(1)计算疏水率(R1):
(1)
式中:R1,疏水率,%;A1,孵育后水相OD600;A0,初始水相OD600。
1.2.4 不同乳杆菌自聚集能力和共聚能力的测定
自聚集试验[18]按照如下方式进行:将制备的乳杆菌悬液用PBS调整初始吸光度A0=0.6±0.02,室温,静置。在随后的8 h内每隔2 h吸取菌悬液上层,测量吸光度At。按公式(2)计算自聚力(R2):
(2)
式中:R2,自聚力,%;At,t时间的吸光度,t 分别为2、4、6和8 h;A0,乳杆菌初始吸光度。
对于共聚试验,将等量的乳杆菌和S.mutans混合,并在随后的8 h内测量上悬浮液的吸光度。按公式(3)计算共聚力(R3):
(3)
式中:R3,共聚力,%;At,t时间的吸光度,t 分别为2、4、6和8 h;A0,乳杆菌初始吸光度;AS0,S.mutans初始吸光度。
1.2.5 不同乳杆菌对溶菌酶的耐受性
参考姚沛琳[17]的方法并稍作修改。分别挑取新鲜平板上的不同乳杆菌置于适量新鲜MRS液体培养基,培养24 h后于4 ℃、10 000 r/min离心10 min,收集菌体重悬于MRS液体培养基,以空白MRS为对照,调节OD600=0.1±0.02,取10 μL菌悬液分别接入100 μL不同质量浓度梯度的溶菌酶溶液(0、0.2、0.4、0.6、0.8、1.0 mg/mL),而后取20 μL处理后的菌悬液接入100孔板,分别加入180 μL空白MRS,37 ℃静置培养24 h,用全自动微生物生长曲线分析仪每隔1 h测定OD600的值,共测24 h。试验进行3次重复,每组设置3个平行组。
1.2.6 不同乳杆菌自身生物膜形成能力的测定
参照 KHAN等[21]的方法进行。将活化好的乳杆菌接种于含有 3 g/L蔗糖的BHI培养基中,37 ℃厌氧培养18 h,用空白的含有3 g/L蔗糖的BHI培养基调整OD600=0.5±0.02,然后取 0.2 mL菌悬液加入到96孔板中。37 ℃培养24 h,弃游离细菌,每孔用 0.2 mL 去离子水轻柔洗涤 3 次;自然干燥后每孔加入0.05 mL 10 g/L 的结晶紫溶液,室温下染色 15 min,使黏附的细菌着色;倾去染色液后,用去离子水洗涤3次以上;干燥后每孔加入0.2 mL 乙醇/丙酮混合液,使孔内的结晶紫充分溶解,酶标仪600 nm波长处测定吸光度。以相同条件下S.mutans 生物膜形成能力为对照组,各实验组每次做3个以上平行,重复3次。
1.2.7 不同乳杆菌发酵上清液对S.mutans黏附性和生物膜消除作用的测定
乳杆菌无细胞发酵上清液的制备:将新活化的乳杆菌接种至MRS液体培养基中,37 ℃培养24 h,4 ℃、9 000 r/min离心15 min,去菌体。上清液用0.22 μm的膜过滤,获得无细胞发酵上清液,-20 ℃ 贮藏备用。
利用96孔板,每孔加入200 μL S.mutans的菌悬液培养24 h后,弃除培养液,用PBS洗涤2次,去除孔内残留培养液后每孔加入200 μL乳杆菌无细胞发酵上清液,其中每种上清液做3组平行,并以等量无菌MRS作对照,然后将96孔板放置于37 ℃培养24 h,采用结晶紫染色的方法测定乳杆菌无细胞发酵上清液对S.mutans生物膜的消除作用[22]。
在测定乳杆菌无细胞发酵上清液对S.mutans黏附作用时,在96孔培养板中每孔加入S.mutans菌悬液和乳杆菌无细胞发酵上清液各100 μL,37 ℃培养24 h,利用结晶紫染色法测定S.mutans黏附性的变化。
1.2.8 不同乳杆菌发酵上清液对S.mutans生长的影响
按照姚沛琳等[17]的实验方法并稍作修改。将S.mutans接种于BHI液体培养基,厌氧培养18 h,用空白BHI调节OD600=0.5±0.02,取0.5 mL S.mutans菌悬液和等量的乳杆菌无细胞发酵上清液加入到1.5 mL新鲜的BHI液体培养基中,37 ℃培养24 h后测定OD600值,对照组以0.5 mL空白MRS培养基代替乳杆菌上清液。
2 结果与分析
2.1 菌落形态和电镜观察结果
L.rhamnosus B6、L.fermentum B44、L.casei LC2W和L.plantarum ST-III在固体MRS培养基上均呈现白色、圆形的菌落形态,表面湿润光滑,边缘规则,无色素产生。其中L.fermentum B44菌落较大且黏度强,结果见图1。扫描电镜观察结果显示,4株乳杆菌都呈现规则的杆状结构,菌体表面光滑,边缘清晰。但4株乳杆菌的粗细、长短略有区别,相比于其他3株菌,L.plantarum ST-III呈现短而粗的杆状形态(图2)。

图1 四株乳杆菌的菌落形态
Fig.1 Colony morphology of four strains of Lactobacillus spp.on MRS agar

图2 四株乳杆菌的菌体形态
Fig.2 The cell morphology of four Lactobacillus strains under scanning electronic microscope
2.2 不同乳杆菌表面疏水性和酸碱电荷的测定
菌体表面疏水性和酸碱电荷跟菌株和宿主之间的非特异性黏附相关。当菌体表面具有较低的酸电荷和较高的碱电荷时不会促进生物膜的形成,而菌株的表面疏水性越高,更加有助于对上皮细胞的黏附[23]。如表1所示,以L.delbrueckii 340为对照,B44、LC2W和ST-III 这3株乳杆菌疏水性显著高于L.delbrueckii 340,表明其在口腔内的黏附能力强。B6、B44、LC2W、ST-III 4株乳杆菌表面疏水性依次递增,而它们的自聚集能力呈现出依次递增趋势,两者间呈正相关(图3)。有研究表明,月见草种子提取物在体外可降低S.mutans表面疏水性抑制其黏附,并降低该菌在动物模型中的致龋性[24]。在徐显睿等[25]的研究中,分别以氯仿和乙酸乙酯作为路易斯酸和路易斯碱,测得鼠李糖乳杆菌LGG的静电作用≥11.06%,表面疏水性在40%左右。在本实验中,4株乳杆菌静电作用高于鼠李糖乳杆菌LGG(表1),而静电作用与对S.mutans黏附性的影响之间具有一定的相关性,菌株酸碱电荷越高,对S.mutans的黏附性的抑制作用越强(图7-b)。
表1 待测菌株表面疏水性和酸碱电荷的测定
Table 1 Surface hydrophobicity,acid and alkali charge of tested strains
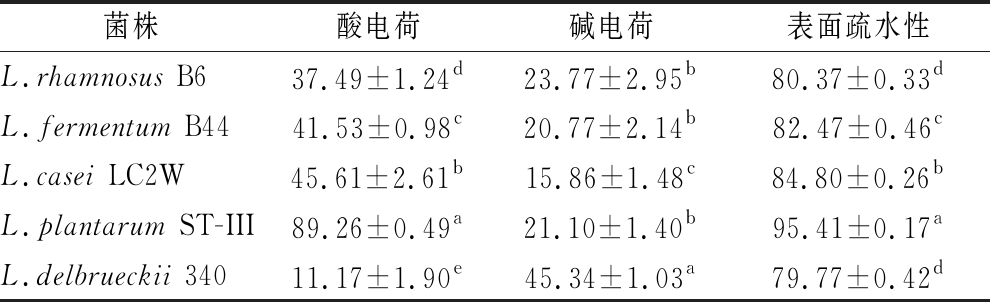
注:同一行不同字母代表差异显著(P<0.05)
菌株酸电荷碱电荷表面疏水性L.rhamnosus B637.49±1.24d23.77±2.95b80.37±0.33dL.fermentum B4441.53±0.98c20.77±2.14b82.47±0.46cL.casei LC2W45.61±2.61b15.86±1.48c84.80±0.26bL.plantarum ST-III89.26±0.49a21.10±1.40b95.41±0.17aL.delbrueckii 34011.17±1.90e45.34±1.03a79.77±0.42d

图3 不同乳杆菌在2、4、6、8 h的自聚集能力
Fig.3 The self-aggregation of different Lactobacillus strains after 2,4,6 and 8 h incubation
2.3 不同乳杆菌自聚集能力和共聚集能力的测定
益生菌的自聚集能力与其黏附宿主细胞的能力有一定的关系,菌体自聚集能力越强,其在口腔内定殖能力越好,对其在口腔内的存活起到重要作用,并且较高的自聚集能力,可以提高口腔环境内的益生菌浓度,使其发挥更好的功能[26]。但也有研究表明,高聚集能力也是一些口腔内致病菌引起口腔疾病的重要因素[27]。乳杆菌在与致病菌S.mutans共孵育过程中,如果共聚集能力强,可以随着唾液流动和口腔清洁等行为,减少口腔内致病菌的数量,进而达到减少致病菌在口腔内荷载的效果。如图3和图4所示,在4个不同的时间段内,不同乳杆菌之间的自聚集能力和共聚能力均存在显著性差异(P<0.05),同时4株乳杆菌的自聚集能力和共聚能力对孵育时间呈现依赖性关系,随着孵育时间的延长,不同乳杆菌的聚集力越强。L.rhamnosus B6初期自聚集能力较弱,而其在6~8 h间共聚集能力显著提高,说明菌株与致病菌S.mutans的交互凝集作用增强,此结果与张秋香等[28]的实验结果相符。综合而言,4株乳杆菌在测试时间内,都具有较好的自聚集和共聚集能力。

图4 不同乳杆菌与S.mutans的共聚能力
Fig.4 Coaggregation of Lactobacillus strains with S.mutans after 2,4,6 and 8 h coincubation
2.4 不同乳杆菌对溶菌酶的耐受性
口腔唾液中含有丰富的溶菌酶,质量浓度为20~80 μg/mL[29],可有效杀死一些革兰氏阳性菌。乳杆菌对溶菌酶的耐受性是衡量其能否在口腔内存活的重要因素。在不同浓度溶菌酶中孵育24 h后,尽管4株乳杆菌悬浮液的OD600值随着溶菌酶浓度的增大出现轻微的波动,但并未出现明显降低(图5)。被测试的4株乳杆菌均能耐受质量浓度为1 mg/mL的溶菌酶,远高于人类口腔中溶菌酶的质量浓度(1~57 μg/mL)[27],因而这些菌株具备在口腔中存活的能力。

图5 不同乳杆菌对溶菌酶的耐受性
Fig.5 Tolerance of different Lactobacillus strains to varied levels of lysozyme
2.5 不同乳杆菌自身生物膜形成能力的测定
有研究表明,除了S.mutans菌外,部分乳杆菌和双歧杆菌也可能与早期龋齿的发展有关联[30]。因此,作为潜在的口腔益生菌,其自身形成生物膜的能力也是一种重要的衡量指标。为避免对口腔内生物膜的形成起促进作用,要求其自身生物膜形成能力较弱。4株乳杆菌形成生物膜的能力远远低于S.mutans(P<0.05),该结果与张秋香等[28]的结果相似,而L.bulgaricus 340与这4株乳杆菌相比,自身生物膜形成能力相对较高(图6)。
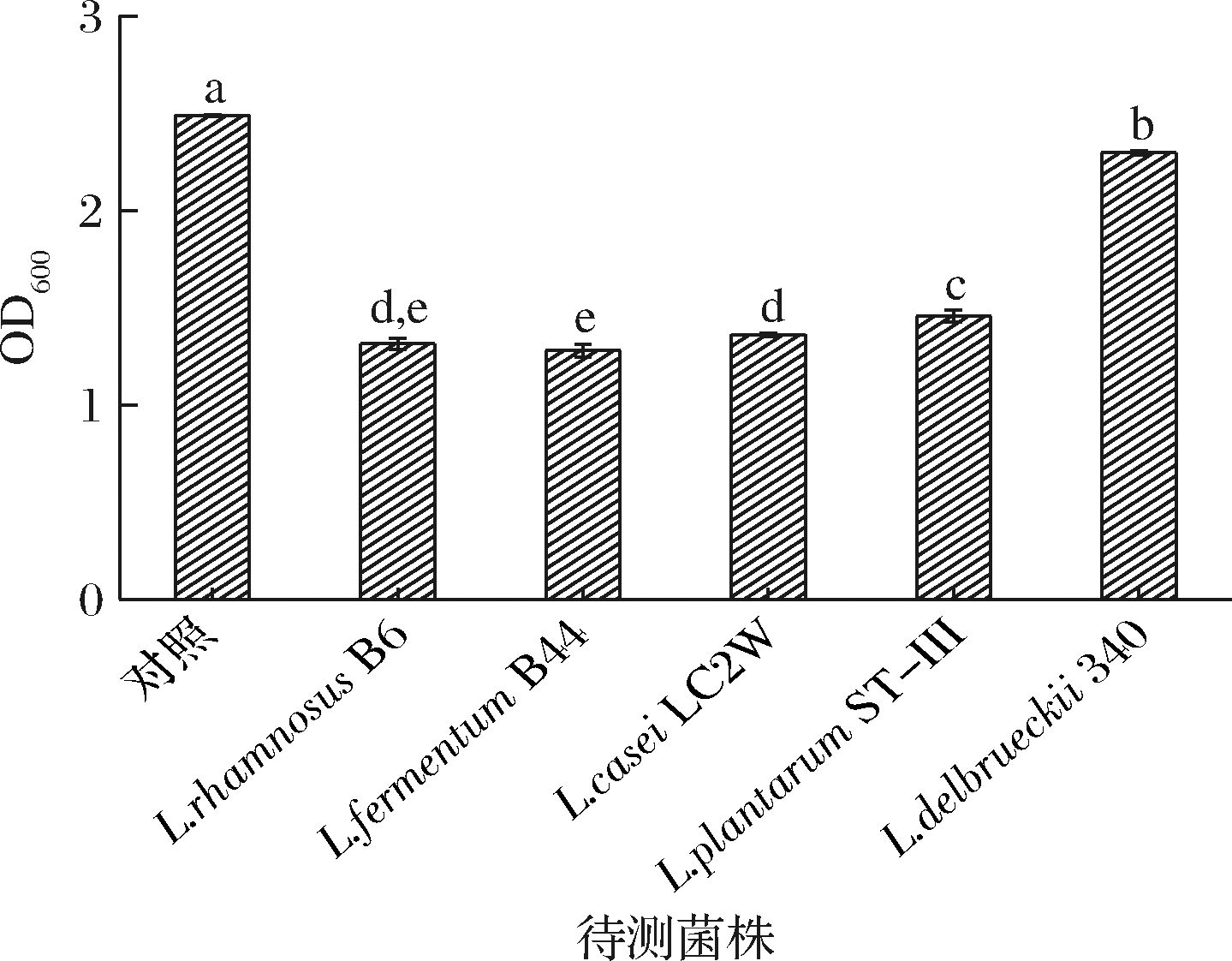
图6 不同乳杆菌形成生物膜的能力
Fig.6 Biofilm forming ability of different Lactobacillus strains
2.6 不同乳杆菌对S.mutans生物膜的消除作用和黏附性的影响
口腔内的S.mutans是导致龋齿发生的主要致病菌[7],该菌具有较强的耐酸性,并且能够利用蔗糖合成不溶性胞外多糖,进而促进口腔内其他菌群在牙齿表面聚集,形成牙菌斑生物膜,导致龋齿。因而,消除S.mutans已形成的生物膜,可以起到一定的治疗龋齿的作用。与空白MRS相比,4株乳杆菌的无细胞发酵上清液对S.mutans生物膜均具有显著的消除作用(P<0.01),消除率分别为31.04%、53.82%、54.28%和31.69%。但L.delbrueckii 340这株菌与4株菌相比,其无细胞发酵上清液对S.mutans生物膜的消除作用明显减弱(P<0.01)(图7-a)。同时,除L.delbrueckii 340之外,其他4株乳杆菌的无细胞发酵上清液都可以显著降低S.mutans对固型介质的不同乳杆菌黏附作用(图7-b)。
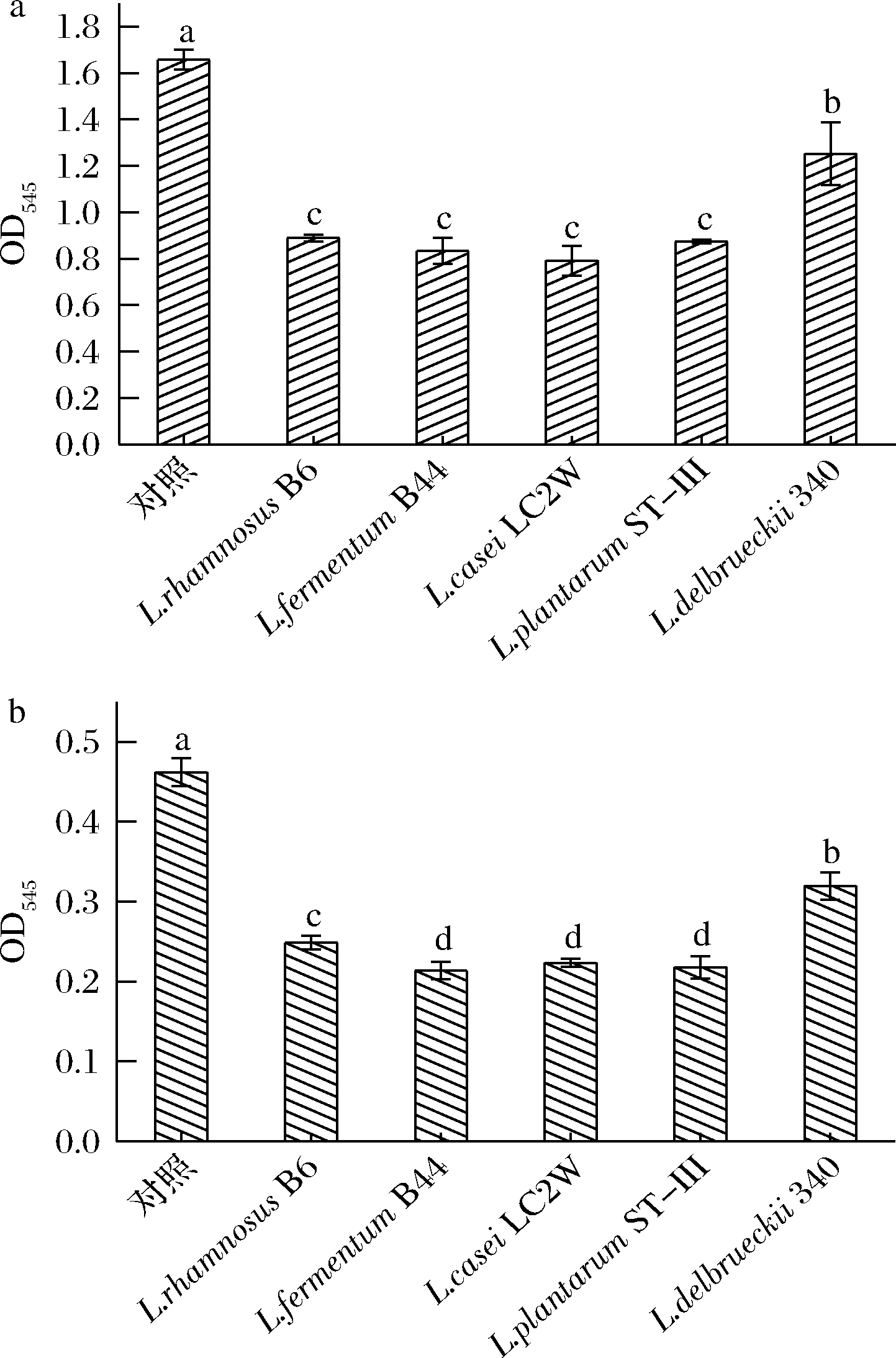
a-对生物膜的消除作用;b-对黏附性的影响
图7 不同乳杆菌对S.mutans生物膜的消除作用及黏附性的影响
Fig.7 Effects of cell free consumed MRS broth of different Lactobacillus strains on formed biofilm and adhesion of S.mutans
2.7 不同乳杆菌发酵上清液对S.mutans生长的影响
S.mutans与不同乳杆菌发酵上清液混合培养后,与对照组(空白MRS)相比,除了L.delbrueckii 340,其他4株乳杆菌都对S.mutans的生长有显著抑制作用(P<0.01)。L.rhamnosus B6、L.fermentum B44、L.casei LC2W和L.plantarum ST-III对S.mutans生长的抑制率分别高达57.42%、37.57%、49.72%和61.92% (图8)。而L.rhamnosus B6、L.fermentum B44、L.casei LC2W、L.plantarum ST-III和L.delbrueckii 340上清液与S.mutans混合培养后pH无明显差异,推测除了有机酸的影响外,还有其他因素对S.mutans的生长产生了显著影响。

图8 不同乳杆菌上清液对S.mutans生长的影响
Fig.8 Inhibition of cell free consumed MRS broth of different Lactobacillus strains on the growth of S.mutans
3 结论
在体外试验中,4株乳杆菌细胞都具备较好的疏水性和静电作用,这有利于其在口腔内的黏附;能够耐受高浓度的溶菌酶,具备在口腔环境中存活的能力;其次,它们表现出较强的自聚及与S.mutans共聚能力,有助于其在口腔的停留及减少口腔内致病菌的荷载。更重要的是,这4株乳杆菌可以抑制S.mutans的生长,其代谢产物可有效降低S.mutans的黏附性且对其形成的生物膜具有一定的消除作用,同时,自身生物膜形成能力较弱。因而,4株乳杆菌具备作为口腔益生菌的潜力。
[1] AYTAC BAL F,OZKOCAK I,CADIRCI B H,et al.Effects of photodynamic therapy with indocyanine green on Streptococcus mutans biofilm[J].Photodiagnosis and Photodynamic Therapy,2019,26:229-234.
[2] KASSEBAUM N J,BERNABÉ E,DAHIYA M,et al.Global burden of untreated caries:A systematic review and metaregression[J].Journal of Dental Research,2015,94(5):650-658.
[3] DU M Q,LI Z,JIANG H,et al.Dental caries status and its associated factors among 3-to 5-year-old children in china:A national survey[J].Chinese Journal of Dental Research,2018,21(3):167-179.
[4] XIAO J,KLEIN M I,FALSETTA M L,et al.The exopolysaccharide matrix modulates the interaction between 3D architecture and virulence of a mixed-species oral biofilm[J].PLoS Pathogens,2012,8(4):e1002623.
[5] YUE J X,YANG H Y,LIU S Y,et al.Influence of naringenin on the biofilm formation of Streptococcus mutans[J].Journal of Dentistry,2018,76:24-31.
[6] HE J Z,WANG S D,WU T X,et al.Effects of ginkgoneolic acid on the growth,acidogenicity,adherence,and biofilm of Streptococcus mutans in vitro[J].Folia Microbiologica,2013,58(2):147-153.
[7] KULSHRESTHA S,KHAN S,HASAN S,et al.Calcium fluoride nanoparticles induced suppression of Streptococcus mutans biofilm:An in vitro and in vivo approach[J].Applied Microbiology and Biotechnology,2016,100(4):1 901-1 914.
[8] KOO H,DUARTE S,MURATA R M,et al.Influence of cranberry proanthocyanidins on formation of biofilms by Streptococcus mutans on saliva-coated apatitic surface and on dental caries development in vivo[J].Caries Research,2010,44(2):116-126.
[9] KIM D,HWANG G,LIU Y,et al.Cranberry flavonoids modulate cariogenic properties of mixed-species biofilm through exopolysaccharides-matrix disruption[J].PLoS One,2015,10(12).DOI:10.1371/journal.pone.0145844.
[10] ANDRÉ C B,ROSALEN P ![]() L C D C,et al.Modulation of Streptococcus mutans virulence by dental adhesives containing anti-caries agents[J].Dental Materials,2017,33(10):1 084-1 092.
L C D C,et al.Modulation of Streptococcus mutans virulence by dental adhesives containing anti-caries agents[J].Dental Materials,2017,33(10):1 084-1 092.
[11] NATTO Z S,HAMEEDALDAIN A.Methodological quality assessment of meta-analyses and systematic reviews of the relationship between periodontal and systemic diseases[J].Journal of Evidence Based Dental Practice,2019,19(2):131-139.
[12] JAKUBOVICS N S.Oral microbiology.Encyclopedia of Microbiology (Fourth Edition)[M].Oxford:Academic Press.2019.
[13] TEANPAISAN R,PIWAT S,TIANVIWAT S,et al.Effect of long-term consumption of Lactobacillus paracasei SD1 on reducing mutans streptococci and caries risk:A randomized placebo-controlled trial[J].Dentistry Journal,2015,3(2):43-54.
[14] SIDHU G K,MANTHA S,MURTHI S,et al.Evaluation of Lactobacillus and Streptococcus mutans by addition of probiotics in the form of curd in the diet[J].Journal of International Oral Health,2015,7(7):85-89.
[15] FERNANDES T,BHAVSAR C,SAWARKAR S,et al.Current and novel approaches for control of dental biofilm[J].International Journal of Pharmaceutics,2018,536(1):199-210.
[16] COMPARE D,ROCCO A,COCCOLI P,et al.Lactobacillus casei DG and its postbiotic reduce the inflammatory mucosal response:An ex-vivo organ culture model of post-infectious irritable bowel syndrome[J].BMC Gastroenterology,2017,17(1):53
[17] 姚沛琳. 乳酸菌抑制变异链球菌生物膜形成的研究[D].无锡:江南大学,2015.
YAO P L.Inhibition of lactic acid bacteria on the biofilm formation of Streptococcus mutans[D].Wuxi:Jiangnan University,2015.
[18] ZHANG G,LU M,LIU R M,et al.Inhibition of Streptococcus mutans biofilm formation and virulence by Lactobacillus plantarum K41 isolated from traditional Sichuan pickles[J].Frontiers in Microbiology,2020,11:774.
[19] WU C C,LIN C T,WU C Y,et al.Inhibitory effect of Lactobacillus salivarius on Streptococcus mutans biofilm formation[J].Molecular Oral Microbiology,2015,30(1):16-26.
[20] SAMOT J,LEBRETON J,BADET C.Adherence capacities of oral Lactobacilli for potential probiotic purposes[J].Anaerobe,2011,17(2):69-72.
[21] KHAN R,ZAKIR M,KHANAM Z,et al.Novel compound from Trachyspermum ammi (Ajowan caraway) seeds with antibiofilm and antiadherence activities against Streptococcus mutans:A potential chemotherapeutic agent against dental caries[J].Journal of Applied Microbiology,2010,109(6):2 151-2 159.
[22] WASFI R,MANSOUR L E,HASHEM A M,et al.Antimicrobial activities against biofilm formed by Proteus mirabilis isolates from wound and urinary tract infections[J].Indian Journal of Medical Microbiology,2012,30(1):76-80.
[23] RIBEIRO S C,O’CONNOR P M,ROSS R P,et al.An anti-listerial Lactococcus lactis strain isolated from Azorean Pico cheese produces lacticin 481[J].International Dairy Journal,2016,63:18-28.
[24] MATSUMOTO-NAKANO M,NAGAYAMA K,KITAGORI H,et al.Inhibitory effects of Oenothera biennis (evening primrose) seed extract on Streptococcus mutans and S.mutans-induced dental caries in rats[J].Caries Research,2011,45(1):56-63.
[25] 徐显睿, 李翠凤,杨洪来,等.具有益生潜力的乳酸杆菌筛选[J].乳业科学与技术,2020,43(2):8-12.
XU X R,LI C F,YANG H L,et al.Screening of Lactobacillus for probiotic potential[J].Journal of Dairy Science and Technology,2020,43(2):8-12.
[26] PERES C M,ALVES M,HERNANDEZ-MENDOZA A,et al.Novel isolates of Lactobacilli from fermented Portuguese olive as potential probiotics[J].LWT-Food Science and Technology,2014,59(1):234-246.
[27] 薛龙, 王立鹤,聂红兵,等.唾液乳酸杆菌w22a和种植体周围炎致病菌体外作用的初步研究[J].口腔医学研究,2016,32(10):1 042-1 046.
XUE L,WANG L H,NIE H B,et al.Antibacterial effects of Lactobacillus salivarius W22a on the periodontal pathogens[J].Journal of Oral Science Research,2016,32(10):1 042-1 046.
[28] 张秋香, 黄银,姚沛琳,等.植物乳杆菌FB-T9抑制变异链球菌及其生物膜形成的研究[J].食品与生物技术学报,2019,38(9):17-26.
ZHANG Q X,HUANG Y,YAO P L,et al.Inhibition of Streptococcus mutans and its biofilm formation by Lactobacillus plantarum FB-T9[J].Journal of Food Science and Biotechnology,2019,38(9):17-26.
[29] SULAIMAN N D,NIKEN A,NUR I J,et al.Isolation and partial purification of lysozyme from saliva of Bali cattle (Bos sondaicus) using an aqueous mixture of polyethylene glycol (PEG) with sodium sulfate[J].African Journal of Biotechnology,2012,11(8):1 977-1 980.
[30] TORLAKOVIC L,KLEPAC-CERAJ V,ØGAARD B,et al.Microbial community succession on developing lesions on human enamel[J].Journal of Oral Microbiology,2012,4(1):16 125.