氧化应激一般是指细胞暴露于高浓度氧分子或氧的化学衍生物而引起的细胞损伤[1]。此时氧自由基通过与蛋白质和脂质以及DNA等生物大分子相互作用,引发DNA片段断裂、蛋白质功能缺陷以及各种毒性物聚集,同时使机体的氧化防御系统出现变化,最终导致如糖尿病、炎症以及癌症等疾病的发生[2-3]。因此,建立氧化应激模型对研究以及筛选抗氧化药物以及功能性食品都至关重要[4-6]。现阶段,利用H2O2建立氧化应激模型最为广泛[7-9]。而偶氮二异丁基二盐酸盐(azodiisobutyl decarbonate,AAPH)是一种小分子偶氮引发剂,也可诱导过氧自由基的生成,进而应用于氧化应激模型的构建[10-11]。
火麻仁是一种优良的膳食性蛋白质来源[12-13],其主要是以麻仁球蛋白和麻仁白蛋白的形式存在。麻仁蛋白中不含有寡聚糖、胰蛋白酶抑制剂等抗营养因子,不会造成蛋白质吸收障碍、反胃等不适症状,因此火麻仁蛋白是良好的易消化蛋白的来源。同时,研究发现火麻仁具有镇痛、抗炎、抗血栓、改善记忆以及抗疲劳等作用,其火麻仁油以及提取物均具有抗氧化和抗衰老的作用[14-17]。因此,利用火麻仁蛋白开发研究食品、药品、保健产品将具有很广阔的发展前景。
本研究为提高火麻仁蛋白的吸收特性以及风味,对火麻仁蛋白进行发酵,之后利用AAPH诱导HepG2细胞氧化应激模型探究发酵火麻仁蛋白粉的抗氧化能力,旨在从细胞活力、细胞形态、抗氧化酶活力以及胞内活性氧(reactive oxygen species,ROS)水平等方面综合评价该物质,从而为火麻仁功能性食品的开发提供理论依据。
1 材料与方法
1.1 材料与试剂
HepG2细胞,中国医学科学院基础医学研究所;火麻仁蛋白粉,辽宁俏牌生物科技有限公司;DMEM(Dulbecco’s modified eagle medium)培养基、磷酸盐缓冲液(phosphate-buffered saline,PBS),中科迈晨科技有限公司;新生牛血清,美国Gibco;AAPH,Sigma公司;Cell Counting Kit-8(CCK-8)试剂盒、2′,7′-二氯二氢荧光素二乙酸酯(2′,7′-dichlorodi-hydrofluorescein diacetate,DCFH-DA)、胰蛋白酶、RIPA裂解液,碧云天生物技术研究所;BCA蛋白浓度测定试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、丙二醛(malondialdehyde,MDA)试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒,南京建成生物工程研究所;TransZol Up裂解液、RNA提取试剂盒,北京全式金生物。
1.2 仪器与设备
生物安全柜,济南鑫贝西生物技术有限公司;CO2培养箱,松下公司;CKX41型倒置生物显微镜,奥林巴斯公司;分析天平,梅特勒-托利多仪器有限公司;Spectra Max酶标仪(i3),MD公司;手持细胞计数器,密理博中国有限公司;实时荧光定量PCR仪,伯乐生命医学产品有限公司。
1.3 实验方法
1.3.1 发酵火麻仁蛋白粉制备工艺[18-19]

得到的发酵火麻仁蛋白粉用于后续实验。
1.3.2 发酵火麻仁蛋白粉蛋白质含量测定
参照GB/T 23530—2009《酵母抽提物》进行测定。
1.3.3 HepG2细胞的体外培养
HepG2为贴壁细胞,可将其培养于含有10%新生牛血清、100 U/mL青霉素和100 U/mL链霉素的DMEM培养基中,于37 ℃、5%CO2的培养箱中温育,取对数期细胞进行实验。
1.3.4 HepG2细胞氧化应激模型构建[20]
1.3.4.1 AAPH的CCK-8细胞毒理学实验
取96孔细胞培养板,每孔加100 μL细胞悬液,细胞浓度为1.5×105个/mL,37 ℃培养24 h后弃去培养液,用PBS清洗1次,每孔加入100、200、400、600、800 μmol/L等5个不同浓度的AAPH 100 μL,以无AAPH的相同培养基孵育细胞为对照,培养24 h后每孔加CCK-8溶液于37 ℃避光孵育2 h,用酶标仪测定吸光度值。
1.3.4.2 氧化应激细胞模型的构建
选取对细胞生长无显著影响的AAPH浓度诱导氧化应激细胞模型,各组细胞加样处理24 h后,小心弃去培养液,用PBS清洗,加入25 μmol/L的DCFH-DA,避光条件下作用30 min,吸出DCFH-DA用PBS清洗,后加入200 μL的PBS。用酶标仪测定细胞在490 nm波长的激发光下荧光物质2′,7′-二氯荧光素(2′,7′-Dichlorofluorescein,DCF)在535 nm波长下的发射光。
1.3.5 发酵火麻仁蛋白粉对HepG2细胞氧化应激损伤的预保护作用
分别选取10、30、50、100、200 μg/mL等5个不同浓度的发酵火麻仁蛋白粉样品研究其对HepG2细胞增殖的影响,实验方法同1.3.4.1。
在建立的氧化应激细胞模型的基础上观察发酵火麻仁蛋白粉对氧化应激损伤细胞产生的预保护作用。
将细胞以2×105个/mL浓度接种于6孔板,待细胞贴壁生长后,用PBS润洗细胞,加入不同的处理液。对照组为无酚红的纯培养基;模型组为添加AAPH组;试验组为将AAPH与发酵火麻仁蛋白粉溶液混合(发酵火麻仁蛋白粉终质量浓度10~30 mg/mL)。细胞上样后37 ℃孵育24 h,测定各组的SOD、ROS、MDA、GSH-Px。SOD、MDA、GSH-Px测定方法按照试剂盒说明书[23-24];ROS测定方法同1.3.4.2。
1.3.6 发酵火麻仁蛋白粉对HepG2细胞抗氧化相关基因的影响
细胞处理过程同1.3.4.2。清洗样品处理后的细胞,每10 cm2生长的培养细胞中加入1 mL的TransZol Up,采用全式金总RNA提取试剂盒提取,得到细胞总RNA后,根据试剂盒配制体系。
基因定量分析采用全式金TransScript Probe One-Step qRT-PCR SuperMix试剂盒。PCR反应条件为:45 ℃ 5 min;94 ℃ 30 s,94 ℃ 5 s;60 ℃ 1 min,循环40次;PCR扩增完毕后,对其进行半定量分析。引物序列见表1。
表1 引物序列
Table 1 Primer sequences

基因上游引物下游引物HO-1CTTGCAGGGACCAGACCTTCCCCCTCTCCACGAACAGTTTNQO1AGGATTCAGGCGTTGGGTCCACGATCAGTGCTCTTCTGCCNrf2CAGTCAGCGACGGAAAGAGTAAGTGACTGAAACGTAGCCGAβ-ActinGCTCTCTTCCAGCCTTCCTTCTTCTGCATCCTGTCAGCAA
采用2-△△CT计算基因表达的相对量,具体如下:
△CT=△CT(目的基因)-△CT(内参基因);
△△CT=△CT(待测样本)-△CT(校准样本);
相对表达量=2-△△CT
1.3.7 统计学处理实验数据
实验均重复3次。采用Origin 8.5统计软件进行分析,结果用![]() 表示并对实验结果进行配对t检验,*表示显著差异(P<0.05)。
表示并对实验结果进行配对t检验,*表示显著差异(P<0.05)。
2 结果与分析
2.1 发酵火麻仁蛋白粉蛋白质含量
根据国标法检测得到发酵火麻仁蛋白粉蛋白质含量为79%。
2.2 HepG2细胞氧化应激模型
2.2.1 AAPH对HepG2细胞增殖的影响
如图1所示,由于AAPH对细胞具有一定的损伤作用,随着AAPH浓度的增加,细胞存活率逐渐下降。当AAPH浓度达到800 μmol/L时显著抑制细胞生长(P<0.05),因此选择AAPH浓度100~600 μmol/L进行后续实验。
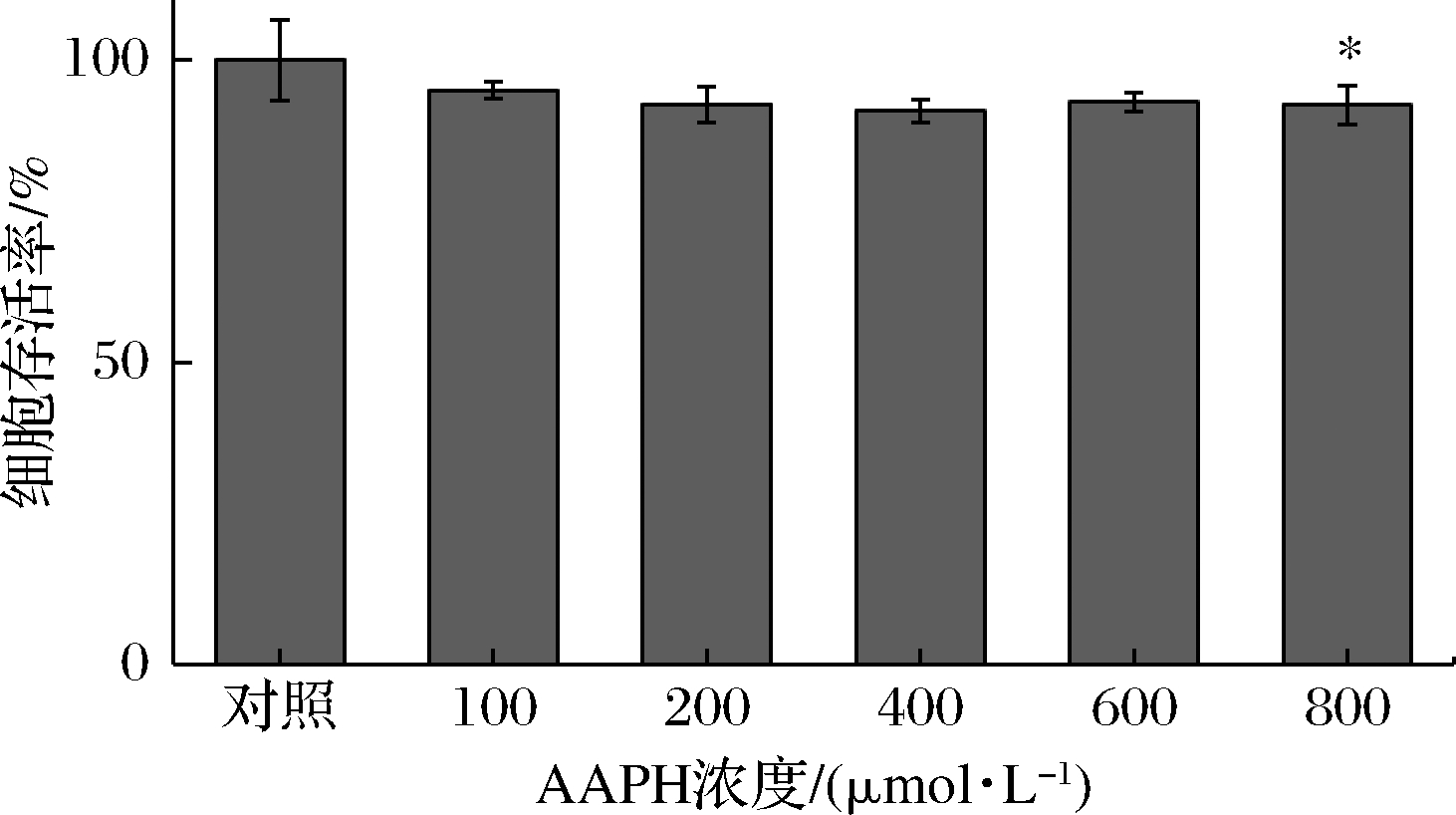
图1 不同AAPH浓度对HepG2细胞活力的影响
Fig.1 Effects of AAPH concentrations on the viability of HepG2 cells
注:*表示相对空白有显著性差异(P<0.05)(下同)
2.2.2 AAPH对HepG2细胞ROS的影响
细胞内过量的ROS会损害细胞,导致细胞内还原氧化稳态的改变,发生氧化应激现象,进而对细胞造成氧化损伤[21-22]。因此,细胞内ROS可以直接反映细胞氧化损伤的程度。各组细胞经过处理后所检测到的细胞内ROS水平如图2所示。处理24 h后,AAPH浓度越高ROS含量也越高,在800 μmol/L时同对照相比,差异显著(P<0.05)。结合AAPH对HepG2细胞增殖的影响,AAPH造模浓度最终选择600 μmol/L。
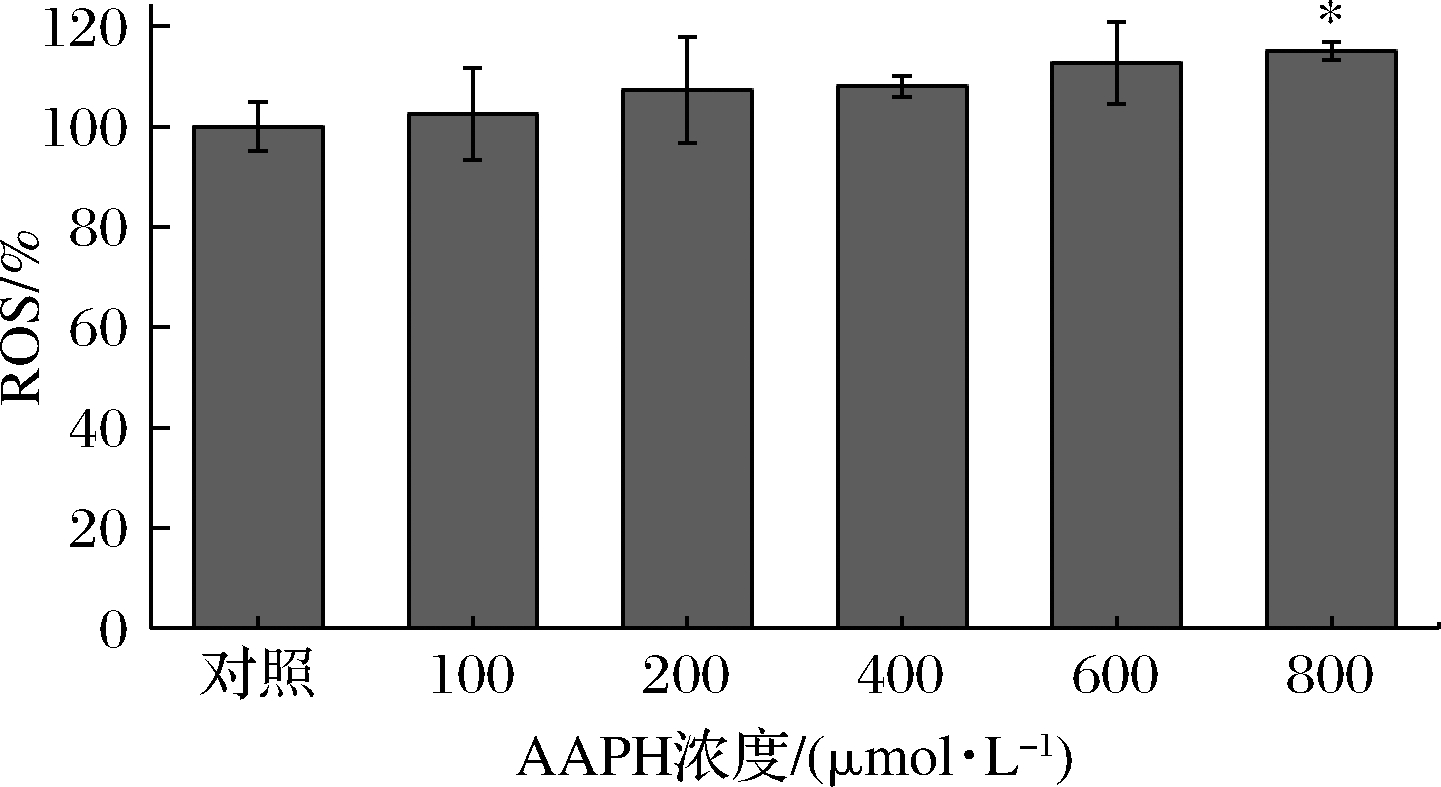
图2 不同AAPH浓度对HepG2细胞内ROS的影响
Fig.2 Effects of AAPH concentration on ROS content in HepG2 cells
2.3 发酵火麻仁蛋白粉对模型细胞抗氧化活性的影响
2.3.1 发酵火麻仁蛋白粉对HepG2细胞增殖的影响
图3为发酵火麻仁蛋白粉对HepG2细胞毒性的影响,在质量浓度为10~30 mg/mL时,发酵火麻仁蛋白均不影响HepG2细胞的活力。因此,可选取10~30 μg/mL中的任意浓度用于后续细胞实验。考虑到发酵火麻仁蛋白粉对氧化应激细胞模型的调节作用可能与剂量有关,因此,后续实验各组均选择低剂量(10 mg/mL)、中剂量(20 mg/mL)和高剂量(30 mg/mL)3种浓度。
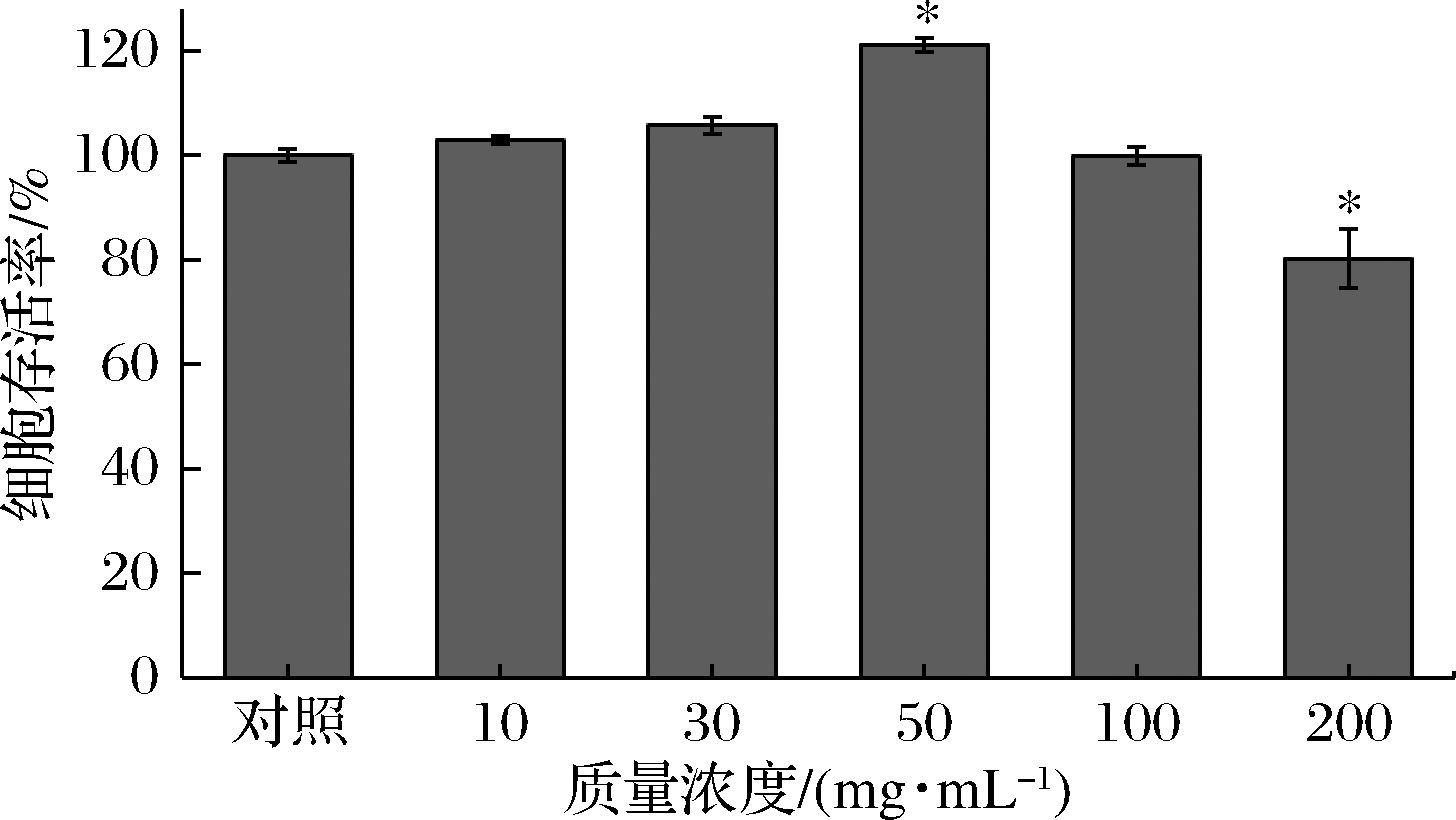
图3 不同浓度发酵火麻仁蛋白粉对HepG2细胞活力的影响
Fig.3 Effects of different concentrations of fermented hemp seed protein powder on the viability of HepG2 cells
2.3.2 发酵火麻仁蛋白粉对HepG2细胞ROS的影响
各组细胞经过处理后所检测到的细胞内ROS水平如图4所示。与对照组相比,模型组胞内荧光值显著升高(P<0.05),约为对照组的1.25倍。说明AAPH可有效提高胞内ROS水平。与模型组相比,发酵火麻仁蛋白粉组细胞内ROS含量显著降低,且随着浓度的增加,细胞内ROS含量也逐渐下降,表明发酵火麻仁蛋白粉能显著降低胞内ROS水平(P<0.05)。
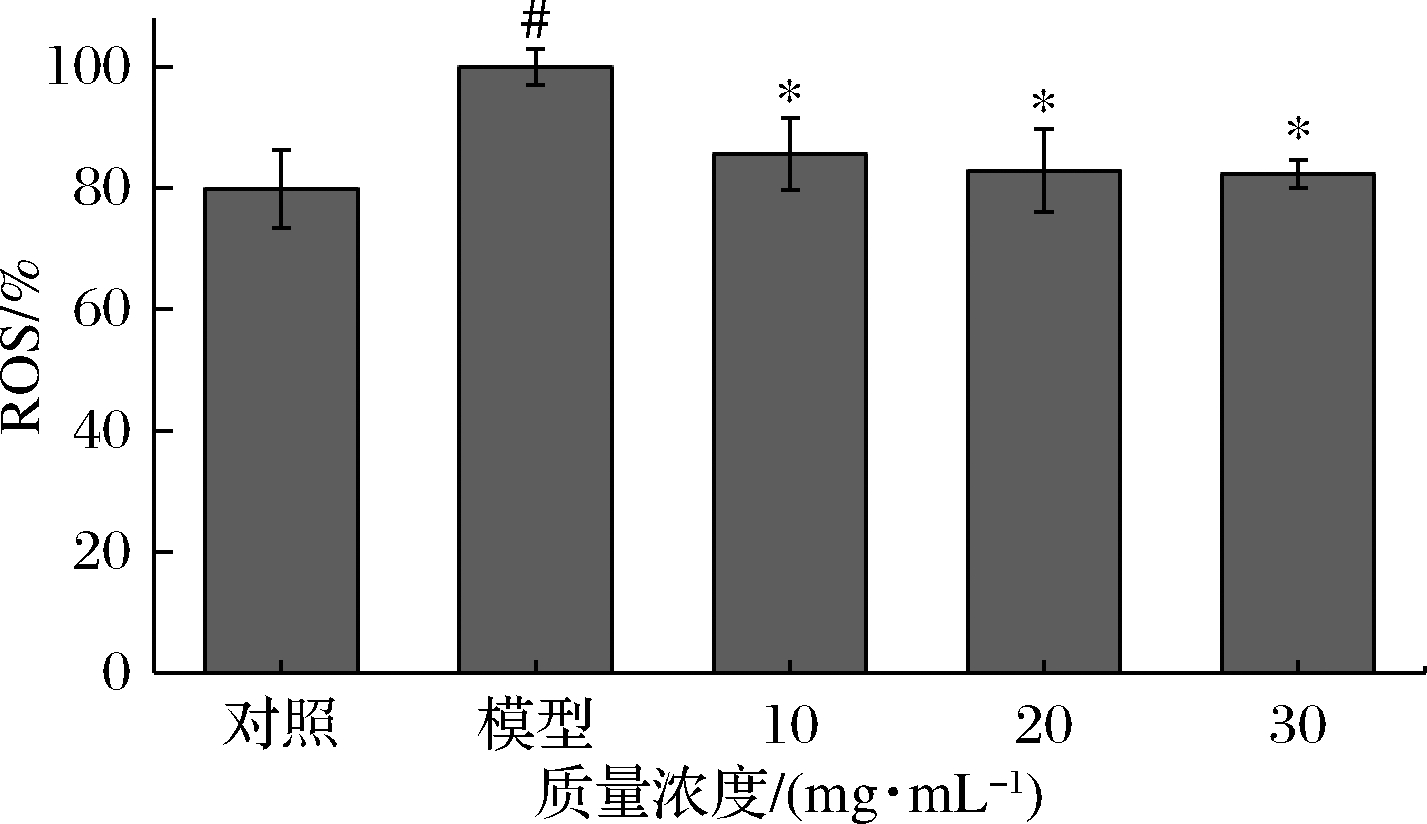
图4 发酵火麻仁蛋白粉对HepG2细胞内ROS的影响
Fig.4 Effects of fermented hemp seed protein powder on ROS content in HepG2 cells
注:#表示相对空白组有显著差异,*表示相对模型组有显著性差异(P<0.05)(下同)
2.3.3 发酵火麻仁蛋白粉对HepG2细胞SOD的影响
SOD是机体抗氧化的主要酶类之一,SOD活力也是判定化合物抗氧化能力的指标之一[23]。由图5可知,HepG2细胞在经AAPH作用后,细胞内SOD活力显著低于对照组(P<0.05)。与模型组细胞相比,发酵火麻仁蛋白粉能够显著提高SOD活力,这说明AAPH的造模液能降低HepG2细胞SOD活力,使细胞清除自由基能力下降,最终导致细胞损伤;而发酵火麻仁蛋白粉能够显著提高模型细胞SOD的活力,对维持机体细胞内的氧化和抗氧化平衡非常重要,可清除氧自由基,减轻组织细胞的过氧化损伤,且数据表明,发酵火麻仁蛋白粉对提高SOD活力具有浓度依赖性。

图5 发酵火麻仁蛋白粉对HepG2细胞内SOD的影响
Fig.5 Effects of fermented hemp seed protein powder on SOD content in HepG2 cells
2.3.4 发酵火麻仁蛋白粉对HepG2细胞MDA的影响
当机体受到有害刺激或抵御恶劣环境时所产生的ROS攻击细胞膜上的不饱和脂肪酸,从而破坏细胞膜结构的完整性。因而,细胞内MDA含量可反映机体内脂质过氧化的程度,进而间接反映细胞氧化损伤程度[24],发酵火麻仁蛋白粉对模型细胞中MDA含量的影响如图6所示。与对照组相比,模型组细胞内MDA的含量显著升高(P<0.05),表明模型组细胞产生大量的MDA。与模型组相比,样品组细胞内MDA的含量显著下降,说明发酵火麻仁蛋白粉能够保护细胞抵御氧化损伤。

图6 发酵火麻仁蛋白粉对HepG2细胞内MDA的影响
Fig.6 Effects of fermented hemp seed protein powder on MDA content in HepG2 cells
2.3.5 发酵火麻仁蛋白粉对HepG2细胞GSH-Px的影响
GSH-Px活力能间接反映机体的氧化应激水平,同时也可以判断化合物的抗氧化能力。发酵火麻仁蛋白粉对氧化应激HepG2细胞中GSH-Px活力的影响如图7所示。与对照组相比,模型组细胞内GSH-Px的活力显著下降(P<0.05),说明AAPH降低细胞内GSH-Px活力,致使细胞的抗氧化能力下降,甚至导致细胞氧化损伤。样品组在质量浓度为20和30 mg/mL时细胞内GSH-Px活力显著高于模型组,说明发酵火麻仁蛋白粉能够通过提高GSH-Px活力保护HepG2细胞抵御氧化损伤。
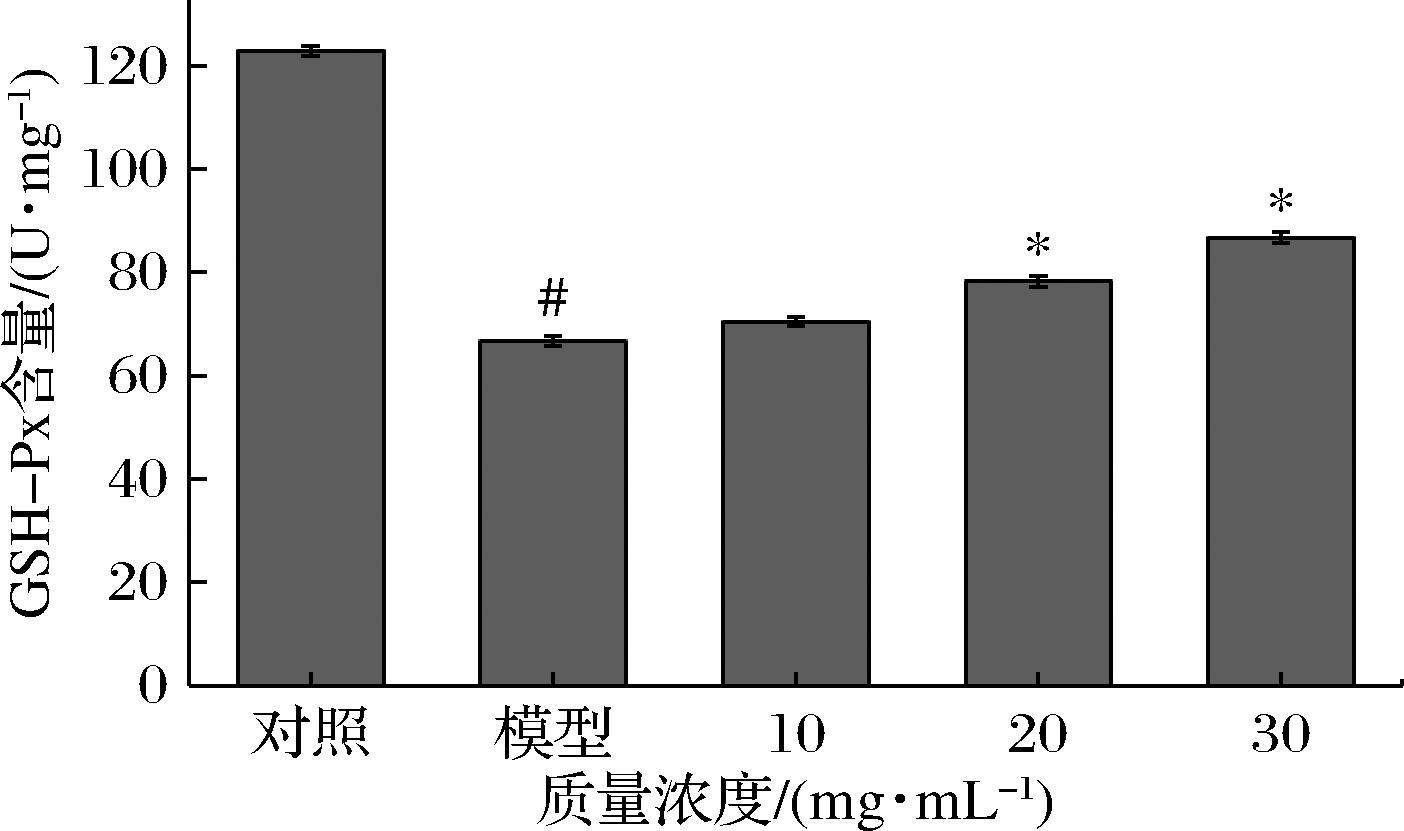
图7 不同浓度发酵火麻仁蛋白粉对HepG2细胞内GSH-Px的影响
Fig.7 Effects of fermented hemp seed protein powder on GSH-Px content in HepG2 cells
2.4 氧化应激相关mRNA的表达情况
研究表明,机体内氧化还原水平失衡是众多疾病的病理生理基础,因此内源性抗氧化信号通路Keap1-Nrf2在研究机体应对各种外来损伤的防御中起着非常重要的作用[25-26]。Nrf2是一种重要的转录因子,通过与ARE结合调节多种抗氧化基因的表达,抵抗氧化应激从而对细胞起到保护作用。Nrf2-ARE通路的下游抗氧化酶包括HO-1、NQO1等,动物及体外细胞实验均证实,提高Nrf2-ARE通路活性,增加HO-1的表达,可清除氧化物质,对抗氧化应激引起的细胞损伤[27]。图8为发酵火麻仁蛋白粉对HepG2细胞中Nrf2、HO-1以及NQO1的mRNA表达量的影响。与正常组相比,模型组的Nrf2、HO-1以及NQO1的mRNA均显著降低,样品组剂量依赖性显著增高Nrf2、HO-1以及NQO1的mRNA表达量,说明发酵火麻仁蛋白粉能够激活Nrf2通路达到抗氧化效果。

图8 发酵火麻仁蛋白粉对HepG2细胞中Nrf2,HO-1以及NQO1 mRNA表达量的影响
Fig.8 Effect of fermented hemp seed protein powder on the expression of Nrf2,HO-1 and NQO1 mRNA in HepG2 cells
3 结论
本研究在利用AAPH诱导的HepG2细胞损伤模型中证实,发酵火麻仁蛋白粉能够通过增加SOD、GSH-Px的活力,降低胞内ROS、MDA水平进而改善细胞氧化应激状态,且与发酵火麻仁蛋白粉浓度呈现出很好的相关性,具有很强的抗氧化作用。实验进一步研究了发酵火麻仁蛋白粉抗氧化酶基因的表达,证明了发酵火麻仁蛋白粉能够激活Nrf2通路进而减轻AAPH诱导的HepG2氧化应激损伤作用。
本研究在细胞层次对发酵火麻仁蛋白粉进行探究,证实了其是一种优良的抗氧化物质,为研究预防与抗氧化相关疾病的功能性食品提供理论基础,同时也为火麻仁蛋白的开发利用奠定了实验基础。
[1] MITTLER R.Oxidative stress,antioxidants and stress tolerance[J].Trends in Plant Science,2002,7(9):405-410.
[2] SITI H,KAMISAH Y,KAMSIAH J.The role of oxidative stress,antioxidants and vascular inflammation in cardiovascular disease:A review[J].Vascular Pharmacology,2015,71:40-56.
[3] ZHU X W,RAINA A K,LEE H G,et al.Oxidative stress signalling in Alzheimer’s disease[J].Brain Research,2004,1000(1-2):32-39.
[4] MEHTA J,RAYALAM S,WANG X Y,et al.Cytoprotective effects of natural compounds against oxidative stress[J].Antioxidants,2018,7(10):147
[5] MITTLER R.Oxidative stress,antioxidants and stress tolerance[J].Trends in Plant Science,2002,7(9):405-410.
[6] 徐清萍, 钟桂芳,孟君.抗氧化剂抗氧化方法研究进展[J].食品工程,2007(2):23-25.
XU Q P,ZHONG G F,MENG J.Research progress on evaluation method of antioxidants[J].Food Engineering,2007(2):23-25.
[7] HE Y,BU L J,XIE H P,et al.Antioxidant activities and protective effects of duck embryo peptides against H2O2-induced oxidative damage in HepG2 cells[J].Poultry Science,2019,98(12):7 118-7 128.
[8] ZHUANG Y L,MA Q Y,GUO Y,et al.Protective effects of rambutan (Nephelium lappaceum) peel phenolics on H2O2-induced oxidative damages in HepG2 cells and d-galactose-induced aging mice[J].Food and Chemical Toxicology,2017,108:554-562.
[9] WANG H L,LIU J,LIU X Y,et al.Protective effects of blueberry against hydrogen peroxide-induced oxidative stress in HEPG2 cells[J].British Food Journal,2019,121(11):2 809-2 820.
[10] ZHANG H J,WANG J,LIU Y L,et al.Wheat bran feruloyl oligosaccharides ameliorate AAPH-induced oxidative stress in HepG2 cells via Nrf2 signalling[J].Journal of Functional Foods,2016,25:333-340.
[11] YAO Y J,WANG H L,XU F R,et al.Insoluble-bound polyphenols of adlay seed ameliorate H2O2-induced oxidative stress in HepG2 cells via Nrf2 signalling[J].Food Chemistry,2020,325:126 865.
[12] 田兆飞, 刘诗涵,李立佳,等.火麻仁及其制品研究进展[J].农业科技与装备,2017(12):53-54.
TIAN Z F,LIU S H,LI L J,et al.Research progress on hemp seed and its products[J].Agricultural Science & Technology and Equipment,2017(12):53-54.
[13] 林金莺. 火麻仁蛋白水解及其抗氧化肽的研究[D].广州:华南理工大学,2010.
LIN J Y.The research on protein hydrolysis and the antioxidative peptide derived from hempseed (Cannabis sativa L.)[D].Guangzhou: South China University of Technology,2010.
[14] 韦凤, 涂冬萍,王柳萍.火麻仁食用开发和药理作用研究进展[J].中国老年学杂志,2015,35(12):3 486-3 488.
WEI F,TU D P,WANG L P.Progress in edible development and pharmacological action of hempseed[J].Chinese Journal of Gerontology,2015,35(12):3 486-3 488.
[15] 沈峰, 尤华智,聂国荣.火麻仁蛋白对荷瘤小鼠免疫调节功能的影响[J].广州医药,2013,44(6):40-41.
SHEN F,YOU H Z,NIE G R.Effect of hempseed protein on immune regulation function of tum origin-bearing mice[J].Guangzhou Medical Journal,2013,44(6):40-41.
[16] 刁秋霞, 李硕,王晶,等.火麻仁酶解发酵液对小鼠抗疲劳的作用[J].武警医学,2013,24(11):945-947.
DIAO Q X,LI S,WANG J,et al.Effect of hempseed fermented liquid on fatiguing mices[J].Medical Journal of the Chinese People’s Armed Police Forces,2013,24(11):945-947.
[17] WANG Q L,XIONG Y L.Processing,nutrition,and functionality of hempseed protein:A review[J].Comprehensive Reviews in Food Science and Food Safety,2019,18(4):936-952.
[18] 郝娇月. 酶解发酵工艺对复合杂粮抗氧化活性的影响研究及产品研发[D].长春:吉林大学,2019.
HAO J Y.The effect of enzymolysis and fermentation on antioxidant activity of composite grains and product development[D].Changchun:Jilin University,2019.
[19] 胡乔迁. 酶解芝麻蛋白肽及其亚铁螯合物的制备与特性[D].扬州:扬州大学,2019.
HU Q Q.Preparation and properties of enzymatic hydrolysis of sesame protein peptide and ferrous chelate[D].Yangzhou:Yangzhou University,2019.
[20] YOSHIOKA Y,LI X,ZHANG T S,et al.Black soybean seed coat polyphenols prevent AAPH-induced oxidative DNA-damage in HepG2 cells[J].Journal of Clinical Biochemistry & Nutrition,2017,60(2):108-114.
[21] ZUO L,ZHOU T,PANNELL B K,et al.Biological and physiological role of reactive oxygen species—the good,the bad and the ugly[J].Acta Physiologica,2015,214(3):329-348.
[22] TAMMA G,VALENTI G,GROSSINI E,et al.Aquaporin membrane channels in oxidative stress,cell signaling,and aging:recent advances and research trends[J].Oxidative Medicine and Cellular Longevity,2018:1 501 847.
[23] 温斐婷. 基于HepG2细胞研究高浓度槲皮素促氧化的作用和机制[D].无锡:江南大学,2016.
WEN F T.The prooxidant effect of high concentration quercetin on HepG2 cells and its potential mechanism[D].Wuxi:Jiangnan University,2016.
[24] 朱俊杰. 大青叶抵御HepG2细胞氧化应激损伤及其机制研究[D].海口:海南大学,2018.
ZHU J J.Study on cytoprotective effects and mechanisms of Clerodendrum cyrtophyllum Turcz leaves against oxidative stress in HepG2 cells[D].Haikou:Hainan University,2018.
[25] LU M C,JI J N,JIANG Z Y.The keap1-Nrf2-ARE pathway as a potential preventive and therapeutic target:An update[J].Medicinal Research Reviews,2016,36(5):924-963.
[26] LOBODA A,DAMULEWICZ M,PYZA E.Role of Nrf2/HO-1 system in development,oxidative stress response and diseases:an evolutionarily conserved mechanism[J].Cellular and Molecular Life Sciences,2016,73(17):3 221-3 247.
[27] CHOI Y H.Berberine hydrochloride protects C2C12 myoblast cells against oxidative stress-induced damage via induction of Nrf-2-mediated HO-1 expression[J].Drug Development Research,2016,77(6):310-318.