糖尿病作为一类以高血糖为主要特征的慢性代谢疾病,极易引起心脑血管疾病、视网膜病变、肾病等并发症,危害人体健康且增加病患经济压力[1]。受膳食、生活方式等众多因素影响,2型糖尿病发病呈快速增长趋势,2019年全球成人糖尿病患者大概有4.63亿,并预计到2030和2045年,糖尿病患者可能达到5.784和7.002亿,其中2型糖尿病人数最多,占患病总人数的90%~95%[2-3]。目前,2型糖尿病的治疗方法主要分为药物治疗和胰岛素治疗,而药物治疗存在毒副作用较强,长期服用可能会对人体的肝脏、肾脏产生潜在危害等问题[4]。将无毒副作用的天然产物用于辅助降血糖成为控制糖尿病的新方法[5]。研究表明,用于降血糖作用的天然产物主要有多糖类、黄酮类、皂苷类、生物碱及不饱和脂肪酸等,这些活性成分主要降糖作用途径有保护胰岛细胞促进胰岛素分泌、增强胰岛素敏感、促进葡萄糖的分解和改善糖脂代谢等[6]。多糖是存在于动物、植物和微生物的一类大分子物质,具有较好的降血糖活性,研究发现多糖的降糖途径主要有改善胰岛素抵抗、保护胰岛细胞增加胰岛素的合成和提高糖代谢等[7]。深入研究不同天然多糖降糖效果、途径,对精准控制血糖,辅助治疗糖尿病具有理论指导和实际应用价值。
蒲公英是一种药食两用蔬菜,富含多糖、多酚、甾醇、三萜等活性成分,传统医学、现代医学和营养学研究均表明,蒲公英具有辅助降糖作用,其中多糖是主要的降糖成分[8]。动物实验表明,蒲公英多糖对糖尿病小鼠模型具有降血糖和抗氧化的作用,体外研究发现,其可以抑制糖苷酶的活性,具有改善糖尿病的脂质代谢和预防糖尿病并发症的作用[9-10]。来源、组成和结构不同的多糖,其降血糖作用和途径有所差异[11-13]。蒲公英的多糖主要存在于根中,先前的报道主要集中在粗多糖的降糖研究,但是并未探讨蒲公英分离纯化后的不同多糖组分的降血糖作用及其作用途径[14],本研究将分离纯化出的蒲公英根不同多糖组分进行降糖作用及其作用途径差异的研究。
1 材料与方法
1.1 材料、试剂与动物
蒲公英根,山东泰安野菜种植基地,烘干磨粉后密封备用;链脲佐菌素、DEAE-52纤维素、Sephadex G-100、D101大孔树脂、透析袋,北京索莱宝有限公司;总胆固醇、甘油三酯、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇、肝糖原试剂盒、葡萄糖含量试剂盒,南京建成有限公司;HepG2和NIT-1细胞,赛齐生物工程有限公司;1640培养基、DEME高糖培养基及其他细胞用品,赛默飞世尔生物制品有限公司;BI血清,上海逍鹏生物科技有限公司;基础饲料、高脂饲料、垫料,山东济南朋悦实验动物繁育有限公司;其他试剂均为分析纯。
4周龄健康雄性ICR小鼠,体重18~20 g,山东济南朋悦实验动物繁育有限公司(许可证号:SCXK(鲁)20190003),小鼠置于18~22 ℃的室温,相对湿度40%~60%,正常照明,自由获取食物和水。
1.2 仪器与设备
SpectraMax M5多功能酶标仪,Molecular Devices公司;IX73研究级倒置荧光显微镜,奥林巴斯(中国)有限公司;LC-20AD高效液相色谱仪、LC20凝胶渗透色谱仪,日本岛津仪器公司。
1.3 实验方法
1.3.1 蒲公英根多糖的制备及分子质量、单糖组成测定
采用热水浸提法[15]对蒲公英根多糖的提取条件进行优化,最终优化提取条件为:1 kg蒲公英根烘干研磨过40目筛,以料液比1∶25(g∶mL)的比例加入水,置于90 ℃的水浴锅浸提3 h,收集滤液并浓缩。
用Sevage法除蛋白,向提取液中加入 1/3 倍体积的Sevage(氯仿∶正丁醇=4∶1,体积比)溶液,搅拌30 min,4 000 r/min 离心10 min,取上清液用80%的乙醇醇沉12 h,离心取沉淀,蒸馏水复溶,经S-8大孔树脂柱层析后,透析膜(分子质量>3 500)室温透析48 h,浓缩后冻干得到粗多糖。采用苯酚硫酸法[16]测得粗多糖的含量为34%。
取冻干粗多糖300 mg溶解于6 mL水中,过0.45 μm水系滤膜后上样至DEAE-52离子交换柱上,分别用水、0.1 mol/L NaCl溶液、0.2 mol/L NaCl溶液洗脱至无多糖洗脱出来,收集3种洗脱组分透析 24 h以去除NaCl,再将3个组分分别上样至sepG100层析柱,洗脱后透析24 h,浓缩冻干制得DP1、DP2、DP3这3种组分。
参考之前报道的方法[17-18],采用高效渗透凝胶色谱和高效液相色谱测定3个多糖组分的分质量和单糖组成。
1.3.2 动物实验
1.3.2.1 动物分组与处理
选取4周龄健康ICR雄性小鼠适应性饲养1周,随机选取8只喂以正常饲料作为正常对照组(normal control,NC组),剩余32只喂以高脂饲料作为实验组,自由饮水,饲养1周后,实验组按30 mg/kg的剂量腹腔注射链脲佐菌素(streptozotocin,STZ),正常组腹腔注射等量的生理盐水,腹腔注射5 d后测血糖。测试之前禁食不禁水12 h,将空腹血糖值(fasting blood glucose,FBG)高于11.1 mmol/L的小鼠确定为造模成功[19]。将造模成功的小鼠按照血糖值平均分为4组,每组8只:糖尿病模型组(diabetes model control,DC组)、DP1多糖组(dandelion polysaccharide 1,DP1组)、DP2多糖组(dandelion polysaccharide 2,DP2组)、DP3多糖组(dandelion polysaccharide 3,DP3组)。正常组和模型组按100 mg/(kg·d)剂量生理盐水进行灌胃,其他组分别灌胃等剂量DP1、DP2、DP3,连续灌胃28 d[20]。
1.3.2.2 生化指标测定
实验过程中,每周测定1次小鼠的体重和空腹血糖水平。小鼠处死前进行口服葡萄糖耐量试验(oral glucose tolerance test,OGTT)。将小鼠禁食不禁水12 h,用2.0 g/kg剂量葡萄糖溶液(葡萄糖质量浓度400 mg/mL)进行灌胃,随后在0、30、60、90和120 min测量血糖水平。
给药4周后,禁食12 h,脱颈处死之前,摘取眼球取眼眶血,将眼眶血3 500 r/min离心10 min取上层血清置于-80 ℃冰箱备用。脱颈处死,取肝脏组织,生理盐水清洗去除组织上血迹,用滤纸吸干水分后,将组织一部分放入10%的福尔马林溶液中固定用于形态观察,另一部分置于-80 ℃冰箱中备用以测定生化指标。将固定的肝脏标本石蜡包埋并组织切片,切片用苏木精-伊红染色(hematoxylin-eosin staining,HE)进行形态学分析[21]。
小鼠血清的甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、肝糖原含量指标按照试剂盒要求测定。
1.3.3 体外细胞实验
1.3.3.1 细胞模型的建立
HepG2胰岛素抵抗模型(insulin resistance,IR)的建立:将HepG2细胞均匀种于96孔板中,用浓度为10-7mol/L的胰岛素培养细胞24 h,发现细胞消耗量明显减少(P<0.05),表明模型成功建立[22]。
NIT-1胰岛损伤模型:将NIT-1细胞均匀种在96孔板中,用5 mmol/L的STZ溶液培养细胞30 min,即可建立胰岛细胞损伤模型[23]。
1.3.3.2 葡萄糖消耗量试验
将HepG2细胞分5组(NC、DC、DP1、DP2、DP3)均匀种在96孔板后,等细胞贴壁生长至孔80%以上,NC组加入200 μL DMEM完全培养液,其他组均加入200 μL 的10-7mol/L胰岛素(胰岛素先用DMSO配制母液后,用DMEM基本培养基配制)以建立胰岛素抵抗模型,24 h后,NC组和DC组加200 μL DMEM完全培养液,DP1、DP2、DP3组分别加入200 μL 200 μg/mL的DP1、DP2、DP3(DP1、DP2、DP3用DMEM基本培养基制得)溶液,培养24 h后,取每个孔的上清液10 μL加入1 000 μL的葡萄糖试剂,置于37 ℃处理10 min,在波长505 nm测定吸光度。按公式(1)、(2)计算葡萄糖含量及消耗量:
葡萄糖含量![]()
(1)
葡萄糖消耗量/(mmol·L-1)=空白组葡萄糖含量-实验组葡萄糖含量
(2)
1.3.3.3 MTT测定细胞活性
将NIT-1细胞分5组均匀种在96孔板后,等细胞贴壁生长至孔80%以上,NC组加入200 μL 的1640完全培养基,其他组加入200 μL 2 mmol/L的STZ溶液(STZ是用1640基本培养基配制)以建立胰岛细胞损伤模型,避光培养30 min后,将96孔板中液体倒干净,NC组和DC组加200 μL 1640完全培养基,DP1、DP2、DP3组分别加入200 μL 200 μg/mL的DP1、DP2、DP3溶液(DP1、DP2、DP3用1640基本培养基制得),培养24 h后,用MTT法检测细胞存活率。
1.4 数据统计分析
每组实验平行3次,结果以平均数±标准偏差(x±s)表示。采用SPSS 19.0对实验结果进行统计分析,以P<0.05 表示差异具有统计学意义。
2 结果与分析
2.1 蒲公英根多糖组分制备
2.1.1 蒲公英根多糖的分离纯化
经过DEAE-52阴离子交换柱得到3种多糖组分(图1-a),用sepG-100柱层析进行纯化后,得到了3个单一且对称的峰(图1-b)。
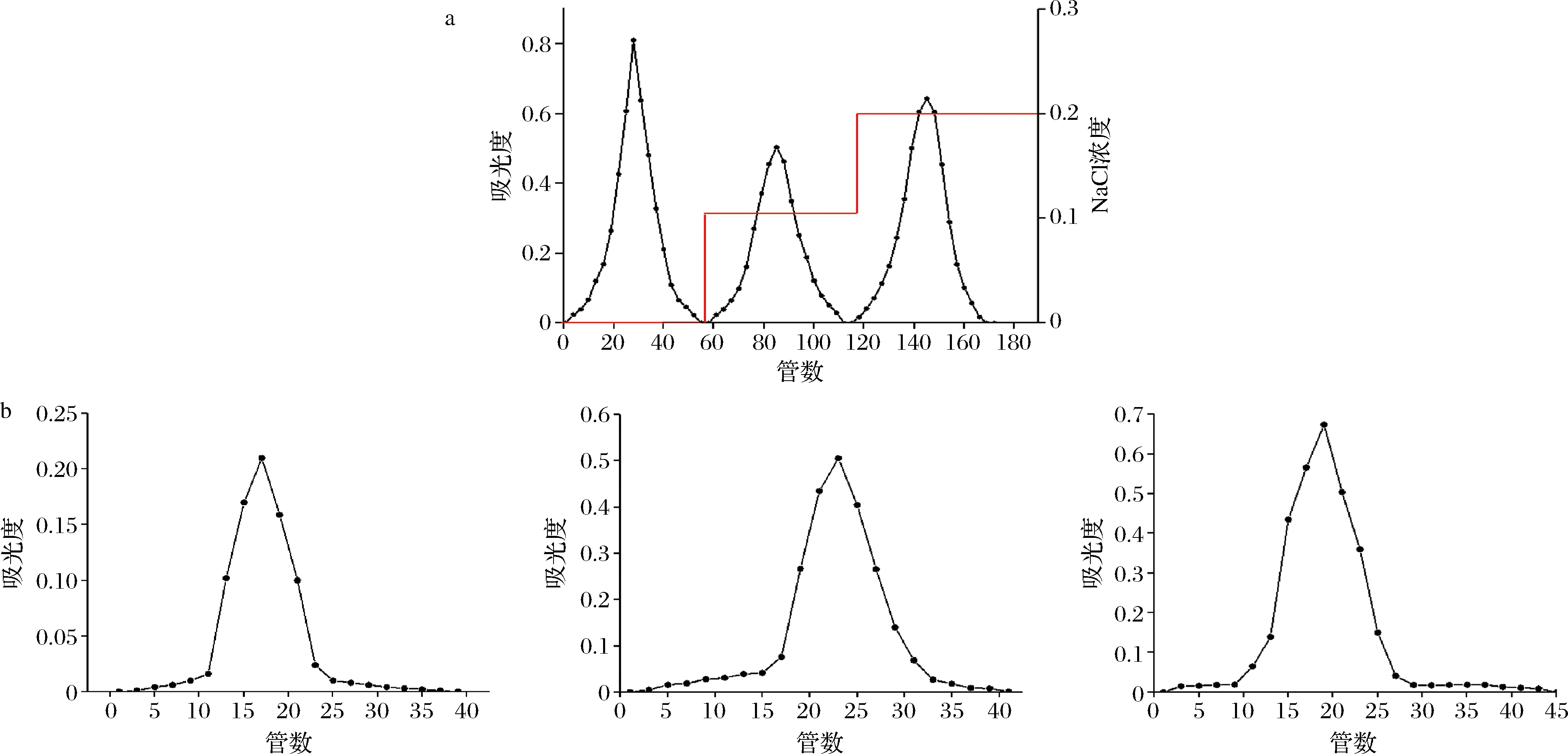
a-蒲公英根多糖DEAE-52洗脱曲线;b-蒲公英根多糖SepG-100柱层析洗脱曲线
图1 蒲公英根多糖DEAE-52洗脱曲线和SepG-100柱层析洗脱曲线
Fig.1 DEAE-52 elution curve and SepG-100 chromatography elution curve of dandeline polysaccharide
2.1.2 蒲公英根多糖的分子质量和单糖组成
由高效渗透凝胶色谱得到的3种多糖组分DP1、DP2、DP3的平均分子质量分别是9 224、56 381、15 853 Da;根据单糖标准品和纯化后的多糖液相色谱图(图2),可以看出DP1、DP2和DP3是由10种相同的单糖分别是:甘露糖、核糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、木糖、阿拉伯糖、岩藻糖,但含量比有所差异,DP1的含量比是0.09∶0.145∶0.03∶0.65∶0.02∶78.67∶0.12∶0.02∶0.09∶0.01;DP2的含量比为0.52∶0.121∶0.39∶0.88∶0.15∶53.70∶1.20∶0.42∶0.80∶0.10;DP3的含量比是1.03∶0.097∶1.99∶0.64∶1.61∶38.02∶3.66∶0.84∶1.84∶0.40。

a-标准单糖液相色谱图;b-DP1液相色谱图c-DP2液相色谱图;d-DP3液相色谱图
图2 标准单糖、DP1、DP2和DP3的液相色谱图
Fig.2 Liquid chromatogram of standard monosaccharides,DP1,DP2 and DP3
2.2 蒲公英根多糖组分对糖尿病小鼠改善效果
2.2.1 蒲公英根多糖对糖尿病小鼠的体重和FBG的影响
2型糖尿病体重会减轻而FBG会升高,主要是因为食物中葡萄糖很难进入细胞提供能量,只能靠体内蛋白质和脂肪过分解提供[24-25]。对表1和图3的数据进行分析,发现随着饲养时间的延长,NC组的小鼠体重逐渐增大,FBG的水平稳定在正常值;而DC组组随着饲养时间的延长,体重呈逐渐下降的趋势,FBG呈逐渐上升的趋势且始终高于11.1 mmol/L,说明建模成功;3种多糖干预组从第2周开始体重呈现缓慢回增的趋势,其中且FBG均显著下降,降低FBG效果为:DP2>DP3>DP1,表明3种多糖组分均具有良好的降血糖效果,且DP2效果最佳。
表1 蒲公英根不同多糖对糖尿病小鼠体重的影响
Table 1 Effect of different dandelion root polysaccharides on body weight of diabetic mice

注:全文显著性用a和b表示,其中与空白对照组相比,a<0.05;与模型对照组相比,b<0.05(下同)
时间NC组DC组DP1组DP2组DP3组第1周22.7±1.9533.1±1.92a31.2±1.35b31.54±1.14b30.26±1.11b第2周25.4±1.3231.54±1.23a29.02±1.43b26.57±0.80b28.97±1.40第3周28.93±1.2429.75±1.4031.99±1.8329.50±1.4531.91±1.56第4周30.29±1.1329.05±1.0034.51±1.27b31.3±1.18b31.64±1.33b第5周32.63±1.4127.05±1.12a32.09±0.98b33.19±1.26b32.62±1.29b
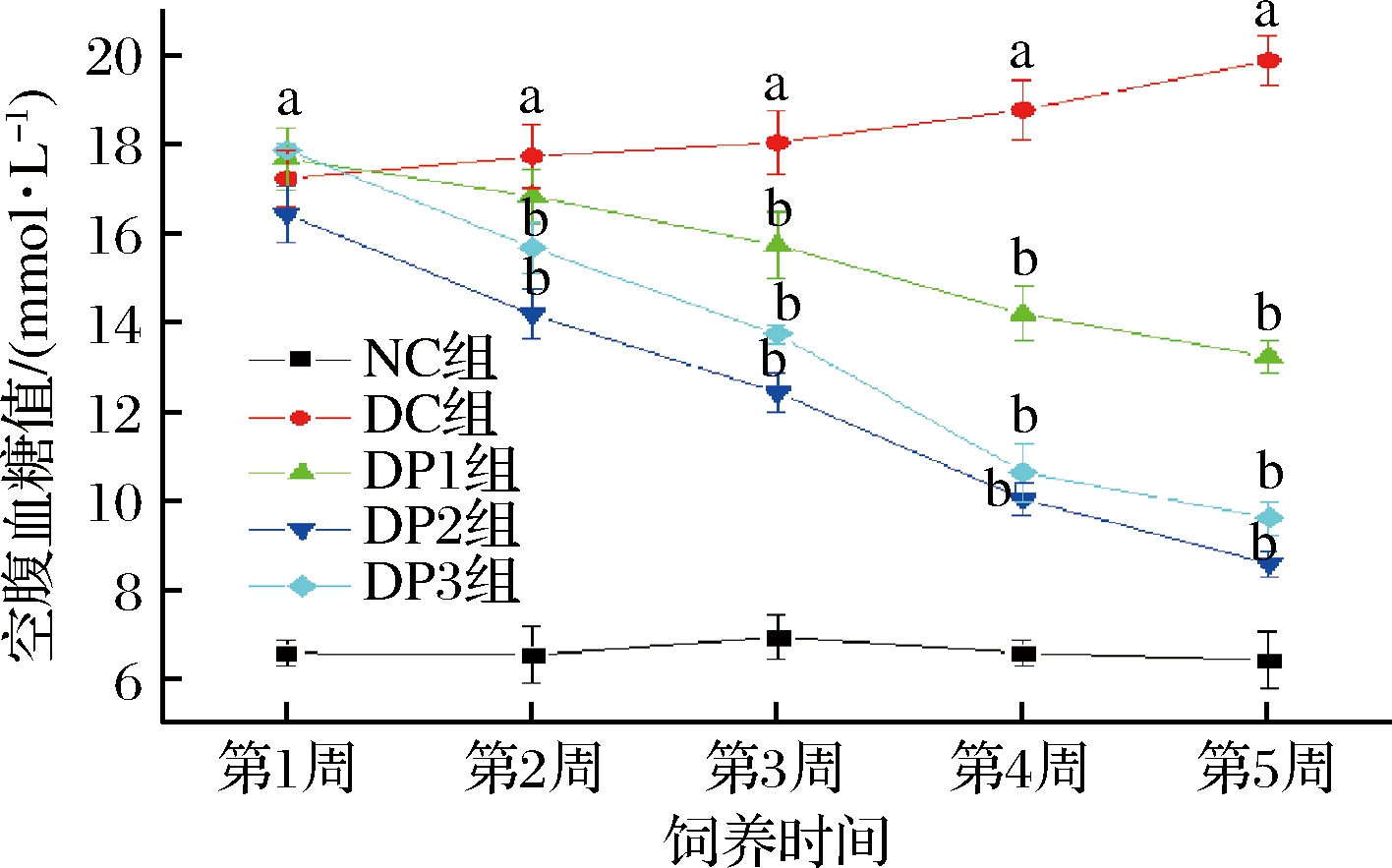
图3 蒲公英根不同多糖对糖尿病小鼠空腹血糖值的影响
Fig.3 Effect of different dandelion root polysaccharides on fasting glucose of diabetic mice
2.2.2 蒲公英根多糖对糖尿病小鼠口服耐受量的影响
OGTT是对葡萄糖的负荷水平的实验,来测定胰岛细胞对血糖的调控作用,正常人摄入糖后,血糖会明显升高,但在2 h之内恢复正常,而糖尿病患者则表现为耐受异常或紊乱。如图4-a所示,NC组小鼠口服葡萄糖后,30 min时血糖值达到峰值,随后血糖逐渐下降,在2 h时恢复至正常水平。相对于NC组,DC组小鼠在30 min后血糖值虽然也逐渐下降,但在120 min后血糖值仍处于高水平,这表明DC组小鼠糖耐量异常。DP1、DP2、DP3组在葡萄糖灌胃120 min后血糖基本回复到实验开始葡萄糖负荷前水平,说明3组多糖干预组的葡萄糖吸收和代谢的过程逐渐恢复正常。此外,如图4-b所示,与NC组相比,DC组小鼠糖耐量曲线下面积升高了146.1%(P<0.05),与DC组相比,DP1、DP2、DP3分别降低了31.3%、44.7%、38.6%(P<0.05),说明DP1、DP2和DP3 3种多糖均能提高小鼠的糖耐力,且DP2的改善糖耐受效果最佳。

a-蒲公英根多糖对小鼠的口服糖耐受量的影响;b-蒲公英根多糖对小鼠的口服糖耐受量曲线下面积的影响
图4 蒲公英根多糖对小鼠的口服糖耐受量的影响和曲线下面积的影响
Fig.4 Effects of dandelion root polysaccharides on glucose tolerance and area under curve in OGTT mice
2.2.3 蒲公英根多糖对血清中TG、TC、HDL-C、LDL-C水平的影响
高糖高脂喂养的2型糖尿病小鼠一般伴随着血脂异常,显著特征是TG、TC水平升高,在糖尿病发病机制中发挥关键作用[26-27]。与相关研究一致[28],图5结果表明,DC组小鼠血清TG、TC、LDL-C含量较NC组小鼠明显增加,HDL-C的含量明显下降(P<0.05),表明高糖高脂喂养可以导致血脂异常。与DC组相比,给予蒲公英根多糖干预后血清中TC、TG、LDL-C、含量明显降低,HDL-C含量明显升高(P<0.05),3种多糖组别之间差异不显著,说明3种蒲公英根多糖均可以改善血脂异常。

a-蒲公英根不同多糖对血清中TG的影响;b-蒲公英根不同多糖对血清中TC的影响;c-蒲公英根不同多糖对血清中LDL-C的影响;d-蒲公英根不同多糖对血清中HDL-C的影响
图5 蒲公英根不同多糖对血清中TG、TC、LDL-C、HDL-C的影响
Fig.5 Effects of different dandelion root polysaccharides on TG、TC、LDL-C and HDL-C levels in serum
2.2.4 小鼠肝脏的形态学变化
从HE染色图中,NC组小鼠肝细胞排列整齐,形态清晰,细胞核清晰可见,血窦间隙排列良好,未见明显的异常病理变化。与NC组相比,DC组肝细胞脂肪组织变性,细胞组织排列紊乱,肝血窦消失,部分细胞出现空泡样变,肝细胞水肿变性,组织结构紊乱。与DC组相比,多糖各处理组细胞排列相对有序,肝细胞组织结构基本恢复正常,静脉依然充血,表明3种蒲公英根多糖对肝脏具有一定的保护作用。

a-NC组对小鼠肝脏结构的影响;b-DC组对小鼠肝脏结构的影响;c-DP1组对小鼠肝脏结构的影响;d-DP2组对小鼠肝脏结构的影响;e-DP3组对小鼠肝脏结构的影响
图6 蒲公英不同多糖对小鼠肝脏结构的影响
Fig.6 Effects of different dandelion polysaccharides on liver structure in mice
2.3 蒲公英根多糖组分对糖尿病小鼠改善作用途径
2.3.1 蒲公英根多糖对糖尿病小鼠的肝糖原含量的影响
糖代谢异常与2型糖尿病关系密切相关,而肝糖原是机体内很重要的一种糖原。如图7所示,与NC组相比,DC组肝糖原含量明显降低,说明造模成功;与DC组相比,DP1明显提高肝糖原含量(P<0.05)可能是肝脏中将葡萄糖转化为肝糖原的酶活性或数量得以提高,从而使合成的肝糖原增加;DP2和DP3虽也可以提高肝糖原含量,但与DC组差异不明显。推测DP1可能是通过提高肝糖原含量,改善糖代谢途径进而降低血糖。
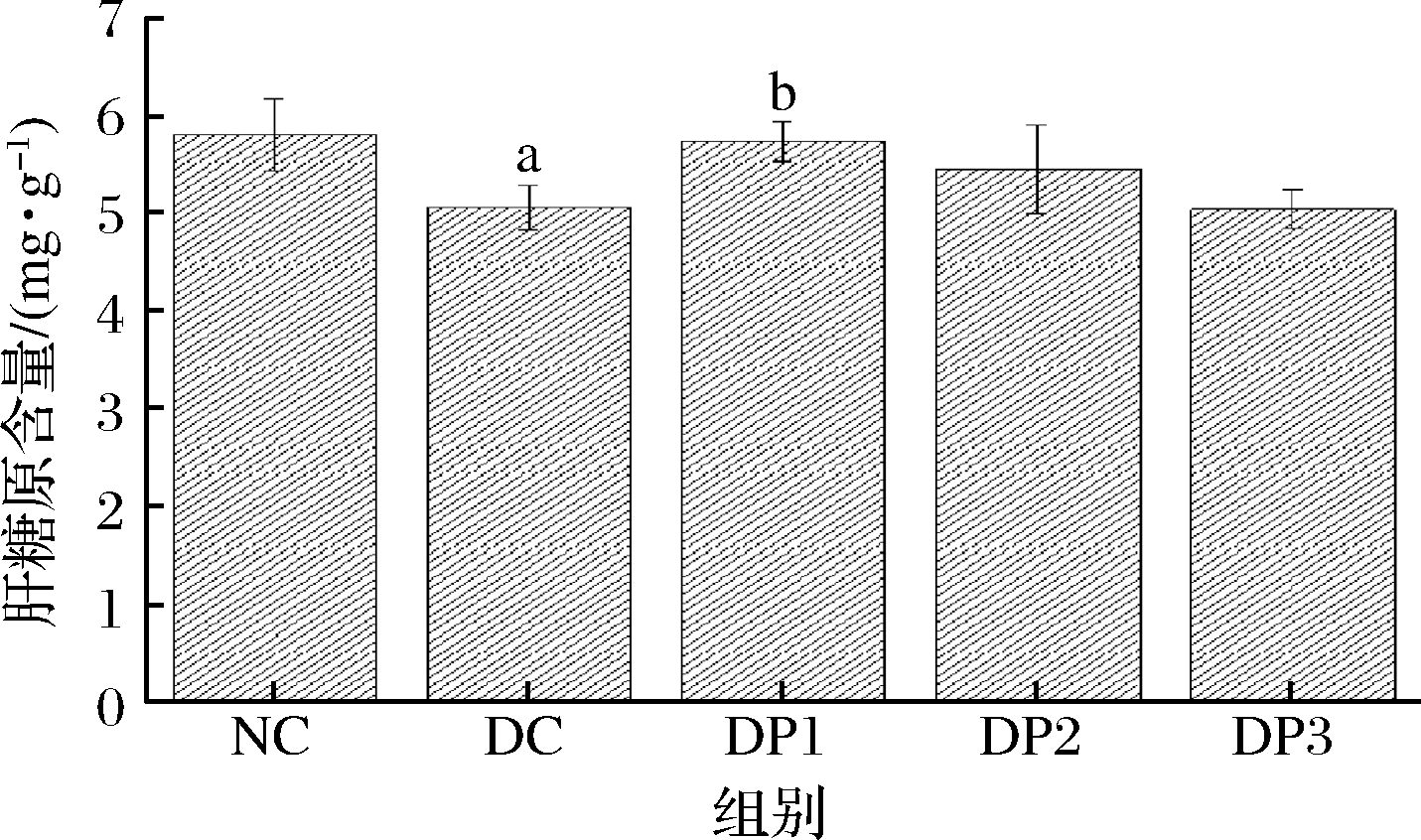
图7 蒲公英不同多糖对糖尿病小鼠的肝糖原的影响
Fig.7 Effects of different dandelion polysaccharides on liver glycogen in diabetic mice
2.3.2 蒲公英根多糖对胰岛素抵抗细胞模型的葡萄糖消耗量影响
造成2型糖尿病的一个重要原因是胰岛素抵抗,如图8显示,与NC组相比,DC组细胞存活率明显降低(P<0.05),而与DC组相比,不同多糖组均明显提高了细胞的存活率(P<0.05)。与NC组相比,DC组葡萄糖消耗量显著降低(P<0.05);与DC组相比,不同多糖组的葡萄糖消耗量有所提升,其中DP2最佳,其次是DP3,最后是DP1(P<0.05)。DP2明显提高IR模型的葡萄糖消耗量,改善胰岛素抵抗,推测DP2可能是通过改善胰岛素抵抗来降低血糖。

图8 蒲公英不同多糖对胰岛素抵抗细胞存活率影响和的葡萄糖消耗影响
Fig.8 Effects of different dandelion polysaccharides on the survival rate and glucose consumption in insulin resistant cells
2.3.3 蒲公英根多糖对胰岛细胞存活率的影响
如图9所示,与NC组相比,DC组的胰岛细胞存活率显著降低(P<0.05),与DC组相比,DP3组明显提高了胰岛细胞的存活率(P<0.05),而DP1和DP2组存活率和DC组无明显差异。DP3显示了对受损胰岛细胞明显的保护作用,推测DP3可能是通过增强对胰岛细胞的保护作用,从而促进胰岛素的分泌而降低血糖。

图9 蒲公英不同多糖对受损NIT-1胰岛细胞的保护作用
Fig.9 The protective effect of different dandelion polysaccharides on damaged NIT-1 islet cells
3 结论
本研究从蒲公英根中分离纯化出了3种多糖,分子质量分别为9 224、56 381、15 853 Da,单糖组成含量比不同的3种多糖组分DP1、DP2和DP3。3种多糖均具有不同程度的降血糖效果,且DP2降血糖作用效果最佳。多糖DP1对于改善糖代谢具有显著影响,多糖均能缓解胰岛素抵抗且DP2效果最佳,DP3能够对受损胰岛细胞具有一定的修复和保护作用,因此具有降血糖的作用。
研究表明许多植物多糖具有降糖作用效果,不同来源的植物多糖主要降糖作用途径有差异[29]。黄参多糖的降血糖作用主要是减少自由基的数量,保护胰岛β细胞,红芪多糖主要是通过修复胰岛细胞,促进胰岛素的释放降糖;白簕多糖主要是增加肝糖原含量,调控糖代谢通路中的相关蛋白;黄精多糖在肝脏和胰腺中明显上调胰岛素受体蛋白(IRS-2)的表达,减轻胰岛素抵抗作用;植物多糖的降血糖作用可能与其分子质量、单糖组成和聚合结构有关[11],不同单糖组成的植物多糖具有不同的降血糖效果,分子质量低的多糖无法形成具有生物活性的聚合结构[7],单糖组合后的多糖比单糖降血糖效果更好。研究表明蒲公英主要通过促进胰岛素分泌、抗氧化、改善胰岛素抵抗、调控糖代谢通路等机制发挥降血糖作用[30],降血糖成分包括多糖、黄酮、皂苷等,其中蒲公英多糖是主要降糖物质,本研究可以看出,由于3种蒲公英根多糖分子结构的差异,使3种多糖具有不同的降血糖效果,并通过不同途径发挥其作用,不同组分蒲公英根多糖与降血糖的构效关系,需进一步深入研究明确。
[1] SEURING T,ARCHANGELIDI O,SUHRCKE M.The economic costs of type 2 diabetes:A global systematic review[J].Pharmaco Economics,2015,33(8):811-831.
[2] ZHOU B,LU Y,HAJIFATHALIAN K,et al.Worldwide trends in diabetes since 1980:A pooled analysis of 751 population-based studies with 4.4 million participants[J].The Lancet,2016,387(10 027):1 513-1 530.
[3] CHATTERJEE S,KHUNTI K,DAVIES M J.Type 2 diabetes[J].The Lancet,2017,389(10 085):2 239-2 251.
[4] KUMAR R,KERINS D M,WALTHER T.Cardiovascular safety of anti-diabetic drugs[J].European Heart Journal-Cardiovascular Pharmacotherapy,2015,2(1):32-43.
[5] WU J,SHI S,WANG H,et al.Mechanisms underlying the effect of polysaccharides in the treatment of type 2 diabetes:A review[J].Carbohydrate polymers,2016,144:474-494.
[6] XU L,LI Y,DAI Y,et al.Natural products for the treatment of type 2 diabetes mellitus:Pharmacology and mechanisms[J].Pharmacological Research,2018,130:451-465.
[7] GANESAN K,XU B J.Anti-diabetic effects and mechanisms of dietary polysaccharides[J].Molecules,2019,24(14):2 556.
[8] 相峰. 蒲公英有效成分的提取及产品开发[D].石河子:石河子大学,2020.
XIANG F.Extraction of active ingredients from Taraxacum mongolicum and product development[D].Shihezi:Shihezi University,2020.
[9] 郭慧静. 蒲公英多糖的提取、分离纯化、鉴定及其生物活性的初步研究[D].石河子:石河子大学,2019.
GUO H J.Extraction,isolation,purification,characterization and its biological activity of polysaccharide from Taraxacum mongolicum[D].Shihezi:Shihezi University,2019.
[10] GUO H J,ZHANG W D,JIANG Y,et al.Physicochemical,structural,and biological properties of polysaccharides from dandelion[J].Molecules (Basel,Switzerland),2019,24(8):1 485.
[11] CHEN C,ZHANG B,FU X,et al.A novel polysaccharide isolated from mulberry fruits (Murus alba L.) and its selenide derivative:Structural characterization and biological activities[J].Food & Function,2016,7(6):2 886-2 897.
[12] CHEN C,YOU L,ABBASI A M,et al.Characterization of polysaccharide fractions in mulberry fruit and assessment of their antioxidant and hypoglycemic activities in vitro[J].Food & Function,2016,7(1):530-539.
[13] ZHANG Q,YU H,XIAO X,et al.Inulin-type fructan improves diabetic phenotype and gut microbiota profiles in rats[J].PeerJ,2018,6:e4 446.
[14] 侯丽然, 孙丽娜,侯巍,等.蒲公英多糖的提取及降糖作用的研究[J].黑龙江医药科学,2010,33(6):36-37.
HOU L R,SUN L N,HOU W,et al.Extraction and hypoglycemic function of dandelion polysaccharide[J].Heilongjiang Medicine Journal,2010,33(6):36-37.
[15] 吴兰芳, 景永帅,张振东,等.土党参多糖不同提取方法的比较研究[J].食品科学,2012,33(18):45-48.
WU L F,JING Y S,ZHANG Z D,et al.A comparative study of different extraction methods for polysaccharides from campanumoea javanica roots[J].Food Science,2012,33(18):45-48.
[16] SHI S,ZHANG Y,HUANG K,et al.Application of preparative high-speed counter-current chromatography for separation and purification of lignans from Taraxacum mongolicum[J].Food Chemistry,2008,108(1):402-406.
[17] HU H B,LIANG H,WU Y.Isolation,purification and structural characterization of polysaccharide from acanthopanax brachypus[J].Carbohydrate Polymers,2015,127:94-100.
[18] XU J,XU L L,ZHOU Q W,et al.Isolation,purification,and antioxidant activities of degraded polysaccharides from enteromorpha prolifera[J].International Journal of Biological Macromolecules,2015,81:1 026-1 030.
[19] JIAO Y,WANG X,JIANG X,et al.Antidiabetic effects of morus alba fruit polysaccharides on high-fat diet-and streptozotocin-induced type 2 diabetes in rats[J].Journal of Ethnopharmacology,2017,199:119-127.
[20] 吴秀密. 南非叶对2型糖尿病的降血糖作用及肝糖异生信号转导通路调控[D].厦门:厦门大学,2018.
WU X M.Hypoglycemic effect of Vernonia amygdalina on type 2 diabetic mellitus and regulation of hepatic gluconeogenesis[D].Xiamen:Xiamen University,2018.
[21] DU X X,TAO X,LIANG S,et al.Hypoglycemic effect of acidic polysaccharide from schisandra chinensis on T2D rats induced by high-fat diet combined with STZ[J].Biological and Pharmaceutical Bulletin,2019,42(8):1 275-1 281.
[22] 曲鹏宇. 鲜食水稻SDF理化性质、单糖组成及对胰岛素抵抗HepG2细胞改善作用研究[D].密山:黑龙江八一农垦大学,2019.
QU P Y.Physicochemical properties,monosaccharide composition and improvement of insulin resistance HepG2 cellsin fresh rice SDF[D].Mishan:Heihngjiang Bayi Agricultural University,2019.
[23] 尹健兰. 厄贝沙坦对胞内胞外氧化应激引起胰岛NIT-1细胞损伤的研究[D].南宁:广西医科大学,2015.
YIN J L.The study of irbesartan on the damage islet cell caused by oxidative stress[D].Nanning:Guangxi Medical University,2015.
[24] PAN Y,WANG C,CHEN Z,et al.Physicochemical properties and antidiabetic effects of a polysaccharide from corn silk in high-fat diet and streptozotocin-induced diabetic mice[J].Carbohydrate Polymers,2017,164:370-378.
[25] CHUNG I M,KIM E H,YEO M A,et al.Antidiabetic effects of three Korean sorghum phenolic extracts in normal and streptozotocin-induced diabetic rats[J].Food Research International,2011,44(1):127-132.
[26] HEEBA G H,HAMZA A A.Rosuvastatin ameliorates diabetes-induced reproductive damage via suppression of oxidative stress,inflammatory and apoptotic pathways in male rats[J].Life Sciences,2015,141:13-19.
[27] FATANI A J,ALREJAIE S S,ABUOHASHISH H M,et al.Lutein dietary supplementation attenuates streptozotocin-induced testicular damage and oxidative stress in diabetic rats[J].BMC Complementary and Alternative Medicine,2015,15(1):204-204.
[28] LIAO Z,ZHANG J,LIU B,et al.Polysaccharide from okra (Abelmoschus esculentus (L.) Moench) improves antioxidant capacity via PI3K/AKT pathways and Nrf2 translocation in a type 2 diabetes model[J].Molecules,2019,24(10):1 906.
[29] 董文南, 李克招,张文婷,等.多糖降血糖作用及其机制研究进展[J].中国实验方剂学杂志,2019,25(19):219-225.
DONG W N,Li K Z,ZHANG W T,et al.Progress in hypoglycemic effect and mechanism of polysaccharides[J].Chinese Journal of Experimental Traditional Medical Formulae,2019,25(19):219-225.
[30] GONZáLEZ-CASTEJóN M,VISIOLI F,RODRIGUEZ-CASADO A.Diverse biological activities of dandelion[J].Nutrition Reviews,2012,70(9):534-547.