代谢综合征是一组代谢紊乱症候群,包括高血糖、肥胖、II型糖尿病等。近年来,全球肥胖人数呈指数级增长,代谢综合征也在全球范围内越来越流行[1-2],通过调节饮食来预防相关疾病已经逐渐成为一种重要的方法。全谷物(whole grain,WG)食物能通过其中各种生物活性成分的协同作用[3],如膳食纤维、抗性淀粉、多酚、植物甾醇、维生素和矿物质等,降低餐后血糖反应[4]、调节肠道菌群[2],从而起到调节血糖[5]、预防肥胖[6]和II型糖尿病[7]等作用。
青稞(Hordeum vulgare L.)又称裸大麦,是青藏高原地区的主要农作物之一。青稞富含膳食纤维,特别是其中的β-葡聚糖(beta-glucan,BG)含量在3.66%~8.62%,是世界上β-葡聚糖含量最高的谷类作物[8]。大量研究表明,β-葡聚糖能通过增加消化体系黏度[9]以及降低α-淀粉酶、α-葡萄糖苷酶酶活性[10]等方式抑制淀粉的消化,从而降低餐后血糖浓度,实现降血糖功效。也有研究表明,食物的结构特征在淀粉消化和血糖反应中也起着重要的作用,破坏食物结构的完整性可能会增加淀粉消化速率[11]、降低其各项生理功效[12]。然而,β-葡聚糖特性和全谷物结构在调节血糖生理活性中谁占主导作用尚不清楚。因此,本文通过分析青稞全粉中β-葡聚糖对淀粉消化的影响,并探究其体外降血糖功效潜在机理,为青稞的加工提供参考和理论依据。
1 材料与方法
1.1 材料与试剂
青稞全粉(hull-less barley,HB),将青稞粉碎过100目筛;高峰α-淀粉酶、α-淀粉酶、胰酶、胃蛋白酶、纤维素酶、β-葡聚糖酶、异硫氰酸荧光素、荧光增白剂,美国Sigma公司;交联β-葡聚糖含量试剂盒,爱尔兰Megazyme公司。
1.2 仪器与设备
HH-6D数显恒温水浴磁力搅拌锅,惠州市宏业仪器有限公司;AXTG16G台式高速离心机,盐城市安信实验仪器有限公司;UV-2450紫外分光光度计,日本岛津公司;Mastersizer 2000激光粒度分析仪,英国Malvern公司;TCW-3快速黏度糊化仪,澳大利亚 Newport Science Corp 公司;Phenom Pro-17A00403扫描电镜,荷兰Phenom World公司;LSM780激光共聚焦显微镜,德国Zeiss公司。
1.3 实验方法
1.3.1 青稞全粉体外消化
将样品分为5组,试验设计如表1所示。为探究β-葡聚糖在青稞全粉中对淀粉体外消化影响的机理,以去掉纤维素的实验组作为对比。加入酶后于50 ℃水浴中反应30 min,经离心去上清液并补入4 mL缓冲液后,用0.2 mL 2 mol/L HCl溶液调pH至1.2,沸水浴5 min糊化,冷却至室温。体外模拟消化在MINEKUS等[13]的方法基础上加以修改。加入3 mL模拟人工胃液,30 μL 0.3 mol/L CaCl2溶液,1 mL 29.5 mg/mL胃蛋白酶,于37 ℃消化30 min,随后加入0.5 mL 1 mol/L NaHCO3溶液终止反应并调pH至6.8;加入3 mL模拟人工肠液,80 μL 0.3 mol/L CaCl2溶液,1 mL 12.4 mg/mL胰蛋白酶,于37 ℃消化120 min。消化全过程使用转子匀速搅拌,第5组在胃消化时用灭活的胃蛋白酶液代替胃蛋白酶液。
表1 青稞全粉体外消化及影响因素分析
Table 1 In vitro digestion of hull-less barley powder and its influencing factors

编号HB/mg纤维素酶/mLβ-葡聚糖酶/mL缓冲液/mL15000042500202350002245001125500004
在模拟肠消化阶段的30、60、90、120 min时各取0.1 mL清液,沸水浴灭酶,用葡萄糖氧化酶(glucose oxidase-peroxidase,GOPOD)试剂测定葡萄糖含量,结果用葡萄糖生成量表示,如公式(1)所示:
葡萄糖生成量![]()
(1)
式中:ΔA,样品吸光度-空白吸光度;VF,终体积,mL;ΔA标,100 μg葡萄糖标品吸光度-空白吸光度。
1.3.2 青稞淀粉体外水解
青稞β-葡聚糖、淀粉和蛋白质的提取分别参照KUREK等[14]、CAO等[15]和杨希娟等[16]的方法。
取5根离心管,分别加入0、15、35 mg青稞β-葡聚糖和15、35 mg青稞蛋白,再于每支心管中加入100 mg青稞淀粉;加入4 mL模拟胰液,沸水浴糊化10 min,冷却至室温后再加入1 mL 10 mg/mL α-淀粉酶,于37 ℃下水解,在反应10、30、60、90 min分别取0.1 mL清液,用GOPOD试剂测定葡萄糖含量,结果用淀粉水解率表示:
淀粉水解率![]()
(2)
式中:ΔA,样品吸光度-空白吸光度;VF,终体积,mL;ΔA标,100 μg葡萄糖标品吸光度-空白吸光度;0.9,葡萄糖转换为淀粉的转换系数;m,样品质量,mg。
1.3.3 青稞β-葡聚糖的含量
将样品分为青稞全粉组、全粉去除蛋白组和全粉去除淀粉及蛋白组,各组称取100 mg 青稞于离心管,实验组再通过预处理除去蛋白或淀粉:加入1 mL 1 mg/mL高峰α-淀粉酶,调pH至7.0,于90 ℃下反应15 min;加入1 mL 1 mg/mL胃蛋白酶,调pH至4.0,于40 ℃下反应15 min。酶解处理完成后,加入7 mL 体积分数95%的乙醇,沸水浴5 min,加入转子搅拌,4 000 r/min离心10 min,弃上清液,再加入7 mL 95%乙醇离心,重复3次即完成预处理。β-葡聚糖的测定方法参照Megazyme公司交联β-葡聚糖试剂盒说明书。
1.3.4 青稞的微观结构
将青稞颗粒浸泡于水中12 h,用薄刀片将其切成厚度为5 μm的薄片,冻干备用。染色参考LANGENAEKE等[17]的方法并加以修改,用质量分数0.25%的异硫氰酸荧光素(fluorescein isothiocyanate,FITC)和质量分数0.01%的荧光增白剂(calcofluor white M2R,CWM2R)分别染色10 min,并用蒸馏水清洗3次,完成后在激光共聚焦显微镜下观察。另外,用扫描电镜观察冻干切片和过筛后青稞粉的微观结构。
1.3.5 青稞全粉粒径测定
将样品分为青稞全粉组、全粉去β-葡聚糖组和全粉去蛋白组,各称取500 mg HB,用30 mL去离子水稀释。去β-葡聚糖组、去蛋白组分别添加30 mg β-葡聚糖酶、胃蛋白酶,于室温下酶解1 h。用激光粒度仪Mastersizer 2000测定其粒径分布,参数设置为:分散剂为水,样品折射率1.520,遮光度为(12±1)%。结果中平均粒径用体积平均径D[4,3]表征。
1.3.6 青稞全粉及淀粉糊化特性分析
糊化特性用快速黏度分析仪测定,根据文献[18]并稍做修改。将样品分为青稞全粉组、全粉去β-葡聚糖组、全粉去蛋白组、青稞淀粉组、青稞淀粉加β-葡聚糖组、青稞淀粉加蛋白组。青稞全粉的3组各称4.0 g青稞全粉,青稞淀粉的3组各称3.0 g青稞淀粉于样品铝盒,再加入一定量的水,添加量由仪器系统计算,并搅拌均匀。在160 r/min搅拌下测定糊化特性,测定程序如下:在50 ℃下加热1 min,4.5 min内均匀升温到95 ℃,在95 ℃下加热2 min,随后又在4.5 min内均匀降温至50 ℃,在50 ℃保持2 min。记录结果中样品的峰值黏度、谷值黏度、终值黏度、回生值、糊化温度。
1.4 数据分析
使用Excel 2010软件、SPSS 21.0软件及Origin 2018软件进行数据分析和图表绘制。
2 结果与分析
2.1 青稞全粉的体外消化
如图1所示,相比于未处理的青稞全粉,除去纤维素和β-葡聚糖都能提高淀粉的消化率。在60 min之前,除去纤维素比除去β-葡聚糖的促消化作用更强,而60 min之后,除去β-葡聚糖的青稞粉中淀粉消化速率呈现急剧上升的趋势。由此可知,在青稞全粉内,淀粉的消化前期主要受纤维素的影响,后期则受β-葡聚糖影响更大。这可能是因为水解掉纤维素后,细胞壁结构受到较大程度的破坏,增加了淀粉与酶的接触面积[19],从而加快了淀粉的消化。而细胞壁中网状β-葡聚糖结构的包裹作用仍然存在,所以淀粉的释放速度较为均匀;而β-葡聚糖虽然参与构成了细胞壁结构,但其可能不占主导地位,故水解β-葡聚糖对细胞壁的破坏程度不如纤维素,淀粉仍被较完整的细胞壁所包裹,所以消化前期淀粉只能缓慢地释放,与细胞壁周围的酶作用,但随着消化的进行,细胞壁中由纤维素维系的结构逐渐被破坏,到达一定程度后,周围的酶得以进入细胞[20]与大量堆积在细胞内且脱离了β-葡聚糖包裹的游离淀粉作用,所以消化速度显著提升。

图1 青稞全粉中纤维素、β-葡聚糖及蛋白质对淀粉体外消化的影响
Fig.1 Effect of cellulose,β-glucan and protein in hull-less barley on the digestion of starch in vitro
另外,未经胃消化的青稞粉保留了更多的蛋白质,淀粉的消化率显著低于正常消化的全粉,说明在青稞全粉中蛋白质也会对淀粉消化有抑制作用。部分蛋白质也参与了细胞壁的构成,酶解蛋白质后完整的细胞结构也会受到一定的破坏。除此之外,还有一种可能的解释是在青稞全粉中蛋白质与淀粉之间存在相互作用力,对淀粉的释放和酶解产生影响,而正常消化的全粉中的蛋白质被胃蛋白酶酶解,这种相互作用力被破坏,因此淀粉的消化率更高。KIM等[21]和JEKINS等[22]发现了小麦粉中存在蛋白质-淀粉相互作用,这种作用具有抑制小麦制品中淀粉消化的能力,LI等[23]最近也进一步证实了小麦粉中蛋白质含量的增加能够提高淀粉对α-淀粉酶的抵抗力。在青稞全粉中,这种蛋白质-淀粉相互作用力可能也同样存在,且影响着淀粉的消化。
2.2 青稞β-葡聚糖和蛋白质对淀粉体外水解的影响
如图2所示,将纯的青稞β-葡聚糖和蛋白质加入青稞淀粉后,均能起到一定程度促进淀粉体外水解的作用,且随添加量增加促进作用更加明显,这与2.1中青稞全粉内β-葡聚糖和蛋白质会抑制淀粉消化的结论截然相反。说明β-葡聚糖和蛋白质对淀粉的抑制作用不是通过抑制酶活性实现的,而可能是因为外加β-葡聚糖和蛋白质后并不能形成完整的青稞细胞结构,没有细胞壁包裹以及其他作用力束缚的淀粉直接暴露在淀粉酶的作用下,仍易被水解。因此,β-葡聚糖和蛋白质之所以能减缓青稞淀粉消化并不是因为其本身具有抑制作用,而可能是得益于青稞的完整结构。

图2 青稞β-葡聚糖、蛋白质对青稞淀粉水解的影响
Fig.2 Effect of β-glucan and protein from hull-less barley on starch hydrolysis
2.3 青稞淀粉和蛋白质对β-葡聚糖含量的影响
如图3所示,去除淀粉和蛋白质后的青稞粉中测得的β-葡聚糖含量最高,为(6.09±0.10)%;只去除蛋白质的青稞粉中β-葡聚糖含量次之,为(5.82±0.08)%;而未处理的青稞全粉中β-葡聚糖含量仅为(5.60±0.06)%。这说明在青稞全粉内,淀粉和蛋白质的存在会降低β-葡聚糖的测定含量。一种可能的解释是在青稞完整结构中β-葡聚糖、淀粉、蛋白质形成了某种特殊结构,三者间产生了一定的相互作用力,这种结构使β-葡聚糖被部分包裹,降低了β-葡聚糖被酶水解的效率,从而降低了β-葡聚糖含量的测量值。而通过高峰α-淀粉酶和胃蛋白酶的作用后,这些结合的淀粉和蛋白质被水解,更多的β-葡聚糖得以释放[24],进而被酶水解,因此BG含量的测量值增加。

图3 青稞全粉中淀粉和蛋白质对β-葡聚糖含量测定的影响
Fig.3 Effect of starch and protein of hull-less barley on the content of β-glucan
注:不同的小写字母表示存在显著性差异,P<0.05
2.4 青稞β-葡聚糖和蛋白质对青稞全粉粒径大小及分布的影响
如图5所示,青稞全粉的粒径分布在1~10、10~100 和100~1 000 μm的粒径区间内各存在1个峰。相较于青稞全粉,去掉BG或蛋白质后的粒径变化呈现了相似的趋势,即位于100~1 000 μm区间的峰高降低,10~100 μm和1~10 μm区间的峰高提高,且平均粒径降低:青稞全粉为(118.61±8.05) μm,去除蛋白质后降低至(92.38±1.93) μm,去除BG后降低为(48.26±1.45) μm。由此可见,BG对全粉粒径的影响更大,这可能是因为BG主要分布于细胞壁中,水解β-葡聚糖后细胞完整性受到一定程度的破坏,且BG形成的网状结构的包裹作用消失,细胞内的小颗粒物质如淀粉溶出,进而影响了测得的粒径大小及分布。而相比于β-葡聚糖,蛋白质对细胞结构的作用要弱,主要组成细胞膜,在机械粉碎作用下容易破裂,仅有少数镶嵌于细胞壁[12],故水解蛋白质对颗粒粒径的影响相对较小。这一结果与CHEN等[20]比较完整荞麦粉和经过破碎的荞麦粉得出的结论一致。

a-青稞原料;b-青稞片放大1 000倍的图像;c-青稞粉放大1 000倍的图像;d-青稞片在激光共聚焦显微镜下的图像,放大倍数10倍
图5 青稞颗粒及粉末的微观结构
Fig.5 Microstructure of hull-less barley and hull-less barley powder
2.5 青稞全粉及淀粉糊化特性分析
对比未处理的青稞全粉,去掉β-葡聚糖或蛋白质后的青稞粉以及单独的青稞淀粉糊化黏度都显著降低。更高的终值黏度表明直链淀粉分子之间的结合强度在未处理的青稞全粉中最大[25],因此β-葡聚糖和蛋白质在青稞全粉内都会影响淀粉的糊化特性,这和LIU等[26]的研究一致,他们发现相较于蛋白质,β-葡聚糖对淀粉糊化特性的影响更大,这可能是因为β-葡聚糖在细胞壁中形成的网状结构将附近的蛋白质和淀粉包裹在一起形成了牢固的结构,共同影响青稞全粉的糊化黏度[27]。与在青稞全粉中相反,单独的纯青稞BG或蛋白质加入青稞淀粉中反而会降低糊化过程中体系的黏度,PEREZ-QUIRCE等[28]也发现向面包中添加小分子质量和中分子质量的β-葡聚糖能降低糊化过程体系的黏度,且随着添加量增加作用越明显,这可能是因为β-葡聚糖和蛋白质的加入减少了糊状混合物中可利用的水分,进而限制了淀粉颗粒的吸水膨胀,提高完整颗粒的保留率,降低了糊化黏度[29],而在青稞全粉中,完整的青稞结构对体系糊化黏度的增加作用强于这种降低糊化黏度的作用,水解β-葡聚糖和蛋白质会破坏青稞结构的完整性,故糊化黏度有所降低。这也解释了为什么β-葡聚糖和蛋白质在青稞全粉内能抑制淀粉消化,而单独和青稞淀粉混匀又会促进淀粉水解。
表2 青稞β-葡聚糖和蛋白质对青稞全粉和青稞淀粉糊化特性的影响
Table 2 Effect of hull-less barley β-glucan and protein on the pasting characteristics of hull-less barley powder and starch
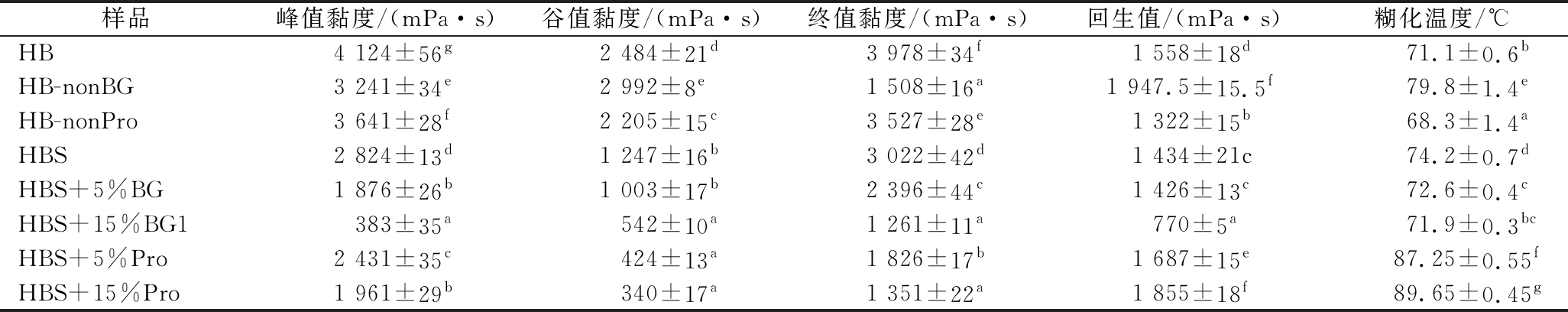
注:同一列之间不同的小写字母表示存在显著性差异( P<0.05)
样品峰值黏度/(mPa·s)谷值黏度/(mPa·s)终值黏度/(mPa·s)回生值/(mPa·s)糊化温度/℃HB4 124±56g2 484±21d3 978±34f1 558±18d71.1±0.6bHB-nonBG3 241±34e2 992±8e1 508±16a1 947.5±15.5f79.8±1.4eHB-nonPro3 641±28f 2 205±15c3 527±28e1 322±15b 68.3±1.4aHBS 2 824±13d1 247±16b3 022±42d1 434±21c74.2±0.7dHBS+5%BG1 876±26b 1 003±17b 2 396±44c1 426±13c 72.6±0.4cHBS+15%BG1383±35a 542±10a1 261±11a770±5a71.9±0.3bcHBS+5%Pro2 431±35c 424±13a 1 826±17b1 687±15e87.25±0.55fHBS+15%Pro1 961±29b 340±17a1 351±22a1 855±18f89.65±0.45g
2.6 青稞颗粒的微观结构
扫描电镜下观察青稞颗粒切片,发现青稞淀粉主要分布于细胞内部(图4-b),而多数淀粉在青稞颗粒研磨粉碎的过程中由于细胞结构破坏而游离出来 (图4-c)[30],只有部分仍保持完整的细胞结构。激光共聚焦显微镜下观察到被染成蓝色的青稞β-葡聚糖呈网状分布于细胞外层的细胞壁中(图4-d),这种分布与ZHANG等[27]观察到的一致,他们发现β-葡聚糖在细胞壁中形成了网状结构,这种网状结构能进一步将附近的蛋白质和淀粉包裹在一起形成紧密的结构,从而降低淀粉酶的可及性,抑制淀粉的消化。这种结构不仅能解释淀粉和蛋白质影响β-葡聚糖含量测定这一现象,同理也说明了青稞全粉中β-葡聚糖和蛋白质抑制淀粉消化的原因。
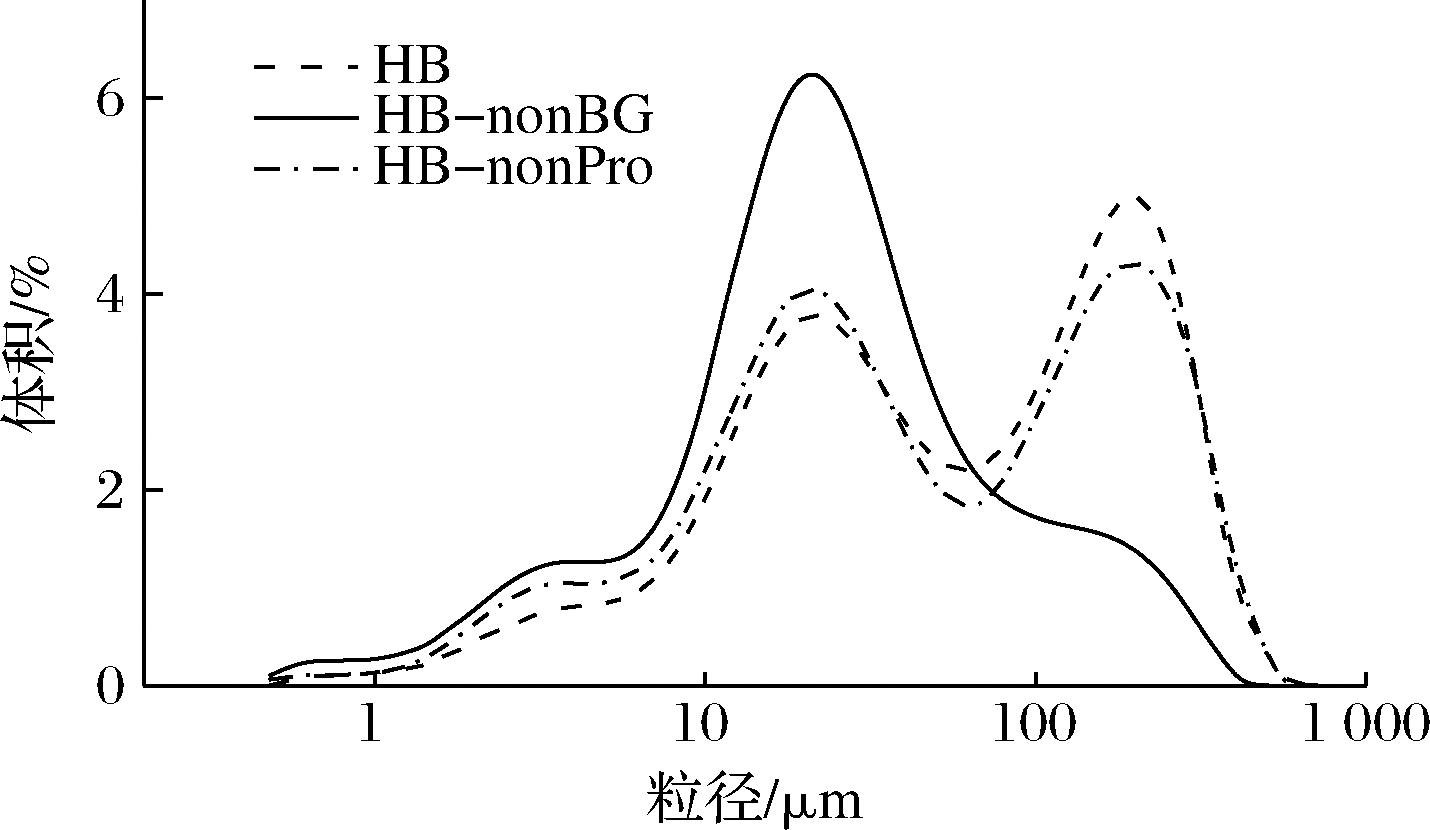
图4 青稞β-葡聚糖和蛋白质对青稞全粉粒径分布的影响
Fig.4 Effect of β-glucan and protein on the particle size distribution of hull-less barley powder
3 结论
研究表明,青稞β-葡聚糖主要位于青稞细胞壁,并对青稞淀粉起到包裹的作用,从而影响了青稞全粉的粒径及糊化特性,且全粉中的β-葡聚糖、蛋白质及纤维素对青稞淀粉的体外消化有抑制作用,而将青稞β-葡聚糖、蛋白质及淀粉重组后,这种作用即消失,且黏度也降低,同时,去除青稞蛋白质和淀粉增加了青稞β-葡聚糖的含量,这些结果说明青稞β-葡聚糖及蛋白质均能抑制淀粉的消化,且这种作用主要得益于青稞的完整细胞结构而不是黏度。因此,青稞全粉的完整结构在抑制淀粉消化中其主导作用,青稞全粉及相关产品更有利于人体健康,特别是对于肥胖和糖尿病患者。但由于体外消化和体内研究有诸多差异性,关于青稞的降血糖功效仍需进一步深入研究。
[1] ROCHLANI Y,POTHINENI N V,KOVELAMUDI S,et al.Metabolic syndrome:Pathophysiology,management,and modulation by natural compounds[J].Therapeutic Advances in Cardiovascular Disease,2017,11(8):215-225.
[2] GONG L X,CAO W Y,CHI H L,et al.Whole cereal grains and potential health effects:Involvement of the gut microbiota[J].Food Research International,2018,103:84-102.
[3] LIU R H.Whole grain phytochemicals and health[J].Journal of Cereal Science,2007,46(3):207-219.
[4] MARVENTANO S,VETRANI C,VITALE M,et al.Whole grain intake and glycaemic control in healthy subjects:A systematic review and meta-analysis of randomized controlled trials[J].Nutrients,2017,9(7):769.
[5] MONTONEN J,BOEING H,FRITSCHE A,et al.Consumption of red meat and whole-grain bread in relation to biomarkers of obesity,inflammation,glucose metabolism and oxidative stress[J].European Journal of Nutrition,2013,52(1):337-345.
[6] LUTSEY P L,JACOBS D R,KORI S,et al.Whole grain intake and its cross-sectional association with obesity,insulin resistance,inflammation,diabetes and subclinical CVD:The MESA study[J].The British Journal of Nutrition,2007,98(2):397-405.
[7] WU W J,QIU J,WANG A L,et al.Impact of whole cereals and processing on type 2 diabetes mellitus:A review[J].Critical Reviews in Food Science and Nutrition,2020,60(9):1 447-1 474.
[8] 臧靖巍, 阚建全,陈宗道,等.青稞的成分研究及其应用现状[J].中国食品添加剂,2004,5(4):43-46.
ZANG J W,KAN J Q,CHEN Z D,et al.Applications of barley and study on its components[J].China Food Additives,2004,5(4):43-46.
[9] ZHANG H,LI Z,TIAN Y J,et al.Interaction between barley β-glucan and corn starch and its effects on the in vitro digestion of starch[J].International Journal of Biological Macromolecules,2019,141:240-246.
[10] XIAO X,TAN C,SUN X J,et al.Effects of fermentation on structural characteristics and in vitro physiological activities of barley β-glucan[J].Carbohydrate Polymers,2020,231.DOI:10.1016/j.carbpol.2019.115685.
[11] HOLM J,HAGANDER B,BJ?RCK I,et al.The effect of various thermal processes on the glycemic response to whole grain wheat products in humans and rats[J].The Journal of Nutrition,1989,119(11):1 631-1 638.
[12] EDWARDS C H,GRUNDY M M,GRASSBY T et al.Manipulation of starch bioaccessibility in wheat endosperm to regulate starch digestion,postprandial glycemia,insulinemia,and gut hormone responses:A randomized controlled trial in healthy ileostomy participants[J].The American Journal of Clinical Nutrition,2015,102(4):791-800.
[13] MINEKUS M,ALMINGER M,ALVITO P,et al.A Standardised static in vitro digestion method suitable for food-an international consensus[J].Food & Function,2014,5(6):1 113-1 124.
[14] KUREK M A,KARP S,STELMASIAK A,et al.Effect of natural flocculants on purity and properties of β-glucan extracted from barley and oat[J].Carbohydrate Polymers,2018,188:60-67.
[15] CAO X Y,TONG J Y,DING M Y,et al.Physicochemical properties of starch in relation to rheological properties of wheat dough (Triticum aestivum L.)[J].Food Chemistry,2019,297.DOI:10.1016/j.foodchem.2019.125000.
[16] 杨希娟, 党斌,吴昆仑,等.青稞蛋白的超声波辅助提取工艺及其功能特性研究[J].中国食品学报,2013,13(6):48-56.
YANG X J,DANG B,WU K L,et al.Study on functional properties and hulless barley protein by ultrasonic-assisted extraction[J].Journal of Chinese Institute of Food Science and Technology,2013,13(6):48-56.
[17] LANGENAEKEN N A,IEVEN P,HEDLUND E G,et al.Arabinoxylan,β-glucan and pectin in barley and malt endosperm cell walls:A microstructure study using CLSM and cryo-SEM[J].The Plant Journal,2020,103(4):1 477-1 489.
[18] KAUSHIK M,YADAV B S,YADAV R B,et al.Assessing the influence of lentil protein concentrate on pasting and rheological properties of barley starch[J].Journal of Food Measurement and Characterization,2020,14(3):1 623-1 633.
[19] SUN J,FU J,WANG Y,et al.Endogenous rice endosperm hemicellulose slows in vitro starch digestibility[J].International Journal of Food Science & Technology,2019,54(3):734-743.
[20] CHEN Z W,HUANG Q Q,XIA Q,et al.Intact endosperm cells in buckwheat flour limit starch gelatinization and digestibility in vitro[J].Food Chemistry,2020,330:127318.
[21] KIM E H J,PETRIE J R,MOTOI L,et al.Effect of structural and physicochemical characteristics of the protein matrix in pasta on in vitro starch digestibility[J].Food Biophysics,2008,3(2):229-234.
[22] JENKINS D J A,WOLEVER T M S,THORNE M J,et al.Effect of starch-protein interaction in wheat on its digestibility and glycaemic response[J].Canadian Institute of Food Science and Technology Journal,1987,20(5):320.
[23] LI H T,LI Z F,FOX G P,et al.Protein-starch matrix plays a key role in enzymic digestion of high-amylose wheat noodle[J].Food Chemistry,2020,336.10.1016/j.foodchem.2020.127719.
[24] KARIMI R,AZIZI MH,XU Q,et al.Enzymatic removal of starch and protein during the extraction of dietary fiber from barley bran[J].Journal of Cereal Science,2018,83:259-265.
[25] JUH SZ R,SALG
SZ R,SALG A.Pasting behavior of amylose,amylopectin and their mixtures as determined by rva curves and first derivatives[J].Starch-Stärke,2008,60(2):70-78.
A.Pasting behavior of amylose,amylopectin and their mixtures as determined by rva curves and first derivatives[J].Starch-Stärke,2008,60(2):70-78.
[26] LIU Y,BAILEY T B,WHITE P J.Individual and interactional effects of β-glucan,starch,and protein on pasting properties of oat flours[J].Journal of Agricultural and Food Chemistry,2010,58(16):9 198-9 203.
[27] ZHANG J,LUO K,ZHANG G.Impact of native form oat β-glucan on starch digestion and postprandial glycemia[J].Journal of Cereal Science,2017,73:84-90.
[28] PÉREZ-QUIRCE S,LAZARIDOU A,BILIADERIS C G,et al.Effect of β-glucan molecular weight on rice flour dough rheology,quality parameters of breads and in vitro starch digestibility[J].LWT-Food Science and Technology,2017,82:446-453.
[29] BRENNAN C S,CLEARY L J.Utilisation glucagel® in the β-glucan enrichment of breads:A physicochemical and nutritional evaluation[J].Food Research International,2007,40(2):291-296.
[30] BONAFACCIA G,MAROCCHINI M,KREFT I.Composition and technological properties of the flour and bran from common and tartary buckwheat[J].Food Chemistry,2003,80(1):9-15.