乳杆菌是益生菌的重要组成部分,常见的乳杆菌有植物乳杆菌、干酪乳杆菌、鼠李糖乳杆菌、罗伊氏乳杆菌[1]等。它是一类优良的益生菌,具有维持肠道菌群稳态、缓解便秘与腹泻、提高免疫力、拮抗病菌、治疗炎症等益生功能[2],与人类的健康息息相关[3],越来越多的被应用于食品、药品、饲料等领域。
乳杆菌在体内产生益生作用需要达到较高的活菌数[4],所以微生态制剂一般采用冷冻干燥的生产工艺制备成菌粉来保证益生效果。提高乳杆菌的冻干存活率主要有两类方法[5-6],一是优化冻干保护剂及冻干工艺参数[7];二是调整菌株的生理状态使其更容易在冷冻干燥的过程中存活下来。
与微生物冻干存活率相关的生理状态主要有形态大小、荚膜多糖、胞内相容性物质及细胞膜组成等几个方面。在乳杆菌冷冻干燥条件下,这些因素均会对最终的存活率造成影响。一般认为细菌的冻干存活率与形态大小存在联系,单个细胞体积小、接近球型形态的细菌冻干存活率高;而单个细胞体积大,呈不规则形态的细菌存活率较低[8]。胞外多糖的产生被认为是有利于提高冻干存活率的因素[9],胞内相容性物质的积累能提高冻干存活率[10],细胞膜脂肪酸组成的复杂变化被认为与冻干存活率密切相关。大量研究表明,细菌能够通过细胞膜成分的改变有效提高在冷冻干燥及其他不良环境中的存活率[11]。但是什么样的细胞膜组成更有利于乳杆菌的冻干存活、通过什么手段可以改变乳杆菌的细胞膜脂肪酸组成从而提高菌的冻干存活率,目前缺乏系统的研究。
本研究旨在通过分析乳杆菌细胞膜组成差异以及其与冻干存活率的联系,得到冻干存活率较高的乳杆菌的细胞膜组成特征。并研究和比较几种调控细胞膜脂肪酸组成的有效方法,为提高乳杆菌冻干菌粉的质量提供参考。
1 材料与方法
1.1 菌株与试剂
1.1.1 菌株
植物乳杆菌(Lactobacillus plantarum)CCFM259、干酪乳杆菌(Lactobacillus casei)15m11、短乳杆菌(Lactobacillus brevis)173-1-2、鼠李糖乳杆菌(Lactobacillus rhamnosus)FAHHBO1、FJND,江南大学食品生物技术中心菌种保藏中心。
1.1.2 试剂
蛋白胨、牛肉膏、酵母粉、无水葡萄糖、无水乙酸钠、七水合硫酸镁、一水合硫酸锰、柠檬酸氢二钠、无水磷酸氢二钾、吐温20、吐温80、浓硫酸、蒽酮、甲醇钠甲醇溶液、正己烷,国药集团化学试剂有限公司;低聚异麦芽糖,上海博飞美科有限公司;食品级胶原蛋白,河北润盈生物科技有限公司;谷胱甘肽,上海麦克林生化科技有限公司。
1.2 仪器与设备
高速冷冻离心机,Eppendorf公司;GRP-9080型隔水式恒温培养箱,上海森信实验仪器有限公司;FE20型pH计、EL3002型电子天平,梅特勒-托利多仪器(上海)有限公司;MS 3 basic型涡旋振荡器,德国IKA公司;MLS-3750型高温高压灭菌锅,日本SANYO公司;ZHJH-C1115B型超净工作台,上海智诚分析仪器制造有限公司;Freeze-dryer Lyobeta 5PS双腔体冻干机,西班牙Telstar公司;KA92 NV02TI低温冰箱,日本西门子;UV-2450紫外分光光度计、GCMS-QP2010 Ultra单四级杆气相色谱质谱联用仪,日本岛津公司;JY92-IIDN超声波仪,宁波新芝;BA410E正置生物显微镜,香港麦克奥迪有限公司。
1.3 实验方法
1.3.1 乳杆菌的活化和培养
从-80 ℃冰箱中取出保菌管、在mMRS固体平板上划线,37 ℃培养48 h后长出较大的菌落。使用接种环挑取较大的单菌落至5 mL液体mMRS试管活化2代,每代培养12~14 h,获得较强活力的种子液。
高活力乳杆菌种子液以1%的接种量接种至mMRS液体培养基中,37 ℃恒温培养12 h至稳定期收菌。保证接种量、培养时间、培养状态一致。
mMRS液体培养基[12](g/L):蛋白胨10.0,牛肉膏10.0,葡萄糖20.0,酵母粉5.0,乙酸钠2.0,无水磷酸氢二钾2.0,柠檬酸氢二胺2.0,硫酸镁0.1,硫酸锰0.05,pH(6.2±0.2)。
1.3.2 乳杆菌形态大小的测定
取培养时间一致的乳酸菌,进行革兰氏染色,在装配DFC425C摄像头的莱卡显微镜下镜检。随机取形态大小具有代表性的,视野中央的100个菌体用显微镜自带的Leica Qwin V3测定长度和宽度,计算其平均值作为该菌株的长和宽。将乳杆菌看成两端是相等的均匀半球,中间是标准圆柱体,估算其面积用于表示乳杆菌大小,如公式(1)所示:
S=4 πr2+2 πrl2
(1)
式中:S,单个乳杆菌菌体表面积,μm2;r,乳酸菌杆的半径,μm;l,乳杆菌的高度,μm。
1.3.3 乳杆菌的冻干工艺和冻干保护剂
收取培养至稳定期的乳杆菌液体培养基,培养时间与测定形态大小的收菌时间一致,8 000×g(15 min)离心,去上清液收获菌泥。将菌泥与冻干保护剂溶液按1∶1(g∶mL)混匀后调pH值至6.4左右,振荡至充分均匀后取1 mL分装至西林瓶。冻干保护剂配方与冻干工艺参照谭莎莎等[13]的方法。
冻干保护剂(g/100mL):低聚异麦芽糖21.49,胶原蛋白7.16,硫酸镁0.6,谷胱甘肽0.45,硫酸锰0.3。
冻干工艺:板层预冷,放入装有乳杆菌的西林瓶,降温至-50 ℃,预冻保持4 h;一次干燥,控制层板温度-30 ℃、真空度200 μbar,保持24 h;二次干燥,控制层板温度25 ℃、真空度5 μbar,保持18 h。
1.3.4 乳杆菌的冻干存活率计算
平板菌落计数法:取0.5 mL菌液以生理盐水10倍依次梯度稀释至3个合适稀释度,各取1 mL稀释液注入无菌培养皿,将已融化并冷却至45 ℃左右的培养基倾注15 mL至培养皿中,立即放在桌上手动摇晃混匀,每个稀释度做3个平行,凝固后倒置于37 ℃培养箱,培养完成后挑选菌落数在30~300 CFU/mL的平板进行活菌计数如公式(2)所示:
冻干存活率![]()
(2)
1.3.5 乳杆菌的荚膜多糖的检测
硫酸蒽酮法测量菌株荚膜多糖含量,0.2 g蒽酮溶于100 mL浓硫酸混匀冷却。用100 μg/mL葡萄糖标准溶液配制0、10、20、30、40、60、80 μg/mL的葡萄糖溶液,取不同浓度葡萄糖溶液各1 mL加4 mL硫酸蒽酮,一起沸水浴10 min后冷却在620 nm处测定吸光值。以葡萄糖含量(μg)作为横坐标、吸光度作为纵坐标做标准曲线。
乳杆菌以1%的接种量接至mMRS液体培养基中,37 ℃恒温培养12 h后8 000×g(10 min)离心,去上清液。称取1 g菌泥,生理盐水洗涤后再以8 000×g(10 min)离心,去掉上清液。菌泥用生理盐水溶解,冰水浴下低功率81 W超声3 min辅助剥除荚膜[14],12 000×g、4 ℃、10 min离心收集上清液。上清液1 mL+4 mL硫酸蒽酮一起沸水浴10 min后冷却,在620 nm处测定吸光值。吸光值对应标准曲线计算单位菌体荚膜多糖含量,如公式(3)所示:
单位菌体荚膜多糖含量/(mg·CFU-1)=
(3)
1.3.6 乳杆菌的细胞膜脂肪酸的检测
细胞膜脂肪酸的提取:乳杆菌以1%的接种量接至mMRS液体培养基中,37 ℃恒温培养12 h后8 000×g(10 min)离心,去上清液。用8.5 g/L无菌生理盐水洗涤离心(6 000×g、4 ℃、15 min)3次,弃掉上清液,称取菌泥0.5 g。然后向得到的菌泥中加入1.5 mL浓度为1 mol/L甲醇钠的甲醇溶液剧烈振荡1.5 min,置于4 ℃静置10 min。加入1 mL的正己烷溶液,振荡1 min,静置5 min,在6 000×g离心5 min后,吸取上清液,用有机系滤头过滤,制得的样品置于气相瓶内然后进行脂肪酸含量的测定[15]。
气相条件:用GC-MS分析细胞膜脂肪酸的组成与含量,毛细管柱0.25 mm×30 m×0.25 μm,载气为高纯氦气,进样量为1 μL,不分流进样。进样口温度240 ℃,柱流速1 mL/min,柱起始温度为160 ℃,以5 ℃/min升温至190 ℃保持5 min,再以2 ℃/min升温至220 ℃,保持5 min。
1.3.7 乳杆菌的胞内甜菜碱的检测
甜菜碱提取[16]:按1.3.1的方法培养乳杆菌12 h至稳定期,8 000×g(10 min)离心得菌泥,取1 g湿菌泥用生理盐水洗涤2遍。加10%(体积分数)高氯酸振荡10 min,KOH调至pH值为7。12 000 ×g离心20 min取上清液,用0.22 μm无机滤膜过滤后定容至20 mL后检测。
液相色谱条件:色谱柱:X Bridge Amide(4.6 mm×250 mm,3.5 μm);流动相∶V(乙腈)∶V(水)=85∶15;检测波长:195 nm;流速:1.0 mL/min;柱温:30 ℃;进样量:10 μL,14 min左右出峰,甜菜碱含量计算如公式(4)所示:
(4)
式中:m,单位菌体的胞内甜菜碱含量,mg;c,甜菜碱质量浓度,μg/mL;N,菌体的活菌数,CFU/mL。
1.3.8 调控乳杆菌细胞膜脂肪酸组成的培养方式
本实验采用4种不同的培养方式(酸胁迫、冷胁迫、添加吐温80、添加吐温20),从而探究不同的培养方式对细胞膜脂肪酸组成的影响以及细胞膜脂肪酸组成与冻干存活率的联系。
酸胁迫实验[17]:活化过的乳杆菌按1%的接种量在mMRS培养基中培养12 h至稳定期,8 000×g(15 min)离心收集菌泥重悬于pH 3.5的mMRS培养基中酸应激4 h,得到的菌体进行后续的冷冻干燥和细胞膜脂肪酸组成分析。
冷胁迫实验[18]:活化过的乳杆菌按1%的接种量在mMRS培养基中培养12 h至稳定期,置于4 ℃条件下冷应激2 h,得到的菌体进行后续的冷冻干燥和细胞膜脂肪酸组成分析。
添加吐温80培养[19]:在mMRS液体培养基中添加2 mL/L的吐温80,活化过的乳杆菌按1%的接种量在含过量吐温80的液体培养基中培养12 h至稳定期,得到的菌体进行后续的冷冻干燥和细胞膜脂肪酸组成分析。
添加吐温20培养:在mMRS液体培养基中添加2 mL/L的吐温20,活化过的乳杆菌按1%的接种量在含过量吐温20的液体培养基中培养12 h至稳定期,得到的菌体进行后续的冷冻干燥和细胞膜脂肪酸组成分析。
1.4 数据统计与分析
试验中每个实验值均是3次平行实验的平均值。不同组之间的显著性差异采用IBM SPSS Statistics 22.0软件进行ANOVA分析(DUNCAN检验),P<0.05 则认为差异显著;采用Graphpad 8.01进行生长曲线和柱形图的绘制。
2 结果与分析
2.1 形态统一的乳杆菌表面物质和相容性物质检测
乳杆菌的冻干存活率受到多个因素的影响,主要包括形态大小、胞外表面物质的产生、胞内相容性物质的积累以及细胞膜脂肪酸的组成等[20]。为了重点研究细胞膜脂肪酸对乳杆菌冻干存活率产生的影响,首先系统分析了江南大学食品生物技术中心菌种保藏中心不同乳杆菌的形态大小、胞外多糖及胞内相容性溶质,然后从中筛选这些条件一致的乳杆菌进一步研究乳杆菌细胞膜脂肪酸组成特征对乳杆菌冻干存活率的影响及细胞膜脂肪酸组成的调控方法。
通过筛选得到5株形态一致的不同种属的乳杆菌,如表1所示。5株乳杆菌形态大小相近,长宽比为3左右,呈典型的杆菌形态。单个杆菌表面积在3 μm2左右,差异较小,不会因形态大小对冻干存活率造成较大差异。
表1 实验中乳杆菌的形态大小、荚膜多糖、胞内甜菜碱浓度
Table 1 The morphology,capsular polysaccharide and the
glycine betaine of the selected Lactobacillus
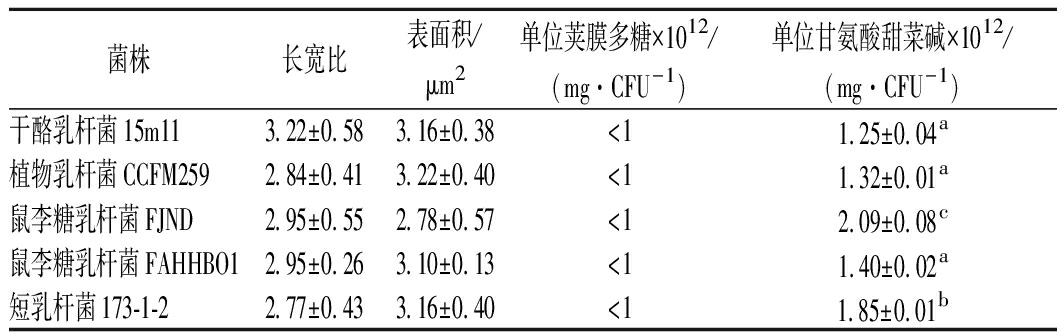
菌株长宽比表面积/μm2单位荚膜多糖×1012/(mg·CFU-1)单位甘氨酸甜菜碱×1012/(mg·CFU-1)干酪乳杆菌15m113.22±0.583.16±0.38<11.25±0.04a植物乳杆菌CCFM2592.84±0.413.22±0.40<11.32±0.01a鼠李糖乳杆菌FJND2.95±0.552.78±0.57<12.09±0.08c鼠李糖乳杆菌FAHHBO12.95±0.263.10±0.13<11.40±0.02a短乳杆菌173-1-22.77±0.433.16±0.40<11.85±0.01b
注:组间不同字母表示具有显著性差异(P<0.05)(下同)
前期研究表明,乳杆菌表面物质的产生过量时,会降低冻干保护剂对乳杆菌的保护效率,导致菌体冻干存活率降低;乳杆菌胞外多糖含量<10-11mg/CFU这个水平时,不会影响菌的冻干存活率[17]。本研究筛选出的5株乳杆菌荚膜多糖产量均<10-12mg/CFU,不会对乳杆菌冻干存活率造成明显影响。
选择最具代表性的相容性溶质甘氨酸甜菜碱表示胞内相容性溶质含量,相容性溶质的积累差异一般在高渗有外源物质补充的环境下发生[21],实验中的乳杆菌在mMRS培养基培养条件下胞内相容性溶质甘氨酸甜菜碱含量很低,远达不到影响冻干存活率的程度。
综上,经筛选所得5株乳杆菌:干酪乳杆菌15m11、植物乳杆菌CCFM259、鼠李糖乳杆菌FJND、鼠李糖乳杆菌FAHHBO1、短乳杆菌173-1-2形态大小差异较小、胞外多糖及相容性溶质不足以影响冻干存活率,通过这5株乳杆菌进行后续的细胞膜脂肪酸研究。
2.2 不同乳杆菌的细胞膜脂肪酸组成
在相同的培养条件下培养5株乳杆菌,利用GC-MS分析了乳杆菌细胞膜脂肪酸的具体组成(表2)。并根据乳杆菌的组成比例(图1)及平均链长等特征对5株乳杆菌的细胞膜脂肪酸组成进行比较分析。
表2 实验乳杆菌菌株的细胞膜脂肪酸组成及相对含量 单位:%
Table 2 The composition and relative content of cell membrane fatty acid of Lactobacillus

甲基脂肪酸酯干酪乳杆菌15m11植物乳杆菌CCFM259鼠李糖乳杆菌FJND鼠李糖乳杆菌FAHHBO1短乳杆菌173-1-2C14∶02.46±0.05d1.71±0.03c1.09±0.06a1.47±0.04b1.76±0.06cC16∶032.39±0.18a39.28±0.10b32.07±0.10a32.94±0.21a32.54±0.13aC16∶18.44±0.05d4.41±0.01b3.2±0.01a5.23±0.01c4.66±0.03bC18∶01.90±0.11a2.59±0.03b12.83±0.01d3.99±0.39c1.56±0.06aC18∶141.32±0.15c35.49±0.01a36.62±0.12b47.87±0.13d47.64±0.25dcycC19∶013.49±0.08c16.52±0.11d14.19±0.16c8.5±0.07a11.84±0.09b不饱和比例63.25±0.12d56.42±0.10b54.01±0.05a61.6±0.21c64.14±0.13e
由表2可知,乳杆菌脂肪酸组成的主要成分为饱和脂肪酸十六烷酸(C16∶0)、不饱和脂肪酸十八烯酸(C18∶1)和环丙烷脂肪酸(cycC19∶0),3种主要的成分占总脂肪酸的80%以上,十六烯酸(C16∶1)和十八烷酸(C18∶0)含量较低不超过10%。不同乳杆菌细胞膜脂肪酸的组成有较大差异,鼠李糖乳杆菌FJND的不饱和度最低为(54.01±0.10)%,平均链长最长达到17.39±0.01。干酪乳杆菌15m11和短乳杆菌173-1-2的不饱和度较高,分别为(63.25±0.12)%以及(64.14±0.13)%,平均链长分别为17.21±0.01 和17.30±0.01。细胞膜的不饱和度及链长会影响细胞膜在冷冻干燥这个不良环境中的流动性,从而影响冻干存活率,一般认为高不饱和度低链长的脂肪酸组成具有较高的膜流动性[22],细菌有利用脂肪酸组成改变细胞膜以应对环境压力,确保细胞膜保持最佳的状态和持续的功能。极地环境中的嗜冷微生物的不饱和度往往可以达到95%以上[23],从而在低温下能存活繁殖。乳杆菌在37 ℃正常培养条件下不饱和度被调控为约55%~65%,通过环境的扰动及添加过量的脂肪酸可以使正常的细胞膜受到扰动,令细胞膜脂肪酸组成发生改变来适应环境的变化。
2.3 细胞膜脂肪酸组成对冻干存活率的影响
5株乳杆菌冻干存活率见表3,在完全相同冻干工艺下5株乳杆菌的冻干存活率有较大差异,由于整个培养以及冻干保护剂都保持一致,形态、胞内外物质的干扰也较小,存活率的差异很大程度上来自于细胞膜脂肪酸的差异。一般而言,较长的链长增加了双分子层间酰基链的相互作用,促进了更紧密的结构,较短的链跨越的疏水双层结构域较少,受链间力的限制也较少,有助于更流动的结构。不饱和脂肪酸中的双键通过增加链的体积和旋转自由度来减少链的相互作用[24],酰基链长和饱和度共同影响细胞膜的流动性,而流动性会影响冷冻干燥过程中膜相变的发生和膜损伤的程度[25]。根据实验中乳杆菌细胞膜脂肪酸组成分析可知,鼠李糖乳杆菌FJND细胞膜不饱和度最低,链长最长,结果其冻干存活率表现较差。干酪乳杆菌15m11和鼠李糖乳杆菌FAHHBO1不饱和度较高,链长较短,表现出了较理想的冻干存活率,这与普遍认为的高不饱和度低链长的脂肪酸组成有利于细胞膜维持流动性相符。乳杆菌细胞膜脂肪酸不饱和度>60%、平均链长<17.30时,乳杆菌存活率较高,推测是由于这个范围内的乳杆菌细胞膜流动性较好,在冷冻干燥过程中受到较小的损伤。实验中短乳杆菌173-1-2的不饱和度为(64.14±0.13)%,平均链长17.31,但存活率较低,仅有(41.87±1.44)%,可能在没有分析到的应激蛋白表达、DNA分子受损修复上存在问题,本文将继续研究通过提高不饱和脂肪酸的含量是否可以提高其冻干存活率。
表3 实验乳杆菌菌株的冻干存活率 单位:%
Table 3 Survival rate of Lactobacillus after freeze-drying
实验菌株干酪乳杆菌15m11植物乳杆菌CCFM259鼠李糖乳杆菌FJND鼠李糖乳杆菌FAHHBO1短乳杆菌173-1-2存活率79.02±0.41a60.29±2.77b45.22±1.54c78.40±3.78a41.87±1.44c

a-乳杆菌细胞膜脂肪酸组成比例;b-乳杆菌细胞膜脂肪酸平均链长
图1 实验中乳杆菌脂肪酸组成比例和细胞膜脂肪酸平均链长
Fig.1 The composition of cell membrane fatty acid and average
chain length of Lactobacillus
注:组间不同字母表示具有显著性差异(P<0.05)(下同)
2.4 细胞膜脂肪酸调控及其对乳杆菌冻干存活率的影响
经过上述的细胞膜脂肪酸组成以及冻干存活率的分析,结果表明乳杆菌细胞膜的组成会影响最终的冻干存活率。对乳杆菌来说,高不饱和度和低链长的细胞膜脂肪酸组成有利于最终的冻干存活。鼠李糖乳杆菌FJND和短乳杆菌173-1-2的冻干存活率较低,考虑是否可以通过环境营养、环境应激手段调节细胞膜脂肪酸组成从而提高乳杆菌冻干存活率。有研究表明,很多因素都能改变脂质组成进而影响细胞膜流动性;包括温度、化学物质、离子、压力、营养物和微生物培养物的生长阶段[26]。吐温20是外源月桂酸(C12∶0)补充剂,吐温80是外源油酸(C18∶1)补充剂,被报道可以改变细胞膜脂肪酸组成[27]。酸应激、冷应激[28]也均有报道能提高乳杆菌不饱和度,改变细胞膜流动性。然而通过这些因素调节细胞膜脂肪酸组成的效果如何,哪种调节细胞膜脂肪酸的手段最适合用在乳杆菌冻干工艺中应用还没有具体的比较总结。本实验选择了较温和并且破坏性较小的调控手段,研究环境应激以及外源脂肪酸添加分别对细胞膜脂肪酸组成和存活率的影响。
2.4.1 环境应激对细胞膜脂肪酸组成的改变
乳杆菌通过冷应激和酸应激处理后,细胞膜脂肪酸会有小幅度的改变,冷应激能略微提高乳杆菌的不饱和度,酸应激对细胞膜脂肪酸组成影响很小。2种应激处理均没有很明显的冻干存活率的提升,其中鼠李糖乳杆菌FJND经过冷应激和酸应激处理后冻干存活率从(45.22±1.54)%分别提高到(45.84±4.11)%和(50.52±1.24)%,短乳杆菌173-1-2经过冷应激与酸应激处理后冻干存活率还发生了下降,这与预期的实验结果有所差别,猜测是应激虽然略微提高了细胞膜脂肪酸不饱和度但是乳杆菌在应激过程中产生了不可逆的损伤,最终的存活率发生下降。
如图2所示,冷应激、酸应激造成的细胞膜饱和度改变很小,链长基本不会发生改变,这是由于环境应激对细胞膜产生扰动后,细胞膜开始改变脂肪酸合成朝着更适合应激环境的方向改变[29],由于环境中没有充足的现成脂肪酸,乳杆菌需要通过延长酶及去饱和酶从头合成或者改变脂肪酸的结构,这个过程通常是比较缓慢的,因此通过冷应激、酸应激处理的乳杆菌饱和度及链长并没有很大的改变,冻干存活率也无显著提高。
2.4.2 添加外源脂肪酸对细胞膜脂肪酸组成的改变
由表4可知,过量添加富含月桂酸的吐温20之后细胞膜组成中出现了本不存在的月桂酸,过量添加富含油酸的吐温80细胞膜脂肪酸中油酸的比例大大提高,说明乳杆菌可以利用环境中现成的脂肪酸调节自身脂肪酸组成。2种脂肪酸的添加均提高了乳杆菌的冻干存活率,月桂酸的添加造成了不饱和度的降低,但是同时造成了平均链长显著的降低,最终冻干存活率有较小幅度的提升。由图3可知,外源油酸的添加极大的提高了不饱和度,平均链长稍有增加,最终的冻干存活率提升较大,鼠李糖乳杆菌FJND的冻干存活率从(45.22±1.54)%提升至(59.63±1.55)%,而短乳杆菌173-1-2冻干存活率从(41.87±1.44)%提升至(60.72±1.15)%。

图3 不同处理后乳杆菌冻干存活率变化
Fig.3 Changes of survival rate of lyophilized Lactobacillus
after different treatments
表4 营养和应激对鼠李糖乳杆菌FJND和短乳杆菌173-1-2细胞膜脂肪酸组成影响 单位:%
Table 4 Effects of environmental nutrition and stress on the fatty acid composition of L.rhamnosus FJND and L.brevis 173-1-2

甲基脂肪酸酯鼠李糖乳杆菌FJND短乳杆菌173-1-2对照组T20T80冷应激酸应激对照组T20T80冷应激酸应激C12∶0ND5.50±0.04NDNDNDND2.62±0.01NDNDNDC14∶01.09±0.06a3.83±0.01d2.87±0.01c1.03±0.01a1.26±0.04b1.76±0.06a1.62±0.02a6.34±0.04c1.83±0.01a2.00±0.06bC16∶032.07±0.10c48.97±0.45d21.29±0.10a29.8±0.07b32.18±0.01c32.54±0.13c35.52±0.06d12.95±0.06a31.02±0.08b32.67±0.04cC16∶13.20±0.01b3.95±0.14c1.23±0.02a4.76±0.09d3.15±0.03b4.66±0.03a4.67±0.16a6.15±0.04c5.03±0.08b4.58±0.11aC18∶012.83±0.01d6.63±0.09b1.12±0.01a8.97±0.01c13.21±0.06e1.56±0.06c1.12±0.13b0.4±0.06a1.08±0.01b2.13±0.08dC18∶136.62±0.12b26.13±0.12a57.54±0.06d46.78±0.01c36.13±0.05b47.64±0.25c43.71±0.16b26.62±0.18a48.74±0.03d46.81±0.35ccycC19∶014.19±0.16c4.99±0.30a15.95±0.06d8.66±0.01b14.07±0.03c11.84±0.09b10.74±0.29a47.54±0.11d12.30±0.01c11.81±0.49b不饱和比例54.01±0.05b35.07±0.32a74.72±0.10d60.2±0.07c53.35±0.11b64.14±0.13b59.12±0.03a80.31±0.04c66.07±0.09b63.20±0.24b
注:ND表示未检测到
通过过量添加外源脂肪酸的方法培养,乳杆菌的饱和度范围、链长范围会发生很大的改变,而冷应激、酸应激造成的细胞膜饱和度改变很小,链长基本不会发生改变。因此,通过调控细胞膜脂肪酸组成提高乳杆菌的冻干存活率,采取添加外源脂肪酸的方法能比应激处理获得更加理想的效果。

a-总不饱和脂肪酸变化;b-链长变化
图2 乳杆菌总不饱和脂肪酸及链长的变化
Fig.2 Changes of total unsaturated fatty acids and
chain length in Lactobacillus
3 结论
不同乳杆菌的细胞膜脂肪酸不饱和度与链长具有差异,且会影响菌体的冻干存活率。高不饱和度、低平均链长的脂肪酸组成更有利于乳杆菌在冷冻干燥的环境下存活。添加外源脂肪酸或环境应激后,乳杆菌细胞膜脂肪酸组成会产生改变,细胞膜脂肪酸组成的改变可以显著提升乳杆菌的冻干存活率。低温、酸等应激对乳杆菌细胞膜脂肪酸影响较小,通过应激处理乳杆菌冻干存活率的变化不显著。而通过添加外源脂肪酸的方式会使乳杆菌饱和度和链长均发生较大的改变,存活率会产生较明显的提升。添加2 mL/L的吐温80后,乳杆菌不饱和度明显提高,平均链长略微提高,冻干存活率显著提高;添加2 mL/L的吐温20后,乳杆菌不饱和度和平均链长均显著下降,冻干存活率略微提升。
[1] DIXIT Y, WAGLE A, VAKIL B.Patents in the field of probiotics, prebiotics, synbiotics:A review[J].Journal of Food:Microbiology, Safety & Hygiene, 2016, 1(2):1-13.
[2] MENG X, ZHANG G, CAO H, et al.Gut dysbacteriosis and intestinal disease:Mechanism and treatment[J].Journal of Applied Microbiology, 2020, 129(4):787-805.
[3] KERRY R G, PATRA J K, GOUDA S, et al.Benefaction of probiotics for human health:A review[J].Journal of Food & Drug Analysis, 2018, 26(3):927-939.
[4] YANG C, YAN J, et al.Dose-response efficacy and mechanisms of orally administered CLA-producing Bifidobacterium breve CCFM683 on DSS-induced colitis in mice-ScienceDirect[J].Journal of Functional Foods, 2020, 75(1):1-17.
[5] CARVALHO A S, SILVA J, HO P, et al.Relevant factors for the preparation of freeze-dried lactic acid bacteria[J].International Dairy Journal, 2004, 14(10):835-847.
[6] 李明慧, 尚一娜, 霍麒文, 等.真空冷冻干燥对乳酸菌损伤机制的研究进展[J].食品科学, 2018, 39(19):273-279.
LI M H, SHANG Y N, HUO Q W, et al.Research progress on damage mechanism of lactic acid bacteria caused by vacuum freeze drying[J].Food Science, 2018, 39(19):273-279.
[7] JOFRÉ A, AYMERICH T, GARRIGA M.Impact of different cryoprotectants on the survival of freeze-dried Lactobacillus rhamnosus and Lactobacillus casei/paracasei during long-term storage[J].Beneficial Microbes, 2015, 6(3):381-386.
[8] SENZ M, VANL B, STAHL U, et al.Control of cell morphology of Lactobacillus acidophilus for enhanced cell stability during freeze-drying and storage[J].New Biotechnology, 2012, 29:208.
[9] LAEZZA A, CASILLO A, COSCONATI S, et al.Decoration of chondroitin polysaccharide with threonine:Synthesis, conformational study and ice-recrystallization inhibition activity[J].Biomacromolecules, 2017, 18(8):2 267-2 276.
[10] NAKAGAWA Y, SOTA M, KOUMOTO K.Cryoprotective ability of betaine-type metabolite analogs during freezing denaturation of enzymes[J].Biotechnol Lett, 2015, 37(8):1 607-1 613.
[11] MAULUCCI G, COHEN O, DANIEL B, et al.Fatty acid-related modulations of membrane fluidity in cells:Detection and implications[J].Free Radical Research Communications, 2016, 50(1):40-50.
[12] DOMINIK R, KAFKA T A, LENZ C A, et al.Interrelation between Tween and the membrane properties and high pressure tolerance of Lactobacillus plantarum[J].BMC Microbiology, 2018, 18(1):72.
[13] 谭莎莎, 马方励, 崔树茂, 等.罗伊氏乳杆菌冻干保护剂的优选及高密度冻干工艺优化[J].食品与发酵工业, 2020, 46(4):1-6.
TAN S S, MA F L, CUI S M, et al.Optimum selection of protectant for lyophilization of Lactobacillus reuteri and optimization of high density lyophilization process[J].Food and Fermentation Industries, 2020, 46(4):1-6.
[14] 吴晟, 崔树茂, 毛丙永, 等.干酪乳杆菌菌体表面物质对冻干存活率的影响[J].食品与发酵工业, 2020, 46(17):73-79.
WU S, CUI S M, MAO B Y, et al.Effects of surface substances of Lactobacillus casei on survival rate of freeze-drying[J].Food and Fermentation Industries, 2020, 46(17):73-79.
[15] 吴重德. 干酪乳杆菌抵御酸胁迫的生理机制解析[D].无锡:江南大学, 2012.
WU Z D.Physiological mechanism of Lactobacillus casei resisting acid stress[D].Wuxi:Jiangnan University, 2012.
[16] LOUESDON S, CHARLOT-ROUGÉ, JUILLARD V, et al.Osmotic stress affects the stability of freeze-dried Lactobacillus buchneri R1102 as a result of intracellular betaine accumulation and membrane characteristics[J].Journal of Applied Microbiology, 2014, 117(1):196-207.
[17] 田丰伟, 尹义敏, 翟齐啸, 等.细胞膜ATPase活性和膜脂肪酸组成对植物乳杆菌耐酸性的影响[J].中国食品学报, 2016, 16(12):17-22.
TIAN F W, YIN Y M, ZHAI Q X, et al.Effects of membrane ATPase activity and membrane fatty acid composition on acid tolerance of Lactobacillus plantarum[J]. Journal of Chinese Institute of Food Science and Technology, 2016, 16(12):17-22.
[18] 张筠, 孟祥晨, 石丹, 等.冷适应对德氏乳杆菌保加利亚亚种FL6冻干存活率及其细胞膜脂肪酸的影响[J].食品科技, 2015, 40(5):20-25.
ZHANG J, MENG X C, SHI D, et al.Effects of cold adaptation on lyophilized survival rate and membrane fatty acids of Lactobacillus bulgaricus FL6[J].Food Science and Technology, 2015, 40(5):20-25.
[19] 马佳歌, 于微, 姜瞻梅, 等.营养胁迫植物乳杆菌KLDS 1.0328 的生理特性及其冷冻干燥菌粉贮存稳定性的分析[J/OL].食品科学, 2021.http://kns.cnki.net/kcms/detail/11.2206.TS.20201016.1806.002.html.
MA J G, YU W, JIANG Z M, et al.Physiological characteristics of Lactobacillus plantata KLDS 1.0328 under nutrient stress and analysis of storage stability of freeze-dried bacterial powder[J/OL].Food Science, 2021.http://kns.cnki.net/kcms/detail/11.2206.TS.20201016.1806.002.html.
[20] LOUESDON S, CHARLOT-ROUGÉ, S, JUILLARD V, et al.Osmotic stress affects the stability of freeze-dried Lactobacillus buchneri R1102 as a result of intracellular betaine accumulation and membrane characteristics[J].Journal of Applied Microbiology, 2014, 117(1):196-207.
[21] 王海娟. 保加利亚乳杆菌细胞内甜菜碱的转运及其调控蛋白初探[D].哈尔滨:哈尔滨工业大学, 2015.
WANG H J.Betaine transport in Lactobacillus bulgaricus cells and its regulatory proteins[D].Harbin:Harbin Institute of Technology, 2015.
[22] DE MENDOZA D, PILON M.Control of membrane lipid homeostasis by lipid-bilayer associated sensors:A mechanism conserved from bacteria to humans[J].Progress in Lipid Research, 2019, 76:100 996.
[23] 李博, MATTHIAS D, 李艳, 等.内陆土壤冷适应细菌的筛选分类与细胞膜脂肪酸的适冷机制[J].微生物学通报, 2010, 37(8):1 110-1 116.
LI B, MATTHIAS D, LI Y, et al.Screening and classification of cold-adapted bacteria in inland soil and the cold-adapted mechanism of fatty acids in cell membrane[J].Microbiology China, 2010, 37(8):1 110-1 116.
[24] QUINN P J.The fluidity of cell membranes and its regulation[J].Progress in Biophysics and Molecular Biology, 1981, 38:1-104.
[25] VELLY H, BOUIX M, PASSOT S, et al.Cyclopropanation of unsaturated fatty acids and membrane rigidification improve the freeze-drying resistance of Lactococcus lactis subsp.lactis TOMSC161[J].Applied Microbiology and Biotechnology, 2015, 99(2):907-918.
[26] MYKYTCZUK N C S, TREVORS J T, LEDUC L G, et al.Fluorescence polarization in studies of bacterial cytoplasmic membrane fluidity under environmental stress[J].Progress in Biophysics & Molecular Biology, 2007, 95(1-3):60-82.
[27] SAITO H E, HARP J R,FOZO E M, et al.Enterococcus faecalis responds to individual exogenous fatty acids independently of their degree of saturation or chain length[J].Applied & Environmental Microbiology, 2018,84(1):e01 633-17.
[28] 印伯星, 车舒雅, 张臣臣, 等.酸胁迫和冷胁迫对鼠李糖乳杆菌的交叉保护作用[J].食品研究与开发, 2020, 41(12):37-41.
YIN B X, CHE S Y, ZHANG C C, et al.Cross protection of Lactobacillus rhamnosus under acid and cold stress[J].Food Research and Development, 2020, 41(12):37-41.
[29] MONTANARI C, KAMDEM S L S, SERRAZANETTI D I, et al.Synthesis of cyclopropane fatty acids in Lactobacillus helveticus and Lactobacillus sanfranciscensis and their cellular fatty acids changes following short term acid and cold stresses[J].Food Microbiology, 2010, 27(4):493-502.