柑橘果茶是一种将柑橘果肉掏空,晾干之后填入茶叶,后经风干收缩而成的复合果茶,如柑普茶、柑白茶和柠檬红茶等。近年来,由于其潜在的健康效应和独特的口感,越来越受到消费者的青睐。湘柑茶是利用湖南丰富的柑橘和茶叶资源,采用湖南主要栽培的特色柑橘品种的柑皮与安化天尖茶为原料,经过挖果、填茶、杀青、干燥等工艺加工而成的一种“湘式”新茶饮。柑橘果茶的柑壳和陈皮原料近似,陈皮根据果实成熟度的不同又可以分为青皮、微红皮和大红皮。ZHANG等[1]利用代谢组学对广陈皮不同成熟期化学特性进行分析,发现它们的黄酮类物质、柠檬苦素、生物碱和酚酸的含量不同。青皮在预防心脑血管疾病、抗癌抗肿瘤方面效果更佳,而大红皮具有更加明显的抑菌、消炎、止咳等生理活性[2]。香气成分是评价茶叶品质的重要指标,新会柑普茶的不同成熟度的茶枝柑制得的柑普茶的风味物质存在显著差异[3]。综上所述,不同的成熟度的柑果对柑橘茶的品质有很大的影响。
顶空气相色谱-离子迁移谱技术(headspace-gas chromatography-ion mobility spectrometry, HS-GC-IMS)是一种基于气相色谱和离子迁移谱技术的新技术,其可以检测未经预处理的液体或固体样品中挥发性有机物的指纹图谱,从而更完整地保存样品的风味。由于仪器对具有高负电性或强质子亲和性官能团结构的识别具有较高的灵敏度,因此利用气相色谱和离子迁移谱技术的新技术分析食品风味物质具有独特的优势。此外,由系统生成的指纹可以更直观、方便地观察样品间的差异。近年来,HS-GC-IMS被广泛应用于食品领域的挥发性化合物分析,如中药[4]、蜂蜜[5]、覆盆子酒[6]等。然而,GC-IMS仪器无法准确测定挥发成分含量。因此,将IMS与其他设备相结合能够增强其优势,以便对香气进行全面评价。气味活性值(odor activity value,OAV)计算被广泛应用于食品中关键气味活性化合物的筛选和鉴定[7]。常用的挥发性有机物测定方法是顶空固相微萃取-气相色谱质谱(head space-solid phase microextraction-gas chromatography-mass spectrometry, HS-SPME-GC-MS)技术,它可以根据保留指数进行比较鉴定,通过加入内标或外标进行准确的定量分析。据此,可以进一步进行OAV计算,筛选出关键香气化合物。到目前为止,还没有涉及柑橘果茶中的香气成分OAV值的报道。
本实验首次以金盆柚和天尖茶为原料制备湘柑茶,研究不同成熟度的金盆柚制备的果茶的加工品质、营养品质、感官评价等,同时通过HS-GC-IMS技术结合HS-SPME-GC-MS技术分析湘柑茶香气品质,并采用主成分分析对湘柑茶品质进行综合评价,以期为消费者对不同成熟度的柑橘制备的湘柑茶的选择比较和产品推广等提供理论参考。
1 材料与方法
1.1 材料与试剂
没食子酸、芦丁、柚皮苷(均为标准品),成都曼思特生物科技有限公司;橙皮苷(标准品),美国MCE公司;氢氧化钠、环己酮、碳酸钠、亚硝酸铝、亚硝酸钠(均为分析纯),甲醇(色谱纯),国药集团化学试剂公司。
金盆柚,湖南省岳阳县惠泰云有限公司;天尖茶,湖南省白沙溪茶厂有限责任公司。采用未成熟、半成熟、完全成熟的金盆柚果实与天尖茶叶进行制备湘柑茶。样品名称和具体原料信息见表1。
表1 湘柑茶信息表
Table 1 Information sheet on Xianggan teas ingredients

样品编号柑橘信息柑橘名称GPS坐标采收时间成熟度茶叶信息T1金盆柚29°15′N, 17.08.2019未成熟T2Citrus junos Sieb. ex Tanaka′yuzu′113°12′E18.09.2019半成熟天尖茶T320.10.2019全成熟
1.2 仪器与设备
DE-500 g型多功能粉碎机,浙江红景天工贸有限公司;DHG-9053A型鼓风干燥箱,上海精宏实验设备有限公司;E1204-IC型电子天平,瑞士梅特勒-托利多公司;UV-1800型紫外-可见分光光度计,岛津仪器(苏州)有限公司;Acquity超高效液相色谱仪,美国Waters公司;Color Quest XE型全自动色度分析仪,美国Hunter Lab公司;Flavour Spec®气相离子迁移谱联用仪:内置500 V/cm电场强度、300 MBq辐射氚、5 kV 漂移电压、98 mm迁移管的IMS标准模块,FS-SE-54-CB-1气相色谱多毛细管柱(15 m×0.53 mm×0.2 μm),德国G.A.S公司;6890 N-5973型气相色谱质谱仪(NIST08谱库),美国Agilent公司;二乙烯基苯/聚二甲基硅氧烷萃取头(DVB/PDMS,50/30 μm,65 μm),德国默克公司。
1.3 试验方法
1.3.1 湘柑茶待测样品的制备
湘柑茶制备:将采摘的金盆柚新鲜柑果用清水洗净后从顶部开盖,挖出果肉并再次清洗晾干,填充市售的天尖茶至柑果壳3/4高度,盖上顶盖,85 ℃杀青2 h后转45 ℃烘干。每隔30 min对湘柑茶进行称重,直到湘柑茶质量不变为止。
待测样制备:将每种湘柑茶成品分成A、B、C 3组:A组取湘柑茶的柑皮液氮辅助下进行研磨,粉碎机粉碎,过40目筛并混合均匀,锡箔袋封口后放在15 ℃下贮藏待进行柑皮相应理化指标的测定;B组取整个成品进行液氮研磨,粉碎机粉碎,过40目筛并混合均匀,锡箔袋封口后放在15 ℃下贮藏待进行香气成分的测定;C组成品用来测定色度和进行感官评价。
1.3.2 指标测定
1.3.2.1 加工特性
湘柑茶的加工特性包括原料果皮厚度、挖果难易程度、成品湘柑茶形态,具体评价表如下。
表2 湘柑茶加工特性评价表
Table 2 Evaluation table of processing characteristics
of Xianggan teas

项目品评标准分值厚薄适中13~20原料果皮厚度 较薄或较厚7~13太薄或太厚0~6囊衣与果皮结合较松散,容易挖果25~40挖肉难易程度 囊衣与果皮结合较紧密,较容易挖果10~25囊衣与果皮结合紧密,不易挖果0~9表面光滑,无裂纹,倒置不漏茶叶25~40成品湘柑茶形态表面较光滑,个别裂纹,倒置轻微漏茶叶10~25表面粗糙有凸起,裂纹较多,倒置漏茶叶0~9
1.3.2.2 色度
用色度分析仪测定湘柑茶柑皮的色泽,记录L*值、a*值和b*值取平均值。其中 L*值为样品的亮度值,a*值为红绿值,b*值为黄蓝值。
1.3.2.3 总黄酮含量
参考SN/T 4592─2016《出口食品中总黄酮的测定》中的分光光度法测定。取1.3.1中的A组1 g待测样品加体积分数为60%的乙醇50 mL,40 ℃超声提取50 min后,滤入100 mL容量瓶中。重复过滤2次,合并滤液待测。吸取2.0 mL样品溶液,用氢氧化钠(质量分数为60%)补充至5.0 mL,加1 mL硝酸钠(50 g/L),摇匀,放置6 min,加入1.5 mL硝酸铝(100 g/L),摇匀,放置6 min,加入4 mL 氢氧化钠(200 g/L),用体积分数为60%的乙醇定容至刻度,摇匀,放置15 min。在510 nm波长处测定吸光度值。结果以每克样品中芦丁质量表示。
1.3.2.4 总酚含量
采用福林-酚法[8]测定。取1.3.1中的A组1 g待测样品加10 mL甲醇,50 ℃超声处理30 min,以4 000 r/min离心10 min,收集上清液于容量瓶中,残渣以10 mL甲醇重复提取2次,合并上清液,用甲醇定容至50 mL,待测。吸取2 mL待测液于10 mL刻度比色管中,加5.0 mL蒸馏水,再加0.5 mL福林酚试剂,摇匀1 min后再加入1.5 mL碳酸钠(质量分数为20%),将样品放入45 ℃的水浴锅反应15 min,取出样品后充分摇匀,在765 nm处测其吸光度值。
1.3.2.5 橙皮苷和柚皮苷含量
采用UPLC法[9]测定。样品预处理:取1.3.2.3中制备的待测液,过0.22 μm滤膜后待测。
UPLC条件:Waters Acquity UPLC BEH Cis键合色谱柱(180 mm×2.1 mm×1.7 pirn);流动相:甲醇(流动相A),水(流动相B);洗脱条件:采用梯度洗脱,0~3 min,40%~45%流动相A;3~7 min,45%~40%流动相A;7~50 min,40%流动相A。流速0.15 mL/min;进样量2 μL;柱温30 ℃;检测波长283 nm;橙皮苷、柚皮苷标准曲线方程分别为:y=23 689x-41 965, R2=0.996 7;y=23 681x-69 798, R2=0.997 6。
1.3.2.6 挥发性香气物质的测定
(1)HS-GC-IMS检测条件
顶空孵化温度80 ℃,孵化时间20 min,孵化转速500 r/min。载气为高纯氮气(≥99.999%),色谱柱温度60 ℃,色谱运行时间30 min,载气的流速梯度设置为2 mL/min保持2 min,在20 min内线性增至100 mL/min后保持10 min。顶空进样针温度85 ℃、进样量100 μL。
(2)HS-GC-MS检测条件
参照遵循吕海鹏等[10]的方法,稍作修改。如下:
顶空-固相微萃取:取B组6 g待测样品移入20 mL 顶空进样瓶中,加入4 mL饱和氯化钠溶液和10 μL的内标物环己酮(50 mg/L,乙醇稀释)后,立即用聚四氟乙烯隔垫密封,60 ℃水浴平衡5 min,顶空萃取30 min后,插入老化好的萃取头,在250 ℃的气相色谱进样器中无分裂解吸5.5 min。
J&W DB-5石英毛细色谱柱(30 m×0.25 mm×0.25 μm);升温程序:50 ℃保持5 min,以3 ℃/min升至125 ℃保持3 min,然后以2 ℃/min升至180 ℃保持3 min,最终在15 ℃/min时增至230 ℃保持6 min;载气(He)流速1.0 mL/min,压力2.4 kPa,进样量1 μL。
质谱条件:电子轰击离子源;电子能量70 eV;传输线温度275 ℃;离子源温度230 ℃;母离子m/z 285;激活电压1.5 V;质量扫描范围m/z 35~550。
通过质谱与标准NIST 08文库的保留指数比较,采用内标法计算挥发性化合物的含量。
1.3.2.7 感官评价
对制备的3种湘柑茶样品进行10 s沸水洗茶后,以1∶50(g∶mL)用煮茶器煮茶20 min后进行感官评价。组成20人评定小组(男女各10人),对汤色(20分),香气(30分),滋味(30分)和形态(20分)进行评定,具体评价标准见表3。
表3 湘柑茶感官评价标准
Table 3 Sensory evaluation criteria of Xianggan teas
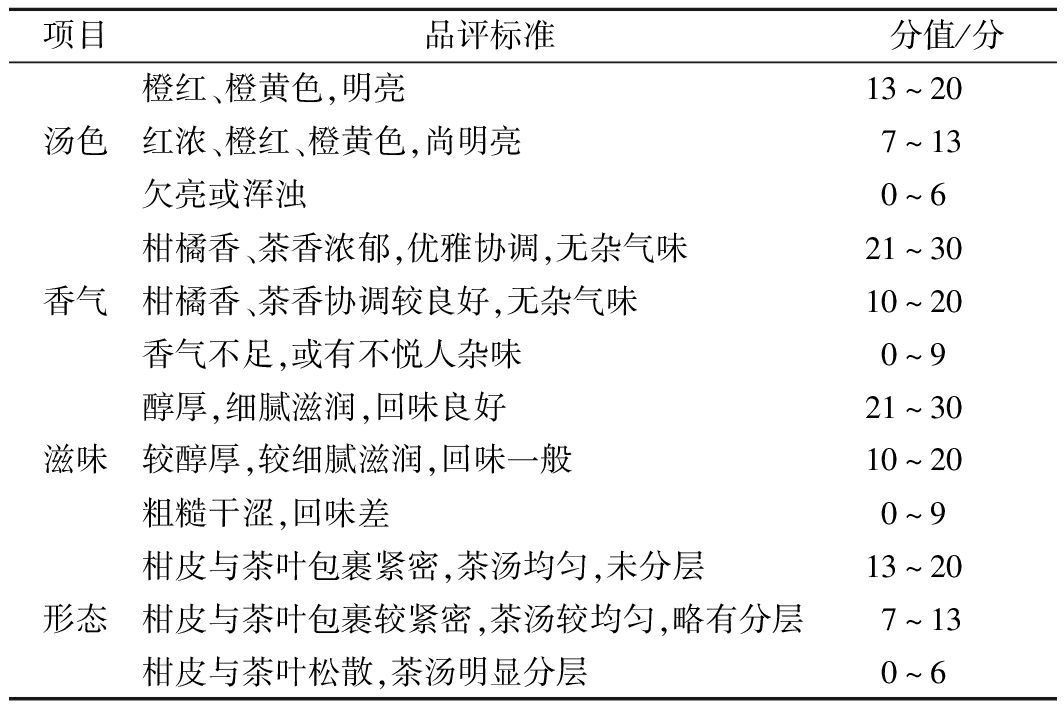
项目品评标准分值/分橙红、橙黄色,明亮13~20汤色红浓、橙红、橙黄色,尚明亮7~13欠亮或浑浊0~6柑橘香、茶香浓郁,优雅协调,无杂气味21~30香气柑橘香、茶香协调较良好,无杂气味10~20香气不足,或有不悦人杂味0~9醇厚,细腻滋润,回味良好21~30滋味较醇厚,较细腻滋润,回味一般10~20粗糙干涩,回味差0~9柑皮与茶叶包裹紧密,茶汤均匀,未分层13~20形态柑皮与茶叶包裹较紧密,茶汤较均匀,略有分层7~13柑皮与茶叶松散,茶汤明显分层0~6
1.4 数据统计和分析
以T1、T2、T3 3种湘柑茶样品的理化指标和关键香气成分作为样本单元进行主成分分析;采用SPSS 20.0对湘柑茶的理化指标进行ANOVA方差分析(P<0.05表示差异显著),采用Origin 2020作图;OAV值的计算参考PANG等[11]的方法;所有实验均重复4次,结果以平均值±标准差表示。
HS-GC-IMS数据使用LAV(Laboratory Analytical Viewer)软件进行,使用内置的NIST数据库和IMS数据库对物质进行定性分析;Reporter插件直接对样品进行二维图谱差异性对比;Gallery Plot插件程序构建挥发性指纹图谱。
2 结果与分析
2.1 湘柑茶的加工特性
如图1所示,湘柑茶的加工品质中果皮的厚度是T2最适宜,太薄会在干燥过程中变脆,产生裂纹,太厚则不利于茶叶填充。随着金盆柚成熟度的增加,囊衣与果皮结合越松散,越容易挖果。3种样品的湘柑茶形态表面均光滑,形态良好。加工品质总分最高的是T3,达74.8分。
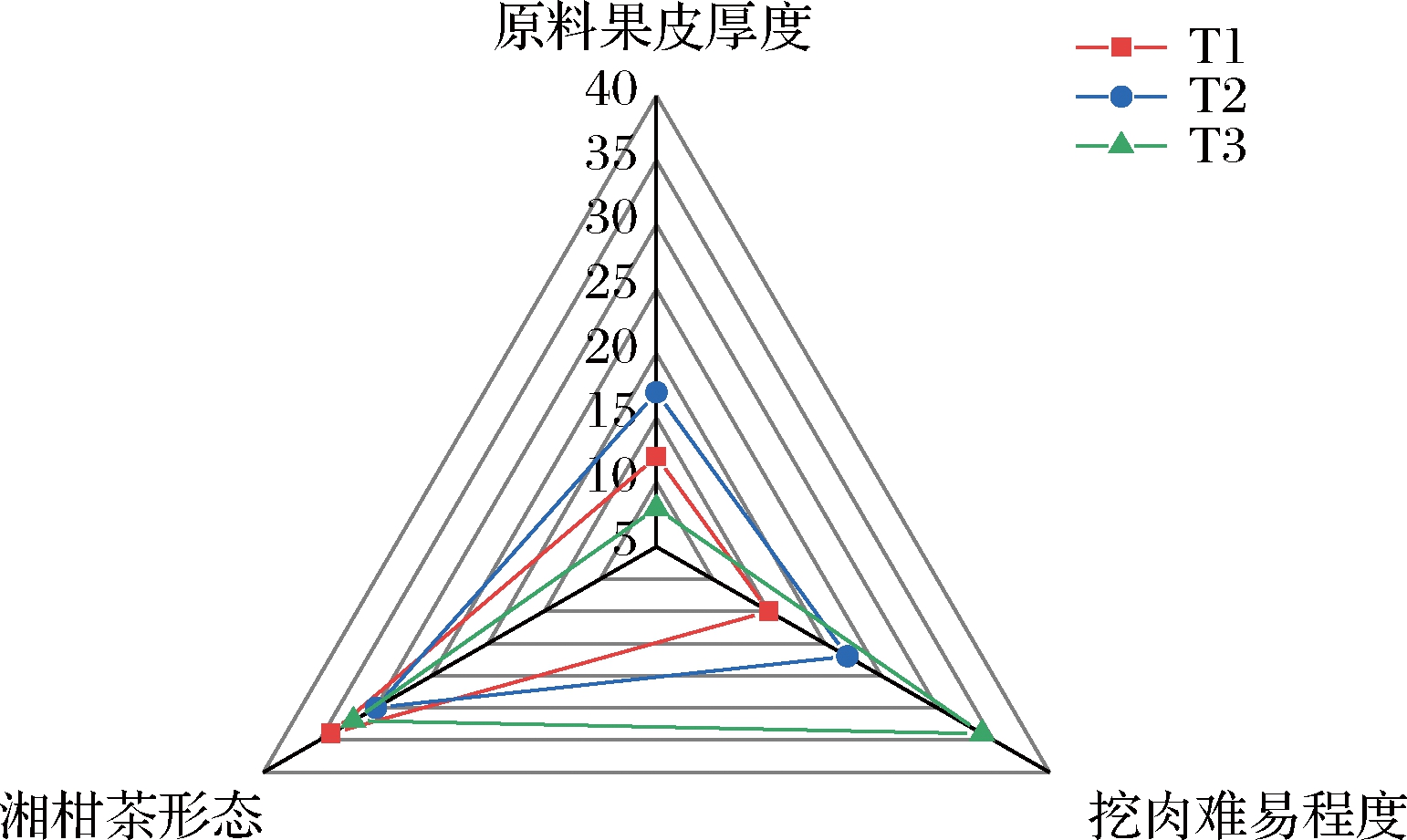
图1 加工特性雷达图
Fig.1 Processing characteristics radar chart
2.2 湘柑茶外型及色度
湘柑茶外型为圆型,外部是柑皮壳,内里为茶叶,顶盖开口。其色泽是最直观的外部体现,在一定程度上影响消费者的选择。柑橘在制备湘柑茶的过程中会发生柑皮颜色的变化,不同的成熟度的柑橘制备的湘柑茶具有显著区别。不同成熟度柑橘制备的湘柑茶外型如图2所示,各色泽值的比较见图3。
湘柑茶的体积随着柑橘的成熟度的增加逐渐增大,T1最小,T2适中,T3最大,这与柑橘新鲜果实的大小一致。L*是明度指数,表示色彩的明暗度,由图3可知,T3的L*值高于其他样品,T1次之。a*值为呈色物质的红绿值,正值时表示红色程度,负值时表示绿色程度[9]。T1的a*值为负值,偏向绿色,与其他样品差异显著(P<0.05);T2的a*值小于T3,且均为正值,即代表颜色偏向红色。b*值为黄蓝值,从黄(+b*)到蓝(-b*)渐变,湘柑茶的b*均为正值,代表偏黄,且T3最偏黄。上述色度与图2的T1感官颜色为绿色,T2为暗橘色,T3为橘黄色相符。

图2 湘柑茶样品
Fig.2 Sample of Xianggan tea
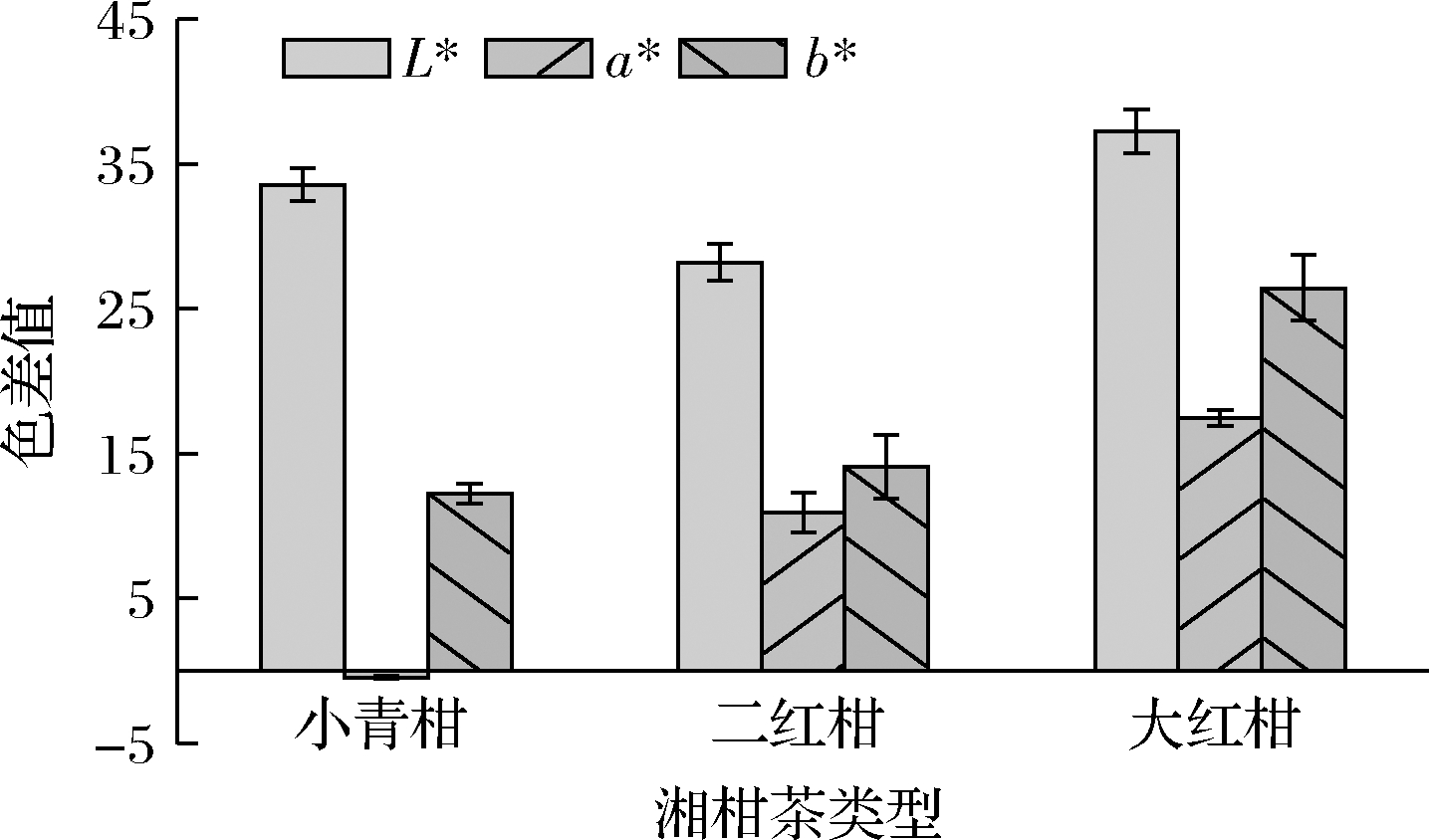
图3 不同湘柑茶的色度
Fig.3 The color of different Xianggan tea
2.3 总黄酮和总酚的含量
总黄酮(total flavonoid, TF)和总酚(total phenols, TP)是自由基清除剂,可以预防心血管疾病,能够抗炎症、降低血脂、血糖等。由图4可知,柑皮中TF含量随着柑橘的成熟逐渐降低,其中T1中TF含量最高为9.2 mg/g,相比其他样品较为显著(P<0.05)。这与施学骄[12]发现随着酸橙果实成熟度增加,总黄酮含量均呈现递减的变化趋势一致。湘柑茶中TP的含量均大于7 mg/g,且T2中TP含量最高,T3次之,T1最低。WANG等[13]研究表明,茶枝柑(Citrus reticulata ‘Chachi’)果皮中绿原酸、对香豆酸和阿魏酸在果皮成熟过程中积累量分别增加了26.7%、17.2%和31.7%。这些酚类化合物的积累促进了TP含量的增加。以采收期为维度,同一柑橘品种中TP的含量随生长期的延长呈先增加后减少[14]。这与湘柑茶的柑皮的采收时间不同而导致的TP变化一致。

图4 总酚和总黄酮含量
Fig.4 Total phenol and flavonoids content
注:不同小写字母表示差异显著(P<0.05)(下同)
2.4 橙皮苷和柚皮苷含量
柑桔皮中黄酮类物质种类繁多, 但现今分离提取主要集中在其中的橙皮苷和柚皮苷上;同时, 这2种物质是所有柑桔属植物的果皮中含量最大的生物活性成分[15]。在本研究中,以金盆柚为原料的同一类型湘柑茶中柚皮苷的含量均大于橙皮苷。其中,由图5可知,随着金盆柚采摘的成熟度逐渐增加,湘柑茶中柚皮苷与橙皮苷的差值也越来越大,在T3中两者差值达到最高为15.2 mg/g。这与施学骄[12]对5~7月采摘的枳壳的橙皮苷与柚皮苷的关系的分析相同。除此之外,湘柑茶中橙皮苷含量随着原料成熟度增大呈下降趋势,且含量均大于3.5 mg/g,满足《中华人民共和国药典》[16]规定陈皮的入药级标准。然而,柚皮苷的含量则呈相反趋势,T1中柚皮苷的含量(15.6 mg/g)远低于T2(19.4 mg/g)和T3(20.6 mg/g)。酸橙随着果实成熟度的增加,柚皮苷的含量往往也相应增加。研究表明,YOO等[17]和WANG等[13]分别发现日本柚子和茶枝柑果皮中的柚皮苷的含量随着果实的成熟而升高,与本研究结果一致。

图5 橙皮苷和柚皮苷含量
Fig.5 Hesperidin and naringin content
2.5 不同成熟度柑橘对湘柑茶香气的影响
2.5.1 HS-GC-IMS分析结果
2.5.1.1 湘柑茶中香气化合物的鉴定
用C2~C9的正丁酮至正壬酮作为外标参考计算每种化合物的保留指数,基于挥发性物质的气相色谱保留时间和离子漂移时间对挥发性组分进行定性分析。以现有的软件内置NIST气相保留指数数据库与IMS漂移时间数据库资料,共鉴定出85个峰,定性检出64种挥发性物质,包括醇类12种、醛类18种、酯类9种、酮类10种、萜烯类10种、杂环类4种和硫化物2种(表4)。此外,还检测到一些数据库中未包含的物质。一些单一化合物在漂移时间尺度上具有多重信号,这可以解释为分析离子与中性分子(如二聚体和水合物)之间的加合物在IMS漂移管的运动过程中形成。研究表明,这种团簇的形成在具有高质子亲和力的化合物中尤为常见[18]。在本研究中,大多数醛、烯烃以及α-松油醇、芳樟醇、2-乙基呋喃、乙酸乙酯和乳酸乙酯都有双峰。
表4 挥发性成分信息表
Table 4 Volatile components information sheet

编号中文名CAS号化学式分子质量保留指数保留时间/s漂移时间/ms备注醇类A1α-松油醇C98555C10H18O154.31 238.2688.2021.296 8单体 A2α-松油醇C98555C10H18O154.31 237.1686.6361.786 4二聚体A34-萜烯醇C562743C10H18O154.31 206.8643.1541.223 84-A4β-松油醇C138874C10H18O154.31 137.2542.9741.222 9-A5芳樟醇C78706C10H18O154.31 108.0500.9581.221 69单体 A6芳樟醇C78706C10H18O154.31 107.4500.1921.699 81二聚体A7正辛醇C111875C8H18O130.21 080.1460.9521.471 95-A8乙醇C64175C2H6O46.1428.5104.5551.132 44-A9反式-2-己烯-1-醇C18829555C7H12O112.2959.2309.7651.258 51-A10芳樟醇氧化物C60047178C10H18O2170.31 072.1449.3451.265 11-A11苏合香醇C98851C8H10O122.21 087.9472.1571.195 97-A12香叶醇C106241C10H18O154.31 238.8689.0661.222 6-A131-戊醇C71410C5H12O88.1758.4190.1131.250 29-A14正己醇C111273C6H14O102.2874.9245.4931.326 58-醛类B1癸醛C112312C10H20O156.31 278.1745.6941.539 49单体 B2癸醛C112312C10H20O156.31 280.2748.722.056 91二聚体B3壬醛C124196C9H18O142.21 113.7509.1821.477 51-B4正辛醛C124130C8H16O128.21 010.2360.2971.403 45单体 B5正辛醛C124130C8H16O128.21 009.7359.5981.832 98二聚体B6苯甲醛C100527C7H6O106.1963.0312.8541.153 33单体 B7苯甲醛C100527C7H6O106.1963.0312.8541.471 51二聚体B8 庚醛C111717C7H14O114.2904.8264.5891.327 73单体 B9庚醛C111717C7H14O114.2904.3264.2031.699 17二聚体B10青叶醛C6728263C6H10O98.1851.4233.6991.183 95单体 B11青叶醛C6728263C6H10O98.1850.6233.3131.520 77二聚体B12糠醛C98011C5H4O296.1829.8222.8881.085 44单体 B13糠醛C98011C5H4O296.1829.8222.8881.335 72二聚体B14丁醛C123728C4H8O72.1558.1133.8321.286 96-B15戊醛C110623C5H10O86.1690.4163.9831.427 34-B16苯乙醛C122781C8H8O120.21 044.6409.8421.251 05-B17反-2-辛烯醛C2548870C8H14O126.21 072.1449.3441.825 66-B18正己醛C66251C6H12O100.2793.6204.741.253 18单体
续表3
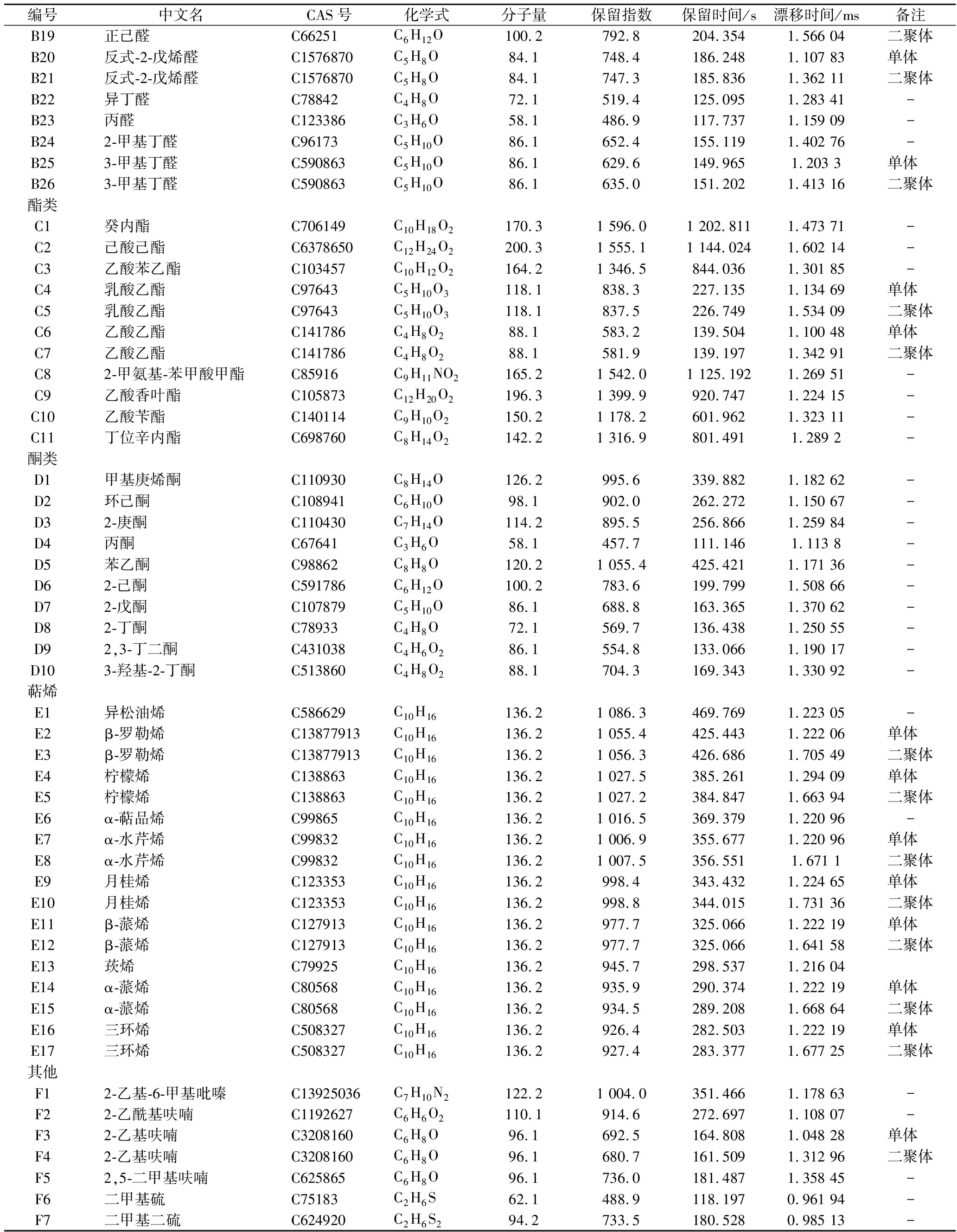
编号中文名CAS号化学式分子量保留指数保留时间/s漂移时间/ms备注B19正己醛C66251C6H12O100.2792.8204.3541.566 04二聚体B20反式-2-戊烯醛C1576870C5H8O84.1748.4186.2481.107 83单体 B21反式-2-戊烯醛C1576870C5H8O84.1747.3185.8361.362 11二聚体B22异丁醛C78842C4H8O72.1519.4125.0951.283 41-B23丙醛C123386C3H6O58.1486.9117.7371.159 09-B242-甲基丁醛C96173C5H10O86.1652.4155.1191.402 76-B253-甲基丁醛C590863C5H10O86.1629.6149.9651.203 3单体 B263-甲基丁醛C590863C5H10O86.1635.0151.2021.413 16二聚体酯类C1癸内酯C706149C10H18O2170.31 596.01 202.8111.473 71-C2己酸己酯C6378650C12H24O2200.31 555.11 144.0241.602 14-C3乙酸苯乙酯C103457C10H12O2164.21 346.5844.0361.301 85-C4乳酸乙酯C97643C5H10O3118.1838.3227.1351.134 69单体 C5乳酸乙酯C97643C5H10O3118.1837.5226.7491.534 09二聚体C6乙酸乙酯C141786C4H8O288.1583.2139.5041.100 48单体 C7乙酸乙酯C141786C4H8O288.1581.9139.1971.342 91二聚体C82-甲氨基-苯甲酸甲酯C85916C9H11NO2165.21 542.01 125.1921.269 51-C9乙酸香叶酯C105873C12H20O2196.31 399.9920.7471.224 15-C10乙酸苄酯C140114C9H10O2150.21 178.2601.9621.323 11-C11丁位辛内酯C698760C8H14O2142.21 316.9801.4911.289 2-酮类D1甲基庚烯酮C110930C8H14O126.2995.6339.8821.182 62-D2环己酮C108941C6H10O98.1902.0262.2721.150 67-D32-庚酮C110430C7H14O114.2895.5256.8661.259 84-D4丙酮C67641C3H6O58.1457.7111.1461.113 8-D5苯乙酮C98862C8H8O120.21 055.4425.4211.171 36-D62-己酮C591786C6H12O100.2783.6199.7991.508 66-D72-戊酮C107879C5H10O86.1688.8163.3651.370 62-D82-丁酮C78933C4H8O72.1569.7136.4381.250 55-D92,3-丁二酮C431038C4H6O286.1554.8133.0661.190 17-D103-羟基-2-丁酮C513860C4H8O288.1704.3169.3431.330 92-萜烯E1异松油烯C586629C10H16136.21 086.3469.7691.223 05-E2β-罗勒烯C13877913C10H16136.21 055.4425.4431.222 06单体 E3β-罗勒烯C13877913C10H16136.21 056.3426.6861.705 49二聚体E4柠檬烯C138863C10H16136.21 027.5385.2611.294 09单体 E5柠檬烯C138863C10H16136.21 027.2384.8471.663 94二聚体E6α-萜品烯C99865C10H16136.21 016.5369.3791.220 96-E7α-水芹烯C99832C10H16136.21 006.9355.6771.220 96单体 E8α-水芹烯C99832C10H16136.21 007.5356.5511.671 1二聚体E9月桂烯C123353C10H16136.2998.4343.4321.224 65单体 E10月桂烯C123353C10H16136.2998.8344.0151.731 36二聚体E11β-蒎烯C127913C10H16136.2977.7325.0661.222 19单体 E12β-蒎烯C127913C10H16136.2977.7325.0661.641 58二聚体E13莰烯C79925C10H16136.2945.7298.5371.216 04E14α-蒎烯C80568C10H16136.2935.9290.3741.222 19单体 E15α-蒎烯C80568C10H16136.2934.5289.2081.668 64二聚体E16三环烯C508327C10H16136.2926.4282.5031.222 19单体 E17三环烯C508327C10H16136.2927.4283.3771.677 25二聚体其他F12-乙基-6-甲基吡嗪C13925036C7H10N2122.21 004.0351.4661.178 63-F22-乙酰基呋喃C1192627C6H6O2110.1914.6272.6971.108 07-F32-乙基呋喃C3208160C6H8O96.1692.5164.8081.048 28单体 F42-乙基呋喃C3208160C6H8O96.1680.7161.5091.312 96二聚体F52,5-二甲基呋喃C625865C6H8O96.1736.0181.4871.358 45-F6二甲基硫C75183C2H6S62.1488.9118.1970.961 94-F7二甲基二硫C624920C2H6S294.2733.5180.5280.985 13-
注:-表示无法准确区分构型
根据各类挥发性有机物的总量,绘制湘柑茶的香气相对组成图。如图6所示,整体来看,烯烃(22.3%~29.2%)、醇类(19.3%~27.0%)和醛类(11.3%~15.3%)作为主要的芳香化合物在所有样品中含量较多。随着柑橘的成熟度的增加,湘柑茶的香气中醇类、醛类、酯类、酮类和烯烃组分总量均逐步增加。江津津等[3]发现未成熟的果实制备的柑普茶的香气中杂环化合物(5.8%)大于相对成熟的果实制备的柑普茶(3.4%),与本研究中湘柑茶中随着成熟度的提高,由杂环化合物和硫化物组成的其他组分香气总量逐渐降低相一致。

图6 湘柑茶的香气相对组成
Fig.6 The aroma of Xianggan tea is relatively composed
2.5.1.2 样品间直观差异性对比
采用风味分析仪的Reporter插件程序生成二维谱图(图7),以便对样品的挥发性物质进行比较。纵坐标表示保留时间,横坐标表示漂移时间,红色垂直线表示反应离子峰(reaction ion peak,RIP),RIP两侧的每个点代表1种挥发性有机物。选择以T1样品的谱图为参比,可直接比较不同处理果实的风味物质差异。扣除背景后相同浓度的化合物颜色为白色,红色点表示化合物的浓度高于参比样品,红色越深表示浓度越高;而蓝点则表示化合物的浓度低于参比样品,蓝色越深表示样品浓度越低。由图7可知,挥发性物质聚集在0~1 000 s,主要分布在漂移时间1.0~1.5 ms。不同湘柑茶具有相似的挥发性物质,但是浓度明显不同。随着成熟度的增加,湘柑茶的挥发性有机物的浓度逐渐降低,主要呈蓝色。不同成熟度制备的湘柑茶的挥发性有机物可通过HS-GC-IMS技术很好地分离,且可直观识别不同处理的挥发性物质的差异。

图7 湘柑茶的HS-GC-IMS差异对比图谱
Fig.7 The HS-GC-IMS differential and comparative
map of Xianggan tea
2.5.1.3 挥发性指纹图谱分析
由于二维光谱显示了挥发性成分的全貌,很难准确分析图像中的重叠物质。因此,根据所有的信号峰形成了湘柑茶的指纹图谱(图8)。在指纹图谱中,每一行代表同一样品的所有挥发性峰,每一列代表同一物质在不同样品中的信号峰。斑点的颜色从蓝色到红色不等,表明挥发性物质的浓度从低到高。鉴定出的85个信号峰值用它们现有名称进行标记,数字代表IMS数据库中没有的未知物质。

图8 基于HS-GC-IMS的湘柑茶的指纹图谱
Fig.8 The fingerprint of Xianggan tea based on HS-GC-IMS
T1在A区域内的挥发性物质的含量比T2、T3多。挥发性物质包括3种酯类:乙酸苯乙酯、乙酸乙酯和丁位辛内酯;3种酮类:2-庚酮、2-己酮和2-丁酮,2-正己醇。其中,酯类主要来源于脂氧合酶途径和氨基酸代谢,这些化合物大多表现出典型的果味或花味,与水果风味的“果香”属性有关。2-庚酮、2-己酮和2-丁酮都属于具有特殊香气的低碳饱和酮,大量存在于奶酪中[19]。B区域内包括绝大部分的醛类,5种酮类,3种醇类,3种酯类,此外还有2,5-二甲基呋喃和2-乙基呋喃。这些物质在T2中的含量均大于其他样品。几乎所有的醛类和酮类都被证明是香气的重要组成部分,醛是次生代谢物,形成于柑橘成熟期间,并提供类似柑橘的水果味道。正己醛、壬醛、青叶醛和癸醛分别是C6、C9或C10醛,起源于多不饱和脂肪酸氧化后的产物被过氧化物裂解酶裂解的过程[20],这是植物产生清香风味成分的基本途径。在水果的主要香气成分中癸内酯具有与桃子、甜牛奶相似的气味,其生物合成与氧化途径有关,如桃子中的β-癸内酯、椰子中的γ-辛内酯等[21]。金盆柚属于杂交香橙品种,这是首次在金盆柚制成的衍生品中发现癸内酯。
在指纹图谱其他区域,芳樟醇、3-羟基-2-丁酮、三环烯、柠檬烯、蒎烯、月桂烯和α-水芹烯等化合物在所有样品中均含量较高。郑敏[22]研究表明柑普茶的外皮中烯烃类化合物的相对含量占87%以上,可见大量的萜烯类物质在湘柑茶的整体香气中起着关键作用。糖醛、2-乙酰基呋喃和3-甲基丁醛-单体在T3中含量最高,湘柑茶干燥过程中,呋喃和吡嗪类化合物通过在美拉德反应中脱水脱氧醛糖降解氨基酸而产生[18]。除此之外,挥发性硫化物是重要的芳香诱导化合物,具有门槛低、气味强的特点,广泛分布于食品中。二甲基硫化物[23]被描述为一种芦笋、玉米和糖蜜的香气,被认为是一种在低浓度下有益的化合物。湘柑茶中二甲基硫在T2中含量较多,二甲基二硫在T1中含量较多。此外,2-甲基丁醛、3-甲基丁醛是在茶叶加工过程中产生这些具有麦芽糖气味的醛,可能是由于其母氨基酸缬氨酸、异亮氨酸和亮氨酸与偏二羰基化合物的反应[24],如氧化茶多酚或甲基乙二醛。
2.5.2.1 挥发性香气成分的测定
由表5可知,3种湘柑茶中共检测出115种香气成分,其中酯类6种、醇类21种、酮醛类10种、烯类65种、烷类7种、酚类4种。目前江津津等[3]比较了4种柑橘果茶的挥发性香气成分,也仅鉴定出42种挥发性成分,因此湘柑茶产生的香气成分种类较其他柑橘制备的柑橘果茶多。香气成分质量浓度总量为T2>T1>T3。其中,烯类最多,醇类次之(图9)。

图9 湘柑茶中挥发性有机物的含量
Fig.9 The content of volatile organic matter in the
Xianggan tea
表5 HS-SPME-GC-MS技术测定湘柑茶中挥发性成分含量
Table 5 Determination of volatile components in Xianggan tea by HS-SPME-GC-MS
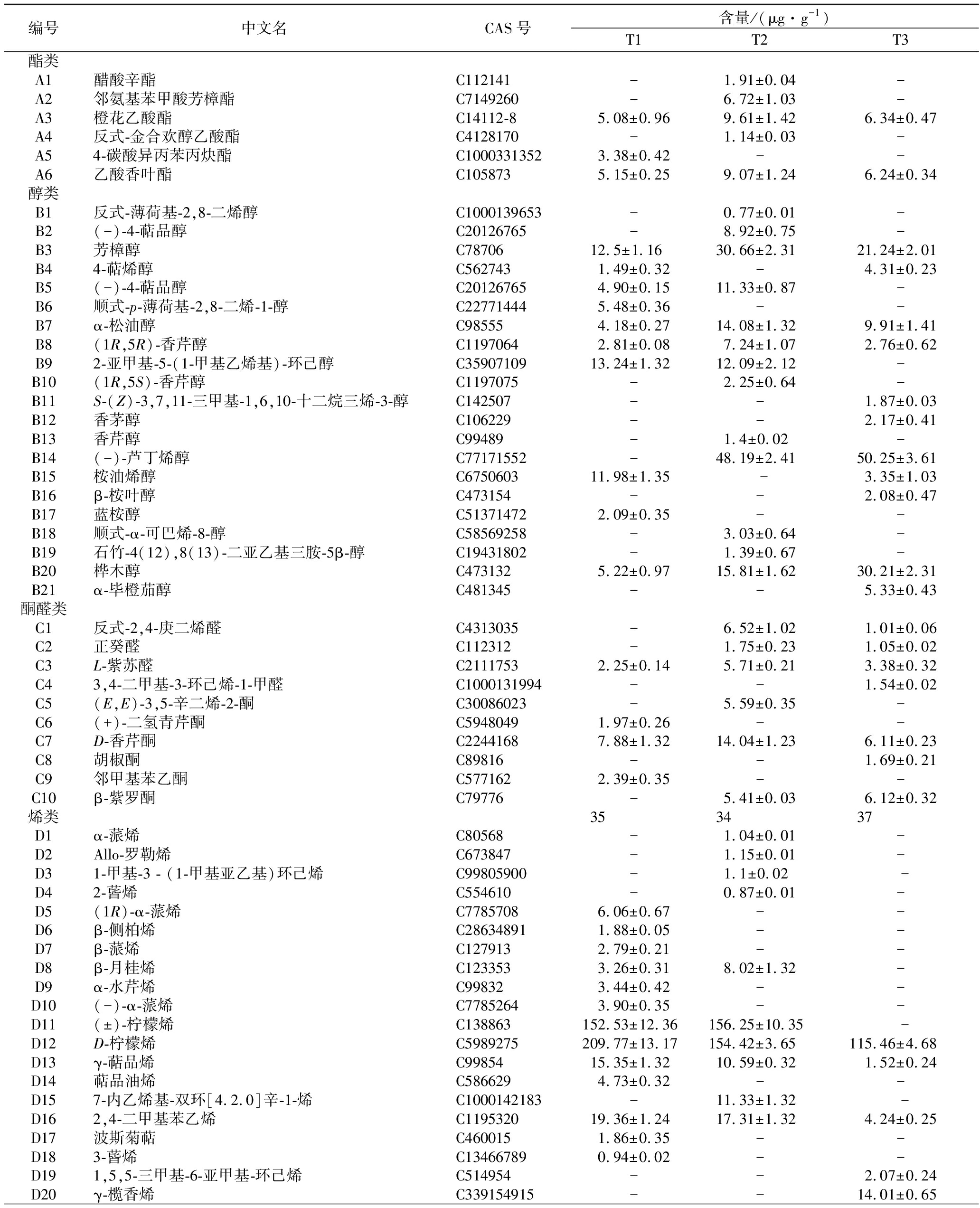
编号中文名CAS号含量/(μg·g-1)T1T2T3酯类A1醋酸辛酯C112141-1.91±0.04-A2邻氨基苯甲酸芳樟酯C7149260-6.72±1.03-A3橙花乙酸酯C14112-85.08±0.969.61±1.426.34±0.47A4反式-金合欢醇乙酸酯C4128170-1.14±0.03-A54-碳酸异丙苯丙炔酯C10003313523.38±0.42--A6乙酸香叶酯C1058735.15±0.259.07±1.246.24±0.34醇类B1反式-薄荷基-2,8-二烯醇C1000139653-0.77±0.01-B2(-)-4-萜品醇C20126765-8.92±0.75-B3芳樟醇C7870612.5±1.1630.66±2.3121.24±2.01B44-萜烯醇C5627431.49±0.32-4.31±0.23B5(-)-4-萜品醇C201267654.90±0.1511.33±0.87-B6顺式-p-薄荷基-2,8-二烯-1-醇C227714445.48±0.36--B7α-松油醇C985554.18±0.2714.08±1.329.91±1.41B8(1R,5R)-香芹醇C11970642.81±0.087.24±1.072.76±0.62B92-亚甲基-5-(1-甲基乙烯基)-环己醇C3590710913.24±1.3212.09±2.12-B10(1R,5S)-香芹醇C1197075-2.25±0.64-B11S-(Z)-3,7,11-三甲基-1,6,10-十二烷三烯-3-醇C142507--1.87±0.03B12香茅醇C106229--2.17±0.41B13香芹醇C99489-1.4±0.02-B14(-)-芦丁烯醇C77171552-48.19±2.4150.25±3.61B15桉油烯醇C675060311.98±1.35 -3.35±1.03B16β-桉叶醇C473154--2.08±0.47B17蓝桉醇C513714722.09±0.35--B18顺式-α-可巴烯-8-醇C58569258-3.03±0.64-B19石竹-4(12),8(13)-二亚乙基三胺-5β-醇C19431802-1.39±0.67-B20桦木醇C4731325.22±0.9715.81±1.6230.21±2.31B21α-毕橙茄醇C481345--5.33±0.43酮醛类C1反式-2,4-庚二烯醛C4313035-6.52±1.021.01±0.06C2正癸醛C112312-1.75±0.231.05±0.02C3L-紫苏醛C21117532.25±0.145.71±0.213.38±0.32C43,4-二甲基-3-环己烯-1-甲醛C1000131994--1.54±0.02C5(E,E)-3,5-辛二烯-2-酮C30086023-5.59±0.35-C6(+)-二氢青芹酮C59480491.97±0.26--C7D-香芹酮C22441687.88±1.3214.04±1.236.11±0.23C8胡椒酮C89816--1.69±0.21C9邻甲基苯乙酮C5771622.39±0.35--C10β-紫罗酮C79776-5.41±0.036.12±0.32烯类353437D1α-蒎烯C80568-1.04±0.01-D2Allo-罗勒烯C673847-1.15±0.01-D31-甲基-3 - (1-甲基亚乙基)环己烯C99805900-1.1±0.02 -D42-蒈烯C554610-0.87±0.01-D5(1R)-α-蒎烯C77857086.06±0.67--D6β-侧柏烯C286348911.88±0.05--D7β-蒎烯C1279132.79±0.21--D8β-月桂烯C1233533.26±0.318.02±1.32-D9α-水芹烯C998323.44±0.42--D10(-)-α-蒎烯C77852643.90±0.35--D11(±)-柠檬烯C138863152.53±12.36156.25±10.35 -D12D-柠檬烯C5989275209.77±13.17154.42±3.65115.46±4.68D13γ-萜品烯C9985415.35±1.3210.59±0.321.52±0.24D14萜品油烯C5866294.73±0.32--D157-内乙烯基-双环[4.2.0]辛-1-烯C1000142183-11.33±1.32 -D162,4-二甲基苯乙烯C119532019.36±1.2417.31±1.324.24±0.25D17波斯菊萜C4600151.86±0.35--D183-蒈烯C134667890.94±0.02--D191,5,5-三甲基-6-亚甲基-环己烯C514954--2.07±0.24D20γ-榄香烯C339154915--14.01±0.65
续表4
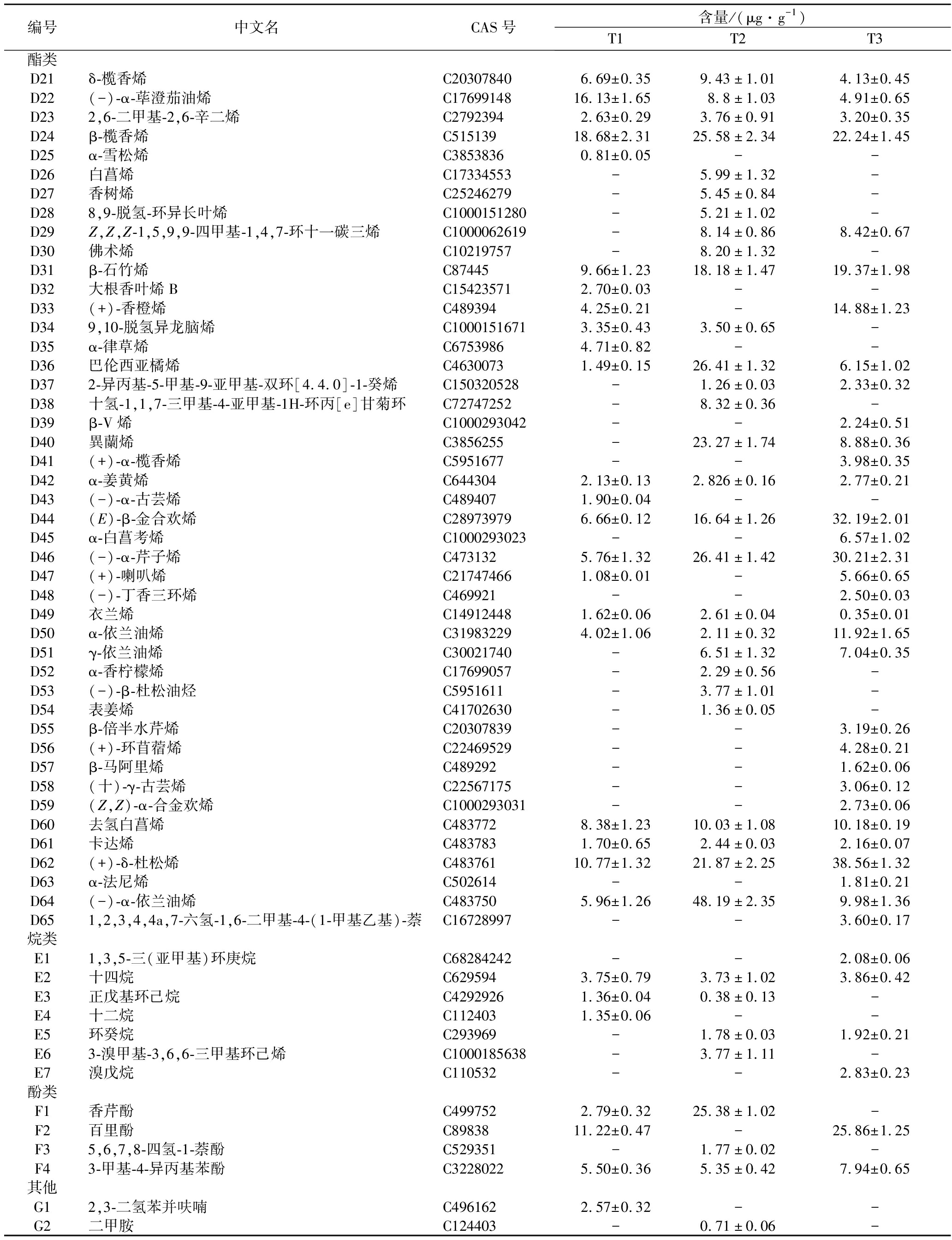
编号中文名CAS号含量/(μg·g-1)T1T2T3酯类D21δ-榄香烯C203078406.69±0.359.43±1.014.13±0.45D22(-)-α-荜澄茄油烯C1769914816.13±1.658.8±1.034.91±0.65D232,6-二甲基-2,6-辛二烯C27923942.63±0.293.76±0.913.20±0.35D24β-榄香烯C51513918.68±2.3125.58±2.3422.24±1.45D25α-雪松烯C38538360.81±0.05--D26白菖烯C17334553-5.99±1.32-D27香树烯C25246279-5.45±0.84-D288,9-脱氢-环异长叶烯C1000151280-5.21±1.02-D29Z,Z,Z-1,5,9,9-四甲基-1,4,7-环十一碳三烯C1000062619-8.14±0.868.42±0.67D30佛术烯C10219757-8.20±1.32-D31β-石竹烯C874459.66±1.2318.18±1.4719.37±1.98D32大根香叶烯BC154235712.70±0.03--D33(+)-香橙烯C4893944.25±0.21-14.88±1.23D349,10-脱氢异龙脑烯C10001516713.35±0.433.50±0.65-D35α-律草烯C67539864.71±0.82--D36巴伦西亚橘烯C46300731.49±0.1526.41±1.326.15±1.02D372-异丙基-5-甲基-9-亚甲基-双环[4.4.0]-1-癸烯C150320528-1.26±0.032.33±0.32D38十氢-1,1,7-三甲基-4-亚甲基-1H-环丙[e]甘菊环C72747252-8.32±0.36-D39β-V烯C1000293042--2.24±0.51D40異蘭烯C3856255-23.27±1.748.88±0.36D41(+)-α-榄香烯C5951677--3.98±0.35D42α-姜黄烯C6443042.13±0.132.826±0.162.77±0.21D43(-)-α-古芸烯C4894071.90±0.04--D44(E)-β-金合欢烯C289739796.66±0.1216.64±1.2632.19±2.01D45α-白菖考烯C1000293023--6.57±1.02D46(-)-α-芹子烯C4731325.76±1.3226.41±1.4230.21±2.31D47(+)-喇叭烯C217474661.08±0.01-5.66±0.65D48(-)-丁香三环烯C469921--2.50±0.03D49衣兰烯C149124481.62±0.062.61±0.040.35±0.01D50α-依兰油烯C319832294.02±1.062.11±0.3211.92±1.65D51γ-依兰油烯C30021740-6.51±1.327.04±0.35D52α-香柠檬烯C17699057-2.29±0.56-D53(-)-β-杜松油烃C5951611-3.77±1.01-D54表姜烯C41702630-1.36±0.05-D55β-倍半水芹烯C20307839--3.19±0.26D56(+)-环苜蓿烯C22469529--4.28±0.21D57β-马阿里烯C489292--1.62±0.06D58(十)-γ-古芸烯C22567175--3.06±0.12D59(Z,Z)-α-合金欢烯C1000293031--2.73±0.06D60去氢白菖烯C4837728.38±1.2310.03±1.0810.18±0.19D61卡达烯C4837831.70±0.652.44±0.032.16±0.07D62(+)-δ-杜松烯C48376110.77±1.3221.87±2.2538.56±1.32D63α-法尼烯C502614--1.81±0.21D64(-)-α-依兰油烯C4837505.96±1.2648.19±2.359.98±1.36D651,2,3,4,4a,7-六氢-1,6-二甲基-4-(1-甲基乙基)-萘C16728997--3.60±0.17烷类E11,3,5-三(亚甲基)环庚烷C68284242--2.08±0.06E2十四烷C6295943.75±0.793.73±1.023.86±0.42E3正戊基环己烷C42929261.36±0.040.38±0.13-E4十二烷C1124031.35±0.06--E5环癸烷C293969-1.78±0.031.92±0.21E63-溴甲基-3,6,6-三甲基环己烯C1000185638-3.77±1.11-E7溴戊烷C110532--2.83±0.23酚类F1香芹酚C4997522.79±0.3225.38±1.02-F2百里酚C8983811.22±0.47-25.86±1.25F35,6,7,8-四氢-1-萘酚C529351-1.77±0.02-F43-甲基-4-异丙基苯酚C32280225.50±0.365.35±0.427.94±0.65其他G12,3-二氢苯并呋喃C4961622.57±0.32--G2二甲胺C124403-0.71±0.06-
注:“-”表示未检出(下同)
酯类。酯类是柑橘中最重要的风味成分之一,其主要来源于脂氧合酶途径和氨基酸代谢,与果实风味的果香属性有关,其含量通常在成熟后期增加[25]。在6种酯类中,橙花乙酸酯和乙酸香叶酯同时存在于3种样品中且含量较高,可见其对湘柑茶的整体香气具有重要贡献。除此之外,每种样品具有独特的酯类,比如醋酸辛酯、邻氨基苯甲酸芳樟酯和反式-金合欢醇乙酸酯只存在于T2中,4-碳酸异丙苯丙炔酯仅存在于T1中。这些物质可以作为它们的独特分子标记物。
醇类。共检测到21种醇类物质,其中芳樟醇、α-松油醇、(1R,5R)-香芹醇和桦木醇在所有样品中均存在。这些醇类成分是湘柑茶在加工过程中碳氢萜烯和其他前体的一系列氧化水合-脱水反应形成的。芳樟醇是一种带有花香的萜类酒精,它可以从香叶醇转化为酶异构,进而在酸性条件下芳樟醇可降解为α-松油醇[26](B7)。除T1样品外,4-萜烯醇和桉油烯醇在其余样品中均存在。这些单萜烯醇是茶树产物的主要成分,即萜类醇及其氧化物是微生物发酵茶如普洱茶中的主要醇类[27]。
酮醛类。在湘柑茶样品中检出4种醛(C1~C4)和6种酮(C5~C10)。几乎所有的醛类和酮类都被证明是影响香气的重要因素,并且在发酵过程中显著增加。醛类化合物广泛存在于茶叶中,是构成其整体香气特征的主要挥发性基团之一。T2和T3中醛类含量和种类明显高于T1。L-紫苏醛同时存在于所有样品中,它来源于肉桂酸的降解[28]。同样,3种湘柑茶样品具有不同的酮类,D-香芹酮是它们的共有化合物。BI等[29]发现,在热加工过程中,D-香芹酮是柠檬烯的氧化产物,可以通过氧化途径氧化相应不饱和位点,使其含量显著增加。
烯类。萜类化合物在柑橘果茶的香气中起着重要的作用。本研究中,共鉴定出65种烯类,其中以单萜类化合物居多,3种湘柑茶中共有的烯类有18种。研究观察到不同样品之间烯类物质的含量和种类存在显著差异。其中D-柠檬烯是柑橘中的一种代表性化合物,具有最高的含量(115~300 μg/g)。先前的研究表明,D-柠檬烯作为增味剂,是柑橘类产品的质量标志。在深加工过程中,D-柠檬烯可能被氧化成过氧化氢,过氧化氢进一步反应生成大量产物,如香芹酮、邻苯三酚和萜烯-4-醇等[28]。
酚类。湘柑茶样品中含有香芹酚、百里酚、5,6,7,8-四氢-1-萘酚和3-甲基-4-异丙基苯酚这4种挥发性酚类化合物。香芹酚和百里酚是食品工业中重要的增味剂,广泛存在于植物中,是鲜叶茶的重要酚类成分[27]。T2中香芹酚的含量最高达25.38 μg/g,同样T3中百里酚的含量最高达25.86 μg/g。这表明不同的成熟度的金盆柚制备的湘柑茶的香气具有显著区别。
2.5.2.2 关键香气化合物分析
消费者通常通过风味来判断食品的可接受性。湘柑茶中挥发性有机化合物的气味活性是决定最终产品质量的主要感官特征之一。为了寻找到湘柑茶中关键的香气化合物,更准确地确定各自挥发性成分对湘柑茶香气的影响,本实验采用了采用OAV来表征各香气化合物对主体香气成分的贡献,分析探讨3种样品中的关键挥发性香气物质。OAV的水平可以反映化合物对样品特征味道的贡献。香气化合物的OAV通过计算浓度除以气味阈值来计算[30]。以往的研究表明,OAV>1表示其对样品整体香气的贡献,OAV越高,化合物的个体贡献越大。
由表6可知,湘柑茶的香气化合物中OAV>1的物质有27种。其中,酯类2种、醇类5种、酮醛类6种、烯类12种和酚类2种。其中,具有柠檬香气的D-柠檬烯的OAV在3种样品中均大于100,具有最高的香气贡献率。其中,除了上文提到的芳樟醇外,具有海桐花香气的α-松油醇也对湘柑茶的香气具有较大影响。(1R,5R)-香芹醇和(1R,5S)-香芹醇是由P450酶对柠檬烯的6-羟基化所形成的[31]。在微生物发酵过程中,糖苷通过水解和进一步氧化得到这些萜醇及其衍生物,并能提供柑橘茶的花香、甘甜和木香的香气。酮是各种茶叶样品中非常重要的香气物质,具有独特的花香和木香。由于它们的阈值较低如β-紫罗酮(C10)等,所以极低的含量也可以影响样品的整体香气。在OAV>1的12种烯类物质中,T1中种类最多达11种,T2有6种,T3有3种。其中有4种蒎烯的同分异构体(D1、D5、D7和D10)具有松节油气味。除了柠檬烯外,具有柑橘香的γ-萜品烯和具有丁香香气的β-石竹烯对湘柑茶的整体香气均有较显著的影响。然而,具有啤酒花香气的α-律草烯和具有黑胡椒、蔼荷似香气的α-水芹烯仅存在于T1的香气中。
表6 湘柑茶的关键香气化合物的OAV值
Table 6 OAV values of key aroma compounds in Xianggan tea

类别编号中文名阈值a/(μg·kg-1)OAVbT1T2T3香气特征酯类A1醋酸辛酯47-40.64-苹果、桃、橙香气A6乙酸香叶酯15034.3360.4741.60玫瑰油与薰衣草油混合后似香气醇类B3芳樟醇0.2256 818.18139 363.6496 545.45花香,似铃兰香气B44-萜烯醇1 2001.24-3.59胡椒香气B7α-松油醇1 2003.4811.738.26海桐花香气B8(1R,5R)-香芹醇25011.244.5611.04柑橘香B11(1R,5S)-香芹醇250-9.00-柑橘香酮醛类C2正癸醛3-583.33350.00辛甜蜡、柑橘样果香C3L-紫苏醛3075.00190.33112.67紫苏,柑橘皮香气C5(E,E)-3,5-辛二烯-2-酮100-55.90-花香C7D-香芹酮16049.2587.7538.19薄荷油、葛缕子香C8胡椒酮680--2.49樟脑气味C10β-紫罗酮0.007-772 857.14874 285.71紫罗兰香烯类D1α-蒎烯14-74.29-松萜特有的气味D5(1R)-α-蒎烯2.22 754.55 - -松节油气味D7β-蒎烯14019.93--松节油气味D8β-月桂烯1.22 716.676 683.33 -甜橘味、香脂气D9α-水芹烯4086.00--黑胡椒、蔼荷似香气D10(-)-α-蒎烯10039.00--松节油气味D11(±)-柠檬烯200762.65781.25 -柠檬香味D12D-柠檬烯346 169.714 541.763 395.88柠檬香味
续表6
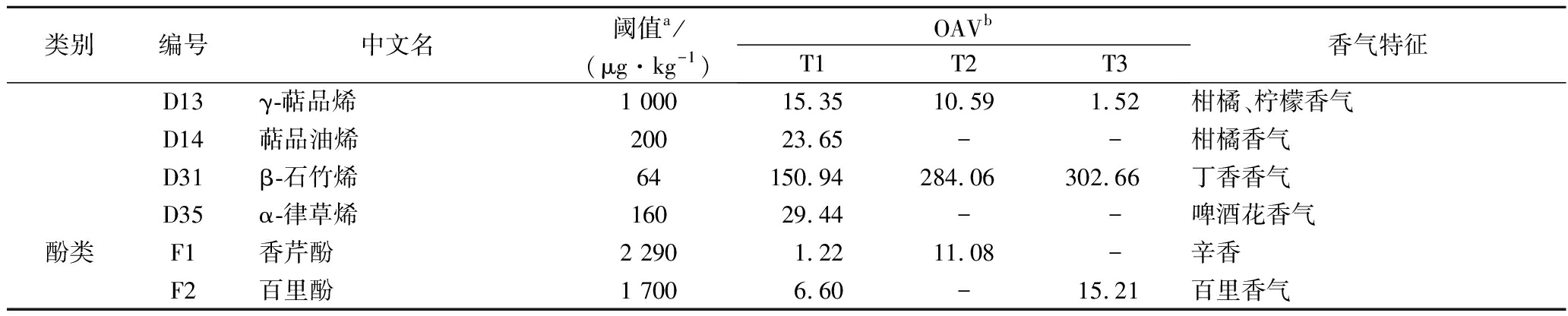
类别编号中文名阈值a/(μg·kg-1)OAVbT1T2T3香气特征D13γ-萜品烯1 00015.3510.591.52柑橘、柠檬香气D14萜品油烯20023.65--柑橘香气D31β-石竹烯64150.94284.06302.66丁香香气D35α-律草烯16029.44--啤酒花香气酚类F1香芹酚2 2901.2211.08-辛香F2百里酚1 7006.60-15.21百里香气
注:a:化合物在水中的阈值参见文献[32];b: OAV为化合物在湘柑茶中的浓度与在水中的阈值的比值
由此可知,3种湘柑茶中均含有柑橘果茶的主体性香气成分,但也有各自独有的香气成分,存在特异性差异。
2.6 感官评价
由图10可知,3种湘柑茶冲泡后茶叶形态良好,柑皮与茶叶包裹较紧密,茶汤均匀。汤色评分较高的为T1和T2,其颜色橙红明亮,T3的汤色则欠亮。香气评分最高的湘柑茶为T2,达21.6分,其柑橘香、茶香浓郁,优雅协调,而T3的香气不足。滋味得分的结果和汤色一致,T1最高,T2次之,T3最低。T1的滋味醇厚,细腻滋润,回味良好。综合感官得分最高的为T2,其汤色红浓明亮,滋味较醇厚,柑橘香、茶香协调较良好,口感良好,总分为67.8,其次为T1,总分达66.1。

图10 感官评价雷达图
Fig.10 Sensory evaluation radar map
2.7 不同成熟度柑橘制备的湘柑茶品质综合分析
主成分分析(principal component analysis, PCA)是一种利用降维技术将多个变量转化为主成分的统计方法,是最重要的降维方法之一。KESEN等[33]通过PCA分析发现,不同地理产地的土耳其橄榄油的香气特征存在明显差异。本研究采用主成分分析法对不同成熟度的金盆柚制备的湘柑茶综合品质进行分析。
如图11-a所示,将湘柑茶的加工特性、TF、TP、橙皮苷、柚皮苷、感官评价和27种关键香气化合物(OAV>1)的含量共33个指标进行PCA分析,结果显示,共提取到11个主成分。第一个主成分贡献率为55.3%,前2个主成分的特征值均大于1,累计方差贡献率达到95.07%。T1、T2和T3分别位于第二象限、第一象限和第四象限。不同湘柑茶样品样本可以很好地区分,说明其综合品质具有显著差异。

a-PCA得分图;b-双重信息图
图11 湘柑茶品质的主成分分析
Fig.11 The principal component analysis from
the quality characteristics of Xianggan tea
为了获得更多细节,使用了双重信息图(图11-b)。水平和垂直坐标为主成分,每个向量代表原始特征。向量在主成分上的投影可以表示两者之间的相关程度。由图中可以清楚地看出,这些指标对不同的湘柑茶样品的影响是不同的。其中TF和烯类香气物质与T1的综合品质呈正相关,这与它们的含量在T1中最高相一致。同样,胡椒酮、4-萜烯醇、柚皮苷和加工品质等对T3的综合品质也有显著贡献。值得注意的是,TP、感官品质和大部分的醇类、酯类、酮醛类均投影在第一象限内,构成了T2综合品质的重要指标。综上所述,不同指标对湘柑茶综合品质的影响的大小与指标的高低相一致,不同成熟度金盆柚制备的湘柑茶综合品质具有显著差异。
3 结论
本研究对不同成熟度的金盆柚制备的湘柑茶进行了加工品质、营养品质、香气品质和感官品质的综合评价。结果显示,T3的加工特性最佳,挖果容易且成品形态良好。T2的感官评价最优,柑皮和茶叶的香气协调性较好,口感良好,接受度较高。营养品质中TF和橙皮苷在T1柑皮中含量最高分别达9.2和12.49 mg/g,且其含量随果实成熟度的增加呈现降低趋势,柚皮苷的变化则呈相反趋势;TP在T2中含量最高达8.4 mg/g,其含量随成熟度呈先增加后减少的趋势。通过HS-GC-IMS技术结合HS-SPME-GC-MS技术分析湘柑茶香气品质,分别鉴定出64种和115种香气成分,主要有烯烃类、酯类,醇类、酮醛类和酚类。通过OAV计算,筛选出27种关键香气化合物,不同湘柑茶中均含有共同的主体性香气成分如D-柠檬烯、芳樟醇、α-松油醇和β-石竹烯等,但也有各自独有的香气成分,这些化合物具有果香、花香、松柏木香等典型的植物香气,构成了湘柑茶的整体风味。最后主成分分析显示,3种湘柑茶的综合品质存在显著差异。
湖南是柑橘和茶叶资源大省,湘柑茶对于联合湖南省内过剩的柑橘和茶叶资源,开发柑橘加工新产品提供了参考。由于本实验仅重点考察了金盆柚的不同果实成熟度对湘柑茶综合品质的影响,后续可进一步开展加工工艺优化和风味形成规律研究,通过加工过程实现对湘柑茶品质的控制,为湘柑茶的规范生产提供可靠的技术支撑。
[1] ZHANG J, WU X, QIU J, et al.Comprehensive comparison on the chemical profile of Guang chen pi at different ripeness stages using untargeted and pseudotargeted metabolomics[J].Journal of Agricultural and Food Chemistry,2020,68(31):8 483-8 495.
[2] 王洁璠. 不同采收期广陈皮药用成分分析及药材评价[D].广州:华南农业大学,2017.
WANG J F.Analysis of medicinal ingredients and evaluation of medicinal materials of dried tangerine peel at different harvesting stages[D].Guangzhou:South China Agricultural University,2017.
[3] 江津津, 谢佩桦, 任芳, 等.基于气相离子迁移谱和顶空固相微萃取的新会柑普茶的风味分析[J].食品工业科技,2020,41(12):214-220.
JIANG J J, XIE P H, REN F, et al.Flavor analysis of Xinhui Tangpu tea based on gas phase ion migration spectrum and headspace solid phase microextraction[J].Science and Technology of Food Industry,2020,41(12):214-220.
[4] LYU W, LIN T, REN Z, et al.Rapid discrimination of Citrus reticulata ‘Chachi’ by headspace-gas chromatography-ion mobility spectrometry fingerprints combined with principal component analysis[J].Food Research International,2020, 131.DOI:10.1016/j.foodres.2020.108985.
[5] ARROYO-MANZANARES N, GARC A-NICOL
A-NICOL S M, CASTELL A, et al.Untargeted headspace gas chromatography-ion mobility spectrometry analysis for detection of adulterated honey[J].Talanta,2019,205.DOI:10.1016/j.talanta.2019.120123.
S M, CASTELL A, et al.Untargeted headspace gas chromatography-ion mobility spectrometry analysis for detection of adulterated honey[J].Talanta,2019,205.DOI:10.1016/j.talanta.2019.120123.
[6] LI H, JIANG D, LIU W, et al.Comparison of fermentation behaviors and properties of raspberry wines by spontaneous and controlled alcoholic fermentations[J].Food Research International,2020,128.DOI:10.1016/j.foodres.2019.108801.
[7] FLAIG M, QI S, WEI G, et al.Characterization of the key odorants in a high-grade chinese green tea beverage (Camellia sinensis;Jingshan cha) by means of the sensomics approach and elucidation of odorant changes in tea leaves caused by the tea manufacturing process[J].Journal of Agricultural and Food Chemistry, 2020, 68(18):5 168-5 179.
[8] 牛雪. 福林酚法测定葡萄酒总酚的优化研究[D].银川:宁夏大学,2015.
NIU X.Optimization study on the determination of total phenols in wine by folinol method[D].Yinchuan:Ningxia University,2015.
[9] 李绮丽, 孙俊杰, 单杨, 等.不同柑橘品种全果制汁适宜性分析[J].食品科学,2019,40(13):36-44.
LI Q L, SUN J J, SHAN Y, et al.Analysis of juice suitability of whole fruit of different citrus varieties[J].Food Science,2019,40(13):36-44.
[10] 吕海鹏, 钟秋生, 林智.陈香普洱茶的香气成分研究[J].茶叶科学,2009,29(3):219-224.
LYU H P, ZHONG Q S, LIN Z.Study on aroma composition of Chenxiang Pu′er tea[J].Tea Science,2009,29(3):219-224.
[11] PANG X, GUO X, QIN Z, et al.Identification of aroma-active compounds in Jiashi muskmelon juice by GC-O-MS and OAV calculation[J].Journal of Agricultural and Food Chemistry, 2012, 60(17):4 179-4 185.
[12] 施学骄. 酸橙果实不同采收期化学成分动态变化及枳实、枳壳药材质量评价研究[D].成都:成都中医药大学,2012.
SHI X J.Dynamic changes of chemical components in lime fruits at different harvesting stages and study on quality evaluation of Fructus aurantii Immaturus and Fructus aurantii[D].Chengdu:Chengdu University of Traditional Chinese Medicine,2012.
[13] WANG H, CHEN G, GUO X B, et al.Influence of the stage of ripeness on the phytochemical profiles, antioxidant and antiproliferative activities in different parts of Citrus reticulata Blanco cv.Chachiensis[J].Food Science & Technology,2016,69:67-75.
[14] 张文娟. 柑橘幼果功能成分提取分析及抗氧化活性研究[D].杭州:浙江大学,2015.
ZHANG W J.Extraction and analysis of functional components and antioxidant activity of citrus fruit[D].Hangzhou:Zhejiang University,2015.
[15] 苏东林,单杨,李高阳,等.RP-HPLC法同时测定柑桔皮中橙皮苷和柚皮苷的含量[J].食品工业科技,2008,30(6):288-290.
SU D L, SHAN Y, LI G Y, et al.Simultaneous determination of hesperidin and naringin in citrus peel by RP-HPLC[J].Science and Technology of Food Industry,2008,30(6):288-290.
[16] 国家药典委员会.中华人民共和国药典,一部[M].北京:中国医药科技出版社, 2015.
National Pharmacopoeia Committee.Pharmacopoeia of the People′s Republic of China, one[M].Beijing:China Medical Science and Technology Press, 2015.
[17] YOO K M, LEE K W, PARK J B, et al.Variation in major antioxidants and total antioxidant activity of Yuzu (Citrus junos Sieb ex Tanaka) during maturation and between cultivars[J].Journal of Agricultural and Food Chemistry, 2004, 52(19):5 591-5 907.
[18] LANTSUZSKAYA (KRISILOVA) E V, KRISILOV A V, LEVINA A M.Structure of aldehyde cluster ions in the gas phase, according to data from ion mobility spectrometry and ab initio calculations[J].Russian Journal of Physical Chemistry A, 2015, 89(9):1 159-1 590.
[19] BERTOLINO M, DOLCI P, GIORDANO M, et al.Evolution of chemico-physical characteristics during manufacture and ripening of Castelmagno PDO cheese in wintertime[J].Food Chemistry, 2011, 129(3):1 001-1 011.
[20] 陈书婷. 脂肪氧合酶的分离纯化及其催化多不饱和脂肪酸的研究[D].无锡:江南大学,2011.
CHEN S T.Separation and purification of lipoxygenase and its catalytic study of polyunsaturated fatty acids[D].Wuxi:Jiangnan University,2011.
[21] KLESK K.Aroma comparison of Marion (Rubus sp.L.) and Thornless Evergreen (Rubus laciniatus L.) blackberries[D]:Corvallis:Oregon State University, 2004.
[22] 郑敏. 柑普茶主要化学成分分析及制备工艺研究[D].武汉:华中农业大学,2017.
ZHENG M.Chemical composition analysis and preparation technology of Kumpucha[D].Wuhan:Huazhong Agricultural University,2017.
[23] RODRíGUEZ-MAECKER R, VYHMEISTER E, MEISEN S, et al.Identification of terpenes and essential oils by means of static headspace gas chromatography-ion mobility spectrometry[J].Analytical and Bioanalytical Chemistry, 2017, 409(28), 6 595-6 603.
[24] TERANISHI R, WICK E L, HORNSTEIN I.Flavor chemistry:30 years of progress[C].Abstracts Of Papers Of The American Chemical Society,1998.
[25] BENGTSSON M, B CKMAN A C, LIBLIKAS I, et al.Plant odor analysis of apple:Antennal response of codling moth females to apple volatiles during phenological development[J].Journal of Agricultural and Food Chemistry, 2001, 49(8):3 736-3 741.
CKMAN A C, LIBLIKAS I, et al.Plant odor analysis of apple:Antennal response of codling moth females to apple volatiles during phenological development[J].Journal of Agricultural and Food Chemistry, 2001, 49(8):3 736-3 741.
[26] BAZEMORE R, GOODNER K, ROUSEFF R.Volatiles from unpasteurized and excessively heated orange juice analyzed with solid phase microextraction and GC-Olfactometry[J].Journal of Food Science, 1999, 64(5):800-803.
[27] XU X, YAN M, ZHU Y.Influence of fungal fermentation on the development of volatile compounds in the Puer tea manufacturing process[J].Engineering in Life Sciences, 2005, 5(4):382-386.
[28] PEREZ-CACHO P R, ROUSEFF R.Processing and storage effects on orange juice aroma[J].Journal of Agricultural and Food Chemistry, 2008, 56(21):9 785-9 979.
[29] BI S, SUN S C, LAO F, et al.Gas chromatography-mass spectrometry combined with multivariate data analysis as a tool for differentiating between processed orange juice samples on the basis of their volatile markers[J].Food Chemistry, 2020, 311.DOI: 10.1016/j.foodchem.2019.125913.
[30] MIYAZAKI T, PLOTTO A, BALDWIN E A, et al.Aroma characterization of tangerine hybrids by gas-chromatography-olfactometry and sensory evaluation[J].Journal of the Science of Food and Agriculture, 2012, 92(4):727-735.
[31] BOUWMEESTER H J, KONINGS M M, GERSHENZON J, et al.Cytochrome P-450 dependent (+)-limonene-6-hydroxylation in fruits of caraway (Carum carvi)[J].Phytochemistry, 1999, 50(2):243-248.
[32] GEMERT L J V.Compilations of Odour Threshold Values in Air, Water and Other Media[M].The Netherlands:Oliemans Punter & Partners BV, 2011.
[33] KESEN S, KELEBEK H, SELLI S.Characterization of the key aroma compounds in Turkish olive oils from different geographic origins by application of aroma extract dilution analysis (AEDA)[J].Journal of Agricultural and Food Chemistry, 2014, 62(2):391-401.