氧化应激是指人体内抗氧化防御系统与活性氧簇形成失去平衡,从而导致氧化损伤[1]。近年来,来源于植物的天然多酚类抗氧化物质备受关注,包括多酚、黄酮、单宁以及花青素类等。多酚类物质属于果蔬中的次生代谢产物,这些成分可通过清除自由基和其他活性氧族展现较强的抗氧化活性,从而起到清除体内自由基,避免机体产生氧化损伤,促进健康、预防癌症、心血管等慢性疾病的作用,因此消费者越发关注各类食物的抗氧化活性[2]。此外,在食品工业中,广泛使用多种抗氧化剂作为脂质过氧化的抑制剂,然而在食品中添加许多化学合成的抗氧化剂如丁基羟基茴香醚、二丁基羟基甲苯等会对人体健康产生潜在危害[3]。因此,寻找天然无毒的抗氧化成分,在食品加工领域也备受关注。
山楂为蔷薇科苹果亚科山楂属(Crataegus pinnatifida Bunge)植物,是我国特有的果树资源,在中国有悠久的食用和药用历史,广泛分布于亚洲、欧洲、中北美洲及南美洲北部[4]。山楂为药食同源植物,山楂果实富含维生素C、黄酮类化合物、有机酸、多糖、矿物质元素等营养物质,保健价值很高,主要具有调节血脂、保肝、降压、助消化、强心、抗氧化、抗肿瘤、抗菌等作用,应用十分广泛[5]。研究表明,山楂中的黄酮类成分主要有金丝桃苷、槲皮素、异槲皮苷、芦丁、牡荆素鼠李糖苷等[6];有机酸主要包括枸橼酸及其甲酸、绿原酸、熊果酸、齐墩果酸等[7]。研究发现不同产地、品种等的山楂叶中含有较高的黄酮类成分,山楂叶、果和籽提取液抗氧化能力高于同浓度的二丁基羟基甲苯[8]。然而,对于不同山楂属果实不同组织(果皮、果肉、果籽)的抗氧化成分及性能尚缺少系统的研究数据。本研究选择3个不同品种的山楂属果实(大山楂、小山楂和山里红)为研究对象,通过测定总酚、总黄酮含量以及抗氧化活性指标(DPPH自由基清除性能,ABTS自由基清除性能,还原能力)等参数综合评价山楂属果实不同组织部位的抗氧化成分及性能。此外,对山楂果实抗氧化成分与抗氧化性能指标之间的相关性也进行了分析。
1 材料与方法
1.1 材料与试剂
不同品种的山楂属果实于采自黑龙江省齐齐哈尔市周边果园。选择大小一致,无机械损伤,无病虫害的新鲜果实,不同品种山楂果实单果重分别为:山里红(3.35±0.26) g,小山楂(13.42±1.32) g,大山楂(42.35±2.58) g。将山楂果实用水清洗,用不锈钢刀将果皮、果肉和果核分离,然后将不同组织冷冻干燥、粉碎,随后密封于塑料袋中,于-25 ℃下保存备用;ABTS、DPPH,美国Sigma-Aldrich 化学试剂公司;Folin-酚试剂、没食子酸(galic acid, GA)标准品、芸香甙(rutin)标准品、抗坏血酸、2.4.6-三吡啶基三嗪[2,4,6-tris(2-pyridyl)-s-triazine, TPTZ]等试剂均为分析纯,天津科密欧化学试剂公司。
1.2 仪器与设备
YB-2500A型多功能粉碎机,永康市速锋工贸有限公司;HX-10-50B型真空冻干机,上海沪析有限公司;752 N紫外可见分光光度计,上海精科仪电有限公司;TGL-16M台式高速冷冻离心机,常州亿能实验仪器公司;XMTD-204数显式恒温水浴锅,天津市欧诺仪器仪表有限公司;SHZ-D(III)循环水式真空泵(配RE-53AA旋转蒸发器),上海亚荣生化仪器厂。
1.3 实验方法
1.3.1 乙醇提取物的准备
取冻干样品0.5 g,加入V(乙醇)∶V(水)=7∶3的提取液20 mL于室温下避光超声提取15 min,2 000 r/min离心分离10 min,将分离后的沉淀重复上述提取过程提取2次,离心后合并上清液,并于-2 ℃贮存,在48 h之内测定总酚、总黄酮、单宁、花青素以及抗氧化活性等指标。每个样品提取3次并进行测定。
1.3.2 总酚含量测定
采用Folin-酚试剂法[9],并稍作修改。取0.15 mL 1.3.1中的提取液于10 mL 试管中,加入0.2 mol/L福林酚试剂1.5 mL混匀,避光静置5 min。然后加入60 g/L的Na2CO3溶液1.5 mL,然后在75 ℃下水浴中把混合溶液加热10 min,随后立即采用冰浴促使反应终止,用蒸馏水定容至10 mL。然后在765 nm处测定反应液的吸光值。配制不同浓度GA标准品,测得吸光度,以浓度为横坐标,吸光度为纵坐标,制作标准曲线。总酚含量以没食子酸当量(gallic acid equivalent,GAE)表示,即每克冻干样中没食子酸的毫克数。
1.3.3 总黄酮含量测定
采用三氯化铝分光光度法[10],并稍作修改。取1.0 mL 1.3.1中的提取液于10 mL 试管中,加入5 g/L NaNO2溶液0.3 mL,并摇匀,避光静置6 min。然后加入10 g/L AlCl3·6H2O溶液0.3 mL,避光静置6 min。然后加入4.0 mL 100 g/L NaOH溶液,用去离子水添加至10 mL,避光静置15 min。在510 nm下测溶液的吸光度值。同时配制不同浓度芦丁标准品,测得其吸光度,以浓度为横坐标,吸光度为纵坐标,制作曲线。山楂中总黄酮含量以芦丁当量(rutin equivalent,RE)表示,即每克冻干样中芦丁的毫克数。
1.3.4 单宁含量测定
采用F-D试剂法测定[11]。取0.5 mL 1.3.1中的提取液于25 mL容量瓶中,各加入70%乙醇(体积分数)0.85 mL、60 g/mL 偏磷酸溶液0.05 mL、水12.5 mL、F-D试剂1.25 mL、1 mol/L碳酸钠溶液5 mL,剧烈振摇,以水稀释至刻度,混匀。于30 ℃恒温箱中放置1.5 h,用分光光度计在波长680 nm处测定吸光度,以Abs值为纵坐标,标准品溶液中单宁酸的含量为横坐标绘制标准曲线,根据方程计算得出单宁的含量。
1.3.5 花青素含量测定
采用pH示差法测定[12]。吸取适当浓度样品提取液1 mL,分别用pH 1.0和4.5的缓冲溶液稀释至5 mL,混匀,达到平衡后,用1 cm比色皿以蒸馏水作空白对照,分别在510和700 nm处测定吸光值。每个样品平行3次,花色苷吸光值和含量分别按公式(1)、公式(2)计算:
A=(A510-A700)pH 1.0-(A510-A700)pH 4.5
(1)
原花青素含量![]()
(2)
式中:V为提取液总体积,mL;n为稀释因子;Mr为矢车菊素-3-葡萄糖苷的相对分子质量,449.2;ε为矢车菊素-3-葡萄糖苷的消光系数,26 900;m为样品质量,g;样品原花青素含量ACY以mg/100g(矢车菊素-3-葡萄糖苷当量)表示。
1.3.6 DPPH自由基清除性能测定
DPPH自由基清除性能的测定参考ABBASI等[13]的方法,并稍作修改。取0.4 mL稀释至合适浓度的1.3.1中所述的提取液于10 mL离心管中,加入A517=1.00±0.02的DPPH自由基的甲醇溶液4.0 mL,室温避光静置20 min,然后在517 nm处测定反应液的吸光度,空白以甲醇代替提取液。同时以吸光度值为纵坐标,标准品溶液中抗坏血酸(维生素C)的质量为横坐标制作标准曲线,根据曲线方程计算样品中的DPPH自由基的清除能力,结果表达为mg/g。如果吸光度值不在线性范围内,将再次稀释提取液。重复测定3次。
1.3.7 ABTS阳离子自由基清除性能测定
ABTS阳离子自由基清除性能的测定参考ZHANG等[14]的方法,并稍作修改。将ABTS溶解于20 mmol/L、pH 4.5的醋酸缓冲溶液中得到7 mmol/L的ABTS贮液,与过硫酸钾溶液 (混合体系中的终浓度为2.45 mmol/L) 混合,在室温下避光反应12~16 h,使溶液达到稳定的氧化态。测定前用20 mmol/L、pH 4.5的醋酸缓冲溶液按体积比1∶75稀释ABTS贮存液,使溶液的吸光值在734 nm下达到0.7±0.02,以此得到ABTS阳离子自由基工作液,该工作液每次测定前现配。测定时反应体系包括3 mL的ABTS工作液和200 μL 1.3.1中所述的合适浓度的提取液。室温避光静置6 min 后在734 nm处测定吸光值。同时以吸光度值为纵坐标,标准品溶液中抗坏血酸(维生素C)的质量为横坐标制作标准曲线,根据曲线方程计算样品中的ABTS阳离子自由基的清除能力,结果表达为mg/g。如果吸光度值不在线性范围内,将再次稀释提取液。重复测定3次。
1.3.8 还原能力的测定
还原能力的测定参考AL-WESGAHY 等[15]的方法,并稍作修改。取1.0 mL稀释至合适浓度的1.3.1中所述的提取液于10 mL 离心管中,蒸馏水补足至1 mL。分别加入2.5 mL磷酸盐缓冲溶液(0.2 mol/L,pH 6.6), 2.5 mL 1%铁氰化钾(质量分数),混匀。50 ℃水浴20 min。然后加入 2.5 mL 10%三氯乙酸(质量分数)。然后在室温下,6 000 r/min离心10 min,取上清液2.5 mL于10 mL离心管中,加入2.5 mL 蒸馏水,再加入0.5 mL 0.1%三氯化铁(质量分数)。反应30 min 后在700 nm 处测定吸光度值。以吸光度值为纵坐标,标准品溶液中抗坏血酸(维生素C)的质量为横坐标制作标准曲线,根据曲线方程计算样品的还原能力,结果表达为mg/g。如果吸光度值不在线性范围内,将再次稀释提取液。重复测定3次。
1.4 数据统计分析
所有实验均重复3次。实验结果表示为“平均值±标准偏差”,数据用Origin Pro 8.5绘制用图,用IBM SPSS Statistics 23进行方差分析,并进行Duncan′s差异显著性分析,P<0.05 表示差异显著。应用Pearson Correlation Test分析样品总酚、总黄酮、单宁、原花青素、抗氧化性能指标之间相关性,并计算相关系数(R2)。
2 结果与分析
2.1 三种山楂属果实不同组织(果核、果肉、果皮)的总酚含量
植物源的抗氧化活性主要是由于酚类化合物的存在,而多酚类化合物的抗氧化机制是基于其供氢能力和金属离子螯合能力[16]。用福林酚试剂测定不同山楂品种不同组织部位中酚类的含量,结果以GAE表示,即每克冻干样中没食子酸的毫克数。果蔬品种的差异、生长环境、成熟的季节、地域、土壤、施肥、光照时间、采收方式和成熟度等因素都影响着果实中总酚含量[17]。山楂果实中的总酚含量因品种和部位不同而表现出差异 (图1)。山楂果皮中的总酚含量显著高于果肉和果核。大山楂和小山楂果皮中总酚含量较高,之间没有显著差异,但是较山里红果皮总酚高约2.14倍;不同品种山楂果肉中总酚含量为23.66~8.21 mg/g,约为4倍的变化;不同山楂品种果核中总酚含量较低,3个品种之间没有显著差异。许多研究者也得出了相似的结果,如枣果皮的总酚含量约是其果肉的10倍[17],芒果果皮的总酚含量约是其果肉的15倍[18]。酚类物质趋向于在外部组织中絮集,这主要是由于酚类物质能够抵抗紫外线辐射,作为防御性物质抵抗病原菌和捕食者的入侵[17]。
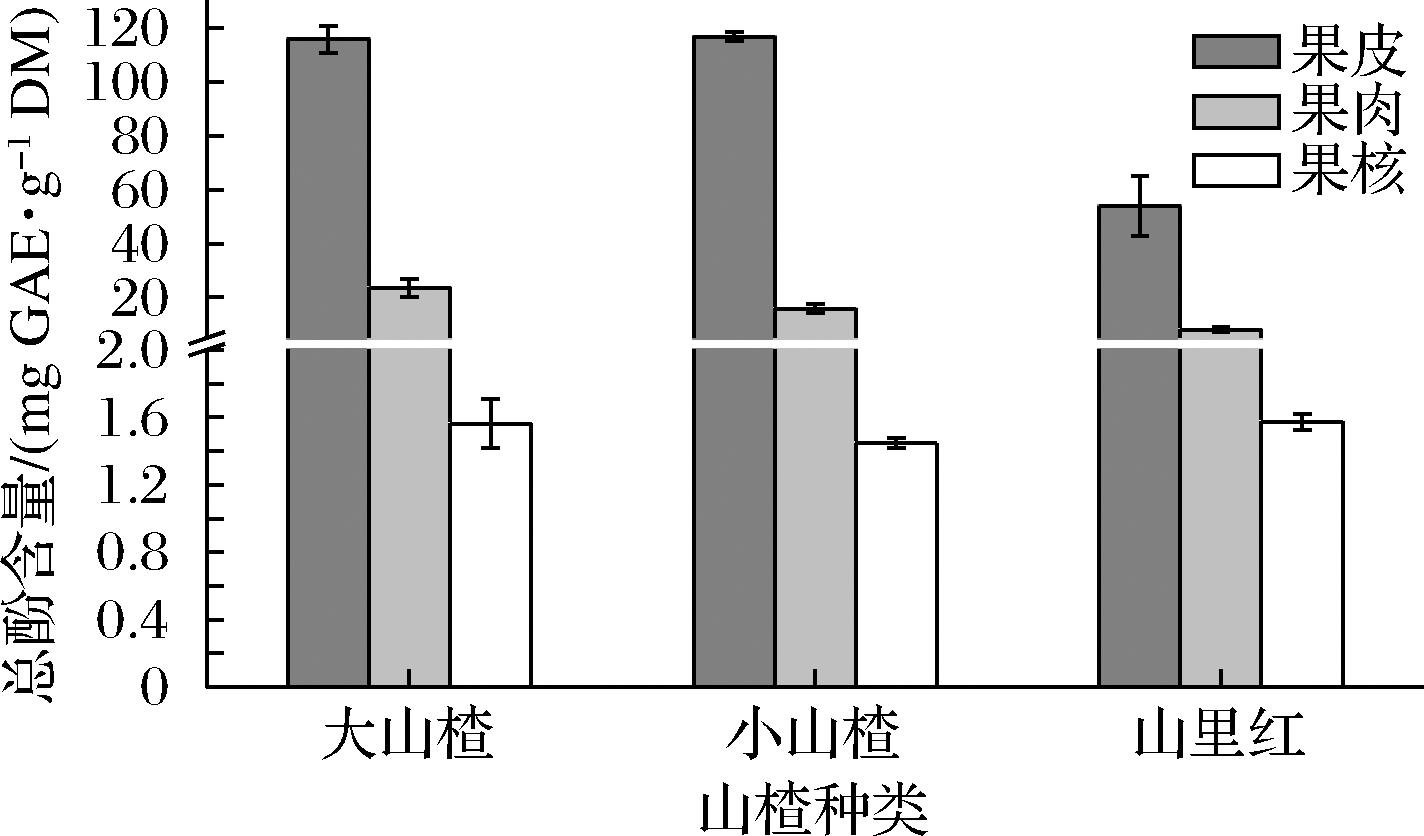
图1 山楂属果实不同组织部位的总酚含量
Fig.1 Total phenolic contents from different tissue parts of
hawthorn cultivars
2.2 三种山楂属果实不同组织的总黄酮含量
黄酮类物质是植物中最常见、分布最广的一类重要的酚类化合物,作为抗氧化剂非常有效。黄酮类化合物可以通过与金属离子形成络合物来抑制金属引发的脂质氧化,从而具有宽泛的药理学和生物化学性能[4]。本研究中用氯化铝比色法测定了山楂中黄酮类化合物的含量,以此作为定量测定的基础,结果采用RE表示,即表示为每克冻干样中芦丁的毫克数。图2显示了3种山楂果实果核、果肉、果皮总黄酮含量的差异。山楂不同组织中的黄酮含量在86.26~1.34 mg RE/g,约为80倍的变化。大山楂和小山楂果皮中总黄酮含量最高,且无显著差异,约为山里红果皮总黄酮含量的2.5倍;大山楂果肉总黄酮含量较高,约为小山楂、山里红果肉总黄酮含量的2倍;山楂果核中总黄酮含量较低,三者之间差异不显著。

图2 山楂属果实不同组织部位的总黄酮含量
Fig.2 Total flavonoids contents from different tissue
parts of hawthorn cultivars
2.3 三种山楂属果实不同组织的单宁和原花青素含量
植物中的单宁类成分具有抗氧化、清除自由基等生理活性功能,具有潜在的开发价值。果实中单宁类物质的存在也使得果实具有明显的涩味,进而影响感官质量,果实在成熟过程中,单宁的含量会逐渐减少,涩味减轻[19]。由表1可知,对于不同品种的山楂果实,果皮的单宁含量显著高于果肉,而在果核中则没有检出单宁含量。山里红果皮中单宁含量最高,其次是小山楂,单宁含量最低的是大山楂;山里红果肉中也含有较高的单宁成分,说明涩味较重,而作为消费者较多食用的大山楂和小山楂果肉中单宁含量较低,且无显著差异。原花青素主要存在于植物的叶、茎、皮、果内,是一种由单体低聚原、高聚原花青素构成的酚类化合物[20]。经研究证实,在抗氧化功能、清除自由基功能等方面原花青素有较强的作用。由表1可知,山楂果皮中花青素含量最高的是山里红,其次是小山楂,原花青素含量最低的是大山楂;山里红果肉中也含有较高的原花青素成分,而大山楂和小山楂果肉中原花青素含量较低,且无显著差异。同时在果核中没有检出原花青素。
表1 山楂属果实不同组织的单宁和原花青素含量
Table 1 Tannin and anthocyanin content of
hawthorn cultivars
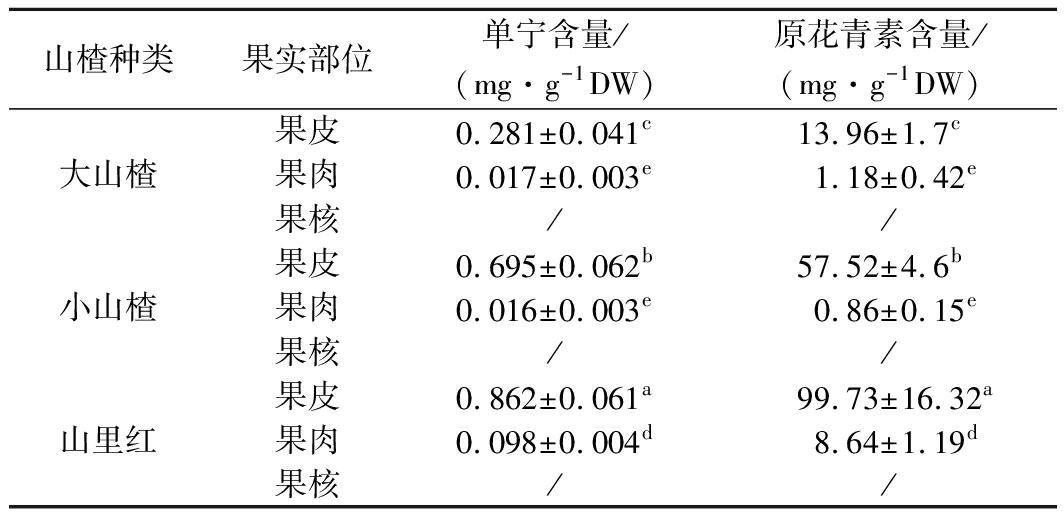
山楂种类果实部位单宁含量/(mg·g-1DW)原花青素含量/(mg·g-1DW)果皮0.281±0.041c13.96±1.7c大山楂果肉0.017±0.003e1.18±0.42e果核/ /果皮0.695±0.062b57.52±4.6b小山楂果肉0.016±0.003e0.86±0.15e果核/ /果皮0.862±0.061a99.73±16.32a山里红果肉0.098±0.004d8.64±1.19d果核/ /
注:表中纵向列中不同字母代表差异显著;/ 代表未检出
2.4 三种山楂属果实不同组织的DPPH自由基清除性能
DPPH自由基清除性能分析是简单、可接受且应用最广泛的技术,用于评估植物提取物的自由基清除能力。DPPH自由基是一种稳定的有机自由基,当其接受电子时,会在515~528 nm处失去吸收光谱带[21]。植物提取物中的多酚类抗氧化成分可提供电子,使稳定的紫色线状DPPH在视觉上显著地猝灭为淡黄色甚至无色[21]。在本研究中,采用维生素C作为当量物质,来衡量不同山楂品种的不同组织中清除DPPH自由基的性能。由图3可知,山楂果皮的DPPH自由基清除能力较高,其次是果肉,果核。山楂果肉提取物的DPPH自由基能力清除较强,三者之间没有显著差异。果核中DPPH自由基清除能力最弱,三者之间没有显著差异。

图3 山楂属果实不同组织的DPPH自由基清除性能
Fig.3 DPPH free radical scavenge capacity of
different tissue parts of hawthorn cultivars
2.5 三种山楂属果实不同组织的ABTS阳离子自由基清除性能
ABTS阳离子自由基氧化后生成相对稳定的水溶性自由基(蓝绿色),ABTS阳离子自由基与水溶性的抗氧化剂反应可让溶液褪色,褪色越显著,该物质的自由基清除能力越强[22]。本研究为评价山楂属果实不同组织部位的ABTS阳离子自由基清除性能,采用维生素C作为当量物质,结果表达为mg 维生素C当量/g DW。由图4可知,山楂果皮的ABTS阳离子自由基清除能力较强,其次是果肉,果核中的酚类物质含量较低,从而使自由基清除能力较弱。山楂果肉提取物的ABTS阳离子自由基清除能力较强,三者之间没有显著差异。果核中ABTS阳离子自由基清除能力最弱,三者之间没有显著差异。在枣不同组织抗氧化成分及活性的研究中,枣果皮的ABTS阳离子自由基清除能力强于果肉和果核,与本实验研究结果相同。

图4 山楂属果实不同组织的ABTS阳离子自由基清除性能
Fig.4 ABTS free radical scavenge capacity of different
tissue parts of hawthorn cultivars
2.6 三种山楂属果实不同组织的还原能力
评价山楂属果实不同组织部位的还原性能,采用维生素C作为当量物质,结果表达为mg 维生素C当量/g DW。如图5所示,3种山楂属果实的果皮显示了最高的还原能力,其次为果肉,果核最低。大山楂和小山楂果皮提取物的还原能力显著高于山里红;在果肉的提取物中,其还原能力强弱为大山楂>小山楂>山里红,且大山楂果肉还原能力是小山楂的1.63倍,是山里红的3.47倍。果核提取物的还原能力较低,且三者之间没有显著差异。
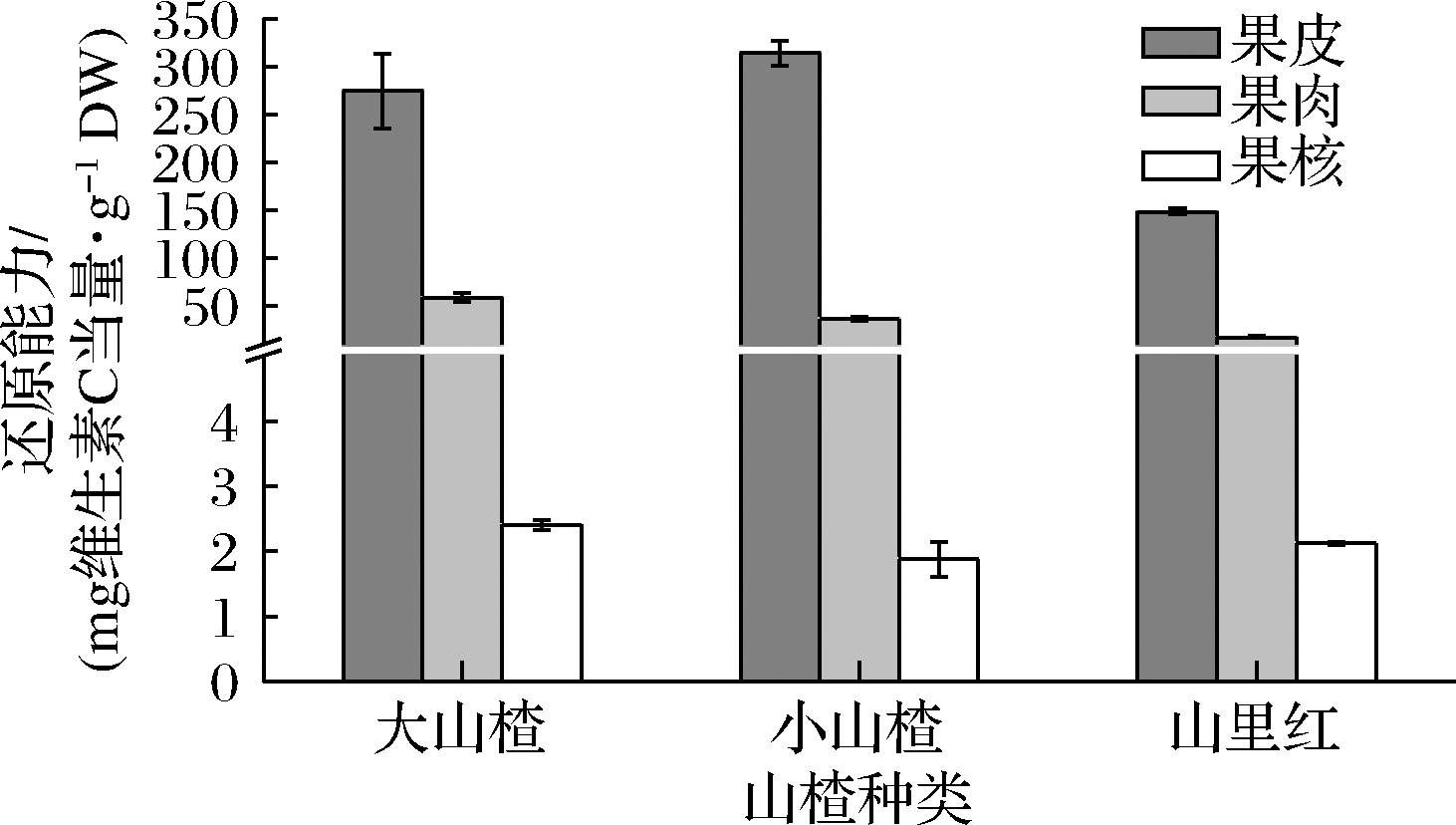
图5 山楂属果实不同组织的还原能力
Fig.5 Reducing power of different tissue parts of
hawthorn cultivars
2.7 三种山楂属果实不同组织的抗氧化成分与抗氧化性能的相关关系
为了评价3种山楂果实中总酚、总黄酮、单宁、花青素含量与抗氧化活性之间的相关性,本研究计算了皮尔逊相关系数(表2)。酚类和黄酮类分子是重要的抗氧化成分,其通过向自由基提供氢原子的能力抑制自由基,许多文献报道表明总酚和总黄酮含量与抗氧化能力呈线性相关[23]。
表2 山楂果实中总酚、总黄酮、单宁、原花青素含量
与抗氧化活性之间的相关性
Table 2 Correlation coefficient between antioxidant capacity and
total phenolics, flavonoids, tannin and anthocyanin contents
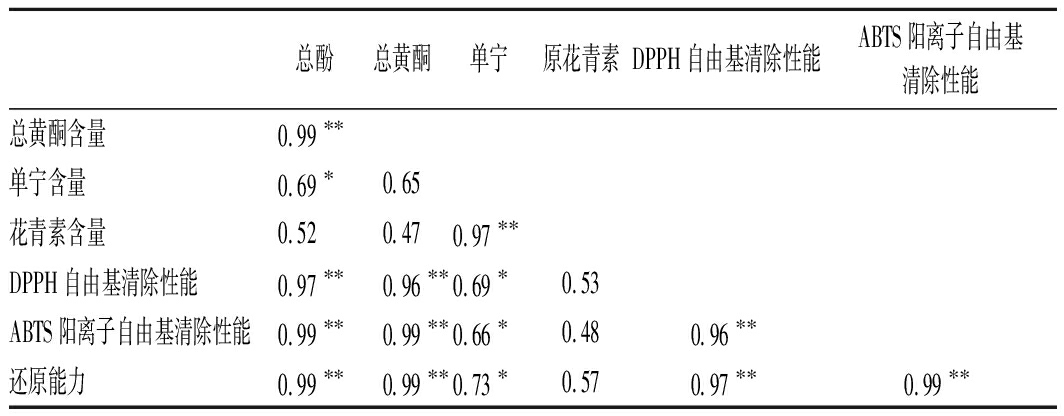
总酚总黄酮单宁原花青素DPPH自由基清除性能ABTS阳离子自由基清除性能总黄酮含量0.99∗∗单宁含量0.69∗0.65花青素含量0.520.470.97∗∗DPPH自由基清除性能0.97∗∗0.96∗∗0.69∗0.53ABTS阳离子自由基清除性能0.99∗∗0.99∗∗0.66∗0.480.96∗∗还原能力0.99∗∗0.99∗∗0.73∗0.570.97∗∗0.99∗∗
注:**表示在0.01水平上显著相关;*表示在0.05水平上显著相关
3种山楂属果实不同组织中中总酚含量与总黄酮含量呈现极显著的相关性(R2=0.99),可以认为在山楂中的酚酸成分以酚类和黄酮类化合物为主。山楂不同组织中总酚含量、总黄酮含量与DPPH 自由基清除性能,ABTS阳离子自由基清除性能和还原能力均呈现极显著的正相关关系,说明山楂提取物中酚类和黄酮类化合物是抗氧化活性的主要提供者。此外单宁含量也与DPPH 自由基清除性能,ABTS阳离子自由基清除性能和还原能力呈现显著的正相关关系,其R2分别为0.69,0.66和0.73,这主要与单宁类物质在果实中含量较低有关。数据显示原花青素含量与抗氧化活性之间没有显著的相关关系,也说明原花青素对山楂提取物的抗氧化活性的贡献较低,这可能是因为花青素含量较低导致。
3 结论
本研究对3种山楂果实不同组织(皮、肉、核)中总酚、总黄酮、单宁、原花青素含量与抗氧化活性进行了对比研究。结果表明,山楂属果实果皮的总酚、总黄酮含量和抗氧化活性最高。其顺序从高到低依次为果皮>果肉>果核;大山楂和小山楂果皮和果肉含有较高的总酚、总黄酮,并且表现出了较强的抗氧化活性。而山里红中的单宁含量比大山楂和小山楂高,说明山里红涩味较重,不适合作为水果食用,但可作为潜在的抗氧化成分的来源;3种山楂属果实不同组织中中总酚含量与总黄酮含量呈现极显著的相关性;总酚含量、总黄酮含量与DPPH自由基清除性能,ABTS阳离子自由基清除性能和还原能力呈现极显著的正相关关系;原花青素含量与抗氧化活性之间相关性不显著。
[1] DA SILVA D T, RODRIGUES R F, MACHADO N M, et al.Natural deep eutectic solvent (NADES)-based blueberry extracts protect against ethanol-induced gastric ulcer in rats[J].Food Research International, 2020, 138.DOI:10.1016/J.FOODRES.2020.109718.
[2] SHARMA R, PADWAD Y.Perspectives of the potential implications of polyphenols in influencing the interrelationship between oxi-inflammatory stress, cellular senescence and immunosenescence during aging[J].Trends in Food Science & Technology, 2020, 98:41-52.
[3] WANG S N, MELNYK J P, TSAO R, et al.How natural dietary antioxidants in fruits, vegetables and legumes promote vascular health[J].Food Research International, 2011, 44(1):14-22.
[4] 王玲, 吴军林, 吴清平, 等.山楂降血脂作用和机理研究进展[J].食品科学, 2015, 36(15):245-248.
WANG L,WU J L,WU Q P, et al.A review of the lipid-lowering activity of and mechanism of fructus crataegi[J].Food Science, 2015, 36(15):245-248.
[5] DEKI V ![]() B, et al.Phenolic and flavonoid content and antioxidant evaluation of hawthorn (Crataegus monogyna Jacq.) fruits and leaves extracts[J].The University Thought - Publication in Natural Sciences, 2020, 10(1):20-25.
B, et al.Phenolic and flavonoid content and antioxidant evaluation of hawthorn (Crataegus monogyna Jacq.) fruits and leaves extracts[J].The University Thought - Publication in Natural Sciences, 2020, 10(1):20-25.
[6] LOU X M, YUAN B, WANG L, et al.Evaluation of physicochemical characteristics, nutritional composition and antioxidant capacity of Chinese organic hawthorn berry (Crataegus pinnatifida)[J].International Journal of Food Science & Technology, 2020, 55(4):1 679-1 688.
[7] WU J Q, PENG W, QIN R X, et al.Crataegus pinnatifida:Chemical constituents, pharmacology, and potential applications[J].Molecules, 2014, 19(2):1 685-1 712.
[8] 徐维盛, 马姗媫, 毕烨, 等.七个不同产地山楂的营养成分分析和抗氧化能力评价[J].营养学报, 2014, 36(3):282-287.
XU W S, MA S J, BI Y,et al.Analysis of the nutritional composition and evaluation of antioxidant capacity of hawthorn fruits from seven different areas[J].Acta Nutrimenta Sinica, 2014, 36(3):282-287.
[9] HOSSAIN M B, BARRY-RYAN C, MARTIN-DIANA A B, et al.Effect of drying method on the antioxidant capacity of six Lamiaceae herbs[J].Food Chemistry,2010, 123(1):85-91.
[10] MEHMOOD A, MURTAZA G.Phenolic contents, antimicrobial and antioxidant activity of Olea ferruginea Royle (Oleaceae)[J].BMC Complementary & Alternative Medicine, 2018, 18(1):173.
[11] HAMEDI F, MOHEBBI M, SHAHIDI F.et al.Ultrasound-assisted osmotic treatment of model food impregnated with pomegranate peel phenolic compounds:Mass transfer, texture, and phenolic evaluations[J].Food and Bioprocess Technology, 2018, 11(5):1 061-1 074.
[12] 田潇瑜, 黄星奕, 白竣文, 等.基于近红外光谱技术的紫薯贮藏期间花青素含量检测[J].农业机械学报, 2019, 50(2):350-355.
TIAN X Y, HUANG X Y, BAI J W, et al.Detection of anthocyanin content of purple sweet potato during storage period based on near infrared spectroscopy[J].Transactions of the Chinese Society for Agricultural Machinery, 2019, 50(2):350-355.
[13] ABBASI A M, SHAH M H, LI T, et al.Ethnomedicinal values, phenolic contents and antioxidant properties of wild culinary vegetables[J].Journal of Ethnopharmacology, 2015, 162:333-345.
[14] ZHANG H, JIANG L, YE S, et al.Systematic evaluation of antioxidant capacities of the ethanolic extract of different tissues of jujube (Ziziphus jujuba Mill.) from China[J].Food and Chenical Toxicology, 2010, 48(6):1 461-1 465.
[15] AL-WESHAHY A, El-NOKETY M, BAKHETE M, et al.Effect of storage on antioxidant activity of freeze-dried potato peels[J].Food Research International, 2013, 50(2):507-512.
[16] ![]() M, KOTNIK P, HADOLIN M, et al.Phenols, proanthocyanidins, flavones and flavonols in some plant materials and their antioxidant activities[J].Food Chemistry, 2005, 89(2):191-198.
M, KOTNIK P, HADOLIN M, et al.Phenols, proanthocyanidins, flavones and flavonols in some plant materials and their antioxidant activities[J].Food Chemistry, 2005, 89(2):191-198.
[17] XUE Z P, FENG W H, CAO J K, JIANG W B.Antioxidant activity and total phenolic contents in peel and pulp of Chinese jujube (Ziziphus jujube Mill.) fruits[J].Journal of Food Biochemistry, 2009,33(5):613-629.
[18] 周毅刚, 许文天, 马小卫,等.芒果果皮和果肉的抗氧化能力分析[J].广东农业科学, 2013,40(24):87-90.
ZHOU Y G, XU W T, MA X W, et al.Antioxidant capacity of pulp and peel from mango cultivars[J].Guangdong Agricultural Sciences, 2013,40(24):87-90.
[19] WIJEKOON M M J O, BHAT R, KARIM A A.Effect of extraction solvents on the phenolic compounds and antioxidant activities of Bunga kantan (Etlingera elatior Jack.) inflorescence[J].Journal of Food Composition & Analysis, 2011, 24(4-5):615-619.
[20] WANG Y, FONG S, JOHNSON C J, et al.Variation of anthocyanins, proanthocyanidins, flavonols, and organic acids in cultivated and wild diploid blueberry species[J].HortScience, 2019, 54(3):576-585.
[21] FITRIANSYAH S N, AULIFA D L, FEBRIANI Y, et al.Correlation of total phenolic, flavonoid and carotenoid content of Phyllanthus emblica extract from bandung with DPPH scavenging activities[J].Pharmacognosy Journal, 2018, 10(3):447-452.
[22] THAIPONG K, BOONPRAKOB U, CROSBY K, et al.Comparison of ABTS, DPPH, FRAP, and ORAC assays for estimating antioxidant activity from guava fruit extracts[J].Journal of Food Composition & Analysis, 2006, 19(6-7):669-675.
[23] WANG C T, CHENG D, CAO J K, et al.Antioxidant capacity and chemical constituents of Chinese jujube (Ziziphus jujuba Mill.) at different ripening stages[J].Food Science & Biotechnology, 2013, 22(3):639-644.