研究表明,人体中95%的自由基是氧自由基,其来源主要分为辐射、药物、酒精等外源性自由基和机体自身代谢产生的内源性自由基两方面,如自由基产生过多而不能及时清除,会通过氧化作用攻击机体内的核酸、蛋白质、糖类及脂肪等大分子物质,破坏细胞结构和功能,导致机体的组织损伤和退行性变化[1]。因此,防止自由基引起的氧化损伤,有效抑制过氧化的发生,一直是研究的热点问题。
南极磷虾分布在环南极海域,蕴藏量巨大,据统计,其生物量约为6.5~10亿t[2-3],并具有极高的营养价值。其中,以南极磷虾为原料提取的南极磷虾油(antarctic krill oil,AKO),含有丰富的磷脂、虾青素、二十碳五烯酸(eicosapentaenoic acid,EPA)、二十二碳六烯酸(docosahexaenoic acid,DHA)、类黄酮、维生素A、维生素E等营养物质,其磷脂含量高达40%,虾青素含量在40~100 mg/kg[4-5],其ω-3脂肪酸与磷脂结合,生物利用率较高[6-7]。研究表明,南极磷虾油具有促进大脑神经发育、提高记忆力、降低血糖和血脂、改善心血管疾病和防止动脉粥样硬化、保护骨骼关节等保健功效[5,8-10],然而对南极磷虾油的抗氧化作用鲜有报道。本实验通过构建小鼠衰老模型,考察南极磷虾油对小鼠的抗氧化作用的影响,为开发南极磷虾油类保健食品提供实验依据。
1 材料与方法
1.1 实验样品
南极磷虾油由辽渔南极磷虾科技发展有限公司提供。
1.2 实验动物
无特定病原体(specific pathogen free,SPF)级癌症研究学会(institute of cancer research,ICR)雄性小鼠,购于辽宁长生生物技术股份有限公司。衰老模型小鼠:SPF级ICR雄性8~10月龄小鼠;动物饲养条件:屏障环境,实验温度20~24 ℃,相对湿度50%~60%。
1.3 实验动物处理
受试小鼠在清洁级动物饲养室内适应性喂养观察7 d,未见异常后眼内眦取血测定血清丙二醛(malondialdehyde,MDA)含量。根据MDA含量将小鼠分层随机分成4个组,每组10只,并适当调整,使各组的平均体重接近均衡。根据样品的人体推荐量5、10、30倍分别设置0.075 g/kg·BW低剂量实验组(L-AKO)、0.150 g/kg·BW中剂量实验组(M-AKO)和0.450 g/kg·BW高剂量实验组(H-AKO),同时设置1个阴性对照组,每组10只小鼠。
1.4 试剂与仪器
MDA、还原型谷胱甘肽(reduced glutathione,GSH)、超氧化物歧化酶(superoxide dismutase,SOD)、蛋白质羰基(protein carbonyl,PCO)试剂盒,南京建成生物工程研究所;BSA124S-CW型赛多利斯精密天平,赛多利斯科学仪器(北京)有限公司;UV-2700型岛津紫外分光光度计,岛津企业管理(中国)有限公司;JW-3021HR型安徽嘉文高速冷冻离心机,安徽嘉文仪器装备有限公司;HH-4型常州万丰恒温水浴锅,常州市万丰仪器制造有限公司。
1.5 实验方法
根据“国食药监保化[2012]107号”文中颁布的《抗氧化评价方法》的要求,以MDA、GSH、SOD和PCO为考察指标。
分别取南极磷虾油1.50、3.00、9.00 g,用玉米胚芽油定容至200 mL,对照组给予等体积玉米胚芽油,分别给予受试动物灌胃,灌胃体积为0.1 mL/10 g·BW,每天灌胃1次,连续灌胃30 d。
30 d后,将老龄小鼠称重,采尾尖血20 μL加入0.48 mL 蒸馏水制成体积分数为4%的溶血液,按试剂盒说明书测定过氧化脂质(lipid peroxide,LPO)降解产物MDA含量、全血抗氧化物质GSH含量;摘眼球采血离心,取血清按试剂盒说明书测定SOD活力、PCO含量。
1.6 实验数据统计
实验数据用SPSS 22.0和Microsoft Excel统计软件进行分析统计处理。
2 结果与分析
2.1 南极磷虾油对实验前后小鼠体重的影响
实验前,各组小鼠体重无明显区别,实验中期和实验末期各剂量实验组小鼠的体重和增重,与阴性对照组相比,差别均无统计学意义(P>0.05)(图1、图2),且在实验期间,各组小鼠生活饮食等未有异常表现,表明南极磷虾油对衰老模型小鼠体重无明显影响(表1)。

a-0 d;b-15 d;c-30 d
图1 不同时间小鼠体重情况
Fig.1 Body weight of mice at different times
注:NS表示无显著相互差异(P>0.05)(下同)

a-体重增长量;b-体重
图2 小鼠体重增加情况
Fig.2 Body weight gain of mice
表1 南极磷虾油对各组老龄小鼠的体重影响![]()
Table 1 The effect on the weight of aged mice in each group

组别数量/只0 d体重/g15 d体重/g30 d体重/g增重量/g对照 1051.27±1.8652.96±1.9454.53±2.113.235±0.445L-AKO1051.34±1.6752.77±1.8654.30±1.952.850±0.53M-AKO1050.83±2.1452.19±2.0753.74±2.362.915±0.425H-AKO1050.42±2.3351.84±2.4153.32±2.462.980±0.55
注:表中各时期各组小鼠的体重及增重量比较,差异均无显著性意义(P>0.05)
2.2 南极磷虾油对老龄小鼠血清中LPO的影响
实验前各组小鼠血清中LPO含量均衡,各组之间差别无统计学意义(P>0.05)。实验末期结果表明各剂量实验组小鼠血清的LPO含量均低于阴性对照组,其中,中、高剂量组与阴性对照组比较,均有显著降低,差异均有统计学意义(P<0.05)(图3)。结果表明受试物具有降低衰老模型小鼠的血清中LPO含量的作用(表2)。
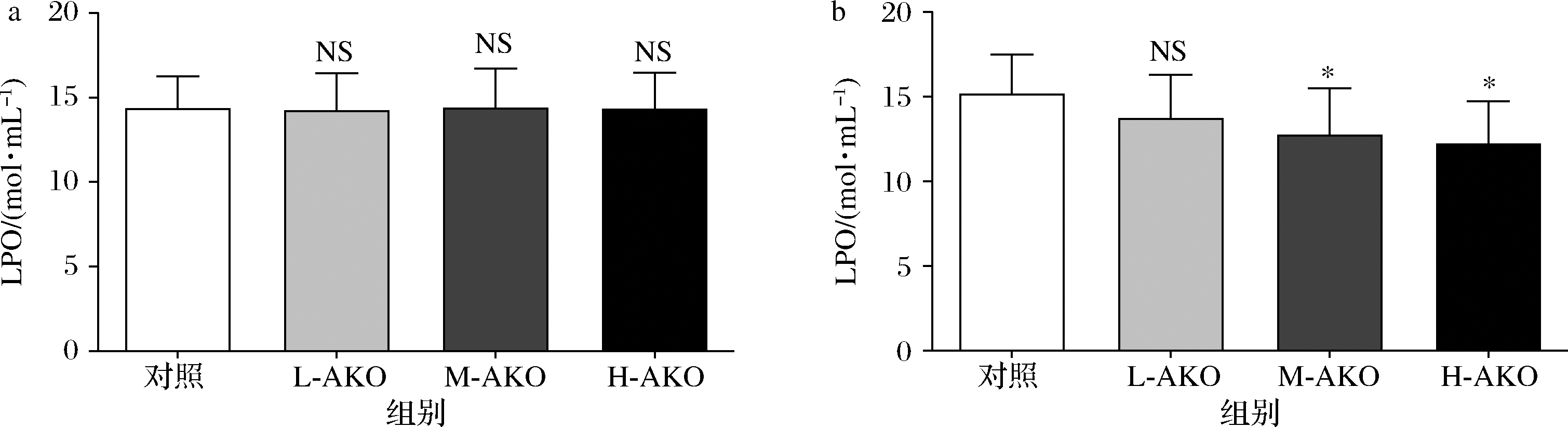
a-0 d;b-30 d
图3 血清LPO含量测定
Fig.3 Determination of serum LPO content
注:*表示差异显著(P<0.05),**表示差异显著(P<0.01)(下同)
表2 南极磷虾油对各组老龄小鼠血清中LPO(以MDA计)
含量的影响![]()
Table 2 The content of LPO (calculated by MDA) in
serum of aged mice in each group

组别数量/只0 d LPO含量/(nmol·mL-1)30 d LPO含量/(nmol·mL-1)P值对照 1014.31±1.9215.12±2.35———L-AKO1014.18±2.2413.67±2.630.809M-AKO1014.35±2.3612.70±2.790.042H-AKO1014.27±2.1812.18±2.540.012
注:“——”表示对照组,其他实验组P值为与对照组相比较的结果(下同)
2.3 南极磷虾油对老龄小鼠血清中SOD活力和GSH含量的影响
2.3.1 南极磷虾油对小鼠血清中SOD活力的影响
SOD活力测定表明,30 d喂养后各剂量实验组小鼠血清中SOD活力与阴性对照组相比均有提高,其中,中剂量组较阴性对照组SOD活力显著增高(P<0.05),高剂量组较阴性对照组SOD活力有极显著增高(P<0.01),差异均有统计学意义(图4)。结果表明受试物具有提高衰老模型小鼠的血清中SOD活力的作用(表3)。
表3 南极磷虾油对各组老龄小鼠血清中
SOD含量的影响![]()
Table 3 The content of SOD in serum of aged
mice in each group

组别数量/只SOD含量/(U·mL-1)P值对照 10167.18±21.05———L-AKO10179.93±18.180.505M-AKO10187.55±18.530.045H-AKO10191.27±20.290.009
2.3.2 南极磷虾油对小鼠血清中GSH含量的影响
GSH测定表明,各剂量实验组小鼠血清中GSH含量与阴性对照组相比均有提高,其中,中剂量组较阴性对照组GSH含量显著提高(P<0.05),高剂量组较阴性对照组GSH含量有极显著提高(P<0.01),差异均有统计学意义(图4)。结果表明受试物具有提高衰老模型小鼠的血清中GSH含量的作用(表4)。
表4 南极磷虾油对各组老龄小鼠血清中GSH含量的
影响![]()
Table 4 The content of GSH in serum of aged
mice in each group

组别数量/只GSH含量/(g·L-1)P值对照 100.357±0.032———L-AKO100.372±0.0360.427M-AKO100.389±0.0430.036H-AKO100.400±0.0410.005
2.4 南极磷虾油对衰老模型小鼠血清中PCO含量的影响
PCO含量测定表明,各剂量实验组小鼠血清中PCO含量与阴性对照组相比虽有所降低,但差别较小,无统计学意义(P>0.05)(图5),表明受试物对老龄小鼠血清中PCO含量无明显影响(表5)。
表5 南极磷虾油对各组老龄小鼠血清中PCO含量![]()
Table 5 The content of PCO in serum of aged mice in
each group

组别数量/只蛋白质羰基含量/(nmol·mg-1蛋白)P值对照 100.479±0.067———L-AKO100.471±0.0480.686M-AKO100.462±0.0440.358H-AKO100.442±0.0530.084

图5 PCO含量测定
Fig.5 PCO content determination
3 讨论
自由基对脂类、蛋白质和DNA的损伤,是导致组织或细胞损伤等病理状况的直接原因。在生物体内,通过酶系统与非酶系统产生氧自由基,能攻击生物膜中的多不饱和脂肪酸,引发脂质过氧化作用,生成LPO,其氧化终产物为MDA,会引起蛋白质、核酸等大分子的交联聚合,从而影响线粒体呼吸链复合物及线粒体内关键酶活性,加剧膜的损伤,产生细胞毒性,进而导致机体损伤,人体衰老,因此MDA含量可以反映机体脂质过氧化速率和强度,也能间接反映组织过氧化损伤程度,是反映机体抗氧化潜在能力的重要参数[11]。

a-SOD含量;b-GSH含量
图4 SOD活力测定与GSH含量测定
Fig.4 SOD activity determination and GSH content determination
SOD和GSH是人体自身代谢过程中生成的抗氧化剂,SOD能专一地清除体内有害的自由基,以解除由自由基氧化体内的某些组分而造成的机体损害;GSH是一种非酶性抗氧化剂,对生物体氧化还原系统和巯基酶有活化作用,通过其巯基氧化-还原态的转换,作为可逆的供氢体,主要在细胞内的水相提供抗氧化保护,复活被活性氧损伤的巯基酶,保护细胞膜中含巯基的蛋白质和含巯基酶不被破坏,同时还可对抗自由基对重要脏器的损害。在成长期,这些抗氧化物质在体内合成旺盛,GSH和SOD等抗氧化剂含量很高,能抑制氧自由基产生,平衡人体的代谢,预防各种慢性病,而随着细胞老化影响,其含量会大幅降低,进而导致器官功能衰退[12-14]。因此,SOD和GSH指标是反映人体抗氧化功能的重要指标。
蛋白质羰基化是蛋白质氨基酸侧链中的自由氨基和亚氨基受到氧自由基攻击生成NH3和相应羰基衍生物的过程,PCO的产生是蛋白质分子被自由基氧化修饰的一个重要标记,通常在人体各类细胞中氧化的蛋白质数量随年龄呈指数上升[15]。因此PCO含量可作为反映机体蛋白质氧化损伤的重要依据。
以自然资源筛选出抗氧化作用的天然成分作为抗氧物的补充是解决抗氧化问题的有效途径之一。南极磷虾油是从南极磷虾中提取的脂质组分,是由磷脂、EPA、DHA、虾青素、胆碱等成分组成的混合物。虾青素具有不饱和酮基和羟基的共轭双键链分子结构,能提供吸引自由基的未配对电子,从而清除自由基,抑制脂质过氧化和增加抗氧化酶活性等[16-17];磷脂可不同程度地提高肝脏、骨骼肌抗氧化酶的活性,对自由基的清除有促进作用,磷脂酰胆碱可在机体内维持SOD活性,保护脂类等分子免受氧自由基的损害[18-20]。
在本研究中,适量南极磷虾油能显著提高衰老模型小鼠血清SOD活力和GSH含量,显著降低血液中LPO含量,但对PCO含量影响小。表明富含虾青素和磷脂等大量生物活性物质的南极磷虾油具有明确的抗氧化的作用,这也为南极磷虾及其深加工产品的应用提供了基础数据。南极磷虾油抗氧化的作用机理机制还有待于深入研究。
[1] 陈瑾歆, 唐聪明.氧自由基的研究进展[J].海南医学院学报, 2004, 10(3):206-208.
CHEN J X, TANG C M.Research progress of oxygen free radicals[J].Journal of Hainan Medical College, 2004, 10(3):206-208.
[2] NICOL S, FOSTER J.Recent trends in the fishery for Antarctic krill[J].Aquatic Living Resources, 2003, 16(1):42-45.
[3] 孙雷, 周德庆, 盛晓风.南极磷虾营养评价与安全性研究[J].海洋水产研究, 2008, 29(2):57-64.
SUN L, ZHOU D Q, SHENG X F.Nutrition and safety evaluation of Antarctic krill[J].Marine Fisheries Research, 2008, 29(2):57-64.
[4] SAVAGE G P, FOULDS M J.Chemical composition and nutritive value of Antarctic krill (Euphausia superba) and southern blue whiting (Micromesistius australis)[J].New Zealand Journal of Marine and Freshwater Research, 1987, 21(4):599-604.
[5] 施佳慧, 吕桂善, 徐同成, 等.磷虾油的脂肪酸成分及其降血脂功能研究[J].营养学报, 2008, 30(1):115-116.
SHI J H, LYU G S, XU T C, et al.Study on fatty acids components and the hypolipidemic activity of superba oil[J].Acta Nutrimenta Sinica, 2008, 30(1):115-116.
[6] WERNER A, HAVINGA R, KUIPERS F, et al.Treatment of EFA deficiency with dietary triglycerides or phospholipids in a murine model of extrahepatic cholestasis[J].American Journal of Physiology.Gastrointestinal and Liver Physiology, 2004, 286(5):G822-G832.
[7] KIDD P M.Omega-3 DHA and EPA for cognition, behavior, and mood:Clinical findings and structural-functional synergies with cell membrane phospholipids[J].Alternative Medicine Review, 2007, 12(3):207-227.
[8] 刘丽, 刘承初, 赵勇, 等.南极磷虾的营养保健功效以及食用安全性评价[J].食品科学, 2010, 31(17):443-447.
LIU L, LIU C C, ZHAO Y, et al.Recent advances in the healthcare function and food safety of Antarctic krill[J].Food Science, 2010, 31(17):443-447.
[9] 贺瑞坤, 罗海吉.南极磷虾油对人类健康的作用[J].食品研究与开发, 2013, 34(20):130-133.
HE R K, LUO H J.Health benefits of Antarctic krill oil[J].Food Research and Development, 2013, 34(20):130-133.
[10] 王亚恩. 南极磷虾油降血脂、抗氧化力及其改善记忆力功能实验研究[D].青岛:中国海洋大学, 2011.
WANG Y E.Experimental study of the Antarctic krill oil on the serum lipids and antioxidation ability and memory ability[D].Qingdao:Ocean University of China, 2011.
[11] ZWART L L D, MEERMAN J H N, COMMANDEUR J N M, et al.Biomarkers of free radical damage applications in experimental animals and in humans[J].Free Radical Biology & Medicine, 1999, 26(1-2):202-226.
[12] SAIRAM R K, SINGH D V, SRIVASTAVA G C.Changes in activities of antioxidant enzymes in sunflower leaves of different ages[J].Biologia Plantarum, 2003, 47(1):61-66.
[13] AIT Y D, SIHEM M, EMMANUELLE P, et al.Tissue antioxidant status differs in spontaneously hypertensive rats fed fish protein or casein[J].Journal of Nutrition, 2003, 133(2):479-482.
[14] 张玉臣, 杜永丽, 聂翠芳, 等.还原型谷胱甘肽的临床应用进展[J].社区医学杂志, 2005, 3(4):26-27.
ZHANG Y C, DU Y L, NIE C F, et al.Clinical application progress of reduced glutathione sodjum[J].Journal of Community Medicine, 2005, 3(4):26-27.
[15] 文镜, 张春华, 董雨, 等.蛋白质羰基含量与蛋白质氧化损伤[J].食品科学, 2003, 24(10):153-157.
WEN J, ZHANG C H, DONG Y, et al.Review on relationship between protein carbonyl content and protein oxidative injury[J].Food Science, 2003, 24(10):153-157.
[16] 杨艳, 周宇红, 徐海滨.虾青素抗氧化活性机制研究进展[J].国外医学 (卫生学分册), 2008, 35(4):231-234.
YANG Y, ZHOU Y H, XU H B.Research progress on antioxidant mechanism of astaxanthin[J].Foreign Medical Sciences (Section Hygiene), 2008, 35(4):231-234.
[17] JANINA D, SEIICHI M, HARUKA Y, et al.Free radical scavenging and cellular antioxidant properties of astaxanthin[J].International Journal of Molecular Sciences, 2016, 17(1).DOI:10.3390/ijms17010103.
[18] 刘仁海, 黄瑾, 何玲, 等.磷脂酰胆碱抗氧化作用的研究[J].农垦医学, 1995 (4):222-223.
LIU R H, HUANG J, HE L, et al.Studies on antioxidation of phosphatidylcholine[J].Agricultural Reclamation Medicine, 1995 (4):222-223.
[19] 费云芸, 董贵俊.磷脂对小鼠运动耐力及肝脏、骨骼肌组织抗氧化能力的影响研究[J].吉林体育学院学报, 2011, 27(5):77-78.
FEI Y Y, DONG G J.Effects of phospholipids on delaying fatigue and anti-oxidation in mice′s liver and skeletal muscle[J].Journal of Jilin Institute of Physical Education, 2011, 27(5):77-78.
[20] 胡滨, 陈一资, 王雪铭, 等.红花籽油的抗氧化功能研究[J].中国粮油学报, 2016, 31(6):86-91.
HU B, CHEN Y Z, WANG X M, et al.The antioxidant activity of safflower seed oil[J].Journal of the Chinese Cereals and Oils Association, 2016, 31(6):86-91.