烟酸又称维生素B3,在生物体的生命活动中起着重要作用。烟酸具有抗氧化活性,可以保护蛋白质免受UV-C辐射的损害[1]。食用含有烟酸的饮食可以降低牛、火鸡或猪等的脂肪含量,从而改善肉质[2]。此外,烟酸还可以作为原料来合成新的化学中间体,例如烟酰胺、6-羟基烟酸[3]等。
利用腈水解酶催化3-氰基吡啶制得烟酸具有产物纯度高、反应时间短、操作过程简单的优点。据报道,产腈水解酶的杜鹃红球菌tg1-A6在55 ℃下能将130 mmol/L 3-氰基吡啶完全转化为烟酸,烟酸的最高质量浓度可达165.2 g/L[4]。FAN等[5]构建了1株产重组腈水解酶的大肠杆菌,基因来源为Ralstonia eutropha H16,该酶可以在20.8 h水解1 050 mmol/L 3-氰基吡啶,积累生产烟酸129.2 g/L。
通过罐上发酵培养可以提高细胞在培养基中的密度,从而提高产物的浓度和比细胞生产率[6]。相比常规细胞培养方法,罐上发酵技术能够提高生产率、减少培养量和设备投资,并增强下游加工能力[7]。通过控制营养物的补料分批培养是实现高细胞密度发酵的最常用方法之一,其包括简单间接反馈方法,例如恒pH培养策略、DO-stat策略、指数进料,或者根据葡萄糖需求量反馈补料等方法[8-9]。顾炳琛等[10]在腈水解酶产生菌的发酵中采用pH调节策略,最终腈水解酶的最高活性可达到583.3 U/mL。
磁性固定化是通过使用磁性纳米材料对酶、抗体或细胞等进行结合,从而实现通过磁场进行产物或细胞分离的一种固定化方法。磁性纳米颗粒比表面积高且在外部磁场下易于分离[11]。与游离酶相比,固定在磁性纳米颗粒上的酶对有机溶剂介导的变性具有更高的抵抗力[12]。而复合型磁性纳米材料则是磁性纳米粒子与特定的载体材料结合而设计的新型材料[13]。阳离子聚合物是复合磁性纳米粒子常使用的材料,可以通过提供静电力的表面修饰提高固定化效率[14]。
在前期工作中,本实验室已成功构建1株产重组腈水解酶的Bacillus subtilis pMA5-NITR,其最高酶活力为38.03 U/mL,可以催化3-氰基吡啶累积生产烟酸,质量浓度达到295.46 g/L[15]。为了进一步提高B.subtilis来源的腈水解酶的产酶潜力和累积生产烟酸的能力,本文采用分批培养、恒速补料培养和恒pH培养等策略对重组菌进行发酵培养,提高酶活力及生物量、降低生产成本,进一步运用氨基化核壳结构磁性Fe3O4纳米粒子对重组菌进行细胞固定化,以提高酶稳定性,提升其转化应用潜力。目前的研究可以为未来腈水解酶产生菌的发酵工艺及大规模生物转化合成烟酸奠定基础。
1 材料与方法
1.1 实验材料
1.1.1 菌种
重组腈水解酶B.subtilis pMA5-NITR(以下简称重组腈水解酶)为实验室保藏,基因是恶臭假单胞菌来源的腈水解酶基因[15]。
1.1.2 试剂
酵母粉、胰蛋白胨、琼脂,OXOID/REMEL(英国);氯化钠、葡萄糖、KH2PO4、K2HPO4·3H2O,国药集团化学试剂有限公司。
1.1.3 培养基
LB培养基(g/L):氯化钠10,胰蛋白胨10,酵母粉5;
TBG培养基(g/L):胰蛋白胨12,KH2PO4 2.3,K2HPO4·3H2O 16.4,酵母粉24,葡萄糖10,甘油5;
补料培养基(g/L):葡萄糖800;
固体LB培养基(g/L):氯化钠10,胰蛋白胨10,酵母粉5,琼脂20;
LB、固体LB培养基于121 ℃灭菌20 min;TBG培养基、补料培养基于115 ℃灭菌20 min。
1.2 实验方法
1.2.1 分析方法
1.2.1.1 酶活力检测方法
酶活力定义:在标准条件下即30 ℃的反应温度下,1 min生成1 μmol烟酸或氨所需酶量为1 U。
取200 μL菌液在12 000 r/min下离心2 min,并用PBS缓冲液(100 mmol/L,pH 7.2)洗涤2次后收集静息细胞,加入800 μL PBS缓冲液进行重悬并于30 ℃金属浴反应5 min。添加200 μL 3-氰基吡啶(500 mmol/L)后继续反应10 min。反应结束后12 000 r/min下离心2 min。取10 μL反应上清液如上述操作进行显色反应,测定酶活力。
1.2.1.2 HPLC分析
本研究中3-氰基吡啶和烟酸均使用HPLC(Dionex Ultimate 3000)进行分析。分析柱使用X-Bridge C18柱(5.0 μm,4.6 mm×250 mm;Waters),0.02%流动相为60%的乙腈和40%的三氟乙酸(均为体积分数)。液相分析的流速、柱温和检测波长分别设置为0.5 mL/min、30 ℃和268 nm。
1.2.2 罐上发酵
1.2.2.1 种子制备
将-80 ℃冻存的B.subtilis pMA5-NITR于LB平板进行划线,37 ℃培养12 h后挑取单菌落接种于10 mL LB培养基中,37 ℃、220 r/min培养12 h。然后按接种量2%转接至100 mL新鲜LB培养基,于37 ℃、220 r/min培养8 h后作为种子液待用。
1.2.2.2 分批培养
发酵罐大小为7.5 L,装有4 L无菌TBG培养基。将种子液按照10%的接种量接种至发酵罐中并添加卡那霉素(Kanamycin)(终质量浓度50 μg/mL)。控制发酵反应温度为30 ℃、搅拌转速为500 r/min,溶氧不低于30%(体积分数),并流加消泡剂。定时取样检测发酵液的菌液浓度、酶活力、pH、残余葡萄糖浓度。
1.2.2.3 恒速补料培养
首先按照1.2.2.2进行分批培养,在发酵过程中流加25%(体积分数)氨水,控制pH不低于7.0。当检测到残余葡萄糖基本消耗完时进行补料,补料速率为3.6 mL/h。
1.2.2.4 恒pH培养
采用恒pH培养法进行补料,在发酵前期进行分批培养,当发酵罐内葡萄糖基本消耗完后根据pH变化进行反馈补料。发酵前期,葡萄糖流加速率为20%,同时流加25%氨水使pH维持在7.0左右;发酵中期,葡萄糖流加速率为15%,同时流加氨水使pH维持在7.0左右;发酵后期,葡萄糖流加速率为5%,同时流加氨水使pH维持在7.0左右。此外,补料全程维持葡萄糖质量浓度在1~5 g/L,发酵中后期通过增加通气量和提高搅拌转速来保证溶氧供给。
1.2.3 制备Fe3O4磁性纳米粒子
1.2.3.1 制备Fe3O4纳米粒子
采用化学共沉淀方法[16],进行Fe3O4磁性纳米粒子制备。具体步骤如下:FeCl3·6H2O和FeCl2·4H2O,按照1∶8的摩尔比溶解于100 mL的超纯水中,并在N2下搅拌混匀。然后滴加氨水到混合溶液中,至pH为11。在70 ℃下反应1 h后,置于室温下冷却。通过外加磁场将产物从溶液中分离,并用蒸馏水反复洗涤至pH变为中性。最后于室温下真空干燥,获得Fe3O4纳米粒子。其主要反应过程为[17]:
Fe2++Fe3++OH-→Fe(OH)2/Fe(OH)3(形成共沉淀);
Fe(OH)2+Fe(OH)3→FeOOH+Fe3O4(pH≤7.5);
FeOOH+Fe2+→Fe3O4+H+(pH≥9.2)。
1.2.3.2 制备Fe3O4@SiO2纳米粒子。
取4 g制备好的Fe3O4纳米粒子,加入160 mL乙醇,40 mL水和5 mL氨水,超声分散1 h后在室温下进行机械搅拌,同时缓慢滴加1 mg/L正硅酸乙酯(tetraethoxysilane,TEOS)至混合溶液中。反应12 h后,通过外加磁场将产物从溶液中分离,蒸馏水反复洗涤至pH变为中性。然后加入50 mL 1 mol/L的HCl,过夜浸泡,外加磁场进行分离,并用蒸馏水洗涤至中性,最后于室温下真空干燥,获得Fe3O4@SiO2的纳米粒子。
1.2.3.3 制备Fe3O4@SiO2@PEI纳米粒子
取1 g Fe3O4@SiO2加入到含有100 mL超纯水的锥形瓶中,超声分散1 h后加入20 mg/mL的聚乙烯亚胺(polyethylenimine,PEI,分子量10 000),N2保护下持续搅拌,反应8 h后,利用外加磁场分离,除去多余未反应的PEI,再超声分散于超纯水中,最后室温下真空干燥,即可得到经PEI修饰的氨基化核壳结构的Fe3O4纳米粒子,即为Fe3O4@SiO2@PEI,保存备用。
1.2.4 制备磁性固定化细胞
1.2.4.1 制备方法
重组腈水解酶10 000 r/min离心5 min后去上清液,使用PBS缓冲液(100 mmol/L,pH 7.2)洗涤3次后重悬制备成静息细胞悬液,使用分光光度计测定菌液浓度后放于4 ℃备用。
将制备的Fe3O4@SiO2@PEI按照一定比例加入到重组腈水解酶静息细胞悬液中,30 ℃、120 r/min培养20 min后利用外加磁场除去未吸附上磁性纳米粒子的菌体。充分洗涤后测定菌液浓度,置于4 ℃备用。
吸附效率计算如公式(1)所示:
吸附效率/%
(1)
1.2.4.2 制备条件对固定化细胞的影响
(1)静息细胞浓度:将制备好的Fe3O4@SiO2@PEI磁性纳米粒子按照1 g/L进行分装,并添加PBS进行重悬,然后超声分散1 h。并将静息细胞按照比例添加至磁性固定化细胞中,分别稀释到1~11 g/L。
(2)温度:分别在20~60 ℃下,将适量的Fe3O4@SiO2@PEI磁性纳米粒子加入到静息细胞悬液中制备磁性固定化细胞。
(3)pH:分别在pH 4.0~9.0环境下,将适量的Fe3O4@SiO2@PEI磁性纳米粒子加入到静息细胞悬液中制备磁性固定化细胞。
测定不同静息细胞浓度、温度及pH下固定化细胞的吸附效率和酶活力,研究不同制备条件对磁性固定化细胞的影响。
1.2.4.3 磁性固定化细胞的性能评价
(1)细胞温度稳定性:将磁性固定化细胞分别置于4、30、40、50 ℃条件下进行孵育,定时取样测定酶活力直至酶活力降低至初始水平的一半。以初始固定化细胞酶活力作为对照,以残余酶活力的自然对数对时间进行作图并计算固定化腈水解酶在不同温度下的半衰期。
(2)底物耐受性:将50~400 mmol/L的3-氰基吡啶分别加入到固定化细胞和游离细胞体系中进行酶催化反应。通过不同3-氰基吡啶浓度下磁性固定化细胞和游离细胞酶活力的变化来评价底物耐受性。
(3)初始底物浓度影响:在相同体积的体系中,分别添加50~400 mmol/L的3-氰基吡啶进行转化反应。每5 min取样,检测磁性固定化细胞对不同浓度底物的转化效率。
1.2.5 磁性固定化细胞批次转化生产烟酸
使用制备好的磁性固定化细胞进行对3-氰基吡啶的转化实验。每批次添加200 mmol/L终浓度的底物3-氰基吡啶,每转化10批次,通过磁场分离磁性固定化细胞和产物,并将磁性固定化细胞转入新的体系进行下一轮批次转化。
2 结果与分析
2.1 重组菌的罐上发酵
2.1.1 分批培养
通过分批培养策略研究重组菌的pH变化、酶活力、葡萄糖浓度和菌液浓度变化情况,分析影响重组菌发酵产酶的因素,为后续发酵优化提供参考依据。由图1可知,在发酵初始阶段,生物量较低,重组菌处于迟缓期,发酵罐内pH基本维持恒定;发酵中期,重组菌达到对数期,菌体开始快速生长,此时酶活力也随着重组菌生物量的提高而快速升高,在36 h时菌液浓度达到最高,OD600为19.27,同时酶活力也达到最大值为63.41 U/mL;随后重组菌进入稳定期中后期,此时发酵罐内葡萄糖基本消耗完毕,发酵pH持续增加;在发酵末期,pH进一步升高,达到8.0以上,重组腈水解酶的酶活力开始出现明显降低。

图1 重组B.subtilis pMA5-NITR分批培养
Fig.1 Batch mode of fermentation of the recombinant
B.subtilis pMA5-NITR
2.1.2 恒速补料培养
在发酵过程中进行补料流加,可以有效补充细菌生长所必需的营养物质。由于葡萄糖廉价易得,并且能够被微生物快速利用,因此被广泛用作重组菌罐上发酵的限制性基质为微生物生长提供能源[18]。黄燕等[19]通过恒速补料培养的方法提升了角质酶的表达水平,在OD600为75时,进行恒速流加0.8 g/(L·h)的乳糖溶液,重组菌在24 h达到最高(OD600为90),酶活力在26 h达到最大为4 788 U/mL,是摇瓶发酵酶活力的28倍。
因此,待初始葡萄糖基本消耗完毕后对重组菌进行补料,葡萄糖流加速率为3.6 mL/h。由图2可知,开始补糖后重组腈水解酶的对数生长期显著延长。在63 h前,重组菌的酶活力和菌液浓度随着时间的增加而升高,酶活力在66 h达到最大值,为125.62 U/mL,是分批培养的1.98倍。菌液浓度在75 h达到最大值,OD600为55.80,是分批培养的2.9倍。
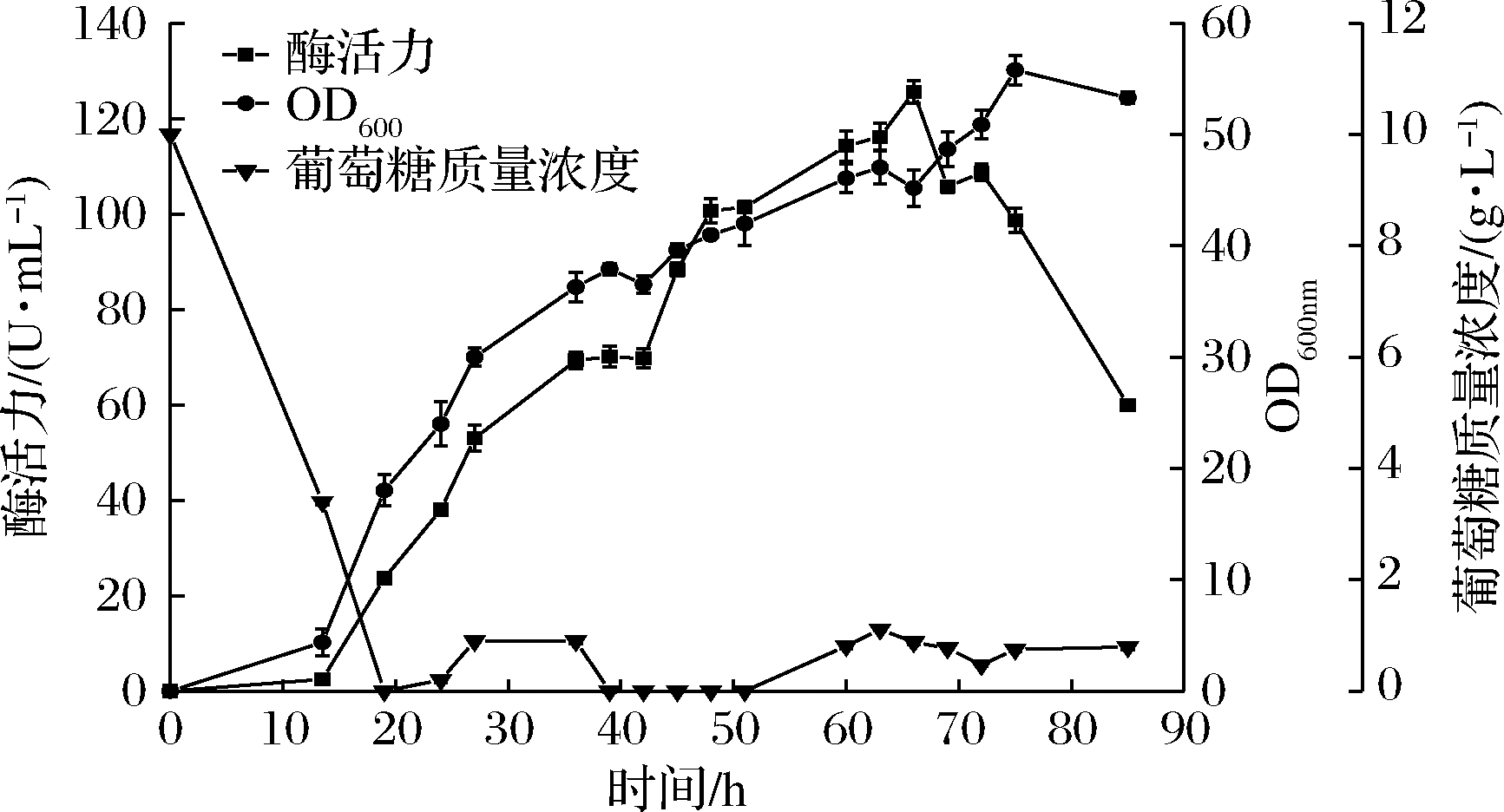
图2 重组B.subtilis pMA5-NITR恒速补料培养
Fig.2 Constant-speed feed fermentation of the recombinant
B.subtilis pMA5-NITR
2.1.3 恒pH培养
由恒速补料培养可知,发酵中后期由于葡萄糖流加速率有限,无法及时满足重组菌生长繁殖所需,使菌体生长减慢,产酶受到限制。采取调控更加精细的恒pH培养策略,对重组腈水解酶进行发酵,有望进一步提升菌体的产酶潜力。
如图3所示,发酵罐内葡萄糖在24 h时基本消耗完毕,此时开始补加葡萄糖。在进行补料之后葡萄糖浓度相对较为稳定,60 h后葡萄糖质量浓度基本稳定在1.2 g/L。重组菌菌液浓度随着时间延长而稳步上升,并在84 h时达到最高(OD600为58.85),是分批培养的3.05倍,随后开始缓慢下降。重组B.subtilis在发酵51 h时有最高酶活力,为167.32 U/mL,是分批培养的2.64倍,随后酶活力开始下降。90 h后酶活力快速降低,96 h时酶活力约为80 U/mL,在108 h时终止发酵。
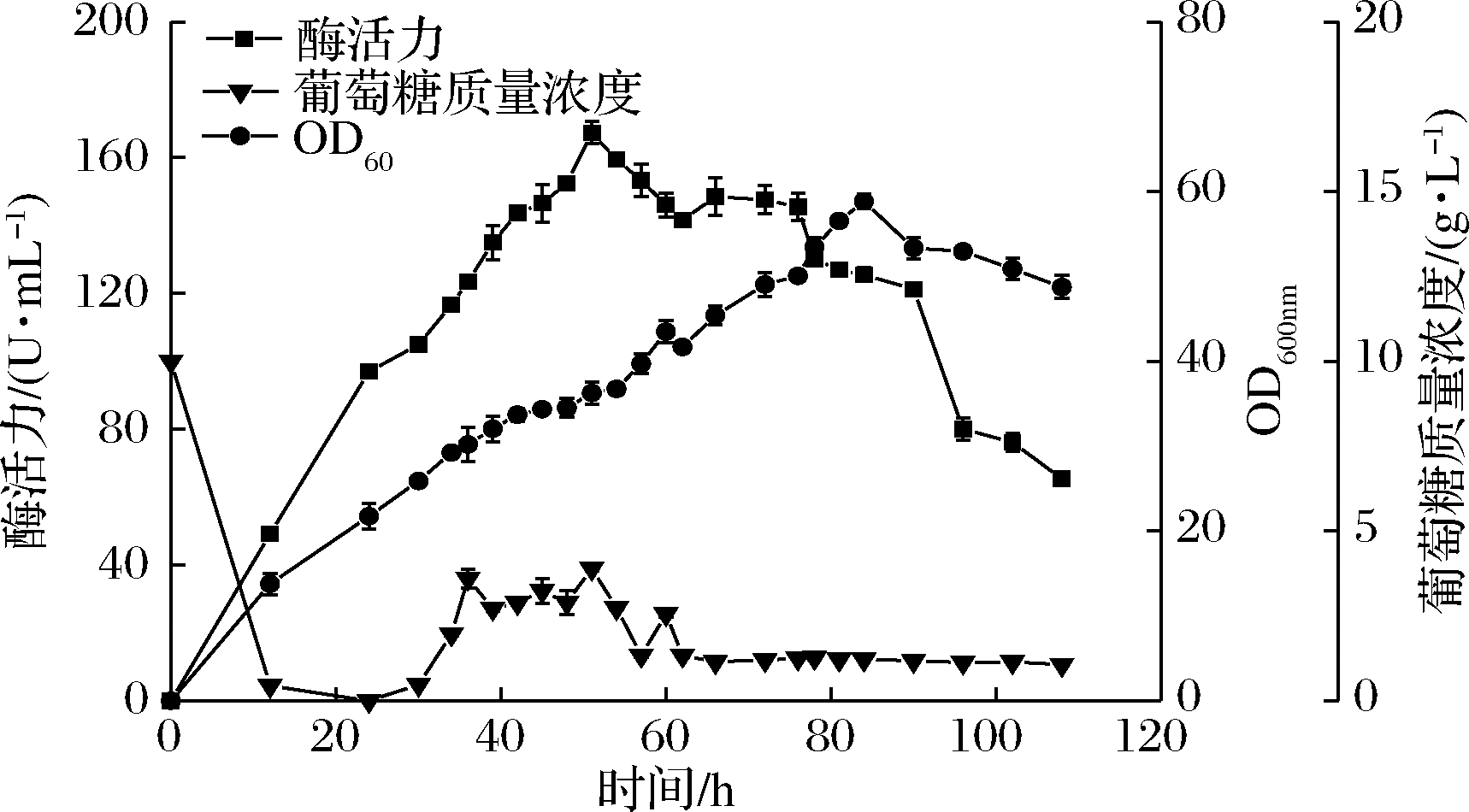
图3 重组B.subtilis pMA5-NITR恒pH培养策略
Fig.3 Feeding fermentation in pH-stat strategy of the recombinant
B.subtilis pMA5-NITR
2.2 重组腈水解酶的磁性固定化
2.2.1 静息细胞浓度对磁性固定化细胞的制备及酶活力的影响
将1 g/L的Fe3O4@SiO2@PEI磁性纳米粒子分别添加到1~11 g/L的静息细胞中进行混合,并按照1.2.4制成磁性固定化细胞。结果如图4-a所示,在静息细胞质量浓度为3 g/L时,吸附效率最高,可达到69%,随着静息细胞浓度的升高,吸附效率逐渐降低。固定化细胞酶活力随静息细胞浓度的增加而升高,在5 g/L时达到最高酶活力,之后随着静息细胞浓度的升高,吸附效率开始下降,而酶活力也随之降低。因此,5 g/L为最佳静息细胞吸附浓度。
2.2.2 温度对磁性固定化细胞的制备及酶活力的影响
为了评估温度对磁性固定化细胞的制备和酶活力的影响,在20~60 ℃下制备磁性固定化细胞。结果如图4-b所示,在55 ℃之前,磁性纳米粒子对细胞的吸附效率随着温度的升高而提高,在55 ℃时达到最大吸附效率为76%,而当温度超过55 ℃,吸附效率开始下降。酶活力在50 ℃之前随着温度的升高而增加,并在50 ℃达到最大,然后随着温度的升高而降低。考虑到腈水解酶的稳定性,选择相对较高的30 ℃作为后续研究温度。
2.2.3 pH对磁性固定化细胞的制备及酶活力的影响
不同pH条件会影响到磁性纳米粒子和菌体表面的带电情况,并影响到两者之间的吸附效率。将静息细胞和磁性纳米粒子在不同pH的缓冲液下进行复合,如图4-c所示,当pH较低时,磁性固定化细胞的吸附效率较低,且随着pH的升高而增大。当pH在7.2时有最高吸附效率为67.33%,然后随着pH的升高而逐渐下降。酶活力受pH的影响较大,在pH 4.0~4.6基本完全丧失酶活力,然后随着pH的上升而升高,并在pH 7.2时有最高酶活力。之后酶活力随着pH的升高而下降,并在pH为8.9时基本完全丧失。同时磁性固定化细胞的酶活力受缓冲液的影响较明显,在PBS缓冲液中酶活力最高。
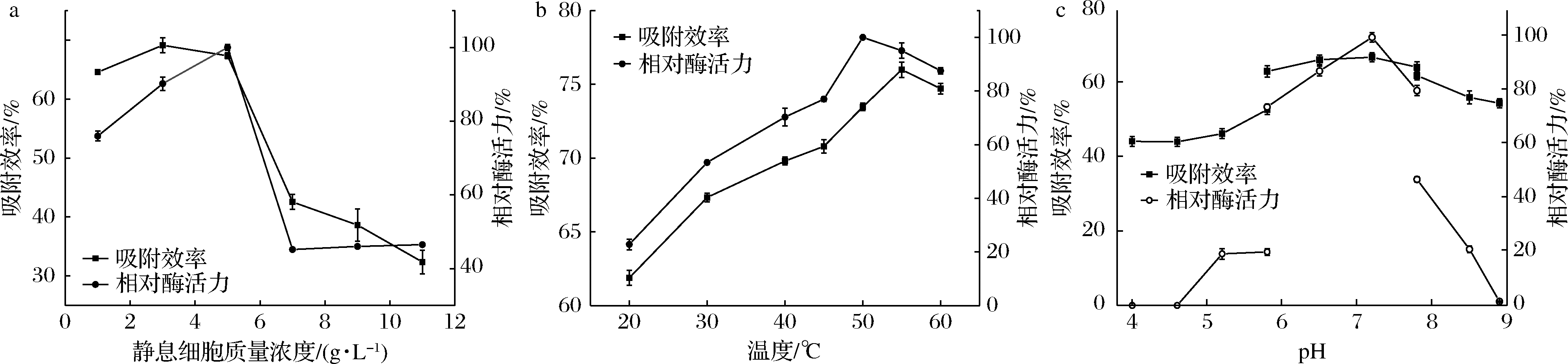
a-不同静息细胞质量浓度;b-不同反应温度;c-不同反应pH
图4 不同制备条件对磁性固定化细胞及酶活力的影响
Fig.4 Effect of different preparation conditions on the magnetically immobilized cells and enzyme activity
2.2.4 磁性固定化细胞的温度稳定性
设置不同的温度孵育磁性固定化细胞,以残留酶活力(residual enzyme activity,RA)的自然对数ln(RA)对时间进行作图。初始固定化细胞酶活力设定为相对活性的100%。由图5-a可知,固定化细胞在4 ℃下最为稳定,其半衰期(t1/2)达到140 h。在30 ℃下相对较稳定,半衰期(t1/2)为15 h。在40、50 ℃ 下保存6 h后,酶活力仅有初始酶活力的29%和5%。和游离细胞相比,磁性固定化细胞在4 ℃下的半衰期提高了2.33倍。
2.2.5 磁性固定化细胞的底物耐受性
底物耐受性是反映酶催化能力的重要指标,良好的底物耐受性可以使酶催化承受更高的底物浓度,提高酶的催化效率和重复使用能力。据报道,产腈水解酶的固定化重组大肠杆菌可以将1 mol/L 3-氰基吡啶完全催化为烟酸,其底物耐受性和稳定性得到显著提升[20]。
在相同反应体系中,分别在磁性固定化细胞和游离细胞反应液中添加50~400 mmol/L终浓度的底物,检测底物耐受性。结果如图5-b所示,随着底物浓度的升高,游离细胞酶活力快速降低,在添加100 mmol/L终浓度的底物时酶活力仅有相对酶活力的59%,在300 mmol/L终浓度底物下基本完全丧失酶活力。磁性固定化细胞在200 mmol/L以下随着底物浓度的升高酶活力逐渐提高,并在200 mmol/L终浓度底物下表现出最高酶活力,然后随着底物浓度的继续升高而逐渐降低。在400 mmol/L终浓度底物下,磁性固定化细胞仍保留有60%的酶活力。磁性固定化细胞的底物耐受性比游离细胞显著提升。
2.2.6 初始底物浓度对磁性固定化细胞转化能力的影响
在相同体系下,分别添加50~400 mmol/L不同初始浓度的底物。结果如图5-c所示,50和100 mmol/L的底物在5 min内即可完全转化完毕,当底物浓度进一步提高,转化时间相应延长,400 mmol/L的底物需要60 min才能完全转化。考虑到转化效率,后续批次转化生产烟酸实验采用200 mmol/L终浓度的底物进行转化。
2.3 磁性固定化细胞批次转化
每批次添加200 mmol/L终浓度的底物3-氰基吡啶,游离细胞在转化10批次后残余酶活力约为初始酶活力的20%,产物抑制较为明显。因此每转化10批次,通过磁场分离磁性固定化细胞与产物,对固定化细胞进行重复使用结果如图6所示。
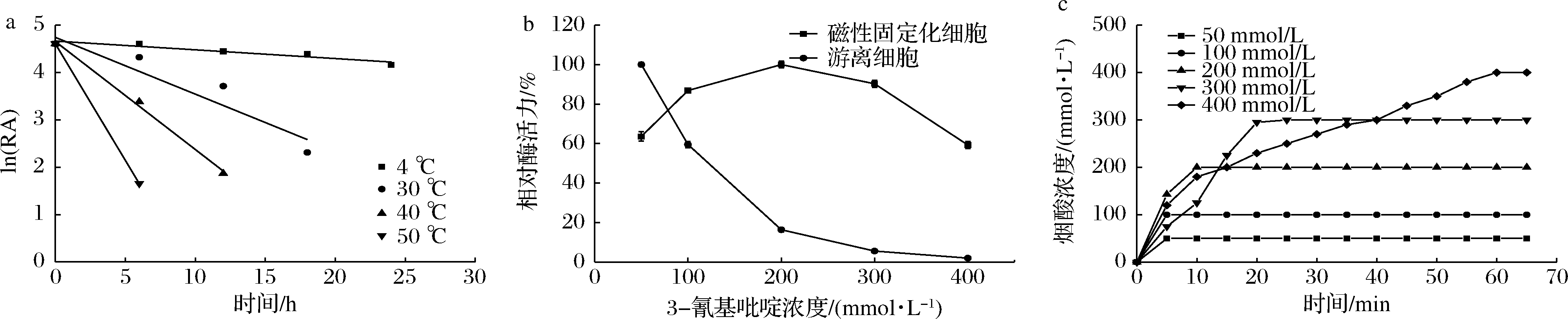
a-磁性固定化细胞的温度稳定性;b-磁性固定化细胞和游离细胞的底物耐受性;c-初始底物浓度对磁性固定化细胞转化能力的影响
图5 磁性固定化细胞的性能评价
Fig.5 Performance evaluation of magnetically immobilized cells
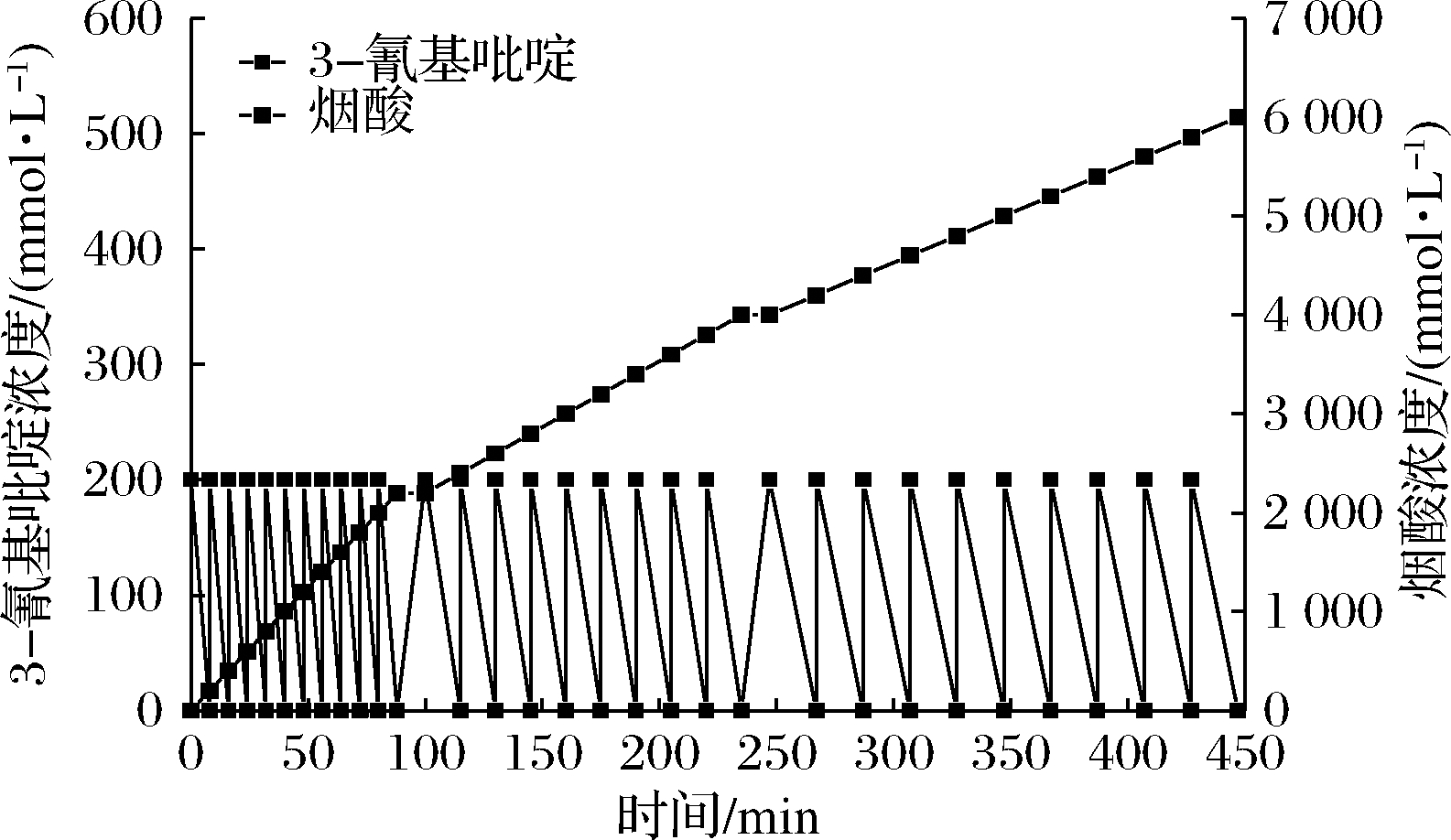
图6 磁性固定化细胞批次转化生产烟酸
Fig.6 Batch conversion of magnetic immobilized cells to
produce nicotinic acid
前10个批次3-氰基吡啶可以在8 min之内转化完毕,第11~20批次底物能够在15 min内完全转化,第21~30批次底物能够在20 min内完全转化,并检测不到底物残留,最终烟酸累积质量浓度达到738.66 g/L,是目前已有报道的B.subtilis腈水解酶生产烟酸的最高水平。据报道,DONG等[21]对腈水解酶产生菌恶臭假单胞菌CGMCC3830进行复合固定,该固定化细胞可以转化14批次3-氰基吡啶,并积累烟酸达418 g/L。
经过酶活力测定,在转化30批次底物后,磁性固定化细胞仍然保留40%酶活力,而游离细胞仅能完成一轮批次转化,酶活力就显著丧失。和游离细胞相比,磁性固定化细胞对3-氰基吡啶的转化速率大大提升,前期是游离细胞的3.75倍。通过磁场快速分离产物后转入新的体系仍能继续进行批次转化,最终累积生成烟酸浓度是游离细胞的2.5倍。
3 结论
本文分别使用分批培养、恒速补料培养以及恒pH培养等不同策略对重组腈水解酶产生菌B.subtilis pMA5-NITR进行发酵培养。其中恒pH培养的策略效果最佳,重组菌最高OD600为58.85,是分批培养的3.05倍;最高酶活力为167.32 U/mL,是分批培养的2.64倍。静息细胞质量浓度5 g/L、反应温度30 ℃、pH 7.2是重组腈水解酶的最佳磁性固定化条件。相较于游离细胞,磁性固定化细胞的底物耐受性明显提升。按照200 mmol/L的批次底物投料浓度,磁性固定化细胞能在450 min内完全转化30批次底物,烟酸累积质量浓度达到738.66 g/L,是目前报道的B.subtilis腈水解酶生产烟酸的最高水平,并且转化完毕后仍能保留40%的酶活力。本研究对于提升腈水解酶转化3-氰基吡啶制备烟酸的工艺经济性具有重要意义,有望为其潜在工业应用奠定坚实基础。
[1] ZUORRO A, LAVECCHIA R.Protective effect of nicotinic acid on human albumin during UV-C irradiation[J].Korean Journal of Chemical Engineering, 2011, 28(10):1 965-1 968.
[2] ADEBOWALE T O, LIU H, OSO A O, et al.Effect of dietary niacin supplementation on performance, total tract nutrient retention, carcass yield and meat lipid profile of growing turkeys[J].Animal Production Science, 2019, 59(6):1 098-1 107.
[3] 陈国忠, 郭秋翠, 谭其秀, 等.1株产烟酸羟基化酶海洋细菌H9的分离鉴定及培养条件优化[J].食品科学, 2017, 38(10):130-136.
CHEN G Z, GUO Q C, TAN Q X, et al.Isolation, identification and culture optimization of Pseudomona sputida H9, a marine bacterium producing nicotinic acid hydroxylase[J].Food Science, 2017, 38(10):130-136.
[4] CHANG Y H, WU F, LUO H.Conversion of 3-cyanopyridine to nicotinic acid by nitrilase in Rhodococcus rhodochrous tg1-A6[J].Journal of University of Science & Technology Beijing, 2007, 29(2):223-226.
[5] FAN H Y, CHEN L F, SUN H H, et al.A novel nitrilase from Ralstonia eutropha H16 and its application to nicotinic acid production[J].Bioprocess & Biosystems Engineering, 2017, 40(8):1-11.
[6] SUBRAMANIAM R, THIRUMAL V, CHISTOSERDOV A, et al.High-density cultivation in the production of microbial products[J].Chemical and Biochemical Engineering Quarterly, 2018, 32(4):451-464.
[7] LEE S Y.High cell-density culture of Escherichia coli[J].Trends in Biotechnology, 1996, 14(3):98-105.
[8] KWON E Y, KIM K M, KIM M K, et al.Production of nattokinase by high cell density fed-batch culture of Bacillus subtilis[J].Bioprocess and Biosystems Engineering, 2011, 34(7):789-793.
[9] ZHOU Y L, LU Z H, WANG X, et al.Genetic engineering modification and fermentation optimization for extracellular production of recombinant proteins using Escherichia coli[J].Applied Microbiology and Biotechnology, 2018, 102(4):1 545-1 556.
[10] 顾炳琛, 龚劲松, 龙华, 等.产腈水解酶重组菌的发酵工艺及催化性质研究[J].分子催化, 2019, 33(2):174-180.
GU B C, GONG J S, LONG H, et al.The fermentation process of a nitrilase-producing strain and its catalytic properties[J].Journal of Molecular Catalysis, 2019, 33(2):174-180.
[11] VAGHARI H, JAFARIZADEHMALMIRI H, MOHAMMADLOU M, et al.Application of magnetic nanoparticles in smart enzyme immobilization[J].Biotechnology Letters, 2016, 38(2):223-233.
[12] HUSAIN Q.Magnetic nanoparticles as a tool for the immobilization/stabilization of hydrolases and their applications:An overview[J].Biointerface Research in Applied Chemistry, 2016, 6(6):1 585-1 606.
[13] 邢朝晖, 苏跃龙, 张琦, 等.磁性纳米材料载体固定纤维素酶技术研究进展[J].生物技术通报, 2015, 31(8):59-65.
XING Z H, SU Y L, ZHANG Q, et al.Research progress on cellulase immobilized by magnetic nanoparticles as carriers[J].Biotechnology Bulletin, 2015, 31(8):59-65.
[14] DISHISHA T, ALVAREZ M T, HATTI-KAUL R.Batch-and continuous propionic acid production from glycerol using free and immobilized cells of Propionibacterium acidipropionici[J].Bioresource Technology, 2012, 118:553-562.
[15] 王顺治, 汪子凯, 龚劲松, 等.腈水解酶在枯草芽胞杆菌中表达及在烟酸合成中的应用[EB/OL].北京:中国科技论文在线, 2020-04-29.
WANG S Z, WANG Z K, GONG J S, et al.Expression of nitrilase in Bacillus subtilis and its application in nicotinic synthesis[EB/OL].Beijing:Sciencepaper Online, 2020-04-29.
[16] 李刚. 氨基化Fe3O4纳米粒子的制备及在烟酸生物催化中的应用[D].无锡:江南大学, 2017.
LI G.Preparation of aminated Fe3O4 nanoparticles and its application in nicotinic acid biocatalysis[D].Wuxi:Jiangnan University, 2017.
[17] WU W, WU Z H, YU T, et al.Recent progress on magnetic iron oxide nanoparticles:Synthesis, surface functional strategies and biomedical applications[J].Science and Technology of Advanced Materials, 2015, 16(2):23 501-23 543.
[18] TU G Y, LI M.Research progress of high density fermentation process of genetic engineering microorganisms[J].Industrial Microbiology, 2004, 34(3):48-52.
[19] 黄燕, 孙益荣, 吴敬, 等.重组Humicola insolens角质酶的高密度发酵优化[J].中国生物工程杂志, 2019, 39(1):63-70.
HUANG Y, SUN Y R, WU J, et al.Optimization of high density fermentation of recombinant Humicola insolens cutinase[J].Chinese Biotechnology, 2019, 39(1):63-70.
[20] PAI O, BANOTH L, GHOSH S, et al.Biotransformation of 3-cyanopyridine to nicotinic acid by free and immobilized cells of recombinant Escherichia coli[J].Process Biochemistry, 2014, 49(4):655-659.
[21] DONG T T, GONG J S, GU B C, et al.Significantly enhanced substrate tolerance of Pseudomonas putida nitrilase via atmospheric and room temperature plasma and cell immobilization[J].Bioresource Technology, 2017, 244:1 104-1 110.