豆粕是大豆榨油后的副产品,其中含有大量大豆异黄酮。大量研究表明,大豆异黄酮与人类健康密切相关,具有一定的抗氧化[1]、抗癌[2-3]、抗肿瘤[4]、降血脂[5]、缓解更年期综合征[6]等生理活性。天然存在的大豆异黄酮共有12种,分为结合型糖苷和游离型苷元。以糖苷形式存在的大豆异黄酮,不能被人体直接吸收,必须水解成苷元才能被吸收并发挥其药理活性[7]。目前报道的糖苷水解方法主要有酸水解法、碱水解法和酶解法。酸水解的效率很高,但强酸条件不易实现工业化,且存在一定的不安全因素;碱水解条件下苷元性质不稳定;而酶水解反应条件温和,因而生物法转化大豆异黄酮糖苷具有独特的优势[8]。
“金花”菌是中国传统发酵黑茶-茯砖茶“发花”过程中的优势菌[9-10],具有抗氧化、调节血脂、逆转动脉粥样硬化、促进肠道健康等多方面促健康作用[11-12]。本研究选用传统发酵茶中有益菌“金花”菌发酵豆粕,探讨“金花”菌对豆粕发酵的影响,对比发酵前后苷元含量以及抗氧化活性的变化,以期对豆粕资源的进一步开发利用提供理论依据。
1 材料与方法
1.1 菌株来源
由本实验室从湖南安化不同茶厂较具代表性的茯茶样品中分离纯化“金花”菌若干株,并分别进行编号、保藏。
1.2 材料与设备
豆粕,宁波中瑞生物科技有限公司;大豆苷、染料木苷、大豆素、染料木素标准品,大连美仑生物科技有限公司;其他化学试剂均为分析纯。
Agilent1260高效液相色谱仪,美国安捷伦科技公司;Synergy H4酶标仪,美国伯腾仪器有限公司;7GI-16M高速冷冻离心机,赛默飞世尔科技(中国)有限公司;SPX-250B-Z恒温培养箱,上海跃进医疗器械厂。
1.3 培养基
栀子苷筛选培养基(g/L):栀子苷1.0,谷氨酸钠10.0,蛋白胨5.0,磷酸二氢钾10.0,硫酸镁0.5,琼脂粉25.0。
土豆茶汁培养基:土豆洗净,称取80 g切丁,沸水煮20 min,4层纱布过滤得土豆汁300 mL;称取茶叶(正山小种)40 g,沸水煮20 min,4层纱布过滤得茶汁100 mL;混匀后加蔗糖16 g,琼脂粉10 g。
“金花”菌液体种子培养基(g/L):大米粉60.0,黄豆粉40.0,蔗糖20.0,海水晶25.0,磷酸氢二钾2.0。
发酵培养基(g/L):豆粕100.0,蔗糖20.0,海水晶25.0,磷酸氢二钾2.0。
1.4 试验方法
1.4.1 高产β-葡萄糖苷酶“金花”菌的筛选及鉴定
菌株初筛:将实验室分离纯化的不同“金花”菌分别点种于栀子苷平板上进行初步的筛选,根据菌落的生长情况及蓝色圈的大小确定进一步筛选的菌株。
菌株复筛:将菌种在土豆茶汁平板上进行活化后接种至种子培养基(250 mL三角瓶,装液量50 mL),于30 ℃,160 r/min恒温摇床培养5 d得液体种子液。按10%接种量将种子液接种至发酵培养基(250 mL三角瓶,装液量50 mL),于30 ℃,160 r/min恒温摇床培养3 d。测定豆粕发酵前后苷元含量,筛选出苷元质量浓度增量最大的菌株作为最优发酵菌株。
菌种鉴定:根据NCBI中冠突散囊菌的ITS rDNA、β-tubulin 和RNA polymerase基因序列设计引物,对待测菌株进行PCR扩增并测序,最后通过BLAST及多基因系统发育树的构建确定其种属[13]。
1.4.2 HPLC法测定大豆异黄酮糖苷及苷元含量
采用HPLC[14-15]测定发酵豆粕提取液中糖苷以及苷元含量,色谱条件:流动相为V(甲醇)∶V(0.2%磷酸)=50∶50,流速0.8 mL/min,柱温37 ℃,检测波长260 nm,进样量10 μL。
样品处理:发酵完成后,菌株发酵液中加入100 mL甲醇超声提取30 min,布氏漏斗抽滤除去固形物得提取液,提取液旋蒸后加10 mL甲醇复溶,过0.22 μm有机膜后HPLC进行检测。空白对照为发酵培养基灭菌后不接菌,其他处理与发酵组保持一致。
标准曲线的绘制:分别精密称取标准品大豆苷、大豆素、染料木苷、染料木素各20 mg,用甲醇溶解并定容至10 mL容量瓶中,得标准储备液2 mg/mL,然后分别从各标准储备液中吸取1 mL,用甲醇稀释至 10、20、25、50、100、200 μg/mL待测,以峰面积(y)为纵坐标,大豆异黄酮浓度(x)为横坐标,对各组分浓度与峰面积关系进行回归分析,分别绘制标准曲线(表1)。
表1 大豆异黄酮标准曲线
Table 1 Standard curve of soybean isoflavone

标准品线性范围/(μg·mL-1)标准曲线相关系数(R2)大豆苷 10~200y=47.694x-136.780.999 2大豆素 10~200y=64.508x-176.280.999 5染料木苷10~200y=61.83x-69.2360.999 8染料木素10~200y=95.256x-89.5470.999 8
1.4.3 发酵条件对豆粕异黄酮苷元转化的影响
1.4.3.1 底物添加量对发酵结果的影响
选取最佳菌株,控制水、蔗糖、菌液(种子液)接种量不变,分别按豆粕添加量为5%、8%、10%、12%、15%(质量分数)添加至发酵培养基中,于30 ℃,160 r/min 恒温摇床培养3 d,按1.4.2所述方法提取并检测,以大豆异黄酮苷元质量浓度为指标,确定最佳底物浓度。
1.4.3.2 菌液接种量对发酵结果的影响
选取最佳菌株,控制水、蔗糖、底物添加量不变,分别按接种量为4%、6%、8%、10%、12%接种至发酵培养基中,于30 ℃,160 r/min恒温摇床培养3 d,按1.4.2所述方法提取并检测,以大豆异黄酮苷元质量浓度为指标,确定最佳接种量。
1.4.3.3 发酵温度对发酵结果的影响
选取最佳菌株,控制水、蔗糖、底物添加量、接种量不变,接种至发酵培养基中,于18、25、30、37 ℃恒温培养箱培养3 d,按1.4.2所述方法提取并检测,以大豆异黄酮苷元质量浓度为指标,确定最佳发酵温度。
1.4.3.4 发酵时间对发酵结果的影响
选取最佳菌株,控制水、蔗糖、底物添加量、接种量不变,接种至发酵培养基中,于30 ℃,160 r/min恒温摇床培养36、48、60、72、84 h,按1.4.2所述方法提取并检测,以大豆异黄酮苷元质量浓度为指标,确定最佳发酵时间。
1.4.4 抗氧化活性的检测分析
通过测定总还原力、总超氧化物歧化酶(total superoxide dismutase,T-SOD)活力、DPPH自由基[16]以及总氧自由基清除能力,综合评价发酵豆粕的抗氧化活性。
采用AGRAWAL等[17]的方法测定发酵液的总还原力;按照T-SOD试剂盒说明测定发酵液的T-SOD活力;按照DPPH自由基清除能力试剂盒说明制作标准曲线和测定发酵液的DPPH自由基清除率,用从标准曲线上算得的相当于抗氧化剂Trolox的量来表示发酵液的DPPH自由基清除能力;参照FENG等[18]和ZHANG等[19]的方法测定发酵液的总氧自由基清除能力。
2 结果与分析
2.1 高产β-葡萄糖苷酶“金花”菌的筛选
在β-葡萄糖苷酶催化条件下,1分子的栀子苷会被水解生成1分子的葡萄糖和1分子的栀子苷元,栀子苷元与氨基酸反应生成栀子蓝色素,可依据菌落背面或周围显现的蓝色来筛选β-葡萄糖苷酶的菌株。
将从茯砖茶样品中分离的“金花”菌分别点种于栀子苷平板,在以0.1%栀子苷为碳源的培养基上,“金花”菌都能生长,其中菌株JH-4、JH-6有蓝色圈(图1),说明其具有较好的β-葡萄糖苷酶活性。

图1 分离菌株菌落形态
Fig.1 Colony morphology of isolated strains
挑取菌落生长及产酶能力较好的“金花”菌进一步试验,考察不同菌株对豆粕中大豆异黄酮转化能力的差异。从图2中可以看出接种金花菌发酵后,豆粕中苷元含量均有较大幅度的提升,其中菌株JH-4转化效果最好,大豆素和染料木素增量最高。因此选取菌株JH-4进行后续发酵实验。
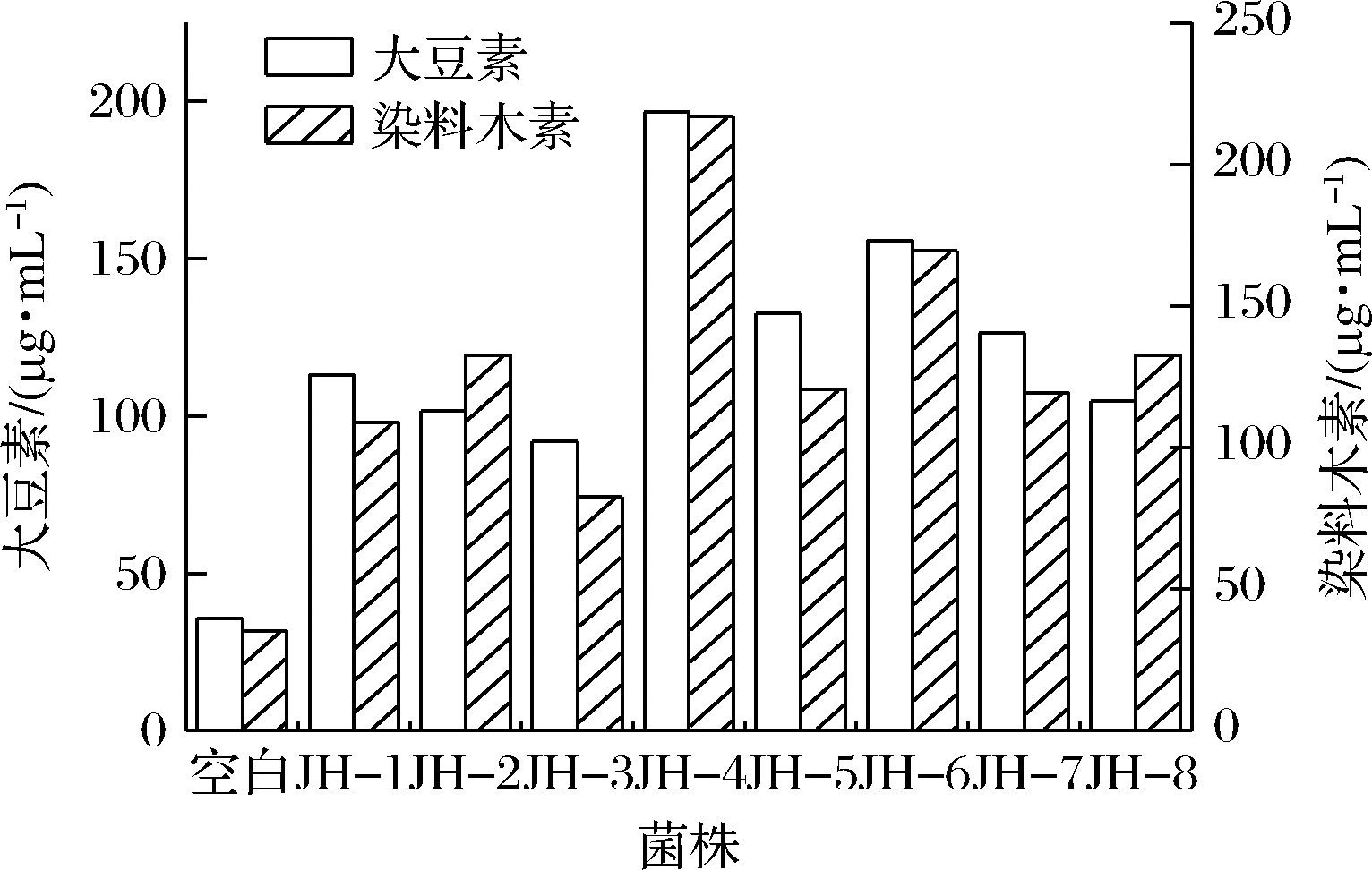
图2 不同菌株发酵豆粕3 d后苷元质量浓度
Fig.2 Aglycone concentration of soybean meal fermented by
different strains for 3 days
2.2 菌种鉴定
测序结果在NCBI数据库中进行Blast比对,下载与待鉴定菌株序列同源性达99%以上的已知分类地位的模式菌株,运用MEGA7的Neighbor-Joining法构建系统发育树[20],如图3所示,综合形态学和分子鉴定结果,鉴定该菌为谢瓦曲霉[21],命名为Aspergillus chevalieri JH-4。

图3 “金花”菌JH-4系统发育进化树
Fig.3 Phylogenetic tree of “Jinhua” fungi JH-4
2.3 发酵条件对豆粕异黄酮转化的影响
2.3.1 最佳底物添加量的确定
将活化好的谢瓦曲霉种子液按接种量10%接种至豆粕添加量为5%、8%、10%、12%、15%的发酵培养基中,30 ℃,160 r/min恒温摇床培养3 d后苷元质量浓度如图4所示。数据表明,前期底物添加量较少时,随着底物添加量的增多,可供菌株利用的营养物质也在增多,有利于菌体生长,对大豆异黄酮糖苷的转化效果增强,因此对应苷元质量浓度呈现递增趋势;当达到最佳底物添加量后,再次添加底物,导致基质含量降低,菌体可利用的活性水含量降低,不利于菌体的生长,进而影响大豆异黄酮糖苷的转化效果从而导致苷元质量浓度降低,因此选取12%作为最佳底物添加量。

图4 不同底物添加量对苷元质量浓度的影响
Fig.4 Effect of different substrate additions on the
mass concentration of aglycones
2.3.2 最佳接种量的确定
将活化好的谢瓦曲霉种子液分别按4%、6%、8%、10%、12%接种量接种至发酵培养基中,30 ℃,160 r/min恒温摇床培养3 d后,苷元质量浓度如图5所示。数据表明,前期菌体接种量较少时,菌体接入发酵培养基后,由于延滞期过长,不利于菌株产生β-葡萄糖苷酶,从而影响大豆异黄酮糖苷的转化效果,导致苷元质量浓度偏低。增加菌体接种量,有利于缩短延滞期,使菌体迅速生长,有利于大豆异黄酮糖苷的转化,缩短发酵周期。在最优接种量的基础上增加菌体接种量,会导致可供菌株利用的营养物质减少,不利于菌体生长,因此对大豆异黄酮糖苷的转化效果呈现下降趋势,对应苷元质量浓度也相应降低,因此选取8%作为最佳菌体接种量。
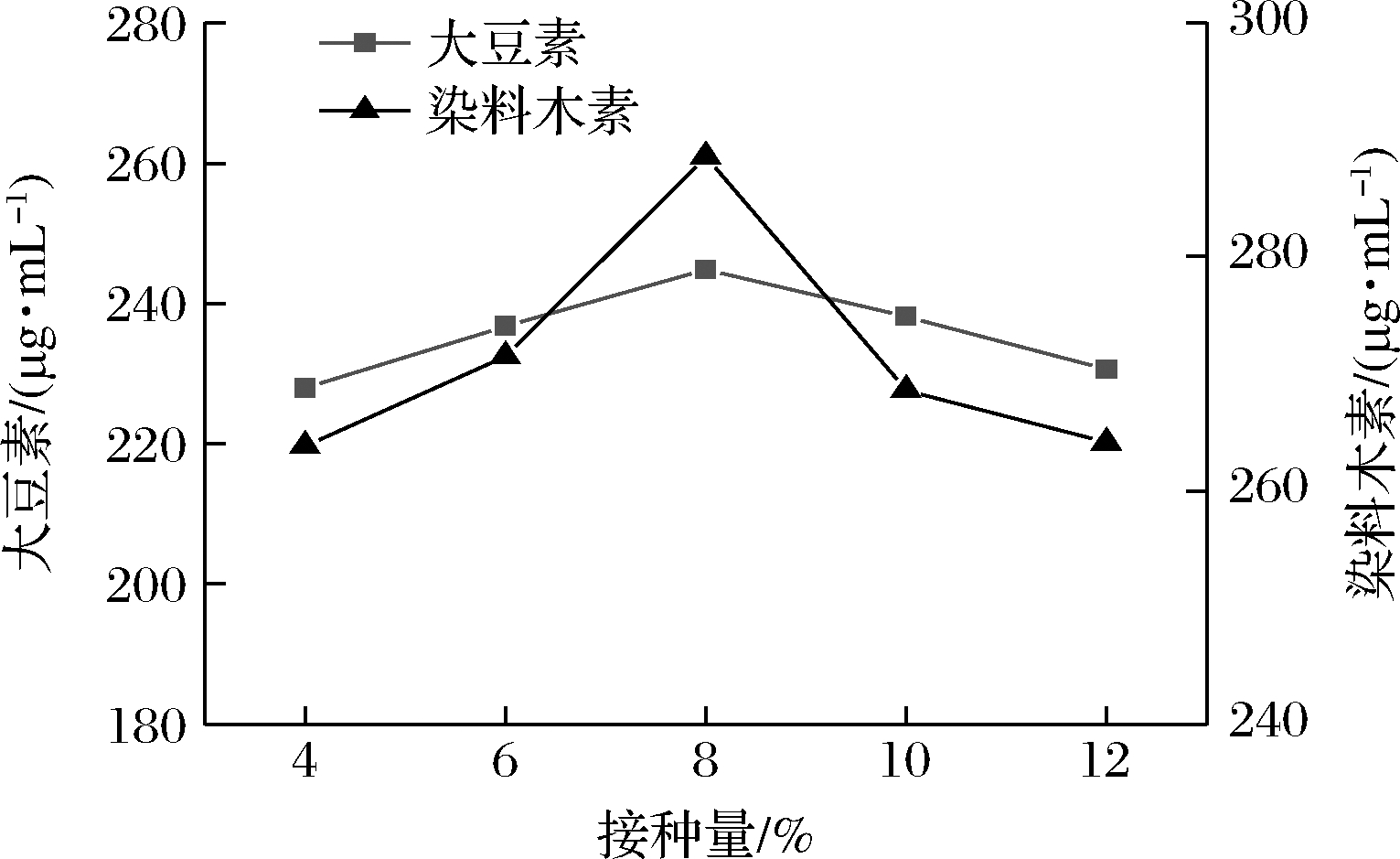
图5 不同接种量对苷元质量浓度的影响
Fig.5 Effect of different inoculations on the mass
concentration of aglycones
2.3.3 最佳发酵温度的确定
将活化好的谢瓦曲霉种子液接种至发酵培养基中,于18、25、30、37 ℃恒温培养箱培养3 d后,苷元质量浓度如图6所示,发酵温度为30 ℃时,苷元质量浓度最高,说明此温度下适宜菌株生长,有利于异黄酮糖苷的转化。因此选取30 ℃为最佳发酵温度。
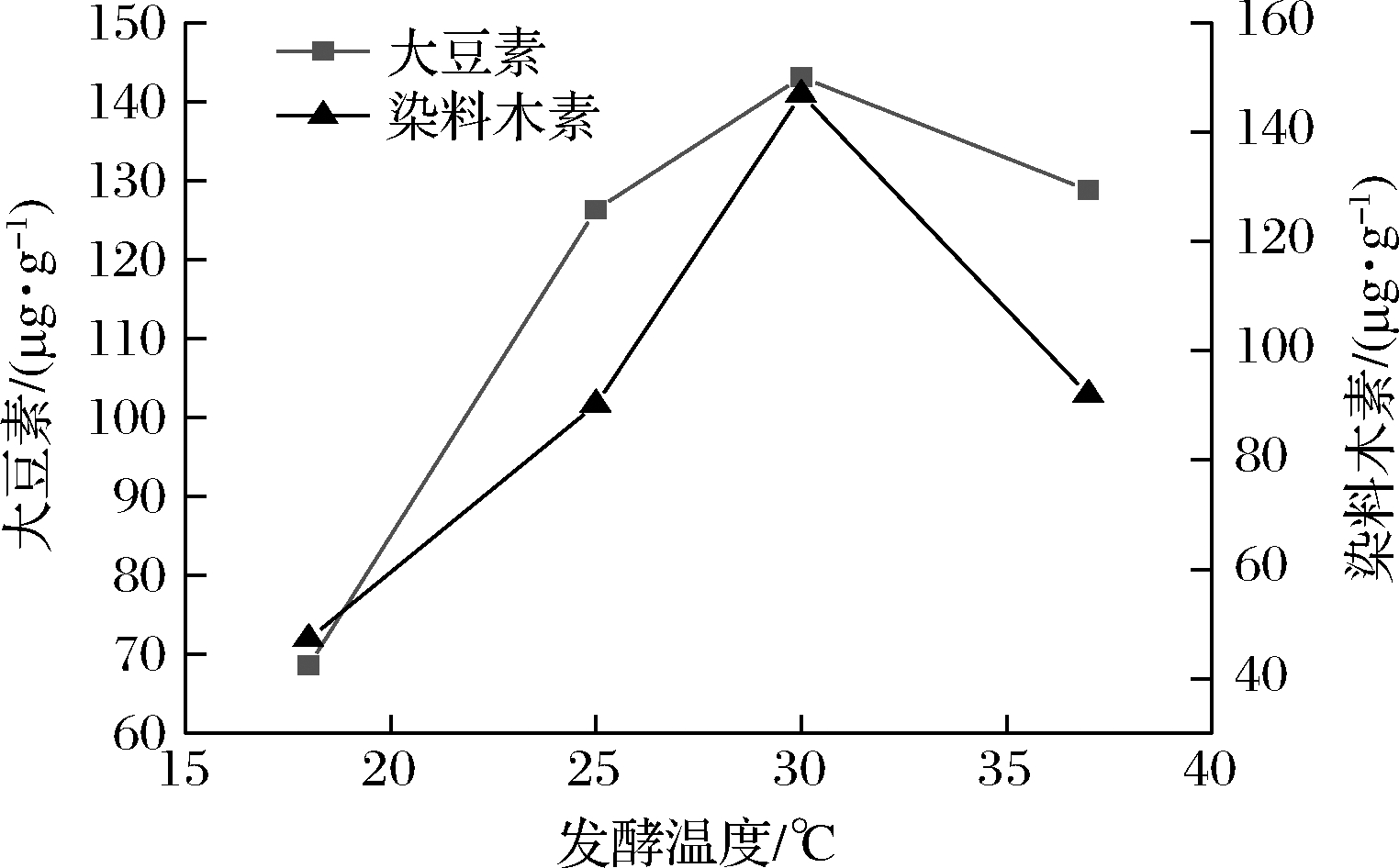
图6 不同发酵温度对苷元质量浓度的影响
Fig.6 Effect of different fermentation temperatures on the
mass concentration of aglycones
2.3.4 最佳发酵时间的确定
将活化好的谢瓦曲霉种子液接种至发酵培养基中,30 ℃,160 r/min恒温摇床培养,分别测定发酵36、48、60、72、84 h后苷元质量浓度,如图7所示,随着发酵时间的推移,苷元含量不断增加,当发酵72 h后苷元质量浓度达到最高,随后出现降低趋势。说明在发酵72 h后培养基中可供菌体利用的营养物质不足,导致菌体利用苷元,使苷元质量浓度下降,因此选取72 h作为最佳发酵时间。
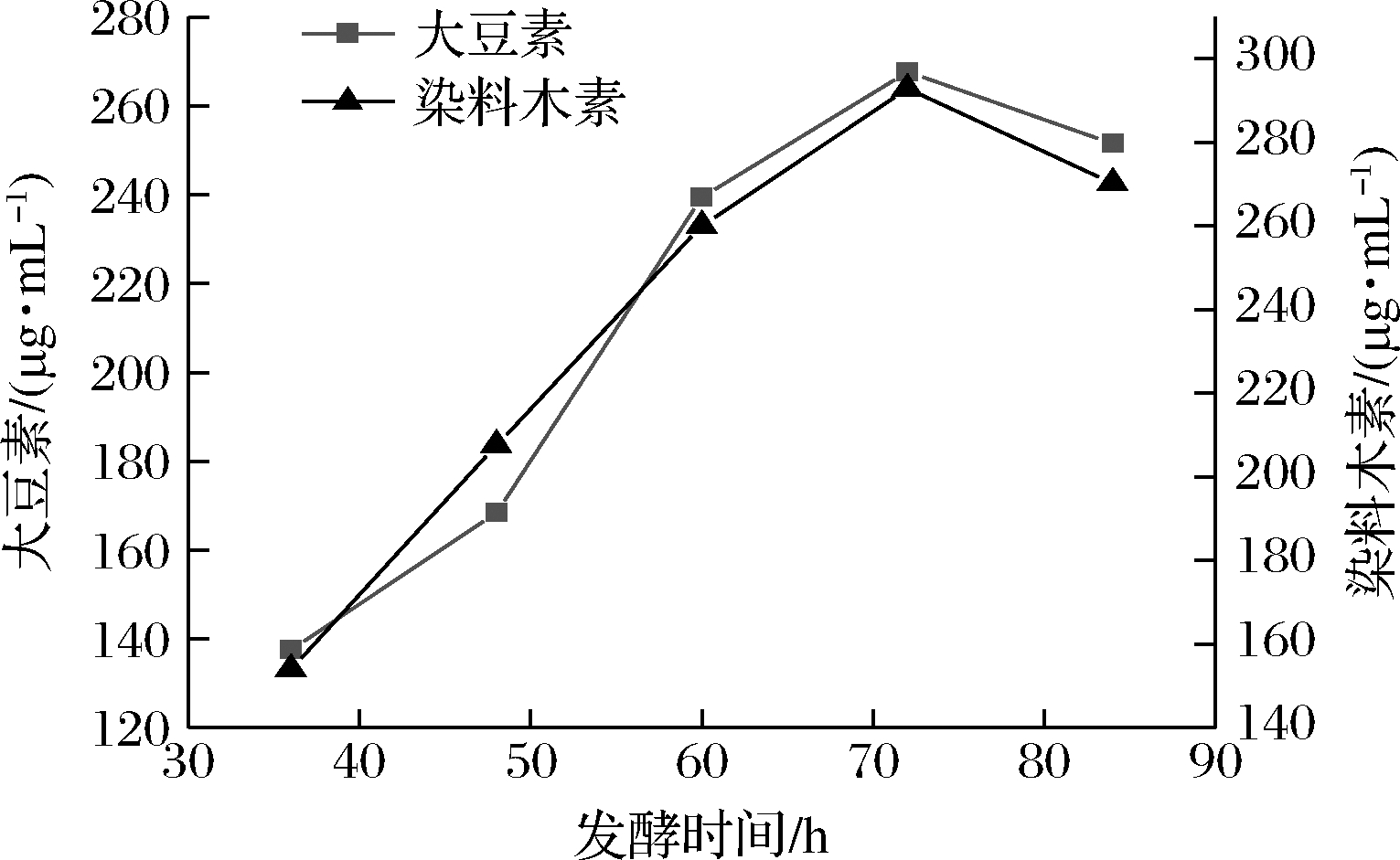
图7 不同发酵时间对苷元质量浓度的影响
Fig.7 Effect of different fermentation times on the
mass concentration of aglycones
2.4 豆粕发酵前后苷元含量及体外抗氧化能力变化
参照单因素试验结果,将基础发酵培养基中豆粕添加量改为12%,将活化好的谢瓦曲霉种子液按8%接种量接种至发酵培养基中,30 ℃,160 r/min恒温摇床培养72 h,在此优化条件下进行豆粕发酵,并对发酵前后糖苷及苷元含量进行检测,同时对发酵前后豆粕的抗氧化活性进行分析。
2.4.1 豆粕发酵前后液相色谱图
由图8可得知,未接菌发酵的豆粕苷元含量非常低,而发酵过后豆粕中糖苷含量显著降低,苷元含量明显升高,其中大豆素与染料木素含量均得到大幅度提升,说明菌株JH-4转化效果较好。按1.4.2所述方法提取并检测发酵前后豆粕中大豆异黄酮含量,发酵后大豆素增至292.94 μg/mL,染料木素增至309.82 μg/mL,分别比发酵前提高8.19和10.13倍;大豆苷从359.35 μg/mL降至30.91 μg/mL,转化率为91.40%;染料木苷从373.64 μg/mL降至1.57 μg/mL,转化率为99.58%。
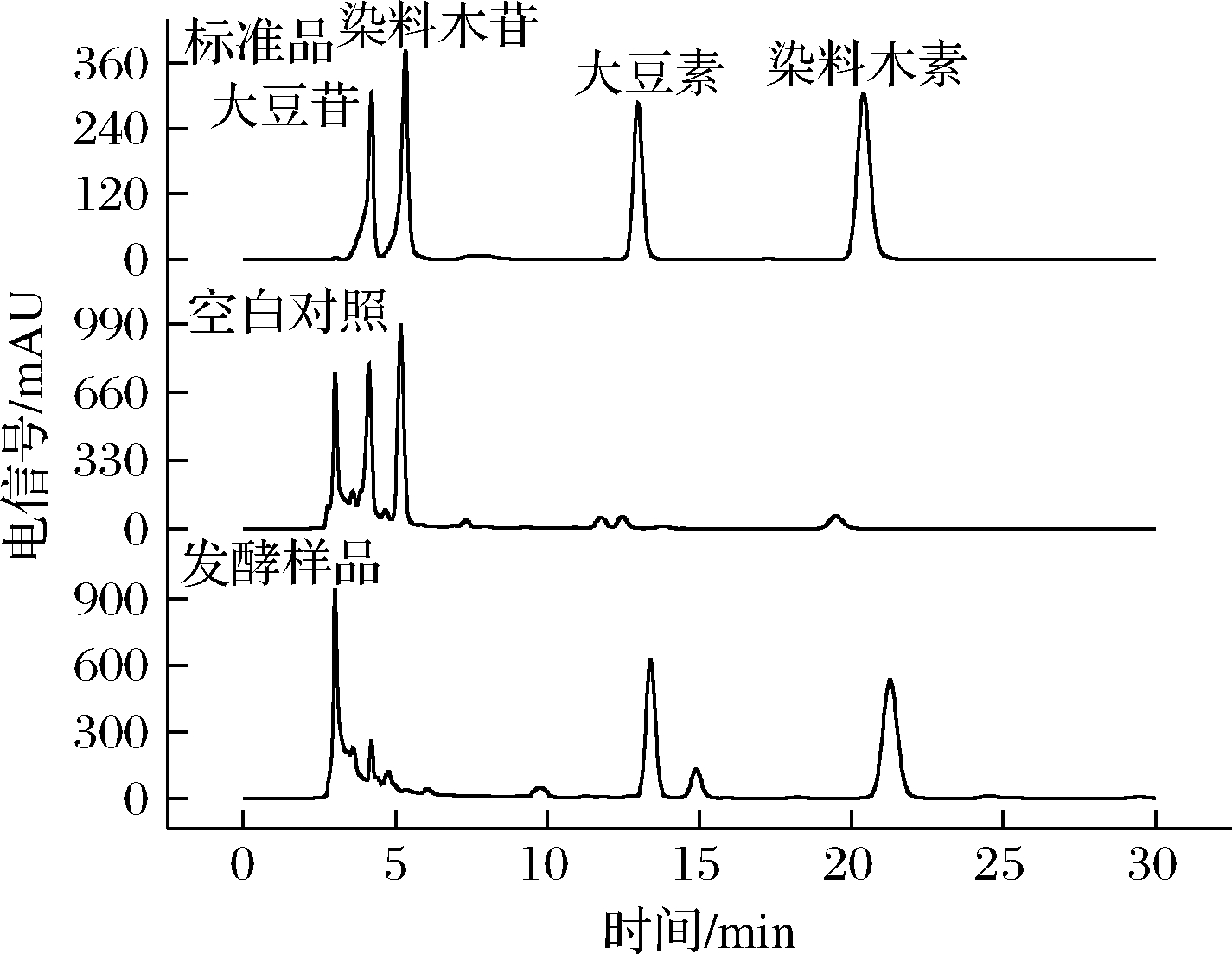
图8 豆粕发酵前后大豆异黄酮高效液相色谱图
Fig.8 HPLC of soybean isoflavones before and after
fermentation of soybean meal
2.4.2 豆粕发酵前后抗氧化能力变化
以发酵上清液为样品,未接菌培养基上清液为对照,测定豆粕发酵前后总还原力、T-SOD、DPPH自由基以及总氧自由基清除能力,结果如表2所示。数据表明,发酵后抗氧化能力得到大幅度提升,其中T-SOD 活力以及总氧自由基清除能力变化最明显,综合判断,发酵后豆粕抗氧化能力明显提高。
表2 豆粕发酵前后抗氧化能力变化
Table 2 Changes of antioxidant capacity of soybean meal before and after fermentation

样品总还原力/(mmol·L-1)总超氧化物歧化酶活力/(U·mL-1)DPPH自由基清除能力/(μg Trolox·mL-1)总氧自由基清除能力/(μmol·L-1)空白对照66.1763.5840.245 776.69发酵样品71.69445.04141.5384 381.99
3 结论
茯茶“金花”菌在发酵过程中能产多种酶参与底物的转化。研究者对实验室保存的不同“金花”菌β-葡萄糖苷酶活力进行筛选并将其应用于豆粕的液体发酵,最终确定1株优势菌Aspergillus chevalieri JH-4。该菌在豆粕添加量12%,接种量8%,发酵温度30 ℃,发酵72 h后大豆苷从359.35 μg/mL降至30.91 μg/mL,转化率为91.40%;染料木苷从373.64 μg/mL降至1.57 μg/mL,转化率为99.58%。大豆素增至292.94 μg/mL,染料木素增至309.82 μg/mL,分别比发酵前提高8.19和10.13倍。实验证明,“金花”菌Aspergillus chevalieri JH-4能够有效转化大豆异黄酮糖苷,有利于发挥豆粕中大豆异黄酮的生物活性,从而提高豆粕的利用价值。
[1] 石群, 李波.大豆异黄酮研究进展及前景展望[J].大豆科技, 2018(5):37-39.
SHI Q, LI B.Research progress and prospect of soybean isoflavones[J].Soybean Science and Technology, 2018(5):37-39.
[2] 王正, 杨青松, 刘露.大豆黄酮抗氧化及抗癌作用[J].生命的化学, 2010, 30(2):198-201.
WANG Z, YANG Q S, LIU L.Antioxidant and anticancer effects of daidzein[J].The Chemistry of Life, 2010, 30(2):198-201.
[3] 赵净洁, 俞鸣, 孟令章.大豆异黄酮抗癌防癌机制研究进展[J].中国公共卫生, 2010, 26(11):1 390-1 392.
ZHAO J J, YU M, MENG L Z.Anticancer and anticancer mechanisms of isoflavones in soybean:A review[J].China Public Health, 2010, 26(11):1 390-1 392.
[4] 蔡娟, 卢建, 施寿荣, 等.大豆,大豆异黄酮研究历程[J].饲料工业, 2013, 34(3):17-20.
CAI J, LU J, SHI S R, et al.Soy and soy isoflavone research journey[J].Feed Industry, 2013, 34(3):17-20.
[5] 纪桂元, 蒋卓勤, 张贵锋.大豆异黄酮降血脂作用研究进展[J].中国公共卫生, 2011, 27(2):253-254.
JI G Y, JIANG Z Q, ZHANG G F.Hypolipidemic effects of soy isoflavones:A review[J].Chinese Journal of Public Health, 2011, 27(2):253-254.
[6] 张录, 刘秀丽, 陈颖, 等.大豆异黄酮对更年期妇女骨质疏松作用的临床研究[J].中国医药指南, 2009, 7(3):41;4.
ZHANG L, LIU X L, CHEN Y, et al.A clinical study on the effect of soy isoflavones on osteoporosis in menopausal women[J].Guide of Chinese Medicine, 2009, 7(3):41;4.
[7] SETCHELL K D, BROWN N M, ZIMMER-NECHEMIAS L, et al.Evidence for lack of absorption of soy isoflavone glycosides in humans, supporting the crucial role of intestinal metabolism for bioavailability[J].The American Journal of Clinical Nutrition, 2002, 76(2):447-453.
[8] 李紫微, 曹庸, 苗建银.大豆异黄酮及其苷元的研究进展[J].食品工业科技, 2019, 40(20):348-355.
LI Z W, CAO Y, MIAO J Y.Research progress of soy isoflavones and their aglycones[J].Science and Technology of Food Industry, 2019, 40(20):348-355.
[9] XU A Q, WANG Y L, WEN J Y, et al.Fungal community associated with fermentation and storage of Fuzhuan brick-tea[J].International Journal of Food Microbiology, 2011, 146(1):14-22.
[10] LI N Q, HUANG J N, LI Y D, et al.Fungal community succession and major components change during manufacturing process of Fu brick tea[J].Scientific Reports, 2017, 7(1):6 947.
[11] CHEN G J, XIE M H, WAN P, et al.Digestion under saliva, simulated gastric and small intestinal conditions and fermentation in vitro by human intestinal microbiota of polysaccharides from Fuzhuan brick tea[J].Food Chemistry, 2018, 244:331-339.
[12] 吕嘉枥, 杨柳青, 孟雁南.茯砖茶中金花菌群的研究进展[J].食品科学, 2020, 41(9):316-322.
LYU J L, YANG L Q, MENG Y N. Development of golden flower fungus community in fuzhuan brick tea: A review[J].Food Science, 2020, 41(9):316-322.
[13] PETERSON S W.Phylogenetic Analysis of Aspergillus species using DNA sequences from four loci[J].Mycologia, 2008, 100(2):205-226.
[14] 张海军, 王英, 王庆钰.大豆异黄酮检测方法研究概述[J].粮食与油脂, 2011,24(3):39-42.
ZHANG H J, WANG Y, WANG Q Y. Survey on methods of detection for soybean isoflavone[J]. Cereals & Oils, 2011, 24(3):39-42.
[15] 张海军, 苏连泰, 李琳, 等.高效液相色谱法(HPLC)测定大豆异黄酮含量的研究[J].大豆科学, 2011, 30(4):672-675;679.
ZHANG H J, SU L T, LI L, et al. Determination of soybean isoflavones content by high-performance liquid chromatographic method[J]. Soybean Science, 2011, 30(4):672-675; 679.
[16] ![]() A, HAMPEL D, et al.ABTS and DPPH methods as a tool for studying antioxidant capacity of spring barley and malt[J].Journal of Cereal Science, 2017, 73:40-45.
A, HAMPEL D, et al.ABTS and DPPH methods as a tool for studying antioxidant capacity of spring barley and malt[J].Journal of Cereal Science, 2017, 73:40-45.
[17] AGRAWAL H, JOSHI R, GUPTA M.Isolation, purification and characterization of antioxidative peptide of pearl millet (Pennisetum glaucum) protein hydrolysate[J].Food Chemistry, 2016, 204:365-372.
[18] FENG L, PENG F, WANG X J, et al.Identification and characterization of antioxidative peptides derived from simulated in vitro gastrointestinal digestion of walnut meal proteins[J].Food Research International, 2019, 116:518-526.
[19] ZHANG N, HE Z J, HE S Y, et al.Insights into the importance of dietary chrysanthemum flower (Chrysanthemum morifolium cv.Hangju)-wolfberry (Lycium barbarum fruit) combination in antioxidant and anti-inflammatory properties[J].Food Research International, 2019, 116:810-818.
[20] 赵仁亮, 吴丹, 姜依何, 等.不同产区加工的茯砖茶中“金花”菌的分离及分子鉴定[J].湖南农业大学学报(自然科学版), 2016, 42(6):592-600.
ZHAO R L, WU D, JIANG Y H, et al. Isolation and molecular identification of "Jinhua" fungi on the Fuzhuan tea produced in different regions[J]. Journal of Hunan Agricultural University (Natural Sciences), 2016, 42(6):592-600.
[21] HUBKA V, KOLARIK M, KUBATOVA A, et al.Taxonomic revision of Eurotium and transfer of species to Aspergillus[J].Mycologia, 2013, 105(4):912-937.