麦芽糊精具有良好的吸水性、持水性、膨胀性、黏弹性和成膜性,因此常作为改良剂被应用到蛋糕或面包等烘焙产品中[1-2],用以改善烘焙产品品质[3]。但随着消费者对面包烘焙食品品质要求的不断提高,开发应用效果良好的改性麦芽糊精逐渐成为热点[4]。相关研究表明,改性麦芽糊精应用于面包品质改良时,能有效降低面包硬度,延缓老化回生[5-7]。
因此,本文选用能特异性转移DP6~10麦芽寡糖的分支酶[8],与能够转移单个葡萄糖生成连续α-1,6-糖苷键连接异麦芽多糖的4,6-α-葡萄糖基转移酶[9-10]相结合,通过双酶复配来制备一种分支链长、特异性强、分支度高且密集的改性麦芽糊精,其在面包质地改善方面的应用效果良好。
1 材料与方法
1.1 菌株与培养基
本实验中选用的分支酶CyBE来源于Cyanothece sp.ATCC 51142,2种4,6-α-葡萄糖基转移酶GTF5和GTF13分别为来源于Bacillus sporothermodurans和Lactobacillus fermentum。产3种来源酶的重组菌株,均为本实验室前期构建保藏。
LB液体培养基(g/L):酵母粉 5.0,胰蛋白胨 10.0,NaCl 10.0。
LB固体培养基:在LB液体培养基的基础上,添加20 g/L的琼脂。
TB培养基(g/L):酵母粉 24.0,胰蛋白胨 12.0,K2HPO4·3H2O 16.43,KH2PO4 2.31,甘油5.0。
1.2 仪器与试剂
ZQZY-CQ恒温振荡培养箱,上海知楚仪器有限公司;TU-1810紫外可见分光光度计,北京普析通用仪器有限责任公司;2WAJ阿贝折光仪,日本AGATO有限公司;7670570真空冷冻干燥机,美国LABCONCO公司;UnivealTA质构仪,上海腾拔仪器科技有限公司。
面包用品,安琪酵母有限公司,其他物品均购于国药集团。
1.3 实验方法
1.3.1 酶液的准备
摇瓶种子液:将本实验室保存菌株Escherichia coli/pET-24a-cybe,E.coli/pET-24a-gtf5和E.coli/pET-24a-gtf13按照2‰ (体积分数)的接种量接入10 mL LB培养基中(含30 mg/L卡那霉素),恒温培养(37 ℃、200 r/min) 12 h。
摇瓶发酵培养:将上步种子液按照5% (体积分数)的接种率接入TB培养基中(含30 mg/L卡那霉素),先恒温培养(37 ℃、200 r/min) 2 h,再更换温度为25 ℃ 培养24 h。
粗酶液获得:将发酵液于4 ℃下离心(8 000 r/min)15 min,收集菌体,收集到的菌体用Na2HPO4-NaH2PO4(50 mmol/L,pH 7.0)缓冲液复溶,再进行高压匀浆破壁(90 MPa),结束后于4 ℃离心(8 000 r/min) 15 min收集上清液,即得粗酶液。
1.3.2 改性麦芽糊精的制备
双酶复配处理:称取一定量的DE6~8麦芽糊精用pH 7.0的Na2HPO4-NaH2PO4缓冲液溶解,在加热磁力搅拌器(90 ℃)下加热糊化30 min,冷却至室温后加入缓冲液定容,使麦芽糊精终质量浓度为150 g/L,然后在30 ℃水浴摇床中温育10 min,加入CyBE反应24 h,反应结束后加热煮沸灭酶终止反应,冷却至30 ℃,再加入GTF5/GTF13反应24 h,煮沸灭酶。或者在上述相同反应条件下,先加入GTF5/GTF13 反应24 h,再加入CyBE反应24 h。
单酶处理:按照上述方法制备终质量浓度为150 g/L的麦芽糊精底物,然后在30 ℃水浴摇床温育10 min,加入CyBE或GTF5/13反应24 h,反应结束后加热煮沸灭酶终止反应。
酶转化液:终反应液冷却至室温后,12 000 r/min离心15 min,取上清液,冷冻干燥用于后续实验。
1.3.3 改性麦芽糊精的可溶性固形物含量测定
取1.2.2冷冻干燥的粉末,分析方法为折光计法,具体实验步骤参照GB/T 12143—2008《饮料通用分析方法》。
1.3.4 面包的制作
面包制作配料:普通小麦高筋面粉190 g,水60 g,糖20 g,盐2 g,奶粉4 g,鸡蛋2个,酵母4 g,黄油10 g。将以上原料搅拌成团并将面团揉至手套膜状态。均匀分割每个面团为60 g,然后在烤箱(38 ℃,相对湿度85%)中醒发60 min,1次醒发结束后整型,按照上述条件再发酵60 min,发酵结束后烘烤15 min(上火190 ℃,下火200 ℃)。添加改性麦芽糊精或改良剂时,需将其充分溶解于水中再用于面包制作。
1.3.5 面包质构的测定
面包样品准备:将烘烤后的面包切成15 mm的均匀薄片。
面包质构参数检测:使用质构仪对面包质地进行检测,检测结果为3次重复的平均值。质构仪检测探头为P/36;测试前速率,测试速率,测试后速率均为1.3 mm/s,测试距离5 mm,两次压缩间隔时间5 s,触发力5 g[11]。
1.3.6 面包抗氧化能力的测定
1.3.6.1 面包多酚提取液的制备
将新鲜的面包芯置于真空冷冻干燥机中,冻干后研磨粉碎。称取4 g研磨好的面包粉末,向其中加入50 mL 80% (体积分数)甲醇,避光提取2 h,期间使用磁力搅拌器搅拌混匀,结束后于5 000 r/min离心10 min,保存上清液。剩余残渣重复上述提取步骤。混合2次提取的上清液,并于4 ℃冰箱中避光保存。
1.3.6.2 总多酚含量测定
Folin-Ciocalteau法[12]测定总多酚含量步骤如下:准确移取2 mL的面包多酚提取液,向其中加入1倍体积的福林酚试剂和3倍体积的H2O,混匀,室温静置3 min。结束后加入5倍体积的10% (体积分数) Na2CO3溶液,充分混合均匀,室温静置30 min,整个提取过程需避光。提取结束后于5 000 r/min离心 5 min,取上清液进行吸光值测定(725 nm)。以没食子酸当量表示(mg没食子酸/g面包粉末)表示总多酚含量。
1.3.6.3 自由基清除能力的测定
面包DPPH自由基、ABTS阳离子自由基和羟自由基清除能力的测定,分别参照![]() 等[12]和SUN等[14]的方法。清除率以维生素C当量(mg 维生素C/g面包粉末)表示。
等[12]和SUN等[14]的方法。清除率以维生素C当量(mg 维生素C/g面包粉末)表示。
2 结果与分析
研究表明,面包老化与糊精的分支度及支链长度之间存在密切关系。其中,较短支链能有效提高糊精的持水能力,DP6~9的支链延缓老化的效果较为明显[15-16]。因此理论上制得分支度高且密集,同时分支链长较短的改性麦芽糊精能有效延缓面包老化。
本研究选用了分支酶CyBE和2种4,6-α-葡萄糖基转移酶(GTF5/GTF13)进行复配。CyBE在催化反应时,主要转移DP6~10的麦芽寡糖在糊精直链上形成支链,同时GTF5/GTF13能够在新形成支链的非还原端,通过连续的α-1,6-糖苷键连接形成异麦芽寡糖结构。因此以CyBE和GTF5/GTF13复配理论上能制备具备上述结构特性的改性麦芽糊精产物。
2.1 改性麦芽糊精溶解度分析
麦芽糊精在食品添加剂中应用广泛,因此良好的溶解性和贮藏稳定性十分重要[17]。酶改性后的麦芽糊精其理化性质也会发生变化,使用阿贝折光仪测定麦芽糊精改性前后溶解度的变化。结果显示(表1),未经酶作用的麦芽糊精底物虽溶解性较好(70.19%),但在室温放置24 h后会发生老化沉降。单酶CyBE、GTF5和GTF13改性后的产物溶解度变差,分别为63.26%、45.87%和43.56%,且存在老化浑浊的现象。经双酶复配得到的4种产物均有较好溶解度,其中CyBE-GTF13组的产物溶解度最高,可达63.17%。且双酶复配产物均具有良好的贮藏稳定性,室温放置7 d后仍呈澄清透明状态,流动性较好。
表1 改性麦芽糊精的溶解度分析
Table 1 Analysis of solubility of modified maltodextrin

样品名称溶解度/%麦芽糊精70.19CyBE63.26GTF545.87GTF1343.56GTF5-CyBE62.31CyBE-GTF560.05GTF13-CyBE59.60CyBE-GTF1363.17
2.2 添加改性麦芽糊精对面包质构参数的影响
质构仪通过模拟人口腔的咀嚼过程来确定受测面包的硬度、黏度和弹性等参数[18],这些参数能直观地展现烘焙面包的品质。其中硬度是面包最重要的质构特性,一般消费者更青睐于质地柔软的面包。
本文研究了不同面包改良剂的添加对面包硬度的影响,实验中添加量均为5% (质量分数) (此添加量参照市售改良剂的建议使用量),其中不添加改性麦芽糊精的为空白对照组,添加改性麦芽糊精的为实验组。面包质构结果如表2所示。改良剂的种类包括本研究制备的改性麦芽糊精、市售糊精类产品(抗性糊精和焦糊精)及市售安琪酵母改良剂。面包质构结果显示,添加了CyBE-GTF13改性麦芽糊精的实验组对面包硬度改良效果最佳,仅为空白对照组的28.98%,且优于市售糊精类产品和安琪酵母改良剂。
表2 面包硬度结果
Table 2 Bread hardness results

实验组硬度/g空白对照2 105.01麦芽糊精1 338.29焦糊精796.31抗性糊精(百龙)1 206.53抗性糊精(林源)1 206.75安琪改良剂765.81GTF131 568.19GTF51 769.39CyBE1 213.10GTF5-CyBE1 083.70CyBE-GTF5787.03GTF13-CyBE641.61CyBE-GTF13610.69
2.3 改性麦芽糊精的添加量优化结果分析
为进一步研究改性麦芽糊精添加量对面包硬度的影响,我们选取了硬度降低相对较大的CyBE-GTF13实验组进行此项研究。结果如表3所示,随着添加量的增大,面包芯的硬度会出现先降低再上升的趋势。当改性麦芽糊精添加量在3%~10%(质量分数)时,对面包硬度的改善效果会随着添加量的增大而变强。而当改性麦芽糊精的添加量>10%时,此时对面包硬度的改善效果会降低。但在实际使用过程中,当添加量为10%时,会引起面粉黏度过大、导致不易起筋、使用感较差等问题。因此,选择5%作为改性麦芽糊精的添加量以进行后续研究。
表3 改性麦芽糊精添加量对面包硬度的影响
Table 3 The results of different modified maltodextrin
additions on hardness
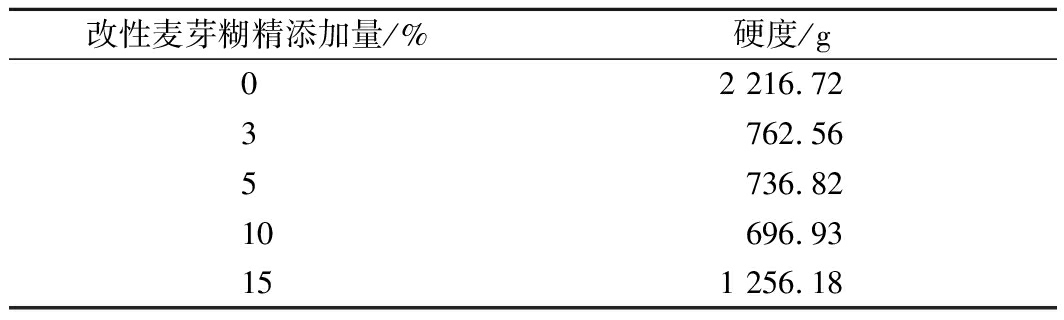
改性麦芽糊精添加量/%硬度/g02 216.723762.565736.8210696.93151 256.18
2.4 改性麦芽糊精对延缓烘焙面包老化的影响
根据前期筛选优化结果,将CyBE-GTF13改性麦芽糊精产物以5% (质量分数)的添加量用于面包制作,TPA质构仪测定面包硬度。结果显示,添加CyBE-GTF13实验组第1天的硬度降至640.15 g,仅为对照组硬度(2 208.53 g)的28.99%。同时,将面包在4 ℃贮藏21 d后,对照组的硬度值为4 257.57 g,而添加了改性麦芽糊精的实验组面包硬度为1 254.48 g,为对照组硬度的29.46%。
2.5 改性麦芽糊精对面包抗氧化性能的影响
抗氧化能力是指能够清除自由基的能力,多酚物质的存在能够提高抗氧化能力,从而预防因自由基存在而引起的例如糖尿病,心血管疾病和老年痴呆等疾病[19]。面粉中存在能够抵抗氧化的多酚类物质,然而游离的多酚类物质会在面团烘烤过程中因高温而损失[20]。
为研究添加改性糊精对多酚类物质的影响,本实验对多酚类物质总含量进行测定,结果表明,添加了CyBE-GTF13改性麦芽糊精的实验组总多酚含量为1.63 mg/g,为空白对照组(0.91 mg/g)的1.79倍。同时,面包的抗氧化能力以DPPH自由基、ABTS阳离子自由基和羟自由基的清除率来表示,结果显示(表4),添加了CyBE-GTF13改性麦芽糊精的实验组对以上3种自由基的清除率较对照组分别提升了2、8、4倍,表明改性麦芽糊的添加对面包抗氧化能力有显著提升作用。分析其原因,改性麦芽糊精因具有分支度高且密集、分支链长较短的特点,相对于具有长直链结构的淀粉,不容易发生聚集老化,因此暴露更多游离的羟基与多羟基的多酚类物质通过氢键作用相互结合[20],使得游离的多酚类物质相对减少,因此在烘焙过程中总的多酚类物质的损失降低,从而抗氧化性能提高。
表4 面包抗氧化能力数据
Table 4 Bread antioxidant capacity data

组别CyBE-GTF13/(mg·g-1)对照组/(mg·g-1)DPPH自由基0.150.050ABTS阳离子自由基0.020.003羟自由基0.180.050
3 结论
本研究以麦芽糊精为底物,利用分支酶(CyBE)和4,6-α-葡萄糖基转移酶(GTF5/GTF13)复配反应制备改性麦芽糊精,研究了不同酶处理(加酶顺序/4,6-α-葡萄糖基转移酶的选择)所制备的改性麦芽糊精产物,在改善面包质地方面的应用效果。实验结果表明4种改性麦芽糊精产物的添加均能够显著改善面包硬度,其中CyBE-GTF13改性麦芽糊精实验组表现最佳。进一步优化了面包制作中改性麦芽糊精的添加量,发现当添加量为5%(质量分数)时,面包硬度值可由对照组的2 208.53 g降至640.15 g,仅为对照组的28.99%,在4 ℃贮藏21 d后,对照组的硬度值为4 257.57 g,而添加了改性麦芽糊精的实验组面包硬度为1 254.48 g,为对照组硬度的29.46%;同时,添加该种改性麦芽糊精的面包对DPPH自由基、ABTS阳离子自由基和羟自由基的清除率,较对照组分别提升了2、8、4倍。以上结果表明,改性麦芽糊精在改善面包硬度,延缓面包老化,提高面包抗氧化能力具有积极作用,该改性麦芽糊精的制备方法为未来食品加工生产领域提供了一定的参考意见与价值。但目前此项研究仅限于实验室水平,未来可进一步探究目标酶在食品安全菌株中的发酵潜力,为规模化生产奠定基础。
[1] 应欣, 卢玉, 李义, 等.麦芽糊精的功能特性及其应用研究进展[J].中国粮油学报, 2019, 34(12):131-137.
YING X, LU Y, LI Y, et al.Research advance in maltodextrins functionality and application[J].Journal of the Chinese Cereals and Oils Association, 2019, 34(12):131-137.
[2] 赵娅, 顾正彪.马铃薯麦芽糊精的组分分析与性能研究[J].食品与发酵工业, 2007, 33(10):66-71.
ZHAO Y, GU Z B.Research on composition and performance of maltodextrin produced from potato starch[J].Food and Fermentation Industries, 2007, 33(10):66-71.
[3] 姚舒婷, 智慧, 沈欣怡, 等.脂肪替代品在烘焙行业中的研究进展[J].食品与发酵工业, 2020, 46(6):285-291.
YAO S T, ZHI H, SHEN X Y, et al.Research progress of fat substitutes in baking industry[J].Food and Fermentation Industries, 2020, 46(6):285-291.
[4] 张晶, 刘亚伟, 方宏兵.修饰麦芽糊精在食品工业中的应用[J].食品工业科技, 2010, 31(10):426-429.
ZHANG J, LIU Y W, FANG H B.Application of modified maltdextrin in food industry[J].Science and Technology of Food Industry, 2010, 31(10):426-429.
[5] ![]() E, PRZYBYSZ M A.The effect of the addition of water, soy protein, inulin, and maltodextrin on the quality of dough and gluten-free breads[J].Italian Journal of Food Science, 2018, 30(4):762-774.
E, PRZYBYSZ M A.The effect of the addition of water, soy protein, inulin, and maltodextrin on the quality of dough and gluten-free breads[J].Italian Journal of Food Science, 2018, 30(4):762-774.
[6] 李方华, 窦光朋, 杜倩, 等.抗性糊精在低热量蛋糕中代替蔗糖的应用研究[J].中国食品添加剂, 2020, 31(1):124-127.
LI F H, DOU G P, DU Q, et al.Resistant dextrin replacing sugar in low calorie cake[J].China Food Additives, 2020, 31(1):124-127.
[7] 李才明, 李阳, 顾正彪, 等.麦芽糊精的支化修饰及其特性研究进展[J].中国食品学报, 2018, 18(10):1-8.
LI C M, LI Y, GU Z B, et al.Research progress on branched modification and characteristics of maltodextrin[J].Journal of Chinese Institute of Food Science and Technology, 2018, 18(10):1-8.
[8] HAYASHI M, SUZUKI R, COLLEONI C, et al.Bound substrate in the structure of cyanobacterial branching enzyme supports a new mechanistic model[J].Journal of Biological Chemistry, 2017, 292(13):5 465-5 475.
[9] LI D, ZHAO Y K, FEI T, et al.Effects of Streptococcus thermophilus GtfB enzyme on dough rheology, bread quality and starch digestibility[J].Food Hydrocolloids, 2019, 96:134-139.
[10] 吴敬, 陈晟, 王蕾, 等.一种4,6-α-葡萄糖基转移酶及其在抗性糊精生产中的应用:中国,CN111424047A[P].2020-07-17.
WU J, CHEN S, WANG L, et al.4,6-α-glucosyltransferase and its application in production of resistant dextrin:China,CN111424047A[P].2020-07-17.
[11] PARK S H, NA Y, KIM J, et al.Properties and applications of starch modifying enzymes for use in the baking industry[J].Food Science and Biotechnology, 2018, 27(2):299-312.
[12] ![]() M, SE,CZYK
M, SE,CZYK  , GAWLIK-DZIKI U, et al.Bread enriched with quinoa leaves-The influence of protein-phenolics interactions on the nutritional and antioxidant quality[J].Food Chemistry, 2014, 162:54-62.
, GAWLIK-DZIKI U, et al.Bread enriched with quinoa leaves-The influence of protein-phenolics interactions on the nutritional and antioxidant quality[J].Food Chemistry, 2014, 162:54-62.
[13] WANG P P, LUO Z G, PENG X C.Encapsulation of vitamin E and soy isoflavone using spiral dextrin:Comparative structural characterization, release kinetics, and antioxidant capacity during simulated gastrointestinal tract[J].Journal of Agricultural and Food Chemistry, 2018, 66(40):10 598-10 607.
[14] SUN Y X, LI T B, LIU J C.Structural characterization and hydroxyl radicals scavenging capacity of a polysaccharide from the fruiting bodies of Auricularia polytricha[J].Carbohydrate Polymers, 2010, 80(2):377-380.
[15] INOKUMA T, VRINTEN P, SHIMBATA T, et al.Using the hexaploid nature of wheat to create variability in starch characteristics[J].Journal of Agricultural and Food Chemistry, 2016, 64(4):941-947.
[16] GIDLEY M.Factors affecting rate and end-products of wheat grain fibre fermentation[J].Cereal Chemistry, 2021, 98:S17-S17.
[17] 赵娅, 顾正彪.麦芽糊精溶液稳定性的研究[J].中国粮油学报, 2008, 23(4):96-101.
ZHAO Y, GU Z B.Study on stability of maltodextrin[J].Journal of the Chinese Cereals and Oils Association, 2008, 23(4):96-101.
[18] PYCIA K, JAWORSKA G, TELEGA J, et al.Effect of adding potato maltodextrins on baking properties of Triticale flour and quality of bread[J].LWT, 2018, 96:199-204.
[19] GAWLIK D U, SWIECA M, DARIUSZ D.Comparison of phenolic acids profile and antioxidant potential of six varieties of spelt (Triticum spelta L.)[J].Journal of Agricultural & Food Chemistry, 2012, 60(18):4 603-4 612.
[20] 祝琳, 吴龙, 陈小强, 等.茶多酚与多糖的相互作用:作用机理及功能特性变化研究进展[J].茶叶科学, 2019, 39(2):203-210.
ZHU L, WU L, CHEN X Q, et al.Interaction between tea polyphenols and polysaccharides:Progress in research on mechanism and function[J].Journal of Tea Science, 2019, 39(2):203-210.