水产品是蛋白质、无机盐和维生素的良好来源,尤其是蛋白质含量丰富,是人类摄取动物性蛋白的重要食品来源之一,一直被世界各国公认为营养、美味的放心食品。随着经济全球化不断加深,会有越来越多的消费者对水产品产生习惯性消费。
然而水产品带来的过敏问题也是层出不穷,大多数的过敏反应属于Ⅰ型免疫球蛋白E(immunoglobulin E, IgE)介导的过敏反应。IgE介导的食物过敏反应程度可从轻微的局部症状发展到严重的全身性反应,临床表现为荨麻疹、呼吸困难、呕吐、腹痛、心血管衰竭等[1],食物过敏已然逐渐成为全球化共性的人类健康问题。2008年国外流行病学调查表明,20%~30%世界人口受食品过敏的影响,水产品过敏尤其严重[2-3],这一数据在近几年仍在持续增长。然而国内还没有类似的系统调查,但有关食用虾、鱼、蟹等水产品引起过敏的报道很多,有5%的儿童和2%的成年人会对某些水产品产生过敏。临床研究表明,在我国食物过敏患者中,海虾、河虾、海蟹的过敏率分别高达40.3%、39.0%和37.8%[4-5]。吕相征等[6]研究发现,对鱼和海鲜类过敏者最多,共占36%;贝类和牛奶次之,分别占13.0%和 12.2%。中国预防医学科学院食品营养与安全中心的调查也表明,水产品是我国食品中最主要的过敏原,并且其所占过敏原比例逐年增加。
水产品中鱼类和甲壳类动物过敏原研究已经较为深入,而对软体动物过敏的研究很少,一项有8 600名参与者的问卷调查的显示,1%的过敏症状与软体动物有关[7]。也有研究发现甲壳类动物(虾、龙虾和螃蟹)和软体动物(鲍鱼、贻贝、扇贝和牡蛎)之间也有交叉反应[8]。因此,很有必要对软体动物过敏原开展深层次研究。
目前已鉴定出6种贝类过敏原,包括肌球蛋白(tropomyosin, TM)[9]、精氨酸激酶(arginine kinase, AK)[10]、肌球蛋白轻链[11]、三糖磷酸异构酶[12]、和肌浆钙结合蛋白(sarcoplasmic calcium-binding protein, SCP)[13]。贝类过敏原在临床上缺乏研究,而TM是太平洋牡蛎中唯一公认的过敏原[14]。
SCP是具有高亲和力性的EF手形Ca2+缓冲液,在骨骼肌中表达量最高[15]。SCP主要存在于无脊椎动物中,其致敏性与对虾的临床反应性有关[16],在各种甲壳类动物中构成过敏原[13,17-18],作用类似于脊椎动物体内的小白蛋白,这2种蛋白都在快速抽搐骨骼肌中高水平表达。在黑虎虾中,SCP被鉴定为对虾过敏原[13],在凡纳滨对虾中其IgE结合活性在分子水平上得到了证实[18]。YANG等[19]通过研究发现,SCP在甲壳类水产中已经鉴定出其线性表位和构象表位,在软体类水产中则只做到了基本理化性质和特异性IgE结合分析。重组蛋白比天然蛋白易获取、纯度和稳定性更高,在使用重组过敏原的体内诊断过敏方面也取得了实质性进展[20-22]。本文从分子质量、二级结构方面对天然SCP和重组SCP进行一致性比对,旨在获取与天然蛋白过敏原本质无差别甚至致敏性更强的替代重组体,对牡蛎中重组SCP的鉴定对未来全面研究具有重要意义。
1 材料与方法
1.1 仪器和试剂
太平洋牡蛎,山东威海;硫酸铵、碳酸氢钠、过硫酸铵、二硫苏糖醇(DL-dithiothreitol, DTT),北京化工厂;EDTA,中国Biotopped公司;Tris(超纯级)、考马斯亮蓝R-250(超高纯),美国Amresco公司;低分子质量蛋白Marker,碧云天公司;卡那霉素和异丙基硫代半乳糖苷(isopropyl β-D-thiogalactoside, IPTG),美国VWR公司;PAS染色试剂盒,北京Solarbio公司。
振荡培养箱,太仓华美公司;多通道超声破碎仪,宁波新芝;冷冻离心机,美国Sigma公司;双稳定时电泳仪,美国BioRad公司; KTA蛋白纯化仪,美国GE Healtheare公司;圆二色(cireular dichroism, CD)光谱仪,英国应用光物理公司;基质辅助激光解吸电离-飞行时间质谱(matrix-assisted laser desorption/ionization time of flight mass spectrometry, MALDI-TOF-MS)仪,德国Ultraflextreme公司;UV-1780紫外可见分光光度计,日本岛津公司。
KTA蛋白纯化仪,美国GE Healtheare公司;圆二色(cireular dichroism, CD)光谱仪,英国应用光物理公司;基质辅助激光解吸电离-飞行时间质谱(matrix-assisted laser desorption/ionization time of flight mass spectrometry, MALDI-TOF-MS)仪,德国Ultraflextreme公司;UV-1780紫外可见分光光度计,日本岛津公司。
1.2 实验方法
1.2.1 天然SCP的提取纯化
蛋白纯化流程主要参考沈苑[23]的方法,并作适当修改。取牡蛎闭壳肌,切碎,溶于10倍体积预冷的缓冲液A(50 mmol/L NaCl,2 mmol/L NaHCO3,10 mmol/L EDTA)中,用高速匀浆机匀浆,离心(10 500×g,20 min,4 ℃)取上清液;进行75%~90%硫酸铵盐析,离心(10 500×g,40 min,4 ℃)取沉淀。将沉淀溶于少量缓冲液B(10 mmol/L Tris-HCl,1 mmol/L DTT,0.1 mmol/L EDTA,pH 8.0)中,并于透析液(10 mmol/L Tris-HCl,pH 8.0,4 ℃)中透析16 h;最后上样于已用缓冲液B平衡好的HiTrap-Q柱。用缓冲液B洗脱未吸附部分,再用1 mol/L NaCl线性洗脱2 h,流速为0.5 mL/min,收集洗脱部分于-80 ℃冻存,随后与重组蛋白样品同步进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis, SDS-PAGE)分析。
1.2.2 重组SCP的诱导表达
登录Uniprot数据库网站查找太平洋牡蛎SCP氨基酸序列(登录号:CGI_10004435)并设计完整的基因序列,将其复制到大肠杆菌表达的目标载体上,本实验以pET-30a(+)质粒构建重组载体克隆方案为NdeI-ATG-Sarcoplasmic calcium-binding protein-His tag-Stop codon--HindIII。从超低温冰箱中取出 BL21(DE3)感受态细胞,置于冰上融化,加入重组质粒(100 ng),轻轻吹吸充分混匀,冰上放置30 min,水浴锅42 ℃热激90 s,冰上放置3 min加入100 μL室温LB液体培养基,在摇床中37 ℃,200 r/min振荡培养60 min,将菌液混匀后涂至卡那霉素抗性平板上。分别挑取3个单克隆,分别接种到4 mL含有50 μg/mL卡那霉素的LB 试管中,在摇床中37 ℃,200 r/min振荡培养,当OD600值达到0.6~0.8时,向2个试管中分别加入0.5 mmol/L IPTG,15 ℃培养16 h和37 ℃培养4 h,最后一支试管为阴性参照。
1.2.3 样品准备
取450 μL培养基离心后的沉淀,重悬于300 μL裂解缓冲液(50 mmol/L Tris-HCl, 150 mmol/L NaCl,5%(质量分数)甘油,pH 8.0),用超声破碎仪裂解10 min。
全菌样品:取100 μL裂解液,与50 μL 5×上样缓冲液(30%甘油,10%(质量分数)SDS,300 mmol/L Tris,250 mmol/L DTT)混合均匀,100 ℃加热10 min,15 000 r/min离心5 min。
细胞裂解物的上清液和沉淀样品:取剩余200 μL裂解液,15 000 r/min离心10 min,分别收集细胞裂解液的上清液和细胞沉淀。混合90 μL 5×上样缓冲液到180 μL上清液中,做为上清样品。用150 μL 5×上样缓冲液重悬沉淀,做为沉淀样品。100 ℃加热10 min后,15 000 r/min离心5 min,待上样。
1.2.4 SDS-PAGE分析
使用SDS-PAGE探究重组蛋白在不同温度和诱导时间以及BL21(DE3)菌的上清液和沉淀中的表达情况。SDS-PAGE:配制5%(聚丙烯酰胺体积分数)浓缩凝胶和15%(聚丙烯酰胺体积分数)分离凝胶进行电泳。将重组SCP蛋白样品溶液(20 μL)与 5 μL上样缓冲液混合,并在95 ℃加热5 min后进行电泳。通过比较低分子质量标记蛋白的电泳迁移率来确定分子质量。使用蛋白质印迹法(Western blot,WB)鉴定组氨酸(His)标签标记的目标蛋白,抗His抗体能够和带有His标签的蛋白质特异性结合。确定重组SCP最佳表达条件后,取天然SCP和重组SCP蛋白样品各20 μL 直接与5 μL上样缓冲液混合,后续操作相同。
1.2.5 MALDI-TOF-MS分析
利用MALDI-TOF-MS,进一步分析重组SCP蛋白的准确性。质谱鉴定的操作:切下通过SDS-PAGE获得的目标蛋白,蛋白样品经DTT还原和碘代乙酰胺烷基化处理后,用胰蛋白酶进行凝胶消化。酶解后得到的肽段再经C18ZipTip脱盐后,与基质α-氰基-4-羟基肉桂酸混合点板。最后用MALDI-TOF-MS仪进行分析,波长337 nm;加速电压25 kV;采用正离子模式,自动获得数据。最后使用Mascot搜索工具将目标蛋白酶解后所产生的得到的肽片段的质量图谱与NCBIprot数据库中的指纹进行比较分析。
1.2.4 CD光谱分析
利用CD光谱测定蛋白质二级结构,准备0.3 mg/mL的天然SCP和重组SCP样品,用CD光谱仪分析其CD光谱,并将测得的3个光谱平均值作为最终数据。对于波长分析,以0.5 nm的步长和2.0 nm的带宽扫描样品,光谱范围为190~260 nm,扫描速度为200 nm/min。
1.2.5 过碘酸雪夫染色法(periodic acid-schiff stain,PAS)和碳水化合物-肽连锁特征
食物过敏原大多数是具有酸性等电点的糖蛋白,且分子质量一般在10~80 kDa[24]。用PAS染色法确定天然SCP是否属于糖蛋白,取经过SDS-PAGE分析的纯蛋白条带,按照试剂盒说明进行实验,牛血清白蛋白(bovine albumin,BSA)作为阴性对照。用β消除法继续验证SCP上的多糖是否有O-糖苷键,根据CHEN等[25]的实验稍作修改,取0.25 mg/mL的天然SCP蛋白样品90 μL与0.5 mol/L的NaOH溶液10 μL混合均匀,于37 ℃静置孵育15 h,测量其在230~300 nm处的紫外吸光值,以10 μL的纯水混合孵育作为对照组。
1.2.6 蛋白多糖含量测定
用苯酚硫酸法测定天然SCP中多糖的含量,以钟岩等[26]和佟海菊等[27]的实验作为参考,取5 g重蒸酚定容于100 mL水中预先配制5%(体积分数)的苯酚溶液,外包锡箔纸放4 ℃备用;准确称取105 ℃干燥恒重的1 g葡萄糖定容于100 mL水中,再取上述溶液1 mL定容于100 mL水中,得到0.1 mg/mL的标准葡萄糖溶液,取10支试管分别加入0、0.1、0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6 mL标准葡萄糖溶液,均补加蒸馏水至2 mL;取天然SCP蛋白溶液,蛋白质量浓度为0.620 9 mg/mL,各0.2 mL于3支试管中,补加蒸馏水至2 mL。以上13支试管先加入5%(体积分数)苯酚溶液摇匀,迅速各加入浓硫酸5 mL,摇2 min,静置10 min,再于100 ℃水浴加热20 min,于避光处冷至室温,在490 nm处测其紫外吸光值,样品3次测量值取平均值作最终数据,以空白试剂作为参比。
1.2.7 氨基酸组成成分分析
Uniprot数据库显示太平洋牡蛎SCP共含有179个氨基酸,SCP的氨基酸组成已经很清楚,本文将SCP的氨基酸组成进行了简单统计。
2 结果与分析
2.1 重组SCP最佳表达条件确定
将含有目的基因的重组质粒pET-30a(+)导入到大肠杆菌BL21(DE3)中,分别在15 ℃诱导16 h和37 ℃ 诱导4 h。用SDS-PAGE和WB检测全菌、上清液、包涵体样品,结果如图1-A所示,由图1-A可以看出无论是15 ℃诱导16 h,还是37 ℃诱导4 h的细胞裂解物的上清液和沉淀中,在22 kDa处均有明显条带,而在没有加入IPTG诱导表达的细胞裂解物中没有条带显示。图1-A表明15 ℃诱导16 h比37 ℃ 诱导4 h蛋白表达量高,且从裂解上清液条带可以看出前者可溶性蛋白含量也高于后者。图1-B表明重组的SCP蛋白中含有His标签,也为下一步的Ni-柱亲和层析纯化做好基础。实验测得最佳表达条件15 ℃诱导16 h蛋白表达水平为25 mg/L,可溶性为70%。
2.2 SDS-PAGE 分析
对牡蛎粗提物进行SDS-PAGE分析,如图2所示。牡蛎粗提物主要含有相对分子质量为20、35和40 kDa 的蛋白条带,经过75%~90%硫酸铵盐析等后续操作上样于HiTrap-Q柱,接收第2个洗脱峰的洗脱部分与重组SCP样品一起电泳。纯化后得到的天然SCP蛋白条带在20 kDa左右,天然提取的牡蛎蛋白除了目的蛋白SCP外,还有较多的杂蛋白,通过纯化也很难得到特别高的纯度,而重组SCP蛋白条带在22 kDa左右,其相对分子质量略大于天然SCP相对分子质量,这主要是由于重组SCP添加组氨酸标签使得蛋白相对分子质量变大,重组SCP蛋白在经过Ni-柱亲和层析后可以得到比较纯的目的条带。

A-SDS-PAGE;B-Western blot
图1 太平洋牡蛎SCP(~21.5 kDa)在BL21(DE3)表达的
SDS-PAGE和Western blot分析
Fig.1 SDS-PAGE and Western blot analysis of human
heavy chain ferritin (~21.5 kDa) expression in BL21 (DE3)
注:M1-分子质量标记,kDa;M2-WB分子质量标记,kDa;PC1-牛血清白蛋白(1 μg);PC2-牛血清白蛋白(2 μg);NC-未诱导的全细胞;
1-15 ℃诱导16 h的全细胞;2-37 ℃诱导4 h的全细胞;NC1-未诱导的细胞裂解上清;3-15 ℃诱导16 h的细胞裂解上清;4-37 ℃ 诱导4 h
的细胞裂解上清;NC2-未诱导的细胞裂解沉淀;5-15 ℃诱导16 h的细胞裂解沉淀;6-37 ℃ 诱导4 h的细胞裂解沉淀;用于WB的抗体为
anti-His抗体(GenScript,Cat.No A00186)

M-分子质量标记,kDa;1-牡蛎粗提液;2-HiTrap-Q
柱洗脱后的纯化天然SCP;3-纯化的重组SCP
图2 太平洋牡蛎天然SCP与重组SCP SDS-PAGE分析图
Fig.2 SDS-PAGE analysis of natural SCP and recombinant
SCP of Pacific oyster
2.3 MALDI-TOF-MS分析多肽
采用质谱法鉴定22 kDa蛋白。用MALDI-TOF分析纯化蛋白经胰蛋白酶消化后产生的肽段。如图3所示,纯化蛋白的质谱显示多个峰,从800~4 000 Da不等,最高峰为2 377 Da。将2 377 Da处的信号与NCBI 数据库进行比较,使用Mascot工具搜索并观察Mowse值,肽段序列匹配的最高得分是太平洋牡蛎SCP(登录号:XP_011436345.1),匹配值为24,评分为212。质谱鉴定的数据表明22 kDa蛋白质是牡蛎SCP。

图3 太平洋牡蛎重组SCP质谱图
Fig.3 Mass spectrometry of recombinant SCP of Pacific oyster
2.4 CD光谱分析
通过上述一系列的实验的分析,已经可以证明重组的SCP是正确的,为了更进一步探究重组SCP与天然SCP是否具有相同的二级结构,进行了CD光谱实验。CD光谱在远紫外区域具有肽键吸收信号,并能反映蛋白质特征二级结构的含量。由图4可以看出,天然SCP信号在198 nm处具有1个正峰值,并且在208和222 nm处具有2个负峰值,此外,摩尔椭圆率θ222/θ208>1,这些信号可以有力地证明它是典型的α-螺旋蛋白质。重组SCP蛋白的CD光谱信号几乎与天然SCP的信号相重叠,可能是由于天然牡蛎SCP纯度不够,而重组的SCP纯度更高,使得在2个负峰处的值稍有偏差,且经蛋白拟合软件CDNN计算得到蛋白二级结构各组成含量如表1所示,2种蛋白各组成含量基本相同,但这足以证明重组SCP与天然的SCP具有近乎相同的空间结构。
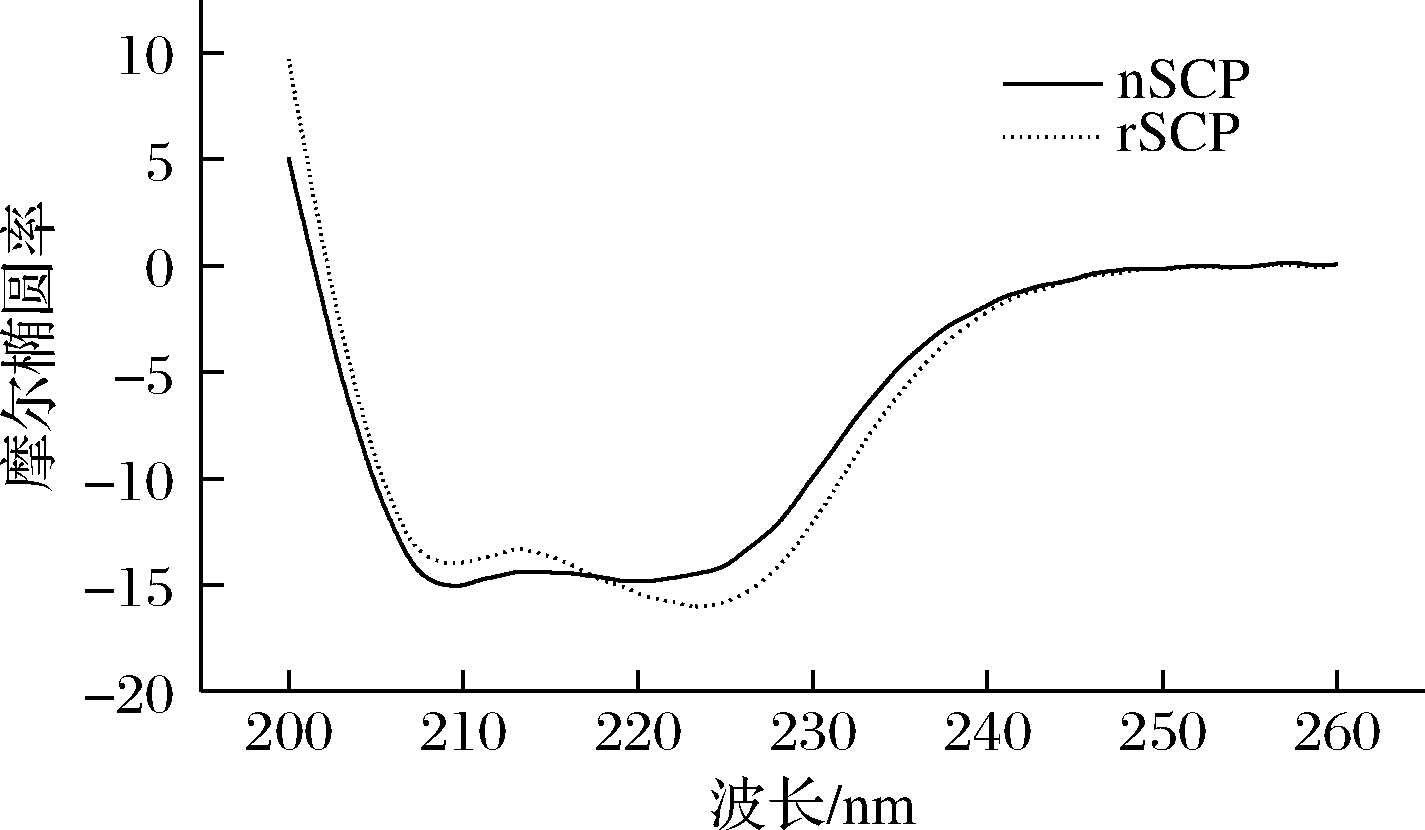
nSCP-天然SCP;rSCP-重组SCP
图4 CD光谱
Fig.4 CD spectrum
表1 二级结构各组成含量测定
Table 1 Determination of components in secondary structure
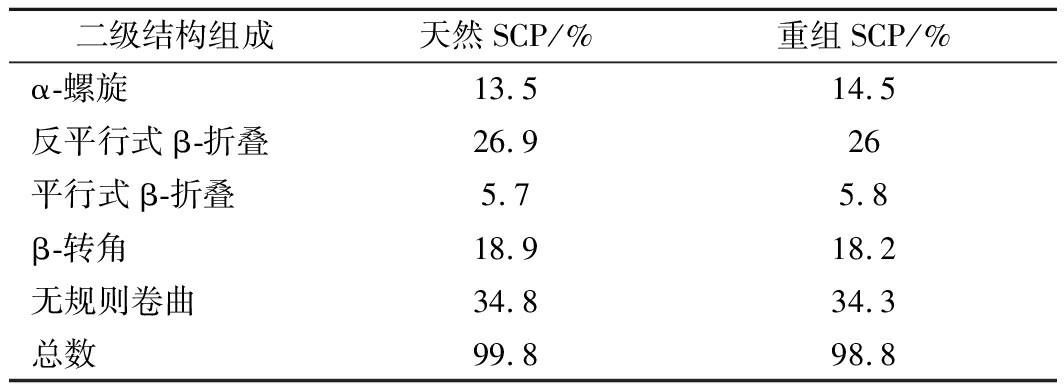
二级结构组成天然SCP/%重组SCP/%α-螺旋13.514.5反平行式β-折叠26.926平行式β-折叠5.75.8β-转角18.918.2无规则卷曲34.834.3总数99.898.8
2.5 PAS染色和碳水化合物-肽连锁特征
PAS染色用于鉴定牡蛎天然SCP是否是糖蛋白,如图5-A所示,阴性对照BSA经PAS染色未出现颜色变化,而SCP蛋白条带经染色出现预期的紫红色,证实SCP确为糖蛋白。如图5-B所示,SCP经NaOH处理后,在230~300 nm处的紫外吸光值明显增加,尤其在244 nm处增加值最大。这一结果表明,SCP的结构中存在1个或多个O-糖苷键[28]。O-糖苷键与多肽链上的丝氨酸或苏氨酸的羟基相连,在碱的作用下,发生β消除反应,分子内脱去1个水分子生成不饱和键,在244 nm处产生了紫外吸收。上述2个实验共同验证SCP是O-糖苷键型的糖蛋白,而研究表明糖蛋白与IgE结合能力有关,即糖蛋白与抗原致敏性存在关联。

1-BSA;2-纯化的重组SCP;Treated-经NaOH处理的实验组;
Untreated-对照组
A-染色;B-紫外光谱分析
图5 PAS染色及重组SCP的紫外光谱分析
Fig.5 PAS staining and UV spectrum analysis of recombinant
SCP
2.6 SCP多糖含量
根据梯度葡萄糖浓度在490 nm处测得的吸光值绘制葡萄糖标准曲线,得到标准方程y=9.463 6x-0.000 4,R2=0.986 2,样品吸光值平均值为0.046,则稀释10倍前的多糖质量浓度为0.049 0 mg/mL,而蛋白质量浓度为0.620 9 mg/mL,即求得蛋白中糖含量为7.89%。

图6 葡萄糖标准曲线
Fig.6 Glucose standard curve
2.7 氨基酸组成
SCP氨基酸组成如图7所示。由图7可以清楚地看出SCP蛋白含有19种氨基酸,其含有非常丰富的天冬氨酸(D)和赖氨酸(K),其次是丙氨酸(A)、蛋氨酸(M)和苯丙氨酸(F),包含人体的8种必需氨基酸,可见氨基酸组成很全面。另外,SCP含有半胱氨酸(C),半胱氨酸与二硫键的形成有关,有利于形成稳定的蛋白质高级结构,这可能与蛋白的过敏性不易消除存在一定的联系。

图7 SCP氨基酸组成
Fig.7 Amino acid composition of SCP
注:*-表示人体必需氨基酸;D-天冬氨酸;K-赖氨酸;A-丙氨酸;
M-蛋氨酸;F-苯丙氨酸;E-谷氨酸;Q-谷氨酰胺;I-异亮氨酸;
G-甘氨酸;V-缬氨酸;T-苏氨酸;S-丝氨酸;L-亮氨酸;W-色氨酸;
N-天冬酰胺;R-精氨酸;Y-酪氨酸;P-脯氨酸;C-半胱氨酸
3 结论
本研究以太平洋牡蛎为对象,采用饱和硫酸铵盐析及阴离子交换等方法分离纯化天然SCP,进行MALDI-TOF-MS以证实该蛋白为牡蛎中提取的天然SCP。通过基因工程重组表达并采用镍柱亲和层析分离纯化重组SCP,进行Western blot证实研究成功利用重组大肠杆菌表达出牡蛎重组SCP。对重组SCP和天然SCP进行SDS-PAGE、CD光谱分析证明了利用重组大肠杆菌表达出的SCP与天然SCP除了分子质量稍有差别,空间结构近乎相同,而重组蛋白相对天然蛋白性质更加稳定便宜获取,为后期利用重组SCP替代天然SCP进行相关实验提供理论支撑。实验利用PAS染色法鉴定牡蛎天然SCP为糖蛋白,利用苯酚硫酸法测定其蛋白中多糖的含量,采用β消化法鉴定此糖蛋白为O-糖苷键型的糖蛋白,另外,也对SCP氨基酸组成成分进行简要分析,这一系列实验旨在证明SCP确为牡蛎中的潜在过敏原。牡蛎营养丰富,蛋白质种类较全,非常适合作为人体营养补充食品,但牡蛎中除原TM和AK 2种重要过敏原,SCP作为新型过敏原也应被研究重视。
[1] SICHERER S H, SAMPSON H A.Food allergy:Review and update on epidemiology, pathogenesis, diagnosis, prevention and management[J].Journal of Allergy and Clinical and Immunology, 2018, 141(1):41-58.
[2] SHARP M F, LOPATA A L.Fish Allergy:In review[J].Clinical Reviews in Allergy & Immunology,2014,46(3):258-271.
[3] HANSON L, TELEMO E.The growing allergy problem[J].Acta Paediatrica,1997,86(9):916-918.
[4] LIANG G Z, LI F J, HOU S B, et al.Analysis of allergens in 1625 cases[J].Practical Clinical Medicine,2005,6(7):14-16.
[5] 吴泳,黄一锦,杨萍娥.2000例过敏性疾病患者变应原检测分析[J].现代中西医结合杂志,2008,17(30):4 732-4 733.
WU Y, HUANG Y J, YANG P E.Analysis of allergen detection in 2000 patients with allergic diseases[J].Modern Journal of Integrated Traditional Chinese and Western Medicine, 2008,17(30):4 732-4 733.
[6] 吕相征,刘秀梅,杨晓光.健康人群食物过敏状况的初步调查[J].中国食品卫生杂志,2005,17(2):119-121.
LYU X Z, LIU X M, YANG X G.Preliminary survey on status of food allergy in young Chinese students[J].Chinese Journal of Food Hygiene, 2005,17(2):119-121.
[7] LE T T K, NGUYEN D H, VU A T L, et al.A cross-sectional, population-based study on the prevalence of food allergies among children in two different socioeconomic regions of Vietnam[J].Pediatr Allergy and Immunology,2019, 30:348-355.
[8] LEUNG P S C, CHOW W K, DUFFEY S, et al.IgE reactivity against a cross-reactive allergen in Crustacea and Mollusca:Evidence for tropomyosin as the common allergen[J].Journal of Allergy and Clinical Immunology,1996,98(5):954-961.
[9] AYUSO R, LEHRER S B, REESE G.Identification of continuous, allergenic regions of the major shrimp allergen Pen a 1 (tropomyosin)[J].International Archives of Allergy and Immunology,2002,127(1):27-37.
[10] CHEN H L, MAO H Y, CAO M J, et al.Purification, physicochemical and immunological characterization of arginine kinase, an allergen of crayfish (Procambarus clarkii)[J].Food and Chemical Toxicology,2013,62:475-484.
[11] AYUSO R, GRISHINA G, BARDINA L, et al.Myosin light chain is a novel shrimp allergen, Lit v 3[J].Journal of Allergy and Clinical Immunology,2008,122(4):795-802.
[12] XIA F, LI M S, LIU Q M, et al.Crystal structure analysis and conformational epitope mutation of triosephosphate isomerase, a mud crab allergen[J].Journal of Agricultural and Food Chemistry,2019,67(46):12 918-12 926.
[13] SHIOMI K, SATO Y, HAMAMOTO S, et al.Sarcoplasmic calcium-binding protein:Identification as a new allergen of the black tiger shrimp Penaeus monodon[J].International Archives of Allergy and Immunology,2008,146(2):91-98.
[14] LEUNG P S, CHU K H.cDNA cloning and molecular identification of the major oyster allergen from the Pacific oyster Crassostrea gigas[J].Clinical and Experimental Allergy,2001,31(8):1 287-1 294.
[15] HERMANN A, COX J A.Sarcoplasmic calcium-binding protein[J].Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology,1995,111(3):337-345.
[16] PASCALM, GRISHIA G, YANG A C, et al.Molecular diagnosis of shrimp allergy:Efficiency of several allergens to predict clinical reactivity[J].The Journal of Allergy and Clinical Immunology:In Practice,2015,3(4):521-529.
[17] BAUERMEISTER K, WANGORSCH A, GAROFFO L P, et al.Generation of a comprehensive panel of crustacean allergens from the North Sea Shrimp Crangon crangon[J].Molecular Immunology,2011,48(15-16):1 983-1 992.
[18] AYUSO R, GRISHINA G, IB
 EZ M D, et al.Sarcoplasmic calcium-binding protein is an EF-hand-type protein identified as a new shrimp allergen[J].Journal of Allergy and Clinical Immunology,2009,124(1):114-120.
EZ M D, et al.Sarcoplasmic calcium-binding protein is an EF-hand-type protein identified as a new shrimp allergen[J].Journal of Allergy and Clinical Immunology,2009,124(1):114-120.
[19] YANG Y, HU M J, JIN T C, et al.A comprehensive analysis of the allergenicity and IgE epitopes of myosinogen allergens in Scylla paramamosain[J].Clinical & Experimental Allergy,2019,49(1):108-119.
[20] MOSER M, CRAMERI R, BRUST E, et al.Diagnostic value of recombinant Aspergillus fumigatus allergen I/a for skin testing and serology[J].Journal of Allergy and Clinical Immunology,1994,93(1):1-11.
[21] LYNCH N R, THOMAS W R,CHUA Y, et al.In vivo biological activity of recombinant Der p II allergen of house-dust mite[J].International Archives of Allergy and Immunology,1994,105(1):70-74.
[22] MENZ G, DOLECEK C, SCHÖNHEIT-KENN U, et al.Serological and skin-test diagnosis of birch pollen allergy with recombinant Bet v I, the major birch pollen allergen[J].Clinical & Experimental Al-lergy,1996,26(1):50-60.
[23] 沈苑. 锯缘青蟹精氨酸激酶的分离纯化、分子克隆及过敏原性研究[D].厦门:集美大学, 2010.
SHEN Y.Arginine kinase from scylla serrata:Purification, cloning, expression and allergenic analysis[D].Xiamen:JiMei University, 2010.
[24] KING T P, HOFFMAN D, LOWENSTEIN H, et al.Allergen nomenclature[J].Allergy, 1995, 50(9):765-774.
[25] CHEN H L, CAO M J, CAI Q F, et al.Purification and characterisation of sarcoplasmic calcium-binding protein, a novel allergen of red swamp crayfish (Procambarus clarkii)[J].Food Chemistry,2013,139(1-4):213-223.
[26] 钟岩, 潘浦群, 王艳红, 等.苯酚-硫酸法测定鲜人参中多糖含量[J].时珍国医国药,200819(8):1 957-1 958.
ZHONG Y, PAN P Q, WANG Y H, et al.Determination of the content of polysaccharides in fresh root of panax ginseng by the method of phenol vitril[J].Lishizhen Medicine and Materia Medica Research,2008,19(8):1 957-1 958.
[27] 佟海菊, 张志胜, 孙克岩, 等.苯酚-硫酸法测定海湾扇贝多糖方法的研究[J].食品工业科技, 2011,32(10):447-448;452.
TONG H J, ZHANG Z S, SUN K Y, et al.Study on determination of polysaccharides content in argopectens irradias by phenol-sulfuric acid method[J].Science and Technology of Food Industry, 2011,32(10):447-448;452.
[28] HANG H C, BERTOZZI C R.The chemistry and biology of mucin-type O-linked glycosylation[J].Bioorganic & Medicinal Chemistry,2005,13(17):5 021-5 034.