罗氏沼虾(Macrobyachium rosenberqii)又名淡水长臂大虾,隶属长臂虾科,沼虾属,是中国重要的经济型淡水虾类。近年来随着生活水平的提高,消费者的消费观念逐渐从经济实惠转变为绿色健康,对营养价 值高且味道鲜美的罗氏沼虾的需求日益攀升。然而,较高的含水量和蛋白质含量在赋予罗氏沼虾极佳的口感和丰富的营养价值的同时,也使得其在贮藏过程中易受到细菌和酶的影响而腐败变质,缩短货架期[1]。因此,开发出一种高效且绿色安全的保鲜方法变得尤为重要。
虾青素是一种脂溶性含氧类胡萝卜素,具有极强的抗氧化活性,能够有效淬灭单线态氧和清除自由基[2-3]。同时,虾青素能够抑制多酚氧化酶活性,具有天然、安全、无毒等特点[4]。因此,近年来虾青素已成为国内外学者研究天然食品保鲜剂的热点对象之一,目前已应用于果蔬、肉制品、奶制品等食品保鲜中。韩青佑[5]制备虾青素-明胶复合膜液对蓝莓进行涂膜保鲜,发现复合膜液可显著降低蓝莓的失重率和腐烂率,抑制蓝莓中丙二醛的积累,延长蓝莓的货架期。刘开华等[6]研究发现,将虾青素与茶多酚联合保鲜鱼丸,可有效抑制鱼丸脂质氧化、蛋白质降解及微生物的生长繁殖,延缓鱼丸贮藏过程中感官品质的下降。EL-BIALY等[7]将从虾壳废弃物中提取得到的虾青素添加到罗非鱼鱼糜中,发现虾青素能够降低鱼糜的pH值,延缓鱼糜脂质氧化。同时,ABDELMALEK等[8]也做了类似的研究,利用油溶法提取虾壳废弃物中的虾青素并将其加入到鸡排中,发现在冷藏条件下,虾青素可有效抑制鸡排脂质氧化和嗜冷菌的生长。由此可见,虾青素在食品保鲜上具有一定的发展空间。
虾青素在水产品上的保鲜报道较少,尤其是在虾类(甲壳类)中的应用目前尚未报道。本文以罗氏沼虾为原料,将实验室自制的南极磷虾源虾青素添加到具有生物可降解性及成膜性的羧甲基壳聚糖膜液中,以3%(质量分数,下同)的甘油作为增塑剂,以 0.4%(质量分数,下同)的吐温-80为乳化剂,对其进行涂膜保鲜处理。以感官评分、菌落总数、pH、总挥发性盐基氮(total volatile basic nitrogen,TVB-N)、硫代巴比妥酸反应物 (thiobarbituric acid reactive substance, TBARS)值、K值为考察指标,研究不同质量浓度的虾青素-羧甲基壳聚糖复合涂膜液对罗氏沼虾在冷藏过程中[(4±1) ℃]的保鲜效果的影响,为虾青素在虾类等水产品保鲜中的深入研究和应用提供理论基础。
1 材料与方法
1.1 材料
罗氏沼虾,上海市浦东新区新芦苑集贸市场;南极磷虾源虾青素为实验室自制。
甲醇(色谱纯)、三氯乙酸(分析纯)、硫代巴比妥酸(分析纯)、硼酸(分析纯)、氢氧化钾(分析纯)、磷酸氢二钾(色谱纯)、磷酸二氢钾(色谱纯),国药集团化学试剂有限公司;三磷酸腺苷及其关联化合物标准品(色谱级),上海阿拉丁生化科技股份有限公司;羧甲基壳聚糖(取代度≥80%,分析纯),上海麦克林生化科技有限公司。
UV-1800PC紫外可见分光光度计,上海美谱达仪器有限公司;H2050R高速冷冻离心机,长沙湘仪有限公司;Waters-2690高效液相色谱仪,美国Waters公司;C18液相色谱柱(250 mm×4.6 mm,5 μm),上海安谱科学仪器公司;FE20 pH计,上海梅特勒-托利多仪器有限公司;DSX-280KB24手提式压力蒸汽灭菌器,上海申安医疗器械厂;BCM型垂直双人标准净化工作台,苏净集团安泰公司;FOSS Kjeltec 8400全自动凯氏定氮仪,丹麦FOSS公司。
1.2 实验方法
1.2.1 虾青素的制备
将南极磷虾虾壳剥离去肉,洗净沥干后置于烘箱中于50 ℃条件下烘干,用粉碎机将烘干后的虾壳粉碎,过100目筛,得到粗细均匀的虾壳粉,于-20 ℃条件下贮藏备用。称取一定量的虾壳粉,使用二氯甲烷溶液在料液比1∶30 (g∶mL),提取温度30 ℃,提取时间2.5 h的工艺条件下对虾壳粉进行浸提,重复2次 上述过程,合并滤液并旋转蒸发浓缩,于-20 ℃条件下贮存备用,所制得的虾青素溶液质量浓度为0.2 mg/mL。
1.2.2 不同质量浓度复合涂膜液的配制及原料预处理
在低温避光条件下,分别添加不同体积(150、300、450 mL)的0.2 mg/mL虾青素浓缩液至质量分数为1%的羧甲基壳聚糖水溶液(含3%甘油作为增塑剂、0.4%吐温-80为乳化剂,均为质量分数)中,用磁力搅拌器于40 ℃条件下进行搅拌使混合物充分溶解并完全挥发二氯甲烷液体,静置30 min后即制得质量浓度为30、60、90 mg/L的虾青素-羧甲基壳聚糖复合涂膜液, 以未添加虾青素的羧甲基壳聚糖组为对照,未经涂膜处理组为空白。
用冰水混合物将鲜活罗氏沼虾浸没猝死,挑选虾体完整且大小一致的罗氏沼虾分别浸渍在制备好的复合涂膜液中10 min,沥干后装入聚乙烯保鲜袋中密封,于(4±1) ℃冷藏。
1.3 保鲜指标的测定
1.3.1 感官评定
参考王秀娟等[9]提出的感官评定方法,从肌肉组织、体表色泽及气味3个方面对各处理组样品的整体可接受性进行感官品质判断。感官评定小组由8名具有感官评定经验的人员组成,总分低于6分的样品的感官品质被认为是不可接受的,表示虾已不可食用。罗氏沼虾感官评分标准见表1。
表1 罗氏沼虾综合感官评分表
Table 1 Sensory evaluation of giant freshwater prawn (Macrobrachium rosenbergii)

项目3分2分1分0分肌肉组织肌肉纹理清晰有弹性,肉与壳连接紧密肌肉略有弹性,肉与壳连接稍松弛肌肉弹性较差,肉与壳连接松弛肌肉组织松软,无弹性,肌肉与壳分离严重体表色泽体表有光泽,虾体透明光亮虾壳出现轻微红色或黑色,头尾部出现黑斑虾体失去固有光泽,出现大面积黑斑体表色泽灰暗,周身壳变黑严重气味 虾体固有气味,无异味略有异味异味较强异味强烈
1.3.2 菌落总数的测定
参照国标 GB 4789.2—2016《食品安全国家标准 食品微生物学检验 菌落总数测定》[10]对各组样品的菌落总数进行测定。
1.3.3 pH的测定
在低温环境下,对各组样品进行去壳、头及虾线处理后,将虾肉剪碎研磨成泥状。称取2 g虾肉于烧杯中,并加入18 mL蒸馏水均质混匀,于10 000 r/min条件下离心10 min,过滤,用 pH 计测定上清液pH值,每组平行测定3次。
1.3.4 TVB-N的测定
参照国标GB 5009.228—2016《食品安全国家标准 食品中挥发性盐基氮的测定》[11]对各组样品的TVB-N进行测定。
1.3.5 TBARS值的测定
参考刘金昉等[12]的方法并做修改。准确称取1 g虾肉于离心管中,加入5 mL质量分数为20%的三氯乙酸溶液和4 mL 蒸馏水,用高压均质机匀浆60 s,并静置1 h 后,于8 000 r/min 条件下离心 10 min,取上清液过滤后定容至10 mL,准确移取 5 mL 溶液于干净试管中,并向其中加入5 mL 0.02 mol/L 硫代巴比妥酸溶液,在沸水条件下反应 20 min 后,取出,流水冷却至室温,于532 nm下测定吸光度A。用蒸馏水作空白对照,每组平行测定 3 次,取平均值。TBARS值按照公式(1)计算:
TBARS值/(mg·kg-1)=A×7.8
(1)
式中:7.8为通过标准曲线得到的系数。
1.3.6 K值的测定
参考余达威等 [13]的方法,采用高效液相进行测量。准确称取搅碎的虾肉样品 5 g于离心管中,加入10 mL体积分数为10%的高氯酸溶液,匀浆2 min,随后于10 000 r/min条件下离心15 min,过滤取上清液,用5 mL 体积分数为5%的高氯酸溶液洗涤沉淀,再次离心取上清液,此操作重复2次,合并上清液,用10 mol/L和1 mol/L的KOH 溶液调其上清液pH至6.50,静置30 min,去除沉淀,取上清液用超纯水定容至50 mL,摇匀,最后过0.22 μm水相膜待测,每组平行测定3次。整个实验过程在0~4 ℃条件下进行。K值按照公式(2)计算:
(2)
式中:WATP,WADP,WAMP,WIMP,WHxR和 WHx 分别是虾肉中三磷酸腺苷、二磷酸腺苷、腺苷酸、肌苷酸、次黄嘌呤核苷和次黄嘌呤6种核苷酸的含量,mol/g。
ATP关联化合物HPLC测定条件:采用C18色谱柱(5 μm,4.6 mm×250 mm)和Waters 2690紫外可见检测器;检测波长为254 nm;柱温 30 ℃;进样量 10 μL;流动相:A 液为pH 6.50的0.05 mol/L 磷酸盐缓冲液,B 液为甲醇,等度洗脱[V(A)∶V(B)=97∶3],流速为1 mL/min。
1.3 数据分析
试验数据均以平均值±标准差(mean±S.D.)表示,试验结果采用SPSS 22.0软件利用Duncan进行多重比较,显著性水平设为0.05。运用Origin 9.1软件作图。
2 结果与分析
2.1 保鲜过程中感官评分变化
各处理组对罗氏沼虾涂膜保鲜过程中的感官评分的变化如图1所示。在贮藏过程中,各组样品的感官评分均呈下降趋势,其中空白组下降最快,其次是1%羧甲基壳聚糖对照组。在第3天时,空白组的感官评分已下降到5.93分,此时虾体肉质变软,虾壳表面出现黑斑,并散发轻微异味。贮藏至第5天时,1%羧甲基壳聚糖对照组和30 mg/L复合涂膜组的感官评分均已低于6分,分别为5.64和5.89分。而60 mg/L 和90 mg/L复合涂膜组的感官评分的变化趋势一直处于缓慢下降状态,其分别在第6天和第7天低于6分,对比空白组,将罗氏沼虾的货架期分别延长了3 d和4 d。由此可见,60 mg/L和90 mg/L的虾青素-羧甲基壳聚糖复合涂膜液可有效延缓罗氏沼虾的腐败变质,延长其货架期。
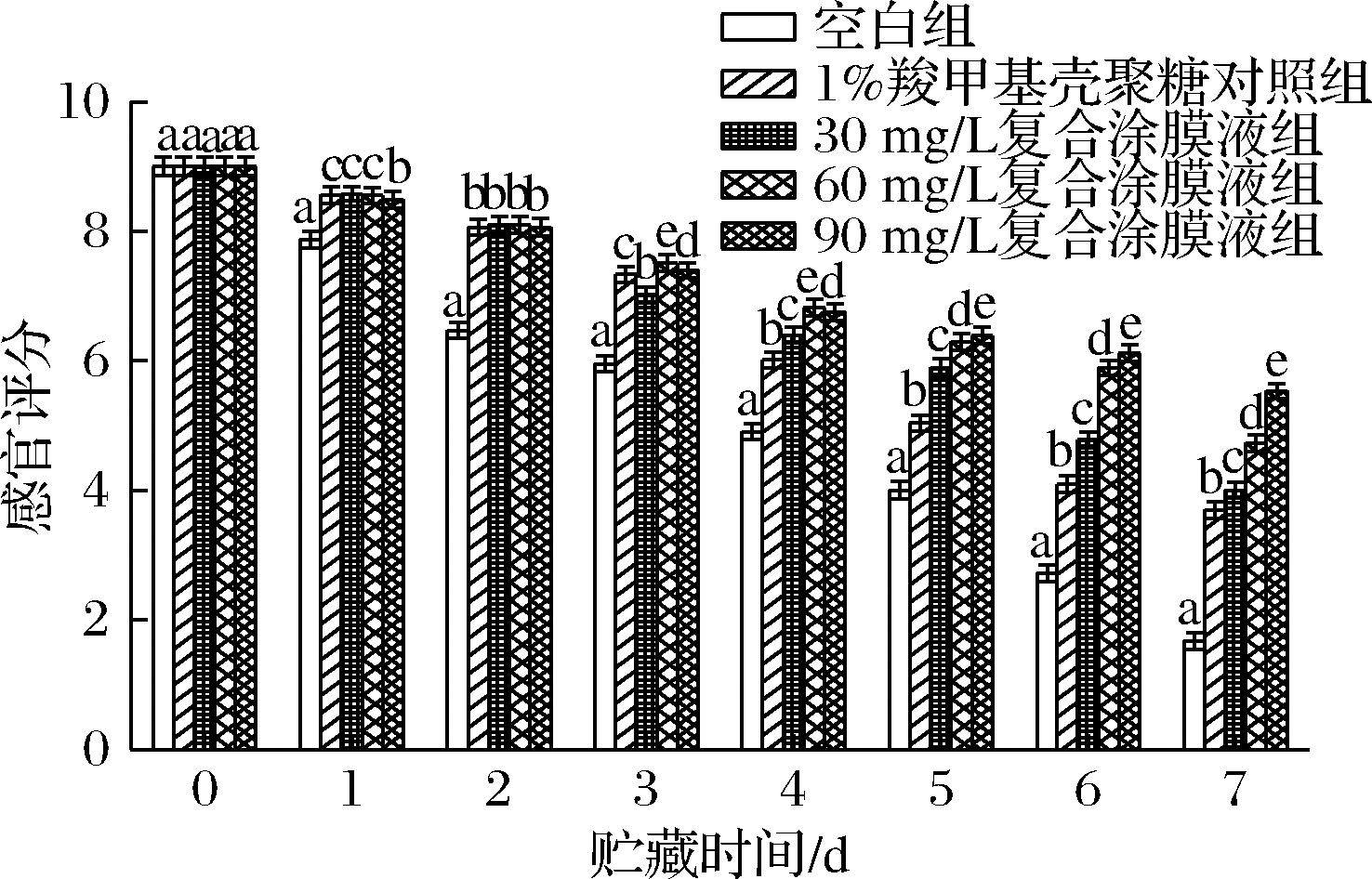
图1 不同保鲜处理组对罗氏沼虾感官品质的影响
Fig.1 Effects of different fresh-keeping treatment groups on
the sensory quality of giant freshwater prawn
(Macrobrachium rosenbergii)
注:小写字母不同者为差异显著(下同)
2.2 菌落总数变化
各处理组对罗氏沼虾涂膜保鲜过程中的菌落总数的变化如图2所示,罗氏沼虾的初始菌落总数为4.73 lgCFU/g,随着贮藏时间的延长,各处理组的菌落总数整体上呈现上升趋势。在贮藏前期,各组样品的菌落总数变化缓慢且出现轻微下降的趋势,而后逐渐上升。与空白组相比,各涂膜保鲜处理组均能在一定程度上抑制罗氏沼虾菌落总数的增加,其中添加了虾青素的处理组表现出更好的抑菌性。在贮藏第3天时,空白组的菌落总数超过了6 lgCFU/g,视为虾体已腐败变质。而此时,各处理组的菌落总数仍保持较低水平。随着贮藏时间的延长,1%羧甲基壳聚糖对照组和30 mg/L复合涂膜液组在第5天的菌落总数分别达到6.18和6.11 lgCFU/g。而60 mg/L和90 mg/L 复合涂膜液组分别在第6天和第7天才超过6 lgCFU/g,货架期较空白组分别延长了3 d和 4 d。由此可证明,添加虾青素有助于抑制微生物生长繁殖,可有效延长罗氏沼虾的货架期。
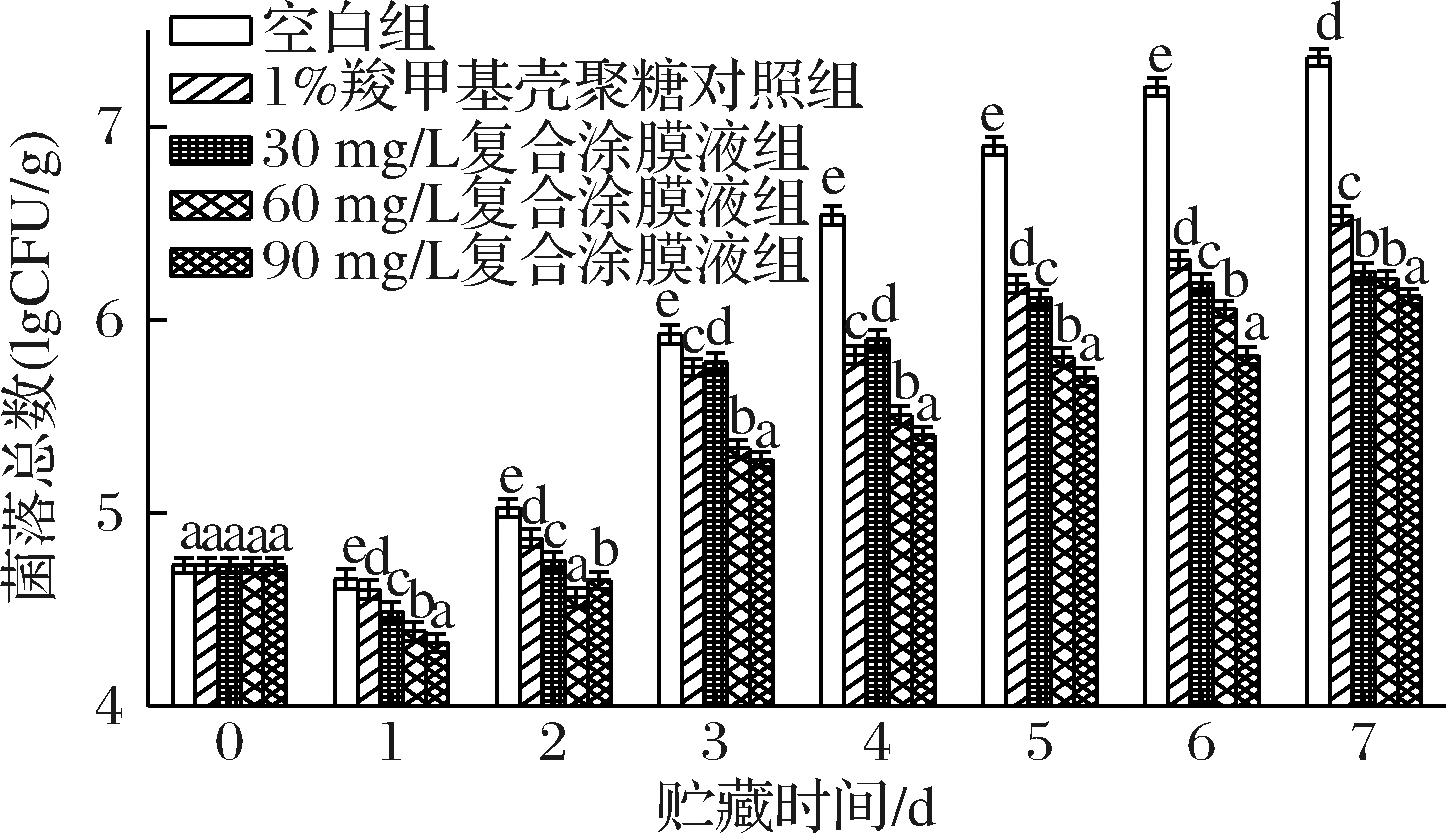
图2 不同保鲜处理组对罗氏沼虾菌落总数的影响
Fig.2 Effects of different fresh-keeping treatment groups on
the total number of colony of giant freshwater prawn
(Macrobrachium rosenbergii)
2.3 pH的变化
在冷藏条件下,各处理组对罗氏沼虾涂膜保鲜过程中的pH的变化如图3所示。罗氏沼虾的初始pH为7.31,在贮藏过程中,各组样品的pH在第1天出现了轻微下降,但整体呈现上升趋势。空白组在第3天的pH达到了7.71,此时虾体处于不新鲜状态,而1%羧甲基壳聚糖对照组一直处于持续上升的趋势,但pH值始终小于空白组,直到第5天时,虾体的pH值超过7.7。含有虾青素的各处理组样品的pH值在贮藏的前2 d处于较低水平。在整个贮藏期间,含有虾青素的各处理组始终低于1%羧甲基壳聚糖对照组和空白组。随着贮藏时间的延长, 90 mg/L虾青素组显示出对pH值升高较好抑制作用,在第7 天超过了7.7,将保质期延长4 d。
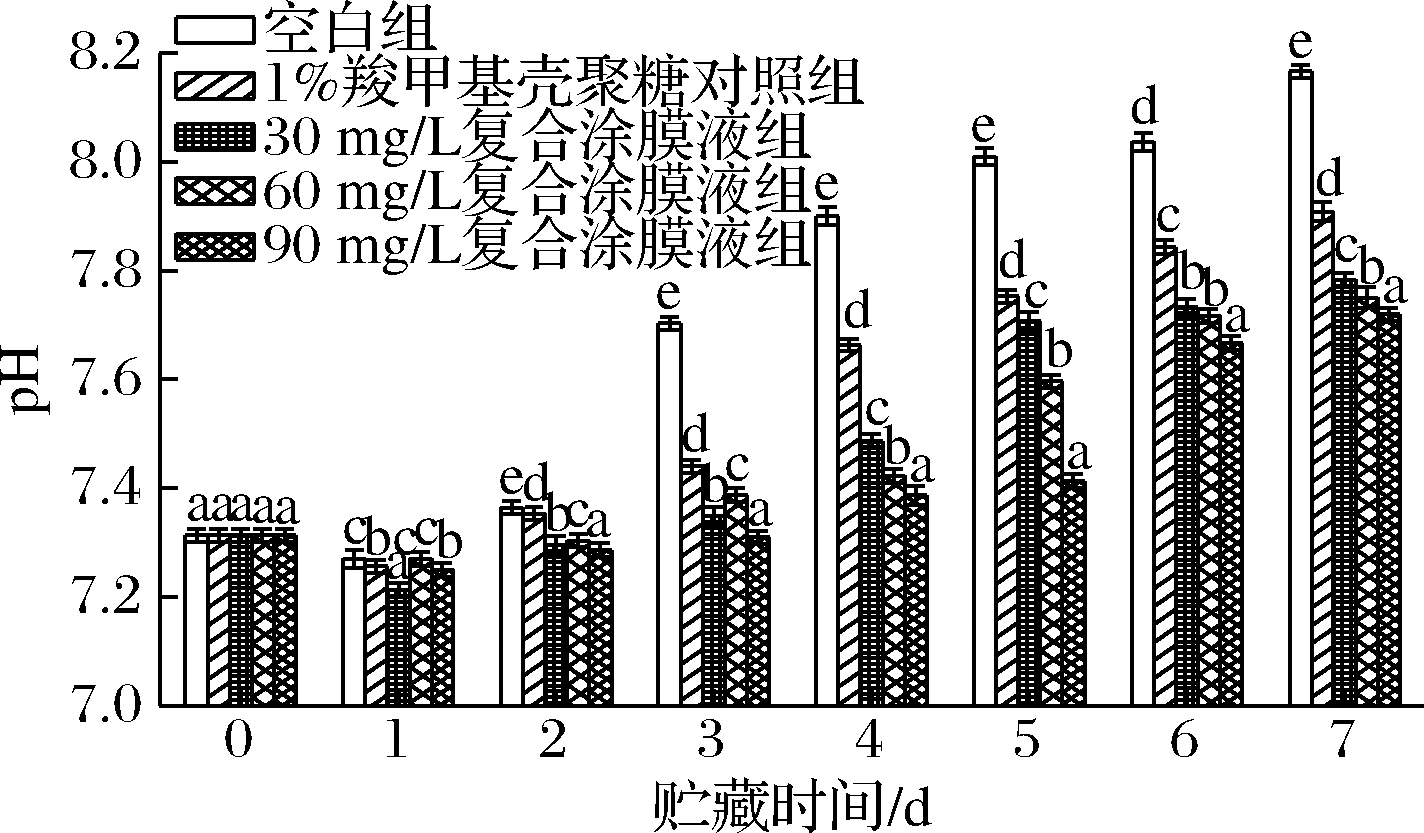
图3 不同保鲜处理组对罗氏沼虾pH的影响
Fig.3 Effects of different preservation treatment groups on
the pH of giant freshwater prawn (Macrobrachium rosenbergii)
2.4 TVB-N值变化
各处理组对罗氏沼虾涂膜保鲜过程中的TVB-N值的变化如图4所示。随着贮藏时间的延长,所有处理组样品的TVB-N值均呈现上升的趋势。贮藏至第3天后,各处理组的增长速度明显加快。空白组、1%羧甲基壳聚糖对照组、30 mg/L复合涂膜液组的TVB-N值分别在第4、5、6天超过20 mg/100g,超过了可食用上限。此时 60 mg/L和90 mg/L复合涂膜液处理组仍处于较低水平。在贮藏结束时,60 mg/L和90 mg/L复合涂膜液处理组的TVB-N值分别为19.73和18.58 mg/100g,均未超过20 mg/100g,在空白组的基础上将罗氏沼虾的货架期延长了4 d。表明添加虾青素可以更好地延缓蛋白质的降解过程,这与刘开华等[6]的研究结果相一致。
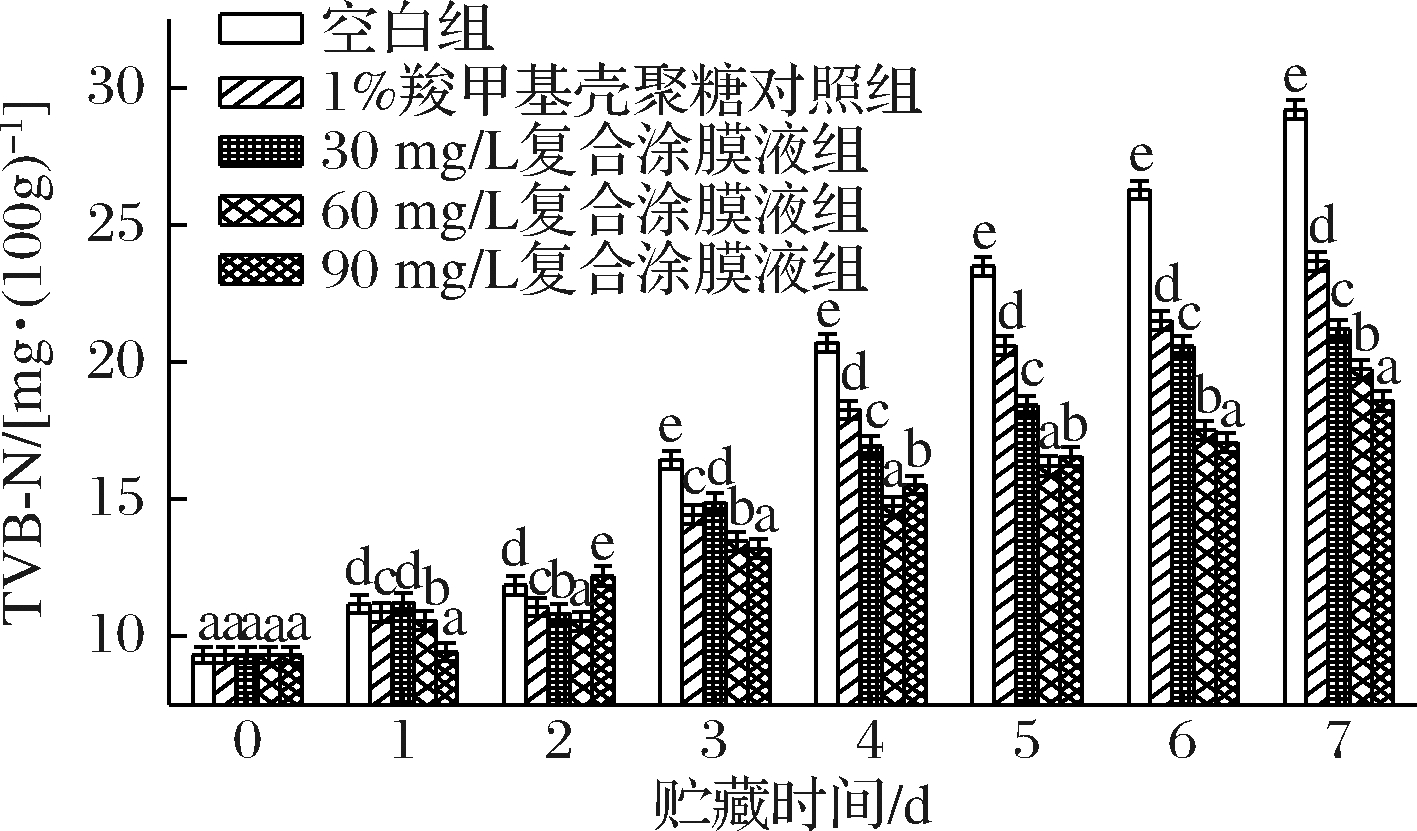
图4 不同保鲜处理组对罗氏沼虾TVB-N值的变化
Fig.4 Changes of TVB-N value of giant freshwater prawn
(Macrobrachium rosenbergii) in different preservation
treatment groups
2.5 TBARS值变化
各处理组对罗氏沼虾涂膜保鲜过程中的TBARS值的变化如图5所示。由图5中可以看出,罗氏沼虾的初始TBARS值为0.34 mg/kg,随着贮藏时间的延长,各组样品的TBARS值均呈现上升趋势。在贮藏结束时,空白组的TBARS增加到了0.96 mg/kg,各处理组较空白组分别降低了25.21%、27.81%、36.94%和40.73%。其中90 mg/L复合涂膜液处理组的抗脂质氧化效果最好。
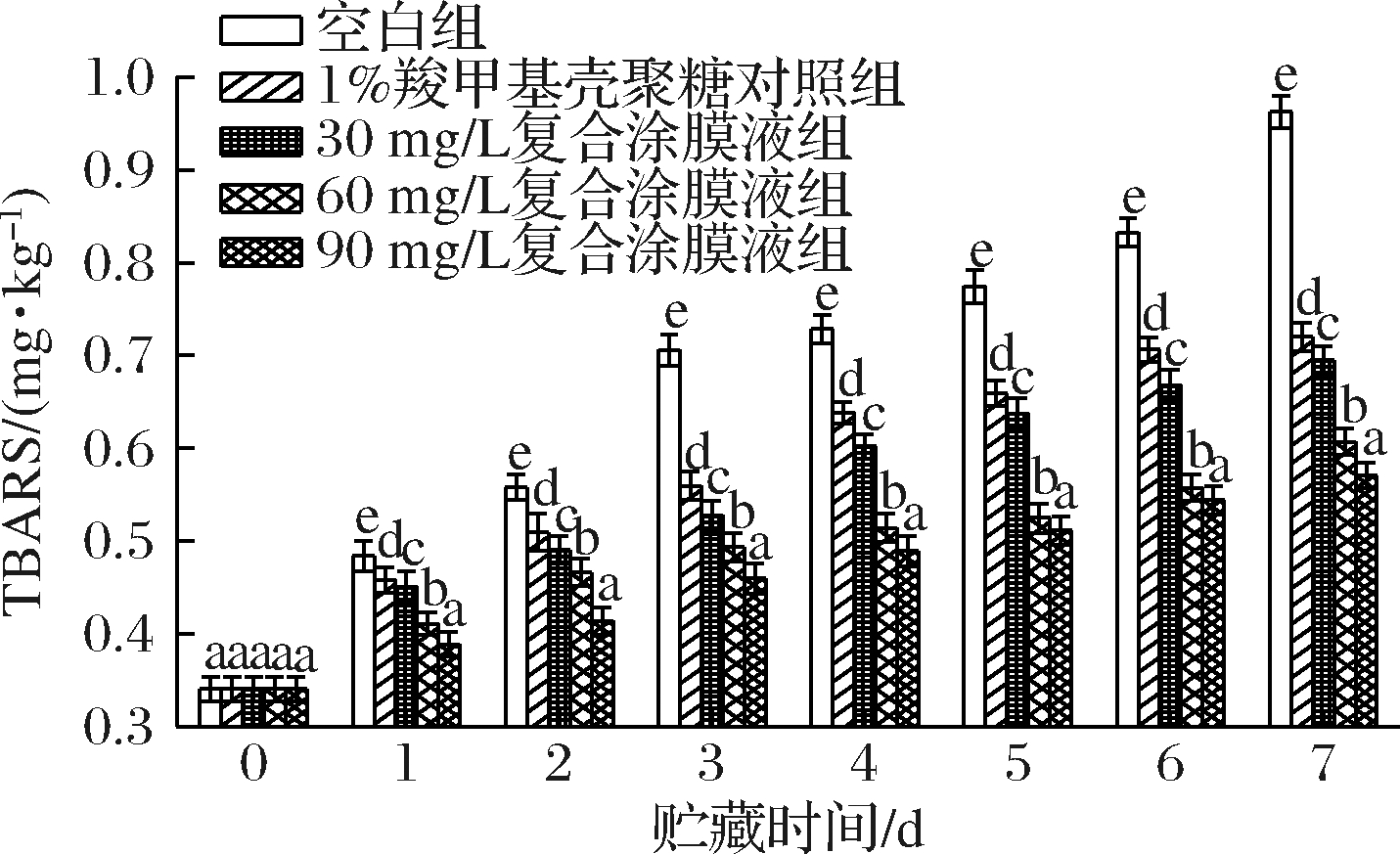
图5 不同保鲜处理组对罗氏沼虾TBARS值的变化
Fig.5 Changes of TBARS value of giant freshwater prawn
(Macrobrachium rosenbergii) in different preservation
treatment groups
2.6 K值变化
各处理组对罗氏沼虾涂膜保鲜过程中的K值的变化如图6所示。样品的初始K值为4.30%,随着贮藏时间的延长,K值逐渐增加,其中空白组增长速度最快,其次是1%羧甲基壳聚糖对照组和30 mg/L复合涂膜液组。而60 mg/L和90 mg/L复合涂膜液组的K值呈现缓慢上升的趋势,在贮藏后期60 mg/L和90 mg/L复合涂膜液组的K值表现出了明显的优势,说明含有虾青素的涂膜液组在贮藏过程中可以有效延缓罗氏沼虾核苷酸的降解。
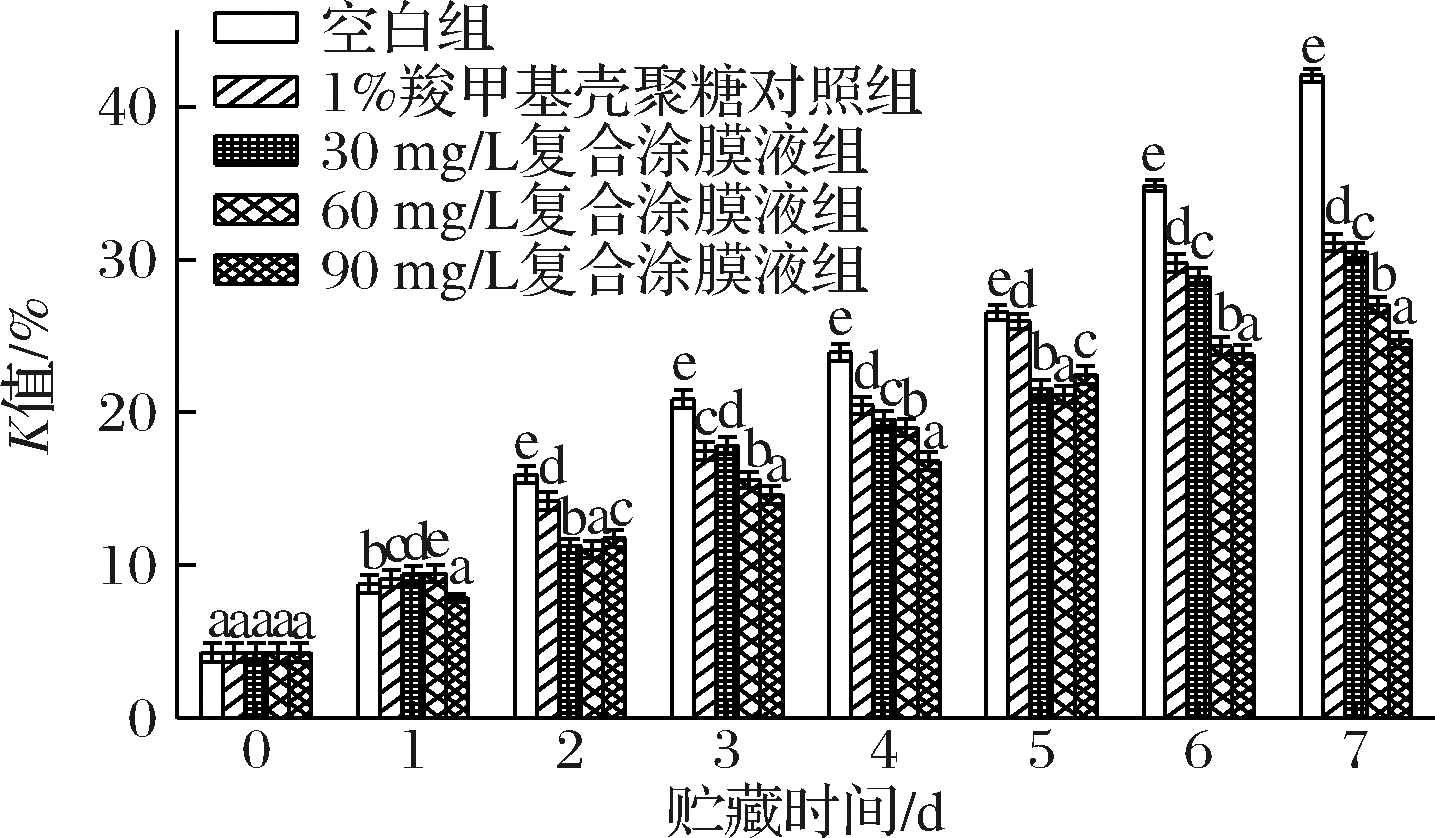
图6 不同保鲜处理组对罗氏沼虾K值的变化
Fig.6 Changes of K value of giant freshwater prawn
(Macrobrachium rosenbergii) in different preservation
treatment groups
3 讨论
在贮藏过程中,虾体内部的大分子物质会在自身多种蛋白酶及微生物的分解作用下生成一系列小分子有害物质如组胺、二甲胺、游离脂肪酸、吲哚等,同时多巴类物质会在多酚氧化酶的作用下转化为醌类,并与氨基酸结合生成黑色素,使得虾类水产品感官上的肌肉组织、体表色泽和气味产生变化[14]。通过触觉、视觉及嗅觉对其感官上的特异性变化进行感官评定,可有效且直观地反应虾类水产品的新鲜度。根据王秀娟等[9]的研究发现,当虾的感官评分低于6时,则认为该样品的感官品质是不可接受的。本研究中空白组在第3天的感官评分已低于6分,表明虾已经开始腐败变质,不具有食用价值。YAN等[15]将弱酸性电解水与抗坏血酸相结合对罗氏沼虾进行浸渍涂膜保鲜,研究发现未处理组的样品在第3天出现了品质的显著下降,不具有食用价值,与本文研究结果相一致。60 mg/L和90 mg/L的虾青素-羧甲基壳聚糖复合涂膜液对罗氏沼虾的感官评分较好。
虾类等水产品在捕捞、运输、贮藏及销售过程中,会受到自身及环境中的微生物的分解破坏作用,产生醛、酮、醇、氨基酸、组胺等小分子产物,使得虾体发生腐败变质并散发异味。因此,微生物的含量与水产品的腐败程度密切相关。通过测定水产品中菌落总数的变化可直接反映水产品的新鲜度,为水产品货架期的预测提供可靠依据。一般来说,虾类水产品的菌落总数小于5 lgCFU/g时,被视为是一级新鲜,而当菌落总数超过6 lgCFU/g时,虾类等水产品便不具有可食用价值[16]。本研究中,在贮藏前期的各组样品的菌落总数出现了轻微下降的趋势,这可能是由于虾体表面的一些微生物对低温冷藏环境的不适应,以及虾体内的营养物质在前期还未全部降解为可被微生物利用的小分子物质,使得微生物的新陈代谢及生长繁殖受到抑制,延缓菌落总数的上升[17]。含虾青素的处理组的菌落总数均上升速率缓慢,尤其是60 mg/L和90 mg/L的虾青素-羧甲基壳聚糖复合涂膜液组的菌落总数上升速率最慢,这可能是由于虾体所带细菌多为嗜冷菌[18],而虾青素对嗜冷菌可能具有独特的抑制作用。USHAKUMARI等[19]采用琼脂打孔法对虾青素的抑菌活性进行了研究,结果发现虾青素对革兰氏阳性菌和革兰氏阴性菌均有显著抑菌效果。MAGESWARI等[20]利用有机溶剂浸提法从嗜冷鞘氨醇单胞菌中提取出虾青素,并对虾青素的抑菌性进行了探索,结果发现虾青素可有效抑制嗜冷菌属单核细胞增生李斯特菌的生长繁殖。目前,对虾青素抑菌机理的研究仍然较少。孟昂[21]以白色念珠菌为研究对象,对虾青素抑菌机理进行了初步探索,发现虾青素通过破坏细胞膜的通透性来起到抑菌的作用。JEYACHANDRAN等[22]从对虾虾壳中提取出富含虾青素的类胡萝卜素溶液,研究其抑菌性发现,其能对微生物的生物膜起到抑制作用,阻碍微生物的生长繁殖。ABDELMALEK等[8]用虾青素保鲜鸡排和刘开华等[6]用虾青素保鲜鱼丸的研究中也证实了这一点。
pH值是判断水产品新鲜度的一个重要指标。虾类水产品在捕捞死后,其体内糖原会发生降解反应,生成乳酸等有机酸类物质,降低虾体的pH值[23]。随着贮藏时间的延长,虾体内部的蛋白质等含氮物质在微生物的分解作用下,转化为三甲胺、硫化氢、吲哚、氨类等多种碱性含氮化合物,造成pH值的升高。因此,通过测定罗氏沼虾贮藏期间pH的变化,反映虾体的新鲜度。MEHMET等 [24]研究发现,虾的pH值与虾类水产品的新鲜度密切相关,认为虾体的pH小于或等于7.7时具有可食用价值。在本研究中,pH在贮藏第1天时出现轻微下降趋势,而后迅速上升,这可能是虾体内部的蛋白质被细菌和内源酶分解产生碱性物质,使得pH值不断升高[25]。90 mg/L的虾青素-羧甲基壳聚糖复合涂膜液组的pH在第7天时才大于7.7,说明一定含量的虾青素配合羧甲基壳聚糖溶液可延缓虾体内蛋白质的分解,较好地抑制虾体pH的升高,维持虾体品质。
TVB-N包括三甲胺、二甲胺、氨和其他挥发性碱性含氮化合物,是判断水产品腐败变质的一个重要鲜度指标。我国河虾食品卫生标准GB 5009.228—2016《食品安全国家标准 食品中挥发性盐基氮的测定》[11]规定:河虾的TVB-N值的可食用上限为20 mg/100g。本研究中,在贮藏前期,TVB-N值先缓慢上升,贮藏3天后开始快速上升,这可能是由于在贮藏前期虾体表面的微生物生长受到抑制,不具有较强的分解破坏作用。同时,虾类水产品在死后,虾体肌肉会进入僵硬期,在达到僵硬最高峰后开始解僵,此时虾体肉质变软,弹性及韧性下降,蛋白质开始发生降解,造成TVB-N值的迅速升高[26]。60 mg/L和90 mg/L复合涂膜液处理组的保鲜效果最好。
TBARS值的升高与不饱和脂肪酸氧化分解加剧有关。罗氏沼虾在死后,体内的不饱和脂肪酸易受到空气中氧气的影响而发生氧化酸败,生成醛酮类低分子羰基化合物,对虾体的色泽和风味造成损害[27]。硫代巴比妥酸可与脂肪氧化的二次产物戊二醛发生反应生成红色复合物,而这种复合物在532 nm处有最大吸收峰,通过测量吸光度可判断脂肪氧化的程度。因此,TBARS值被广泛用作评价脂肪氧化程度的指标[9]。在本研究的贮藏过程中,含虾青素的处理组明显优于空白组和对照组,这主要是由于虾青素具有极强的抗氧化性,能够清除膜内外自由基,淬灭单线态氧,阻碍虾体内游离脂肪酸自动氧化的进行,有效延缓罗氏沼虾脂肪氧化程度[28]。CARBALLO等[29]用虾青素保鲜羊肉发现虾青素在冷藏条件下可抑制脂肪氧化,延长货架期。POGORZELSKA等[30]得到了相同的结论,虾青素可抑制猪肉糜脂肪氧化。
在水产品贮藏过程中,核苷酸的降解是水产品品质发生劣变的一个重要原因。K值是ATP及其降解产物的含量的比值,能够反映水产品肌肉中核苷酸的降解情况。许多研究报道指出K值与虾类水产品的新鲜度具有关联,其可作为评价虾类等水产品新鲜度的化学指标[31-32]。K值越大,则表明核苷酸降解越严重,虾类就越不新鲜。在本研究中,60 mg/L和90 mg/L 复合涂膜液处理组的K值最小,比空白组、对照组分别低35.71%、12.90%和41.11%、20.38%。
4 结论
在(4±1) ℃条件下,各处理组对比空白组均对罗氏沼虾具有一定的保鲜效果。由综合感官评分、菌落总数、pH、TVB-N值、TBARS值和K值6个指标测定结果发现,60 mg/L和90 mg/L复合涂膜液组较单一使用1%(质量分数)羧甲基壳聚糖处理组均表现出较好的保鲜效果,可有效抑制微生物的生长繁殖,延缓脂质氧化及蛋白质分解,使得罗氏沼在低温贮藏期间具有较好的感官品质,将货架期延长3~4 d。因此,虾青素-羧甲基壳聚糖复合膜液在虾类等水产品的保鲜中具有良好的保鲜效果和应用前景。
[1] ZHU S C, ZHOU Z Y, FENG L G, et al.Postmortem changes in physicochemical properties of songpu mirror carp (Cyprinus carpio ) during iced storage [J].Food Bioscience, 2015, 9:75-79.
[2] NAGUIB Y M.Antioxidant activities of astaxanthin and related carotenoids[J].Journal of Agricultural and Food Chemistry, 2000, 48(4):1 150-1 154.
[3] GOTO S, KOGURE K, ABE K, et al.Efficient radical trapping at the surface and inside the phospholipid membrane is responsible for highly potent antiperoxidative activity of the carotenoid astaxanthin[J].Biochimica et Biophysica Acta-BBA, 2001, 1 512(2):251-258.
[4] CHINTONG S, PHATVEJ W, RERK-AM U, et al.In vitro antioxidant, antityrosinase, and cytotoxic activities of astaxanthin from shrimp waste[J].Antioxidants, 2019, 8(5):128.
[5] 韩青佑. 虾壳中虾青素的提取及其在保鲜中的应用[D].上海:上海海洋大学, 2017.
HAN Q Y.Extraction of astaxanthin from shrimp shell and its application in preservation [D].Shanghai:Shanghai Ocean University, 2017.
[6] 刘开华, 邢淑婕.虾青素联合茶多酚对南湾鳙鱼丸保鲜效果的研究[J].食品科技, 2013, 38(1):164-167.
LIU K H, XING S J.Effects on fresh preservation of Nan-wan sand gurnard fish ball for astaxanthin and polyphenols[J].Food Science and Technology, 2013, 38(1):164-167.
[7] EL-BIALY H A A, ABD-EL-KHALEK H H.A comparative study on astaxanthin recovery from shrimp wastes using lactic fermentation and green solvents:An applied model on minced Tilapia[J].Journal of Radiation Research and Applied Sciences, 2020, 13(1):594-605.
[8] ABDELMALEK B E, SILA A, GHLISSI Z, et al.The influence of natural astaxanthin on the formulation and storage of marinated chicken steaks[J].Journal of Food Biochemistry, 2016, 40(4):393-403.
[9] 王秀娟, 张坤生, 任云霞.添加剂对壳聚糖涂膜保鲜虾的效果研究[J].食品科技, 2008, 33(7):239-242.
WANG X J, ZHANG K S, REN Y X.Study on effects of additive to the preservation of shrimp by coating with chitosan[J].Food Science and Technology, 2008, 33(7):239-242.
[10] 中华人民共和国国家卫生和计划生育委员会,国家食品药品监督管理总局.GB 4789.2—2016 食品微生物学检验菌落总数测定[S].北京:中国标准出版社, 2016.
National Health and Family Planning Commission, National Food and Drug Administration of the People′s Republic of China.GB 4789.2—2016 Determination of the total number of bacterial colonies in food microbiology inspection[S].Beijing:China Standards Press, 2016.
[11] 国家卫生和计划生育委员会. GB 5009.228—2016 食品安全国家标准 食品中挥发性盐基氮的测定[S].北京:中国标准出版社, 2016.
National Health and Family Planning.GB 5009.228—2016 National Food Safety Standard Determination of volatile basic nitrogen in food[S].Beijing:China Standards Press, 2016.
[12] 刘金昉, 刘红英, 齐凤生, 等.复合生物保鲜剂结合冰温贮藏对南美白对虾的保鲜效果[J].食品科学, 2014, 35(20):286-290.
LIU J F, LIU H Y, QI F S, et al.Preservation effect of complex biological preservative combined with ice temperature storage on Penaeus vannamei[J].Food Science, 2014, 35(20):286-290.
[13] 余达威. 壳聚糖涂膜对冷藏草鱼片的品质影响研究[D].无锡:江南大学, 2019.
YU D W.Study on effect of chitosan-based coating on the quality of refrigerated grass carp (Ctenopharyngodon idella) fillets[D].Wuxi:Jiangnan University, 2019.
[14] 王娟娟. 南美白对虾虾壳中甲壳素的提取及其羧甲基化衍生物的应用[D].上海:上海海洋大学, 2017.
WANG J J.Extraction of chitin from shrimp shells of Penaeus vannamei and its application in carboxymethylation derivatives[D].Shanghai:Shanghai Ocean University, 2017.
[15] YAN W, ZHANG Y, YANG R, et al.Combined effect of slightly acidic electrolyzed water and ascorbic acid to improve quality of whole chilled freshwater prawn (Macrobrachium rosenbergii)[J/OL].Food Control, 2020, 108.https://doi.org/10.1016/j.foodcont.2019.106820.
[16] AL-DAGAL M M, BAZARAA W A.Extension of shelf life of whole and peeled shrimp with organic acid salts and bifidobacteria[J].Journal of Food Protection, 1999, 62:51-56.
[17] 李思敏. 低温物流中海捕虾的品质变化与货架期预测[D].杭州:浙江工商大学, 2020.
LI S M.Quality change and shelf life forecast of sea shrimp in low temperature logistics [D].Hangzhou:Zhejiang Gongshang University, 2020.
[18] 章红兵. 对虾加工与检验[M].青岛:青岛海洋大学出版社, 1991.
ZHANG H B.Shrimp Processing and Inspection[M].Qingdao:Qingdao Ocean University Press, 1991.
[19] USHAKUMARI U N, RAMANUJAN R.Isolation of astaxanthin from marine yeast and study of its pharmacological activity[J].International Current Pharmaceutical Journal, 2013, 2(3):67-69.
[20] MAGESWARI A, SUBRAMANIAN P, SRINIVASAN R, et al.Astaxanthin from psychrotrophic Sphingomonas faeni exhibits antagonism against food-spoilage bacteria at low temperatures[J].Microbiological Research, 2015, 179:38-44.
[21] 孟昂. 雨生红球藻中虾青素结晶的制备、稳定性与功能性的研究[D].济南:济南大学, 2020.
MENG A.Preparation, stability and activity of astaxanthin crystals in Haematococcus pluvialis[D].Jinan:Jinan University, 2020.
[22] JEYACHANDRAN S, KIYUN P, IHN-SIL K, et al.Identification and characterization of bioactive pigment carotenoids from shrimps and their biofilm inhibition[J/OL].Journal of Food Processing and Preservation, 2020, 44(10).https://doi.org/10.1111/jfpp.14728.
[23] 吕华. 石榴皮提取物保鲜作用及抗菌复合膜制备研究[D].舟山:浙江海洋大学, 2015.
LYU H.Study on preservative function of pomegranate peel extracts and on preparation of antibiofilm[D].Zhoushan:Zhejiang Ocean University, 2015.
[24] MEHMET B, FARUK B, HAMI A.Preservation and shelf-life extension of shrimps and clams by high hydrostatic pressure[J].International Journal of Food Science & Technology, 2009, 44:1 495-1 502.
[25] BENJAKUL S, VISESSANGUAN W, RIEBROY S, et al.Gel-forming properties of surimi produced from bigeye snapper, Priacanthus tayenus and P macracanthus, stored in ice[J].Journal of the Science of Food and Agriculture, 2002, 82(13):1 442-1 451.
[26] 张振. 壳聚糖-ε-聚赖氨酸—卡拉胶复合涂膜对冷藏中国对虾品质影响研究[D].沈阳:沈阳农业大学, 2020.
ZHANG Z.Effect of chitosan combined with ε-polylysine and carrageen coating on the quality of refrigerated Chinese shrimp (Fenneropenaeus chinensis) [D].Shenyang:Shenyang Agricultural University, 2020.
[27] 米红波, 刘爽, 李学鹏, 等.天然抗氧化剂在抑制水产品贮藏过程中脂质氧化的研究进展[J].食品工业科技, 2016, 37(8):364-368;373.
MI H B, LIU S, LI X P, et al.Research progress of nature antioxidant in inhibiting lipid oxidation of aquatic product during storage[J].Science and Technology of Food Industry, 2016, 37(8):364-368;373.
[28] KAMATH B S, SRIKANTA B M, DHARMESH S M, et al.Ulcer preventive and antioxidative properties of astaxanthin from Haematococcus pluvialis[J].European Journal of Pharmacology, 2008, 590(1-3):387-395.
[29] CARBALLO D E, CARO I, ANDRES S, et al.Assessment of the antioxidant effect of astaxanthin in fresh, frozen and cooked lamb patties[J].Food Research International, 2018, 111:342-350.
[30] POGORZELSKA E, GODZISZEWSKA J, BRODOWSKA M, et al.Antioxidant potential of Haematococcus pluvialis extract rich in astaxanthin on colour and oxidative stability of raw ground pork meat during refrigerated storage[J].Meat Science, 2018, 135:54-61.
[31] HE Q, XIAO K J.The effects of tangerine peel (Citri reticulatae pericarpium) essential oils as glazing layer on freshness preservation of bream (Megalobrama amblycephala) during superchilling storage[J].Food Control, 2016, 69:339-345.
[32] LI X P, ZHOU M Y, LIU J F, et al.Shelf-life extension of chilled olive flounder (Paralichthys olivaceus) using chitosan coatings containing clove oil[J].Journal of Food Processing and Preservation, 2017, 41(5):1-8.