呋喃西林(nitrofurazone,NFZ)是一种人工化学合成的广谱抗生素,具有抗菌谱广、不易产生抗药性且低成本的特点,广泛应用于水产养殖业[1]。氨基脲(semicarbazide,SEM),被认为是抗生素呋喃西林药物的特征性代谢物[2]。NFZ原药及其代谢残留物存在致癌、致突变、致畸的风险。美国、欧盟、日本及中国先后规定禁止在畜禽和水产养殖中使用NFZ药物。NFZ原药在动物体内的半衰期短,代谢迅速,原药本身难以被检测,而SEM能与蛋白质紧密结合,形成稳定的残留物质,可在体内存在几个星期。因此,在水产品风险监测和监督抽查中,以残留物SEM的检测值来判断养殖中是否非法使用NFZ。我国对动物源性食品中SEM残留的限量要求为1.0 μg/kg[3]。
目前,NFZ代谢物一般采用毛细管色谱分析方法[4]、免疫层析法[5-6]、生物传感器法[7]、高效液相色谱法[8-9]和液质联用法[10-13]检测,这些检测方法多应用在可食部分[14],虾壳中残留分析方法报道较少[15]。近些年来,甲壳类水产品抽检结果表明SEM超标现象较严重,导致水产品的质量备受质疑,也对水产养殖业造成负面影响。有研究表明甲壳类水产品中存在内源性SEM,且可能来源于甲壳。相关标准[10]显示SEM衍生的方式为恒温振荡,衍生时间16 h。微波技术已在样品提取、消解、有机合成和衍生等诸多领域得到了广泛应用。微波提取不仅具有低耗能、耗时短等优点,同时还具有高效率,易操作等优势,微波辅助提取技术已被广泛应用于衍生提取工艺中[16]。因此,本文将微波技术运用于辅助SEM衍生[17-18],针对虾类肌肉和壳2个部位进行SEM检测方法的优化,以期实现快速衍生目的,提高样品检测效率。与恒温振荡方式对比,本方法衍生时间缩短,方法灵敏度高、重现性好,适用于甲壳类水产品中NFZ代谢物残留测定。
1 材料与方法
1.1 材料与试剂
SEM标准品及SEM内标(SEM·HCl -13C-15N2),美国Sigma-Aldrich公司;乙腈(质谱纯)、2-硝基苯甲醛(色谱纯),美国Thermo Fisher公司;实验用水为超纯水;盐酸、乙酸乙酯、正己烷、二甲基亚砜、磷酸氢二钾、氢氧化钠(均为分析纯),广州化学试剂厂。
1.2 仪器与设备
TQ-S-Micro超高效液相色谱串联质谱仪,美国Waters公司;MAS-Ⅱ常压微波辅助合成萃取仪,上海新仪器微波化学科技有限公司;TDZ5-WS离心机,长沙湘仪离心机仪器有限公司;Sigma 3k30高速冷冻离心机,德国Sigma公司;IKA T50均质机,德国IKA公司;AS20500/BDT超声清洗机,天津奥特赛恩斯仪器有限公司;Sartorius BS3223S电子分析天平,德国Sartorius公司;Milli-Q超纯水系统,美国Millipore公司;涡旋混合器,美国Henry Troemner公司。
1.3 仪器工作条件
1.3.1 液相色谱条件
进样量:5.0 μL,柱温:30 ℃,色谱柱:ACQUITY UPLC®BEH C18(50 mm×2.1 mm×1.7 μm)反相色谱柱,流速:0.30 mL/min。流动相:A相为体积分数为0.1%的甲酸水(色谱纯)溶液,B相为乙腈;梯度洗脱程序见表1。
表1 液相色谱梯度洗脱条件
Table 1 Program of gradient elution

时间/min流速/(mL·min-1)A/%B/%00.375253.00.370304.00.330704.50.375256.00.37525
1.3.2 SEM及内标质谱条件
离子源:电喷雾电离正离子(electrospray ionization positive ion,ESI+)模式扫描;检测方式:多反应监测(multiple-reaction monitoring,MRM)模式。离子源温度:150 ℃;毛细管电压:3.5 kV;脱溶剂气体温度:600 ℃;脱溶剂气体流量:1 000 L/h,锥孔气体流量:50 L/h。母离子、子离子、锥孔电压、碰撞能量如表2所示。
表2 NFZ代谢物及其内标的质谱条件
Table 2 NFZ metabolites and their internal target
mass spectrometry conditions

药物离子对(m/z)锥孔电压/V碰撞能量/eVSEM209.1>166.1∗, 209.4>192.124,249,10SEM-13C-15N2212.1>168.1249
注:*代表定量离子
1.4 样品采集
罗氏沼虾样品采自珠海养殖基地,用便携冰箱运回实验室,在广州华润万家超市、水产市场购买斑节对虾、南美白对虾、罗氏沼虾3种虾类样品,-20 ℃冷冻保存待测。检测分析前,将样品解冻至室温,将样品分为虾肉和去头虾壳。虾壳70 ℃温度条件下烘干24 h,再用粉碎机粉碎。
1.5 样品前处理
1.5.1 虾肉预处理
振荡预处理:参考农业部783号公告-1—2006,优化后使用。称取均质虾肉样品2 g于50 mL离心管中,加入0.2 mol/L盐酸5 mL,100 ng/mL内标工作液100 μL,0.05 mol/L 2-硝基苯甲醛溶液200 μL,涡旋混匀5 min,离心管置于37 ℃恒温水浴振荡器、200 r/min避光振荡16 h。
超声预处理:称取均质虾肉样品2 g于50 mL离心管中,加入0.2 mol/L盐酸5 mL,100 ng/mL内标工作液100 μL,0.05 mol/L 2-硝基苯甲醛溶液200 μL,涡旋混匀5 min,置于40 ℃超声波清洗机中超声。
微波预处理:称取均质虾肉样品2 g于50 mL离心管中,加入0.2 mol/L盐酸5 mL,100 ng/mL内标工作液100 μL,0.05 mol/L 2-硝基苯甲醛溶液200 μL,涡旋混匀5 min,置于400 W微波。
取出衍生化样品冷却至室温,4 000 r/min离心10 min,取上清液转入50 mL离心管,加入磷酸氢二钾溶液2.0~4.0 mL混匀,调节pH至7.0~7.5,加入5 mL乙酸乙酯,涡旋15 min,4 000 r/min离心10 min,取上清液,重复乙酸乙酯提取操作1次,合并上清液于10 mL离心管,40 ℃水浴氮气吹干,残渣用1.5 mL乙腈-甲酸水溶液[V(乙腈)∶V(0.1%甲酸)=5∶95],加入1.5 mL正己烷,涡旋8 min,12 000 r/min离心10 min,过0.22 μm滤膜,待测。
1.5.2 虾壳预处理
参考曹爱玲等[19]方法优化后使用。虾壳在70 ℃热风干燥箱烘适量时间,然后用粉碎机粉碎,称取烘干粉碎的虾壳2.00 g于50 mL离心管中,依次加入0.4 mol/L盐酸5 mL、100 ng/mL内标工作液100 μL、0.05 mol/L 2-硝基苯甲醛溶液200 μL,涡旋混匀5 min,最后置于37 ℃恒温水浴振荡器200 r/min避光振荡16 h,后面与1.5.1虾肉处理方法相同。
1.6 SEM标准曲线的绘制
100 μg/mL SEM标准储备溶液:称取5.0 mg SEM,用甲醇溶解,定容于50 mL容量瓶中,于0~4 ℃避光存放。
SEM标准工作溶液:准确吸取适量SEM标准储备液,用乙腈稀释,配制浓度为10和100 ng/mL的标准工作溶液。
分别准确移取10 ng/mL SEM标准工作溶液100、200、500 μL,100 ng/mL SEM标准工作溶液100、200、500和1 000 μL于7个50 mL离心管中,按1.5步骤操作,按1.3条件检测。
1.7 数据处理
实验所得数据采用Origin和Microsoft Excel 2016处理。
2 结果与分析
2.1 液相色谱和质谱条件的优化
不同型号的仪器在液相色谱质谱最佳方法参数方面都会有所差别,本方法采用Waters TQ-S Micro液质联用,取1 mL 1 μg/mL的SEM标准工作液,和1 mL 1 μg/mL的SEM内标工作液,按照1.5的方法定容于2 mL样品瓶中。分别吸取300~500 μL样品于毛细管注射器,以流动注射的方式,在ESI+模式下,选定已知目标物的母离子,进行离子源参数优化;而后分别以二级质谱方式进行其子离子及碰撞能量优化。采用ACQUITY UPLC®BEH C18反相色谱柱对流动相洗脱条件进行优化。优化后的洗脱条件详见1.3.1。优化后的质谱方法详见1.3.2。该方法的总离子流图如图1所示。

图1 SEM及其内标总离子流图
Fig.1 SEM and its internal standard total ion flow diagram
如图1所示,优化后的方法样品SEM出峰时间在1.14 min,峰形良好,在受到虾壳、肌肉样品中其他基质的影响下,仍能准确地检测到SEM,具有较强的抗干扰性。在肌肉样品SEM含量很低的情况下,仍能保持良好峰形,表明方法灵敏度高。单个样品检测时长为6 min,在稳定检测SEM的同时,大大缩短了检测时间,适用于现代水产品安全质量的监测。
2.2 样品前处理中盐酸用量的优化
前处理方法主要利用在酸性环境下将SEM从蛋白质上解离后衍生,提取浓缩的原理。本研究将虾类分为肌肉、虾壳两部分,由于虾壳与肌肉组织成分不同,主要由几丁聚糖和CaCO3组成,其中CaCO3含量很高,在解离衍生的同时会消耗酸,使其无法维持在稳定的酸性环境下衍生,导致SEM无法衍生完全。上机检测结果会出现内标工作溶液相应不稳定或偏低现象,导致SEM含量偏低或未检出。经优化及对比实验,优化添加盐酸浓度及体积见表3。
表3 盐酸添加浓度和体积
Table 3 The added concentration and volume of
hydrochloric acid in the sample
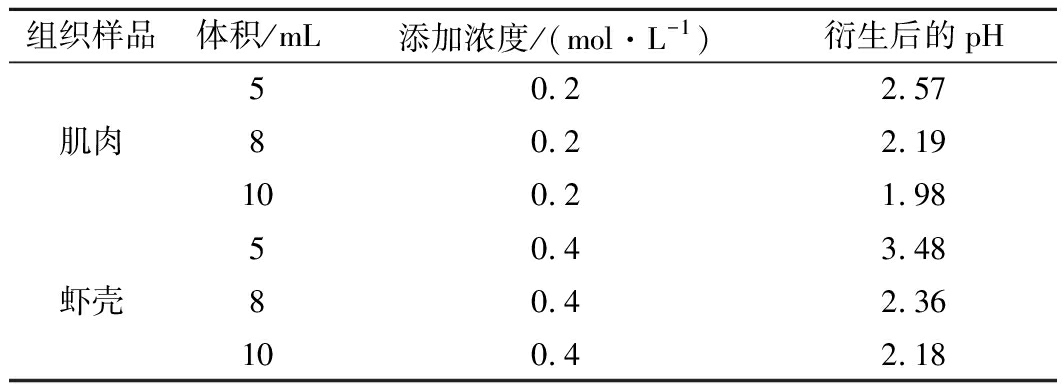
组织样品体积/mL添加浓度/(mol·L-1)衍生后的pH50.22.57肌肉80.22.19100.21.9850.43.48虾壳80.42.36100.42.18
由表3可知,2 g肌肉、虾壳样品添加盐酸,肌肉经过16 h衍生后,pH均保持在2.57以下,说明其解离衍生反应在稳定的酸性条件下进行,保证了SEM充分衍生。虾壳在添加5 mL和肌肉相同浓度的盐酸后,pH在7以上,因此增加盐酸浓度进行实验,在加入5 mL 0.4 mol/L 盐酸时,肌肉样品的pH达到3.48。结果表明,2 g虾肉在加入5 mL 0.2 mol/L盐酸,2 g虾壳在加入5 mL 0.4 mol/L盐酸时,样品pH达到在稳定酸性条件下衍生的要求,此时盐酸用量,为最佳条件。
2.3 衍生方式的优化
本实验对比了水浴振荡、超声波辅助衍生和微波辅助衍生3种方式对衍生效果的影响,结果列于表4。由表4可以看出,这3种方法对衍生效果具有显著性差异。超声波高频率振荡,可加速样品分散,增大样品与溶剂的接触面积,提高传质速度,从而缩短衍生反应的时间。按照1.5方法进行超声操作,在常温下分别衍生30、60和90 min。结果表明,超声30 min时,衍生不完全;超声90 min,衍生物峰面积达到最大,但是弱于振荡12 h的效果。按照李剑等[20]的方法,设定微波提取温度为60 ℃,分别微波衍生10、20和30 min。结果表明,微波10 min时,衍生不完全;微波超过20 min,衍生物峰面积增加不显著,微波衍生30 min和振荡衍生16 h没有显著差异,均能满足痕量分析要求。
表4 微波辅助、超声波和恒温振荡衍生方法的对比(n=3)
表4 Comparison of the derivative methods of
microwave-assisted and constant temperature (n=3)
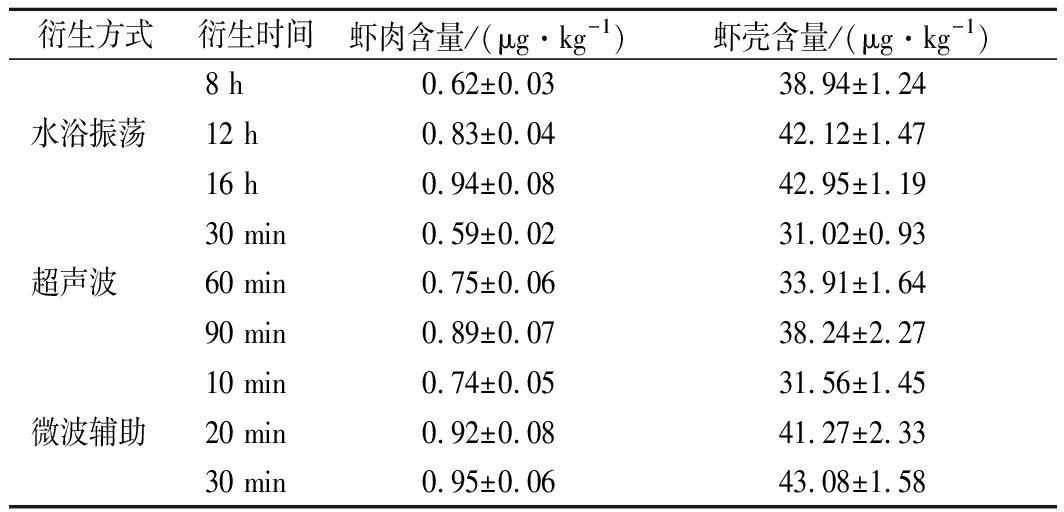
衍生方式衍生时间虾肉含量/(μg·kg-1)虾壳含量/(μg·kg-1)8 h0.62±0.0338.94±1.24水浴振荡12 h0.83±0.0442.12±1.4716 h0.94±0.0842.95±1.1930 min0.59±0.0231.02±0.93超声波60 min0.75±0.0633.91±1.6490 min0.89±0.0738.24±2.2710 min0.74±0.0531.56±1.45微波辅助20 min0.92±0.0841.27±2.3330 min0.95±0.0643.08±1.58
2.4 方法的适用性评价
2.4.1 方法的线性范围与检测限
按1.6中的方法配制标准工作液,经超高效液相色谱-质谱测定,以SEM浓度为横坐标,SEM峰面积与内标物峰面积比率为纵坐标,绘制标准工作曲线(图2)。
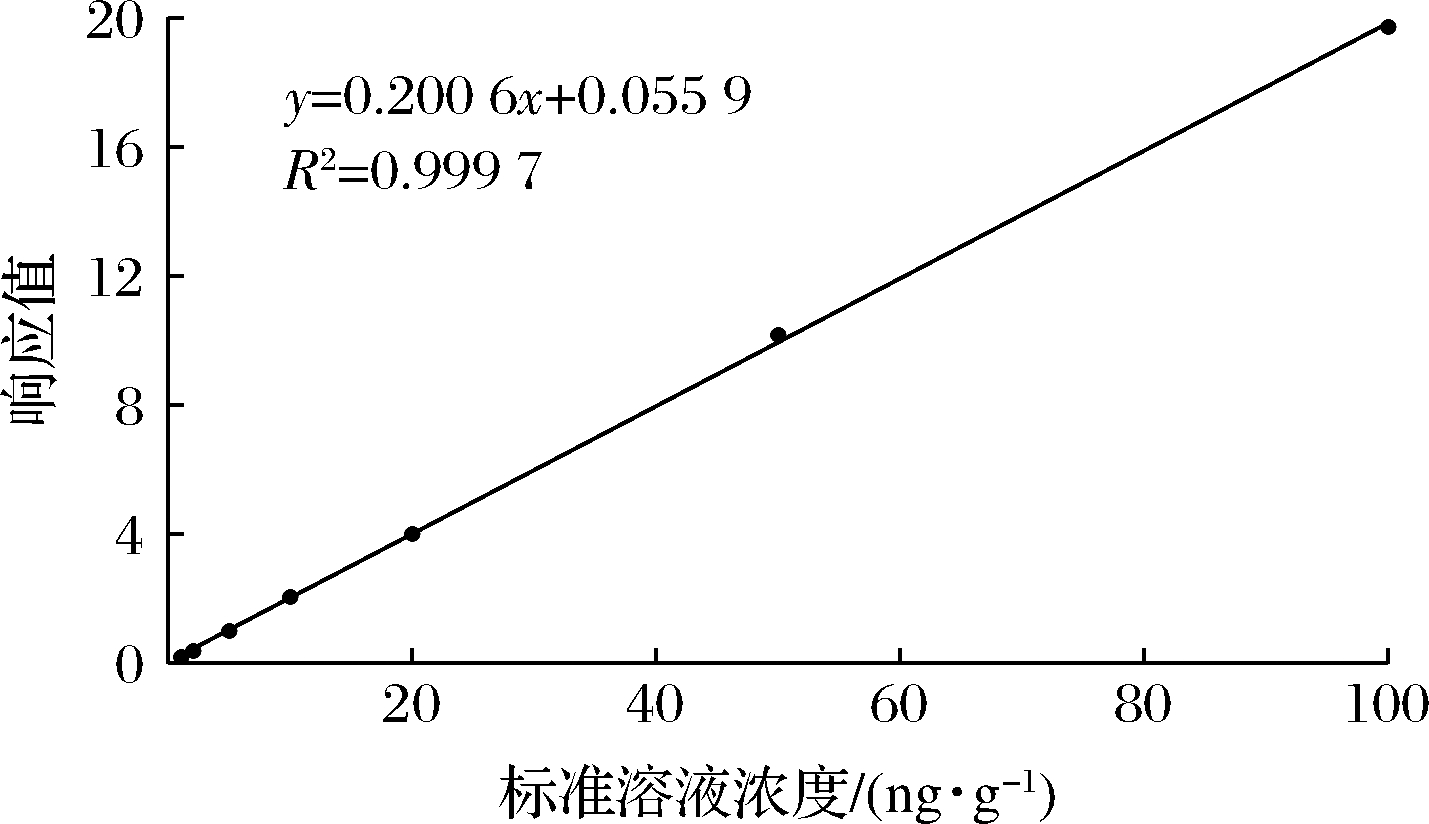
图2 SEM标准曲线图
Fig.2 SEM standard curve
结果表明,SEM浓度越高,响应越高,回归方程为y=0.200 6x+0.055 9,R2=0.999 7,SEM浓度在0.5~100 μg/L与其峰面积比值呈良好的线性关系。该方法的检出限为0.2 μg/kg,定量限为 0.5 μg/kg(S/N≥10),可以对SEM进行准确的定性定量分析,满足现行限量标准下的检测要求。
2.4.2 方法的准确度和精密度
为考察优化后的方法对虾体中SEM测定结果的准确性和稳定性,选择虾肉和虾壳样品进行标准添加实验,进行加标回收率和精密度的测定。根据SEM在不同组织中本底含量,其添加水平为1.0~20.0 μg/kg,每个添加水平做3个平行样品,通过回收率和精密度评价方法的准确度、重复性和适用性,结果见表5。
由表5可知,虾肉和虾壳中SEM的平均回收率为91.4%~103.6%;精密度为3.06%~6.56%。以上研究结果表明,本方法的准确度、精密度和重现性均良好,能够满足虾肉和虾壳中SEM分析的要求。
表5 样品中SEM的加标回收率和精密度
Table 5 Standard recovery and precision of
SEM in samples
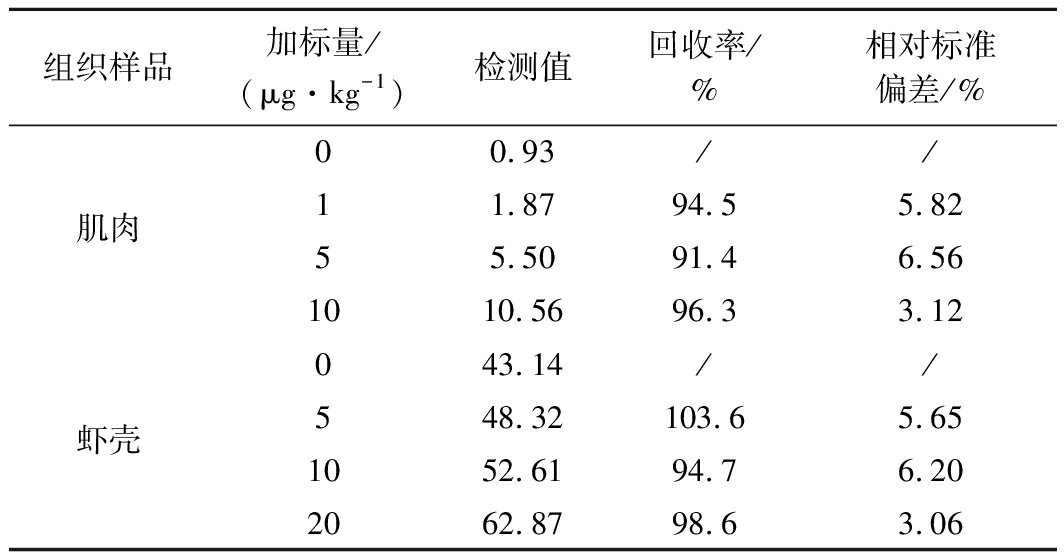
组织样品加标量/(μg·kg-1)检测值回收率/%相对标准偏差/%00.93//肌肉11.8794.55.8255.5091.46.561010.5696.33.12043.14//虾壳548.32103.65.651052.6194.76.202062.8798.63.06
2.5 实际样品测定
采用本方法对市场上采集的斑节对虾、南美白对虾和罗氏沼虾3种养殖虾类,每种虾类20份样品进行检测。结果显示,斑节对虾虾肉中SEM含量为未检出~0.76 μg/kg,南美白对虾虾肉中SEM含量为未检出~0.33 μg/kg,罗氏沼虾虾肉中SEM含量为0.71~2.72 μg/kg。斑节对虾虾壳中SEM含量为3.04~15.36 μg/kg,南美白对虾虾壳中SEM含量为2.42~10.27 μg/kg,罗氏沼虾虾壳中SEM含量为26.38~64.16 μg/kg。3种虾类样品的总离子流图如图3所示,虾类样品中SEM含量高低不同,均能呈现良好的峰形图,在样品基质中杂质的干扰下仍能准确检测出SEM,从峰形、响应值可以初步判断出样品SEM含量的高低。结果表明,斑节对虾、南美白对虾和罗氏沼虾虾肉中能够检出NFZ代谢物SEM,并且虾壳中SEM含量远高于虾肉,该方法灵敏度高,准确性强,适用于虾类样品中NFZ代谢物残留的实际监测。

a-斑节对虾虾壳;b-斑节对虾虾肉;c-南美白对虾虾壳;d-南美白对虾虾肉;e-罗氏沼虾虾壳;f-罗氏沼虾虾肉
图3 虾类样品的MRM图谱
Fig.3 MRM chromatograms in shrimp
3 结论
本研究在农业部783号公告-1—2006方法基础上,根据虾类不同部位进行样品前处理优化,建立了微波辅助衍生超高效液相色谱-串联质谱法测定NFZ代谢物的检测方法。在样品提取中,采用微波波辅助衍生方法代替传统的恒温振荡法,并在此基础上探讨了微波辅助衍生的时间,发现微波温度为60 ℃衍生时间为30 min时衍生效率达到最佳。盐酸在代谢物衍生过程中具有重要作用,添加0.4 mol/L盐酸5 mL,能够保障虾壳中NFZ代谢物完全衍生。SEM在0.5~100 μg/L 线性关系良好,相对回收率为91.4%~103.6%,相对标准偏差为3.06%~6.56%,检出限为0.2 μg/kg,定量限为0.5 μg/kg。该方法检测时间短,简便、可靠,准确度和精密度符合残留分析要求,能满足市场上养殖虾类中NFZ药物的检测监控要求,为相关部门的监督检测提供新的方法参考。
[1] 程波, 舒秀君, 宋蓓, 等.甲壳类水产品氨基脲残留来源研究进展[J].广东海洋大学学报, 2018, 38(5):93-98.
CHENG B, SHU X J, SONG B, et al.Research progress of semicarbazide residues in crustacean aquatic products[J].Journal of Guangdong Ocean University, 2018, 38(5):93-98.
[2] 范清涛, 陈胜军, 邓建朝, 等.甲壳类水产品中氨基脲产生及控制方法研究进展[J].食品安全质量检测学报, 2020, 11(5):1 439-1 445.
FAN Q T, CHEN S J, DENG J C, et al.Research progress on the production and control method of semicarbazide in crustacean aquatic products[J].Journal of Food Safety & Quality Inspection, 2020, 11(5):1 439-1 445.
[3] 曹爱玲, 余招锋, 陈怡琳, 等.动物源食品中呋喃西林及其代谢物氨基脲研究进展[J].中国动物检疫, 2019, 36(6):62-67.
CAO A L, YU Z F, CHEN Y L, et al.Research progress of furacillin and its metabolite in food of animal origin[J].China Animal Quarantine, 2019, 36(6):62-67.
[4] WICKRAMANAYAKE P U, TRAN T C, HUGHES J G, et al.Simultaneous separation of nitrofuran antibiotics and their metabolites by using micellar electrokinetic capillary chromatography[J].Electrophoresis, 2006, 27(20):4 069-4 077.
[5] 吴烁, 张彪, 张万利, 等.荧光微球免疫层析方法定量检测水产品中四种硝基呋喃代谢物[J/OL].食品科学,2020.https://kns.cnki.net/kcms/detail/11.2206.TS.20201228.1609.026.html.
WU S, ZHANG B, ZHANG W L, et al.Quantitative determination of four nitrofuran metabolites in aquatic products by fluorescence microsphere immunochromatography[J/OL].Food Science,2020.https://kns.cnki.net/kcms/detail/11.2206.TS.20201228.1609.026.html.
[6] VASS M, DIBLIKOVA I, CERNOCH I, et al.ELISA for semicarbazide and its application for screening in food contamination[J].Analytica Chimica Acta, 2008, 608(1):86-94.
[7] O′MAHONY J, MOLONEY M, MCCONNELL R I, et al.Simultaneous detection of four nitrofuran metabolites in honey using amultiplexing biochip screening assay[J].Biosensors & Bioelectronics, 2011, 26(10):4 076-4 081.
[8] 魏涯, 岑剑伟, 郝淑贤, 等.高效液相色谱法测定池塘底泥中呋喃西林的研究[J].南方水产科学, 2014, 10(1):71-77.
WEI Y, CEN J W, HAO S X, et al.HPLC determination of nitrofurazone in sediment of aquacutue pond[J].Journal of Southern Fisheries Science, 2014, 10(1):71-77.
[9] TANG T, WEI F D,WANG X, et al.Determination of semicarbazide in fish by molecularly imprinted stir bar sorptive extraction coupled with high performance liquid chromatography[J].Journal of Chromatography B, 2018, 1 076:8-14.
[10] 中华人民共和国农业部. 农业部783号公告-1—2006 水产品中硝基呋喃类代谢物残留量的测定液相色谱-串联质谱法[S].北京:中国标准出版社,2006.
Ministry of Agriculture of the People′s Republic of China.Announcement No.783 of the Ministry of Agriculture-1—2006 Determination of nitrofuran metabolite residues in aquatic products by liquid chromatography-tandem mass spectrometry[S].Beijing:China Standard Press,2006.
[11] KAUFMANN A, BUTCHER P, MADEN K, et al.Determination of nitrofuran and chloramphenicol residues by high resolution mass spectrometry versus tandem quadrupole mass spectrometry[J].Analytica Chimica Acta, 2015, 862:41-52.
[12] ALDEEK F, HSIEH K C, UGOCHUKWU O N, et al.Accurate quantitation and analysis of nitrofuran metabolites, chloramphenicol, and florfenicol in seafood by ultrahigh-performance liquid chromatography-tandem mass spectrometry:Method validation and regulatory samples[J].Journal of Agricultural and Food Chemistry, 2018, 66(20):5 018-5 030.
[13] VALERA-TARIFA N M, PLAZA-BOLA OS P, ROMERO-GONZáLEA R, et al.Determination of nitrofuran metabolites in seafood by ultra high performance liquid chromatography coupled to triple quadrupole tandem mass spectrometry[J].Journal of Food Composition and Analysis, 2013, 30(2), 86-93.
OS P, ROMERO-GONZáLEA R, et al.Determination of nitrofuran metabolites in seafood by ultra high performance liquid chromatography coupled to triple quadrupole tandem mass spectrometry[J].Journal of Food Composition and Analysis, 2013, 30(2), 86-93.
[14] KIM D, KIM B, HYUNG S W, et al.An optimized method for the accurate determination of nitrofurans in chicken meat using isotope dilution-liquid chromatography/mass spectrometry[J].Journal of Food Composition and Analysis, 2015, 40:24-31.
[15] BARTOSZ S, ANDRZEJ P, MARTA G, et al.New method of analysis of nitrofurans and nitrofuran metabolites in different biological matrices using UHPLC-MS/MS[J].Journal of Veterinary Research, 2018, 62(2):161-166.
[16] 李攻科, 杜甫佑, 肖小华.微波辅助萃取技术在中药现代化中的应用[J].精细化工, 2007, 24(12):1 184-1 191.
LI G K, DU F Y, XIAO X H.Application of microwave-assisted extraction in the modernization of chinese traditional medicine[J].Fine Chemicals, 2007, 24(12):1 184-1 191.
[17] 尹怡, 张宏峰, 刘书贵, 等.微波辅助衍生-液相色谱-串联质谱法快速测定养殖水体中5种硝基呋喃类代谢物残留[J].质谱学报, 2016, 37(2):106-113.
YIN Y, ZHANG H F, LIU S G, et al.Determination of nitrofuran metabolites in fishery water by microwave assisted derivatization and liquid chromatography-tandem mass spectrometry[J].Journal of Chinese Mass Spectrometry Society, 2016, 37(2):106-113.
[18] LUO X Z, YU Y X, KONG X J, et al.Rapid microwave assisted derivatization of nitrofuran metabolites for analysis in shrimp by high performance liquid chromatography-fluorescence detector[J].Microchemical Journal, 2019, 150: 104189.
[19] 曹爱玲, 陈怡琳, 蔡路昀, 等.不同烘干温度对甲壳类水产品中氨基脲检出量的影响[J].中国动物检疫, 2020, 37(1):94-99.
CAO A L, CHEN Y L, CAI L Y, et al.The effects of different drying temperatures on the detectable amount of semicarbazide in crustacean aquatic products[J].China Animal Health Inspection, 2020, 37(1):94-99.
[20] 李剑, 陈泽暖, 蔡楠.超高效液相色谱-串联质谱法快速检测水产品中硝基呋喃类代谢物残留研究[J].江苏调味副食品, 2019, 36(1):34-37;44.
LI J, CHEN Z N, CAI N.Ultra high performance liquid chromatography-rapid determination of nitrofuran metabolites in aquatic products by tandem mass spectrometry[J].Jiangsu Condiment and Subsidiary Food, 2019, 36(1):34-37;44.