β-胡萝卜素是自然界中广泛存在的天然色素。β-胡萝卜素具有多种生理功能,被广泛应用于功能性食品中[1]。由于β-胡萝卜素属于脂溶性物质,难溶于水,人体直接摄入的β-胡萝卜素通常吸收性差,生物利用率低,并且β-胡萝卜素极其不稳定,对光、氧和热敏感,易被降解和异构化,从而使β-胡萝卜素的生物活性大大降低,限制了其在医药、食品、化妆品等领域的应用。为了提高β-胡萝卜素的水溶性、稳定性以及生物利用率,在过去的几十年里,人们对其进行了大量的研究。将β-胡萝卜素封装到合适的递送载体中是提高其水溶性、稳定性以及生物利用率的有效方法。目前,主要应用的运载体系有脂质体、乳液、β-环糊精、微胶囊以及固体脂质纳米颗粒等。本文综述了近年来利用不同体系运载β-胡萝卜素的研究进展。
1 β-胡萝卜素简介
1.1 β-胡萝卜素的结构与性质
β-胡萝卜素是一种四萜烯类化合物,是最重要的类胡萝卜素之一,分子式为C40H56,相对分子质量为536.88,分子结构式如图1所示。β-胡萝卜素主要由2个紫罗兰酮环和多个共轭烯烃双键构成,属于多烯色素。β-胡萝卜素在室温下呈结晶状,是一种暗红色粉末,稀溶液呈橙色或黄色,略有臭味,不溶于水,易溶于二硫化碳、二氯甲烷及三氯甲烷等有机溶剂,微溶于乙醚、石油醚和环己烷。β-胡萝卜素对光、氧及热很敏感,容易被降解。β-胡萝卜素具有较高的维生素A活性,其维生素A活性在类胡萝卜素中位列第一[2]。
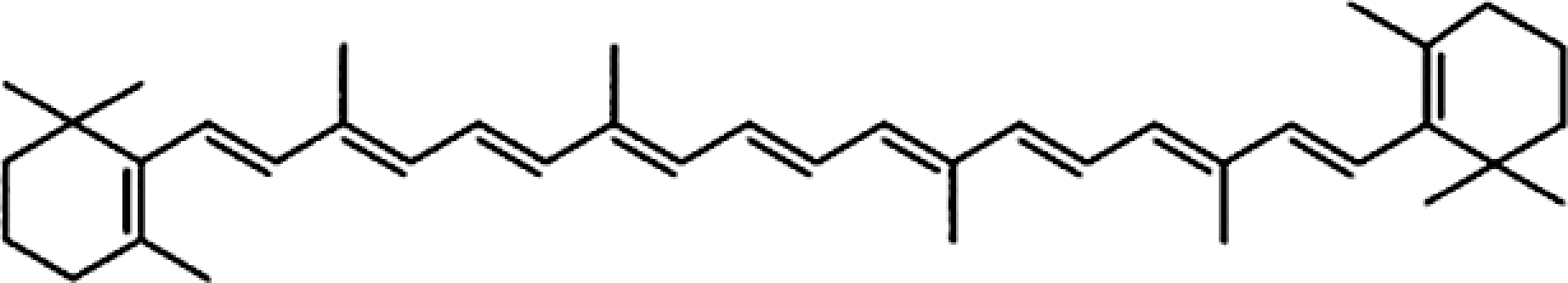
图1 全反式β-胡萝卜素的分子结构式
Fig.1 Molecular structural formula of all-trans β-carotene
1.2 β-胡萝卜素的生理功能
β-胡萝卜素具有抗氧化性、抗癌、增强免疫力以及提高繁殖性能等生理功能。β-胡萝卜素中所含的共轭双键能够吸收未配对的电子,可以有效清除人体内的自由基和活性氧[3];其还能抑制皮肤中脂肪过氧化物的生成,增强皮肤弹性[4],可以作为口服防晒霜。β-胡萝卜素能通过抑制细胞周期进程和影响细胞间信号传递,如抑制癌细胞增殖或诱导癌细胞凋亡等达到抗癌的效果,其还能通过多种途径从蛋白或者核酸的水平来影响机体免疫系统,增强机体免疫力。研究表明,摄入一定量的β-胡萝卜素有益于人体健康,例如可预防黄斑变性、白内障或心血管疾病等[5-7]。给动物饲喂一定量的β-胡萝卜素还能达到提高动物繁殖性能的目的[8-9]。此外,作为活性最高的维生素A前体物质,β-胡萝卜素还具有抗炎、保护视力、促进细胞分裂等生理功能。β-胡萝卜素的多种生理功能使其成为人类饮食中重要的营养素之一。
1.3 β-胡萝卜素的生物利用率
β-胡萝卜素的生物利用率是指摄入的β-胡萝卜素可用于生理功能的部分所占比例。研究表明,一个健康的成年人对日常饮食中摄取的β-胡萝卜素的吸收率只有14%左右[10]。全反式β-胡萝卜素与顺式β-胡萝卜素相比更不容易溶解,生物利用率更低[11]。人体吸收β-胡萝卜素通常是在小肠阶段进行的,β-胡萝卜素进入人体经胃肠消化后到达小肠,通过被动扩散被小肠吸收[12]。因此,人们常采用体外消化试验来评价β-胡萝卜素的生物利用率[13]。为了提高β-胡萝卜素的水溶性、稳定性以及生物利用率,研究者采用多种手段将β-胡萝卜素进行包埋[14],一方面能防止其被氧化降解,增强水溶性和稳定性,另一方面还能将其输送到易于人体吸收的特定位置,提高生物利用率。
2 体系运载β-胡萝卜素
2.1 脂质体运载β-胡萝卜素
脂质体是由磷脂组成的球状双分子层或多层囊泡,粒径通常控制在1 000 nm内,低于100 nm的一般称纳米脂质体。由于其独特的性质,如控释性能、生物相容性和保护作用等,常被用作药物输送系统[15]。
MORAES等[16]通过喷雾干燥法得到的β-胡萝卜素脂质体粉末在真空下冷藏贮存60 d后,β-胡萝卜素的降解率不足10%,显著提高了β-胡萝卜素的贮存稳定性。TAN等[17]用薄膜蒸发法制备了β-胡萝卜素纳米脂质体,并对其DPPH自由基清除率、铁离子还原能力以及脂质过氧化抑制能力进行测定,研究发现脂质体包埋后的β-胡萝卜素抗氧化能力显著增强,同时还发现β-胡萝卜素的载入提高了脂质体的稳定性,二者之间存在着协同保护作用。TONIAZZO等[18]向负载β-胡萝卜素的脂质体中加入黄原胶和瓜尔豆胶,研究发现这2种混合物可显著提高脂质体在贮藏过程中的稳定性,3个月后被包埋的β-胡萝卜素的保留率依然高达90%。郑景霞[19]制备了β-胡萝卜素-薏苡仁油复合脂质体,发现复合脂质体较普通脂质体分散更均匀、抗氧化能力更强,用果胶和壳聚糖对脂质体修饰后还提高了β-胡萝卜素的贮藏稳定性和缓释作用。
脂质体不仅可以运载脂溶性物质,还可以运载水溶性物质,特殊的结构使其具有较强的细胞亲和力,能被很好地吸收利用。此外,脂质体的粒径小、电位绝对值高、靶向性能好以及包封率高,并且油脂含量低,还可根据需求调控其囊泡的大小。脂质体的诸多优点使它得到了广泛的应用,但是也存在一定的缺点,如脂质体在贮藏过程中极易受外界影响而发生沉淀,在食品行业的应用依然受到一定的限制。
2.2 乳液运载β-胡萝卜素
乳液即一相液体以微小液滴状态分散于另一相液体中形成的非均相液体分散系,一般由3部分组成:连续相、分散相和乳化剂。过去乳液运载功能因子主要应用在医药领域,近年来随着保健食品的发展,乳液在运载食品功能因子方面得到了广泛的研究与应用[20]。
FU等[21]将β-胡萝卜素包裹在由小麦面筋纳米颗粒-黄原胶复合物形成的生物聚合物颗粒稳定的皮克林乳液中,发现其贮藏稳定性高于单独使用小麦面筋纳米颗粒稳定的乳液。ZHONG等[22]研究发现用燕麦分离蛋白-平菇β-葡聚糖偶联物稳定的水包油乳状液包埋后的β-胡萝卜素在胃肠中的稳定性和生物利用率均得到有效提高。GASA-FALCON等[23]分别用乳铁蛋白、海藻酸钠和ε-聚-L-赖氨酸层层包埋β-胡萝卜素制成3层乳液,与单层乳液(乳铁蛋白)和双层乳液(乳铁蛋白、海藻酸钠)相比,3层乳液包埋后β-胡萝卜素的生物利用率更高。HAN等[24]将β-胡萝卜素包埋在由扇贝性腺分离蛋白制备的乳状液中,提高了β-胡萝卜素的稳定性,然后又将这种乳液包埋在藻酸钙微珠中,β-胡萝卜素的稳定性进一步得到了提高。
将β-胡萝卜素制成乳液不仅能提高水溶性,还可以提高生物利用率,且制备方法也较为简便。但是乳液在贮藏期间容易发生奥氏熟化现象,出现絮凝和分层[25],不利于长时间保存。
2.3 β-环糊精包合物运载β-胡萝卜素
β-环糊精是一种由多个葡萄糖单元构成的低聚糖,呈环状分子结构。这种结构的内表面具有疏水性,能够携带一些香料、色素等有机物,而外表面具有亲水性,可溶于水。有研究利用这一特点将脂溶性芯材嵌入到β-环糊精的疏水空腔内,可达到提高芯材水溶性的目的[26]。
简云飞等[27]制备了β-胡萝卜素/β-环糊精包合物,通过一系列表征确认两者形成的包合物非常稳定。
ARIKAN等[28]研究发现β-环糊精可将β-胡萝卜素成功地输送到体外培养的动物细胞内。周叶红等[29]分别用β-环糊精及改性后的β-环糊精(2-羟丙基-β-环糊精、磺丁基醚-β-环糊精)包埋β-胡萝卜素,发现包埋后均提高了β-胡萝卜素的稳定性和抗氧化能力,且经改性后的β-环糊精包埋形成的包合物使β-胡萝卜素的水溶性提高了12倍以上。NIU等[30]用辛烯基琥珀酸酐对β-环糊精进行改性,发现经改性后的β-环糊精包埋后,β-胡萝卜素的物理稳定性和氧化稳定性均得到提高;与未改性的β-环糊精相比较,改性后的β-环糊精制备的包合物的粒径更小、Zeta电位的绝对值更高。
据文献[31]报道,β-环糊精与芯材可形成稳定的包合物,对芯材起到了良好的保护效果。但β-环糊精的水溶性差,直接作为载体运载的效果并不理想,可以通过改性生成衍生物,或引入新基团提高水溶性。
2.4 微胶囊运载β-胡萝卜素
微胶囊是一种将固体、液体或气体包埋后封存在微型容器或包埋物内,形成微小粒子的保护技术,可以在保留芯材物质原有特性的基础上实现其缓慢释放、瞬间释放或持久保存[32]。
JAIN等[33]观察到用阿拉伯胶与乳清分离蛋白(whey protein isolation,WPI)制成的β-胡萝卜素微胶囊在具备有良好外观形貌的同时还可起到缓释的作用。孙瑞瑞[34]用阿拉伯胶和明胶制备的β-胡萝卜素微胶囊可明显提高其贮藏稳定性及生物利用率。白丽娜等[35]用WPI和半乳糖的美拉德反应产物 (MRPs)制备的β-胡萝卜素微胶囊具有较好的表面结构和较小的粒径,热稳定性也表现良好。JIANG等[36]发现以WPI和半乳糖的美拉德反应产物为原料制备的β-胡萝卜素微胶囊提高了β-胡萝卜素的贮存稳定性,且效果优于以WPI和半乳糖为原料制备的β-胡萝卜素微胶囊。THAKUR等[37]采用酪蛋白和瓜尔豆胶通过复合凝聚技术制备了β-胡萝卜素油性分散体微胶囊,并观察到这种微胶囊的表面形貌比较均匀,然后将制备的微胶囊进行冻干,发现冻干后仍保留了β-胡萝卜素的功能结构,体外模拟实验显示β-胡萝卜素能完好地到达胃肠中,证实了此方法适合口服。
微胶囊能够有效提高β-胡萝卜素的稳定性,但是其粒径偏大,容易残留有机物,可通过开发新型壁材和改进工艺来满足不同的需求。
2.5 固体脂质纳米颗粒运载β-胡萝卜素
固体脂质纳米颗粒是由天然存在或人工合成的固态类脂为载体,将药物镶嵌于类脂核或黏附于类脂表面制备而成的固体胶粒给药系统[38]。固体脂质纳米颗粒具有生物相容性好、易降解等特性,是一种发展前景良好的新型给药系统的载体[39]。
MEHRAD等[40]用含有棕榈酸和玉米油的固体脂质纳米颗粒包埋β-胡萝卜素,并用WPI进行稳定,发现其稳定性得到了提高,并且包埋物的氧化稳定性也得到了改善。JAIN等[41]以单硬脂酸甘油酯和明胶作为原料包埋β-胡萝卜素,制备成的固体脂质纳米颗粒可提高其生物利用率和抗癌特性。OLIVEIRA等[42]分别以天然和游离的酪蛋白酸钠为表面活性剂制备了固体脂质纳米颗粒,研究发现用游离酪蛋白酸钠稳定的β-胡萝卜素纳米颗粒表现出更好的防止生物活性降解的保护作用。ABREU-MARTINS等[43]发现固体脂质纳米颗粒中含有高浓度氢化棕榈油比含有硬脂酸甘油酯消化慢,但对于β-胡萝卜素的生物利用率来说,前者比后者高。这说明可通过调配固体脂质相满足不同的需求,为寻找具有最佳生物活性的输送系统提供了新思路。
固体脂质纳米颗粒不仅有较好的靶向性能,而且毒性较低,适合规模化生产。但是这种方法没有脂质体的包埋率高,而且类脂的物理状态较为复杂,油相容易结晶,真正投入生产还有待进一步改进技术。
2.6 其他体系运载β-胡萝卜素
除了以上介绍的载体以外,固体分散体、凝胶、胶束以及纳米结构脂质等也可以运载β-胡萝卜素。ISHIMOTO等[44]利用热熔技术将β-胡萝卜素制备成的固体分散体可大大提高其水溶性。CUI等[45]将β-胡萝卜素加入到含有不同含量的单甘油酯的有机凝胶中,发现在一定范围内,β-胡萝卜素的保留率随着单甘油酯含量的增加而升高,还发现有机凝胶有望为亲脂性生物活性物质提供更高的负载量和稳定性。BOCKUVIENE等[46]通过机械化学方法将β-胡萝卜素和壳寡糖制备成复合物,发现该络合作用可提高β-胡萝卜素的水溶性,并且不会降低β-胡萝卜素自由基的清除能力,为进一步开发出亲脂性和不稳定化合物的新型递送系统提供了依据。纳米结构脂质载体是在固体脂质纳米颗粒的基础上研发的第二代脂质纳米颗粒,相比具有载药量高、稳定性好等优点。HEJRI等[47]使用溶剂扩散法制备的含有β-胡萝卜素的纳米结构脂质载体不仅有较小的粒径,而且有效提高了β-胡萝卜素的稳定性。
3 结论
β-胡萝卜素因其可给人体带来诸多健康效益被广泛研究。作为一种脂溶性化合物,人们为了提高其稳定性、水溶性以及生物利用率,将β-胡萝卜素包埋在各种微/纳米载体中,目前虽然已有多种包埋方法将其成功包埋,并达到了一定效果,但都处在理论阶段,并且在试验阶段用到的是体外消化模型,并没有进行临床试验,能否真正达到理论的效果还有待进一步验证。此外,现有的包埋技术虽然在某方面提高了β-胡萝卜素的功能性,但是也存在一定的弊端,例如乳液的稳定性较差,β-环糊精的水溶性不理想,固体脂质纳米颗粒的包埋率较低并且成本较高等。对现有的运载体系技术进行改进,优化工艺,开发新型的包埋技术,真正实现β-胡萝卜素的高效利用是未来研究的重点方向。
[1] 赵延福, 张慧, 李慧, 等.天然类胡萝卜素功能性产品的开发和应用[J].中国食品添加剂, 2017(8):154-159.
ZHAO Y F, ZHANG H, LI H, et al.Development and application of natural carotenoids functional products[J].China Food Additives, 2017(8):154-159.
[2] S NCHEZ C, BARANDA A B, MARA
NCHEZ C, BARANDA A B, MARA
 N D I M.The effect of high pressure and high temperature processing on carotenoids and chlorophylls content in some vegetables[J].Food Chemistry, 2014, 163:37-45.
N D I M.The effect of high pressure and high temperature processing on carotenoids and chlorophylls content in some vegetables[J].Food Chemistry, 2014, 163:37-45.
[3] 范晓岚, 杨军, 糜漫天, 等.β-胡萝卜素的抗氧化作用与疾病预防[J].中国公共卫生, 2003, 19(4):479-480.
FAN X L, YANG J, MI M T, et al.The antioxidative effect of β-carotene and disease prevention[J].Chinese Journal of Public Health, 2003, 19(4):479-480.
[4] HEINRICH U, NEUKAM K, TRONNIER H, et al.Long-term ingestion of high flavanol cocoa provides photoprotection against uv-induced erythema and improves skin condition in women[J].The Journal of Nutrition, 2006, 136(6):1 565-1 569.
[5] WEI Y, SUN C X, DAI L, et al.Structure, physicochemical stability and in vitro, simulated gastrointestinal digestion properties of β-carotene loaded zein-propylene glycol alginate composite nanoparticles fabricated by emulsification-evaporation method[J].Food Hydrocolloids, 2018, 81:149-158.
[6] 顾学裘, 张永恒, 吴玉波, 等.β-胡萝卜素具有防癌功效的机制[J].哈尔滨医科大学学报, 1996, 30(4):403-404.
GU X Q, ZHANG Y H, WU Y B, et al.β-carotene has anti-cancer effect mechanism[J].Journal of Harbin Medical University, 1996, 30(4):403-404.
[7] HU X M, WHITE K M, JACOBSEN N E, et al.Inhibition of growth and cholesterol synthesis in breast cancer cells by oxidation products of β-carotene[J].The Journal of Nutritional Biochemistry, 1998, 9(10):567-574.
[8] 卢建军. β-胡萝卜素在动物繁殖机能上的作用[J].中国饲料, 1999(3):19.
LU J J.The function of β-carotene in animal reproduction[J].China Feed, 1999(3):19.
[9] 冯俊, 邓斐月, 余燕玲, 等.微囊化β-胡萝卜素对妊娠母猪繁殖、免疫和抗氧化功能的影响[J].浙江大学学报(农业与生命科学版), 2009, 35(6):665-669.
FENG J, DENG F Y, YU Y L, et al.Effects of β-carotene microcapsules on reproducibility, immunity and antioxidant capability in late-pregnancy sows[J].Journal of Zhejiang University (Agriculture and Life Sciences), 2009, 35(6):665-669.
[10] HASKELL M J.The challenge to reach nutritional adequacy for vitamin A:β-Carotene bioavailability and conversion:Evidence in humans[J].American Journal of Clinical Nutrition, 2012, 96(5):1 193S-1 203S.
[11] O′SULLIVAN L, GALVIN K, AISLING A S, et al.Effects of cooking on the profile and micellarization of 9-cis-, 13-cis- and all-trans-β-carotene in green vegetables[J].Food Research International, 2010, 43(4):1 130-1 135.
[12] PARKER R S.Absorption, metabolism, and transport of carotenoids[J].The FASEB Journal, 1996, 10(5):542-551.
[13] GARRETT D A, FAILLA M L, SARAMA R J.Development of an in vitro digestion method to assess carotenoid bioavailability from meals[J].Journal of Agricultural and Food Chemistry, 1999, 47(10):4 301-4 309.
[14] 薛露, 彭珍, 关倩倩, 等.β-胡萝卜素包埋产品的制备与性能分析[J].饮料工业, 2020, 23(2):26-31.
XUE L, PENG Z, GUAN Q Q, et al.Preparation and characterization analysis of β-carotene-embedded products[J].Beverage Industry, 2020, 23(2):26-31.
[15] PANJA S, KHATUA D K, HALDER M.Effect of casein on pure lecithin liposome:Mixed biomacromolecular system for providing superior stabilization to hydrophobic molecules[J].Colloids and Surfaces B:Biointerfaces, 2019, 180:298-305.
[16] MORAES M, CARVALHO J M P, SILVA C R, et al.Liposomes encapsulating beta-carotene produced by the proliposomes method:Characterisation and shelf life of powders and phospholipid vesicles[J].International Journal of Food Science & Technology, 2013, 48(2):274-282.
[17] TAN C, XUE J, ABBAS S, et al.Liposome as a delivery system for carotenoids:Comparative antioxidant activity of carotenoids as measured by ferric reducing antioxidant power, DPPH assay and lipid peroxidation[J].Journal of Agricultural and Food Chemistry, 2014, 62(28):6 726-6 735.
[18] TONIAZZO T, BERBEL I F, CHO S, et al.β-carotene-loaded liposome dispersions stabilized with xanthan and guar gums:Physico-chemical stability and feasibility of application in yogurt[J].LWT - Food Science and Technology, 2014, 59(2):1 265-1 273.
[19] 郑景霞. β-胡萝卜素-薏苡仁油复合脂质体的制备及功能特性研究[D].南昌:南昌大学, 2018.
ZHENG J X.Preparation and functional properties of β-carotene-coix seed oil composite liposomes[D].Nanchang:Nanchang University, 2018.
[20] 杨佳, 王宇, 张君慧.类胡萝卜素乳液及其应用研究进展[J].农产品加工, 2017(20):75-77;82.
YANG J, WANG Y, ZHANG J H.Research progress in production and application of carotenoids emulsion[J].Farm Products Processing, 2017(20):75-77;82.
[21] FU D W, DENG S M, MCCLEMENTS D J, et al.Encapsulation of β-carotene in wheat gluten nanoparticle-xanthan gum-stabilized pickering emulsions:Enhancement of carotenoid stability and bioaccessibility[J].Food Hydrocolloids, 2019, 89:80-89.
[22] ZHONG L, MA N, WU Y L, et al.Gastrointestinal fate and antioxidation of β-carotene emulsion prepared by oat protein isolate-Pleurotus ostreatus β-glucan conjugate[J].Carbohydrate Polymers, 2019, 221:10-20.
[23] GASA-FALCON A, ACEVEDO-FANI A, OMS-OLIU G, et al.Development, physical stability and bioaccessibility of β-carotene-enriched tertiary emulsions[J/OL].Journal of Functional Foods, 2020, 64.https://doi.org/10.1016/j.jff.2019.103615.
[24] HAN J R, ZHANG Z P, SHANG W H, et al.Modulation of physicochemical stability and bioaccessibility of β-carotene using alginate beads and emulsion stabilized by scallop (Patinopecten yessoensis) gonad protein isolates[J/OL].Food Research International, 2020, 129.https://doi.org/10.1016/j.foodres.2019.108875.
[25] MAO L K, MIAO S.Structuring food emulsions to improve nutrient delivery during digestion[J].Food Engineering Reviews, 2015, 7(4):439-451.
[26] 周怡平. β-环糊精包埋β-胡萝卜素的研究[D].大连:大连理工大学, 2005.
ZHOU Y P.Study on the inclusion compound of β-carotene with β-cyclodextrin[D].Dalian: Dalian University of Technology, 2005.
[27] 简云飞, 张海容.β-胡萝卜素与β-环糊精包合物的制备与表征[J].化学研究与应用, 2017, 29(8):1 183-1 187.
JIAN Y F, ZHANG H R.Preparation and characterization of β-carotene and β-cyclodextrin inclusion complex[J].Chemical Research and Application, 2017, 29(8):1 183-1 187.
[28] ARIKAN  , RODWAY R G.Effect of cyclodextrin-encapsulated β-carotene on progesterone production by bovine luteal cells[J].Animal Reproduction Science, 2000, 64(3):149-160.
, RODWAY R G.Effect of cyclodextrin-encapsulated β-carotene on progesterone production by bovine luteal cells[J].Animal Reproduction Science, 2000, 64(3):149-160.
[29] 周叶红, 马学文, 梁文婷, 等.β-环糊精及衍生物与β-胡萝卜素包合物性质[J].应用化学, 2016, 33(7):827-833.
ZHOU Y H, MA X W, LIANG W T, et al.Preparation and physicochemical properties of the inclusion complexes of β-carotene with β-cyclodextrin and its derivatives[J].Chinese Journal of Applied Chemistry, 2016, 33(7):827-833.
[30] NIU H, CHEN W J, CHEN W X, et al.Preparation and characterization of a modified-β-cyclodextrin/β-carotene inclusion complex and its application in pickering emulsions[J].Journal of Agricultural and Food Chemistry, 2019, 67(46):12 875-12 884.
[31] 王晓平, 廖工铁, 侯世祥.β-环糊精衍生物研究进展[J].华西药学杂志,1992, 7(2):100-103.
WANG X P, LIAO G T, HOU S X.Research progress on the β-cyclodextrin derivatives[J].West China Journecl of Pharmaceutical Sciences, 1992, 7(2):100-103.
[32] 肖晨晨, 高洁, 李红艳, 等.微胶囊技术的研究进展[J].科学技术创新, 2019(29):36-37.
XIAO C C, GAO J, LI H Y, et al.Research progress on the microcapsulary[J].Science and Technology Innovation, 2019(29):36-37.
[33] JAIN A, THAKUR D, GHOSHAL G, et al.Microencapsulation by complex coacervation using whey protein isolates and gum Acacia:an approach to preserve the functionality and controlled release of β-carotene[J].Food and Bioprocess Technology, 2015, 8(8):1 635-1 644.
[34] 孙瑞瑞. 紫苏β-胡萝卜素的超临界CO2萃取及其微胶囊产品的研究[D].哈尔滨: 东北农业大学, 2017.
SUN R R.Research on extraction of Perilla frutescens β-carotene by supercritical CO2 and its microencapsulation[D].Harbin: Northeast Agricultural University, 2017.
[35] 白丽娜, 李桐, 王春燕, 等.以MRPs为壁材的β-胡萝卜素微胶囊化及其产品特性[J].中国食品学报, 2018, 18(2):93-101.
BAI L N, LI T, WANG C Y, et al.The Microencapsulation of β-carotene as wall material of mrps and the characteristic of the products[J].Journal of Chinese Institute of Food Science and Technology, 2018, 18(2):93-101.
[36] JIANG Z M, BAI L N, YANG N, et al.Stability of β-carotene microcapsules with Maillard reaction products derived from whey protein isolate and galactose as coating materials[J].Journal of Zhejiang University-SCIENCE B, 2017, 18(10):867-877.
[37] THAKUR D, JAIN A, GHOSHAL G, et al.Microencapsulation of β-carotene based on casein/guar gum blend using zeta potential-yield stress phenomenon:An approach to enhance photo-stability and retention of functionality[J].AAPS PharmSciTech, 2017, 18(5):1 447-1 459.
[38] 郭童林, 王翠, 沈丽霞.固体脂质纳米粒的研究进展[J].神经药理学报, 2017, 7(6):15-21.
GUO T L, WANG C, SHEN L X.Research progress of solid lipid nanoparticles[J].Acta Neuropharmacologica, 2017, 7(6):15-21.
[39] 梁静茹, 权维燕, 李思东, 等.纳米药物载体在医药领域应用的研究进展[J].山东化工, 2019, 48(19):78-81.
LIANG J R, QUAN W Y, LI S D, et al.Research progress of nano-drug carriers in medicine[J].Shandong Chemical Industry, 2019, 48(19):78-81.
[40] MEHRAD B, RAVANFAR R, LICKER J, et al.Enhancing the physicochemical stability of β-carotene solid lipid nanoparticle (SLNP) using whey protein isolate[J].Food Research International, 2018, 105:962-969.
[41] JAIN A, SHARMA G, THAKUR K, et al.Beta-carotene-encapsulated solid lipid nanoparticles (BC-SLNs) as promising vehicle for cancer:An investigative assessment[J].AAPS PharmSciTech, 2019, 20(3):1-7.
[42] OLIVEIRA D R B, FURTADO G D F, CUNHA R L.Solid lipid nanoparticles stabilized by sodium caseinate and lactoferrin[J].Food Hydrocolloids, 2019, 90:321-329.
[43] ABREU-MARTINS H H D, ARTIGA-ARTIGAS M, PICCOLI R H, et al.The lipid type affects the in vitro digestibility and β-carotene bioaccessibility of liquid or solid lipid nanoparticles[J].Food Chemistry, 2020, 311:1-10.
[44] ISHIMOTO K, MIKI S, OHNO A, et al.β-Carotene solid dispersion prepared by hot-melt technology improves its solubility in water[J].Journal of Food Science and Technology, 2019, 56(7):3 540-3 546.
[45] CUI M N, MAO L K, LU Y, et al.Effect of monoglyceride content on the solubility and chemical stability of β-carotene in organogels[J].LWT, 2019, 106:83-91.
[46] BOCKUVIENE A, SEREIKAITE J.Preparation and characterisation of novel water-soluble β-carotene-chitooligosaccharides complexes[J/OL].Carbohydrate Polymers, 2019, 225.https://doi.org/10.1016/j.carbpol.2019.115226.
[47] HEJRI A, KHOSRAVI A, GHARANJIG K, et al.Optimisation of the formulation of β-carotene loaded nanostructured lipid carriers prepared by solvent diffusion method[J].Food Chemistry, 2013, 141(1):117-123.