灰树花(Grifola frondosa)是一种名贵的药食用真菌,以子实体或菌丝体作为食用部分,具有多种活性功能[1-2],如抗氧化[3]、降血糖[4]、降血脂、抗肿瘤[5]、清除重金属[6],并且含有较为丰富的生物活性物质,如灰树花多糖、多酚、甾醇类、萜类等活性成分[2,7]。传统灰树花固态培养主要是利用木屑、稻草以及农作物副产品作为生长基质,灰树花采收后,菌糠则被丢弃,造成很大的资源浪费及环境污染。开发一种新型的灰树花生长基质,并完全利用其发酵基质,具有很高的研究价值[8]。本研究通过前期的实验将已优化的苦荞、薏仁米等各种基质的比例作为灰树花发酵基质进行实验。苦荞作为西南地区一种药食同源谷物,富含黄酮类物质,其芦丁含量极高[9-10],薏仁米富含薏仁酯、薏仁素和丰富的淀粉物质[11-12],两者可以作为灰树花发酵基质,为灰树花的生长提供碳氮源。
天麻(Rhizoma gastrodiae)是一种名贵中药[2,13],富含天麻素(p-hydroxymethylphenyl-β-D-glucopyranoside,GA)、对羟基苯甲醇(p-hydroxybenzyl alcohol,HA)、对羟基苯甲醛(p-hydroxylbenzaldehyde,HBA)、巴利森苷(parishin),具有很高的药理功效[14-15]。课题组前期试验验证了添加一定比例的天麻提取物参与灰树花液态深层发酵能够显著地促进灰树花胞外多糖的分泌及生物量的增加以及分解利用天麻成分进行生物转化[16-20]。本研究将中药天麻以不同比例的添加量参与灰树花的固态发酵,旨在进一步丰富和拓展中药资源与食用菌共发酵以及两者之间相互影响、生物转化的研究前景以及中药菌质产品的食药价值。
1 材料与方法
1.1 材料与试剂
灰树花(菌种编号5404),中国普通微生物菌种保藏管理中心;天麻,贵州大方;苦荞,贵州威宁;薏仁米,贵州兴仁;GA对照品、HA对照品、HBA对照品、巴利森苷对照品、芦丁对照品、异槲皮苷对照品,北京索莱宝生物科技有限公司;Al(NO3)3、NaNO2,上海阿拉丁试剂有限公司;其余试剂均为市售分析纯;斜面培养基为马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基。
1.2 仪器与设备
BXM-30R型立式灭菌锅、恒温培养箱,上海博讯实业有限公司医疗设备厂;SW-CJ-1D型净化工作台,苏州净化设备有限公司;TGL-20M型台式高速冷冻离心机,长沙迈佳森仪器设备有限公司;CTFD-12S型真空冷冻干燥机,青岛永合创信电子科技有限公司;Agilent 1100型高效液相色谱仪及检测器、Agilent 5TC-C18型色谱柱,美国Agilent公司。
1.3 实验方法
1.3.1 灰树花固态发酵培养基配制流程
灰树花固态发酵培养基配制流程如图1所示。

图1 灰树花固态发酵培养基配制流程图
Fig.1 Flow chart of preparation of Grifola frondosa
solid fermentation medium
1.3.2 灰树花菌种培养方法
1.3.2.1 斜面种子培养
从母种试管中挑取黄豆粒大小菌丝块接种于PDA培养皿中部,25 ℃恒温培养,至菌丝长满整个斜面,转置4 ℃保存。
1.3.2.2 发酵培养
培养基成分组成:苦荞粉4.5 g;苦荞皮1.5 g;薏仁米1.5 g;麸皮0.4 g;葡萄糖0.1 g;
天麻粉:天麻烘干,超微粉碎机打碎成天麻粉,过60目筛。分别按照培养基质量分数的0%、10%、20%、30%、40%、50%加入到发酵培养基中参与固态发酵。
将上述材料混匀加水,置于灭菌锅中灭菌(121 ℃、30 min),培养基降低到室温,接入灰树花菌种于培养基中,放入恒温恒湿培养箱中进行生长发酵12 d(25 ℃)。
1.3.3 发酵基质的处理
发酵基质在恒温恒湿培养箱中培养12 d后,将其进行真空冷冻干燥,干燥之后的发酵物超微粉碎并过80目筛,收集粉末,置于-20 ℃条件下保存,作为实验材料。
1.4 分析方法
1.4.1 总黄酮含量的测定
精确称取0.4 g菌粉,加入20 mL 50%的乙醇中,常温摇晃提取1 h,8 000 r/min离心10 min,取上清液,作为待测样品溶液。采用NaNO2、Al(NO3)3显色法测量,总黄酮含量以芦丁当量表示。
1.4.2 GA、HA、HBA、巴利森苷含量的测定[2]
1.4.2.1 色谱条件
色谱柱:Agilent 5TC-C18型色谱柱(250 mm×4.6 mm,5 μm);洗脱程序:0~35 min(0%~30% B),35~40 min(30%~100% B),40~45 min(100%~3% B);流动相:0.1%的磷酸水(D)、乙腈(B);流速:1 mL/min;检测波长:221 nm;柱温:30 ℃。
1.4.2.2 样品溶液的配制
精确称取0.5 g发酵粉末,加入10 mL 75%乙醇,常温浸提12 h,8 000 r/min离心10 min,取上清液作为待测样品溶液,按照上述HPLC条件进行GA、HA、HBA、巴利森苷含量的测定,将各种物质的峰面积代入标准曲线,得到各种物质的含量。
1.4.3 芦丁、异槲皮苷含量的测定[21]
1.4.3.1 色谱条件
流动相:0.02%的磷酸水、乙腈;流速:1 mL/min;检测波长:360 nm;柱温:30 ℃;等度洗脱:V(乙腈)∶V(0.02%磷酸水)=20∶80。
1.4.3.2 样品溶液的配制
精确称取0.5 g发酵粉末,加入10 mL甲醇,常温浸提12 h,8 000 r/min离心10 min,取上清液作为待测样品溶液,按照上述HPLC条件进行芦丁、异槲皮苷含量的测定,将各种物质的峰面积分别代入标准曲线,得到各种物质的含量。
1.5 数据处理与分析
所有的数据使用Origin 10软件画图,使用SPSS 19.0软件进行数据分析。实验数据以平均值±标准偏差表示(n=3),使用单因素方差分析(ANOVA)和配对t 检验进行显著性分析,P<0.05表示数据具有显著性差异。
2 结果与分析
2.1 灰树花固态发酵不同时间形态及表观结构的变化
图2为灰树花在未添加天麻培养基上的生长变化。在生长7 d时,灰树花菌丝体基本铺满培养基,且菌丝颜色亮白,联结致密,说明灰树花能够在基质上进行正常的生长,此种培养基未对灰树花的生长产生抑制作用。图3为发酵组和未发酵组在不同时间菌质的表观形态图。由图3可知,在发酵组,随着灰树花发酵时间的延长,基质结构产生大量细微的孔隙,在发酵终点时,基质由外到内均产生了较大的孔隙,结构近乎崩解,相比于发酵组,未发酵组基质在0~12 d的表观结构形态均未发生明显的变化,结构均较为完整致密。对比两者基质的表观结构,说明经灰树花发酵,对基质结构产生了显著的崩解作用,通过对基质结构的破坏,使得基质的营养物质更容易析出,增加了菌丝体与基质的接触面积,有利于菌丝体更好地吸收利用营养物质以供自身的生长代谢。

图2 不同生长时间灰树花在基质上的菌丝体变化
Fig.2 The change of mycelium of G.frondosa in the
substrate at different days

图3 发酵组和未发酵组基质不同时间的扫描电镜
Fig.3 Scanning electron microscopy of substrates in fermented and
unfermented groups at different days
2.2 不同天麻添加量对灰树花发酵基质总黄酮含量的影响
如图4所示,通过相同天麻添加比例,不同接菌方式[一组为未发酵组(未接菌),一组为发酵组(接菌)],对比每组总黄酮含量,结果表明灰树花在生长发酵的同时能够分解总黄酮,使得总黄酮含量明显降低。天麻参与灰树花固态发酵能够一定程度的促进灰树花分解总黄酮,在天麻添加量分别为10%、20%、30%、40%、50%(质量分数)时,相比于空白组(0%)分解总黄酮的能力分别提高了1.05、1.24、1.2、1.3和1.01倍。此结果验证了灰树花能够在以苦荞为主要基质的培养基进行正常的生长,是由于其能够对基质中富含的总黄酮类物质进行分解代谢提供自身的生长需求。同时也验证了添加一定比例的天麻参与灰树花发酵能够一定程度的促进其分解代谢总黄酮的能力。通过提高总黄酮类物质的分解能力,提高大分子黄酮类物质转化为小分子黄酮苷类物质,并且增加其水溶性和分子利用程度,进而提高菌质食药用价值。

a-天麻添加量0%;b-天麻添加量10%;c-天麻添加量20%;d-天麻添加量30%;e-天麻添加量40%;f-天麻添加量50%
图4 不同天麻添加量对发酵基质总黄酮含量的影响
Fig.4 The effect of different proportions of R.gastrodiae on the total flavonoids content of fermentation substrate
注:**示与未发酵组相比,具有显著性差异(P<0.01)(下同)
2.3 不同天麻添加量对灰树花发酵基质芦丁及异槲皮苷含量的影响
由图4和图5研究结果可知,以苦荞为主要发酵基质,灰树花会对总黄酮类物质进行分解。为进一步探究对灰树花发酵基质中总黄酮类物质中具体成分含量的影响,采用HPLC对基质中芦丁和异槲皮苷进行含量检测(图6),结果表明在发酵12 d后,发酵基质中芦丁和异槲皮苷的含量均有不同程度的降低。由图7可知,随着天麻添加量的增加,发酵基质中芦丁的含量减少程度更高,相比于空白组(0%),在天麻添加量为10%、20%、30%、40%、50%时,芦丁含量降低量分别增加了1.37、1.70、1.03、1.13和4.0倍(P<0.01)。与空白组相比均具有极显著性差异,说明在天麻添加量为50%时,对灰树花分解芦丁具有最大的促进作用;由图8可知,在天麻添加量为分别为20%、30%、40%、50%时,对灰树花分解异槲皮苷具有极显著地促进作用,相比于空白组(0%),对异槲皮苷的降低量分别提高了1.06、1.09、1.08和1.08倍(P<0.01)。文献记载,橙皮苷酶可以将芦丁有效地转化为异槲皮苷[21],在此次实验中,分别对同一基质中的芦丁和异槲皮苷物质进行含量测定,异槲皮苷的含量并未升高,可以排除芦丁含量的减少是由于灰树花分泌的橙皮苷酶将其转化为异槲皮苷,而是灰树花在生长过程中对芦丁进行了分解利用。
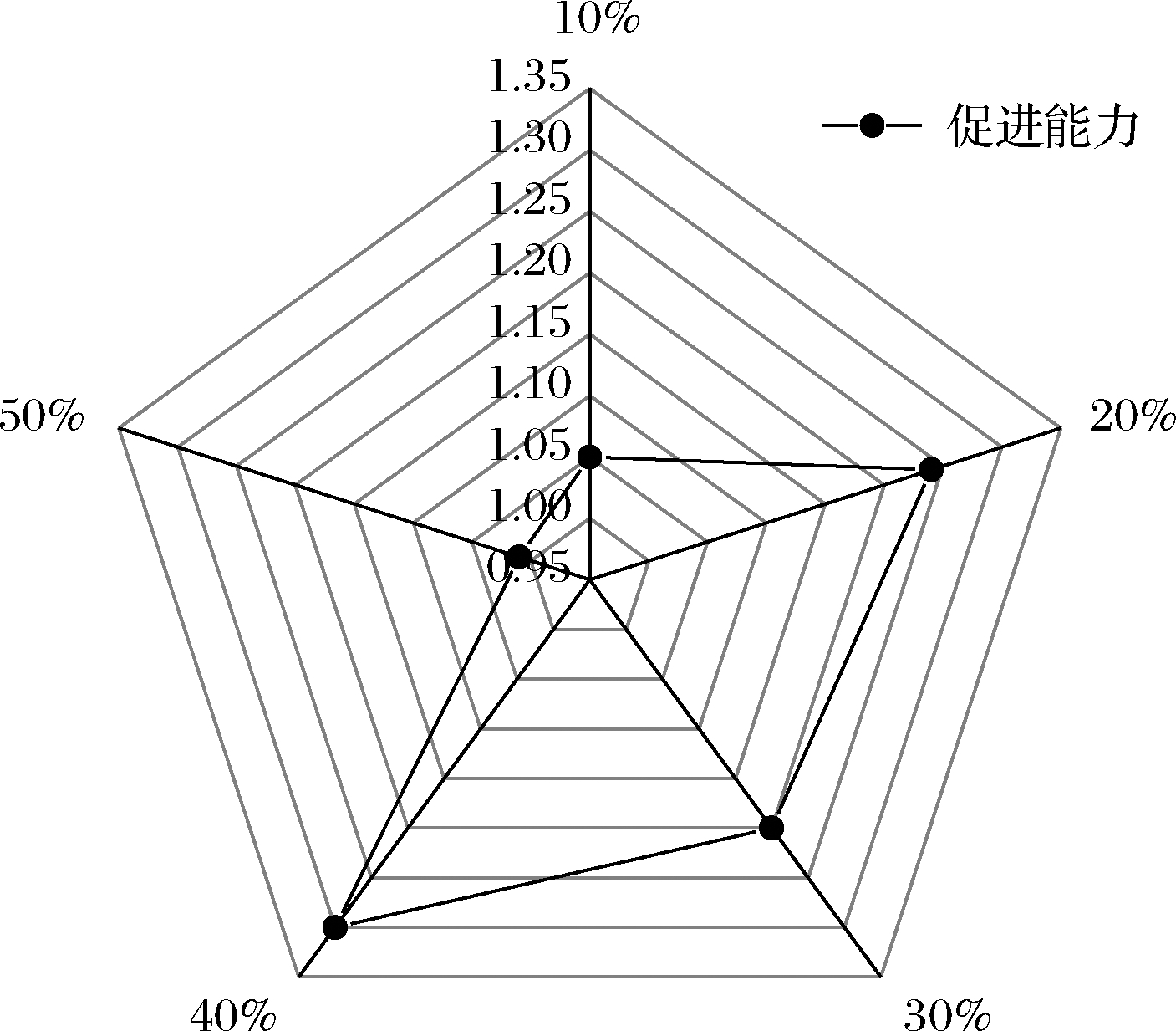
图5 不同天麻添加量对促进灰树花对总黄酮分解
能力的影响
Fig.5 The effect of different proportions of R.gastrodiae on the
promotion of G.frondosa on the decomposition of
total flavonoids

a-芦丁;b-异槲皮苷
图6 芦丁和异槲皮苷的高效液相色谱图
Fig.6 High performance liquid chromatogram of
rutin and isoquercitrin

图7 不同天麻添加量对发酵基质中芦丁降低量的影响
Fig.7 The effect of different proportions of R.gastrodiae on the
reduction of rutin in fermentation substrate
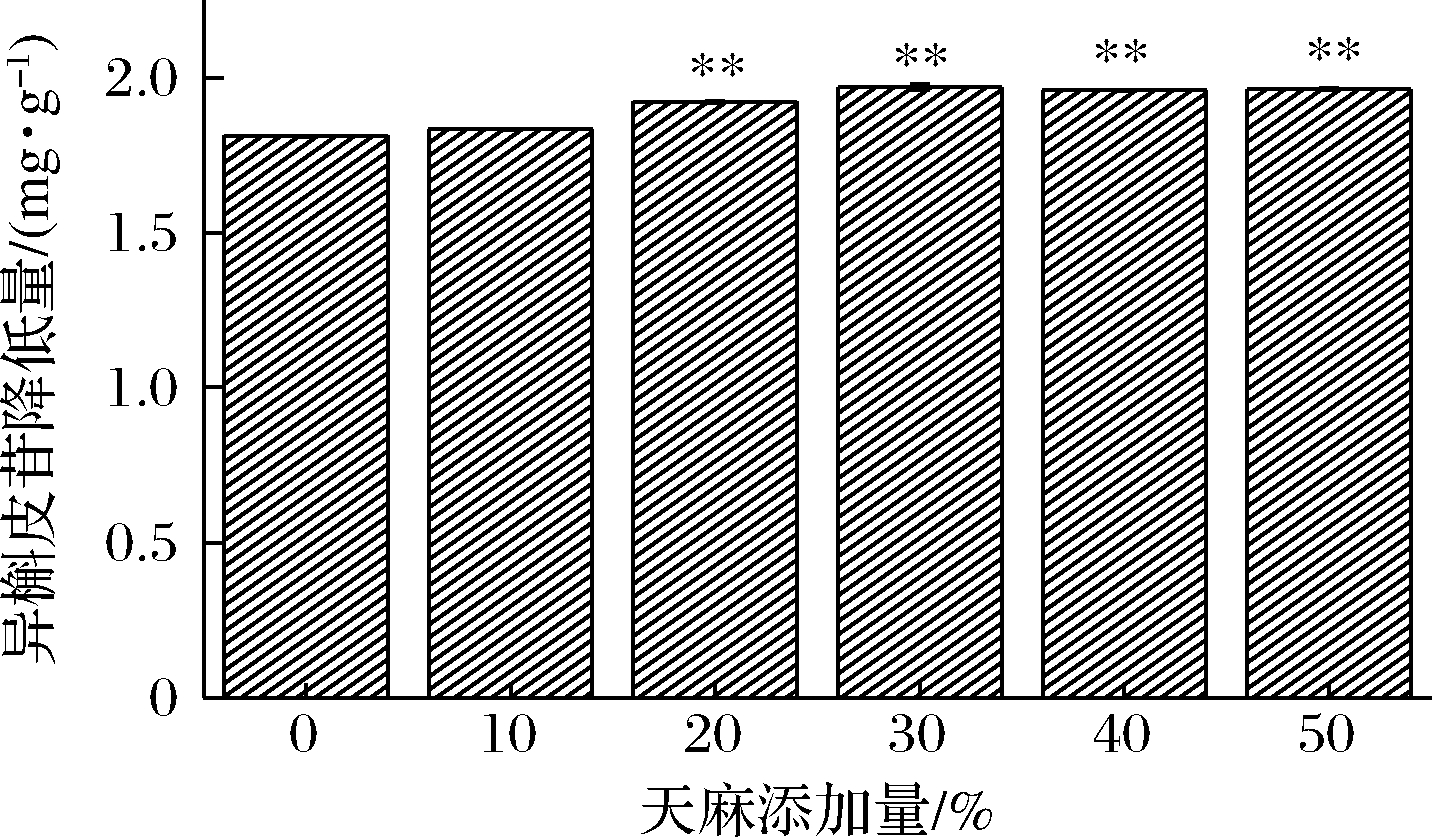
图8 不同天麻添加量对发酵基质中异槲皮苷
降低量的影响
Fig.8 The effect of different proportions of R.gastrodiae on the
reduction of isoquercitrin in fermentation substrate
2.4 灰树花对不同添加量天麻主要成分的影响
微生物在生长代谢的同时会向外界分泌多种胞外酶:如纤维素酶、蛋白酶、淀粉酶等[22-24],分泌的胞外酶会按照各种酶的专一性选择性地分解代谢有机物转化为小分子。灰树花分泌的胞外酶同样可以作用于天麻的成分,选择天麻所含的4种主要成分(GA、HA、HBA、巴利森苷)进行HPLC检测,探究灰树花对天麻4种成分的影响。图9为天麻4种主要成分的混标图,结果表明,在天麻添加量为10%~50%时,与未接种灰树花(未发酵组)相比,接种灰树花(发酵组)能够几乎完全分解GA。由表1可知,在天麻添加量为10%时,灰树花对HA和HBA的分解最为显著,表明高比例的天麻参与灰树花固态发酵能够抑制灰树花对天麻本身对HA和HBA的分解;添加天麻都能够提高巴利森苷的含量,其中50%天麻添加量提高其含量最为显著。表明在天麻参与灰树花固态发酵时,整个发酵体系存在着巴利森苷成分不同程度的生物转化。文献表明在微生物参与谷物进行发酵时,能够改变整个发酵体系的生物活性的种类和含量,进而提高发酵物的食药用价值[25-26]。
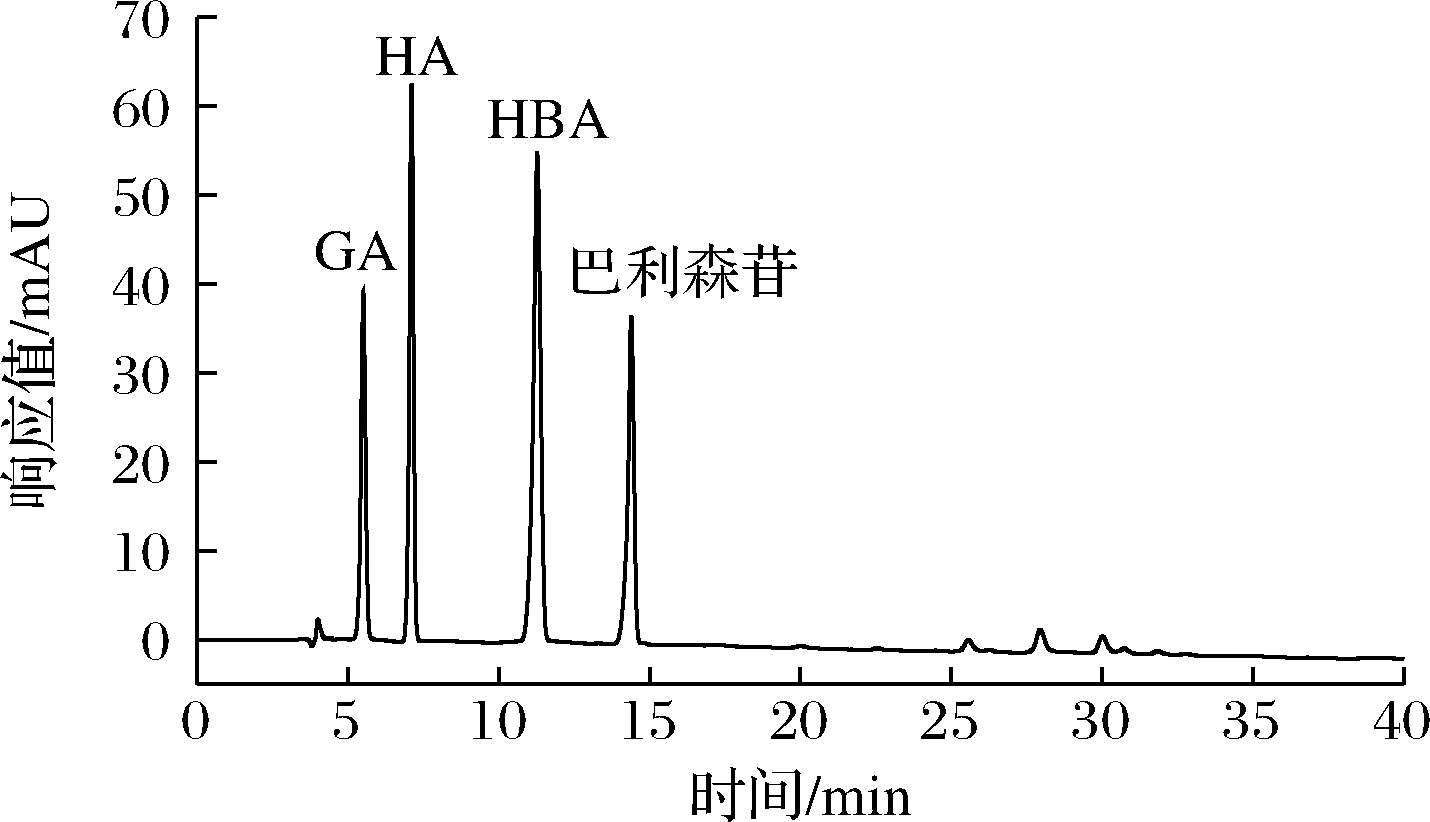
图9 GA、HA、HBA、巴利森苷的标准对照品色谱图
Fig.9 Chromatograms of standard reference substances of
GA, HA, HBA, and parishin
表1 灰树花对不同天麻添加量基质中天麻主要成分的影响
Table 1 Influence of G.frondosa on the main components of
R.gastrodiae in different dosages of R.gastrodiae
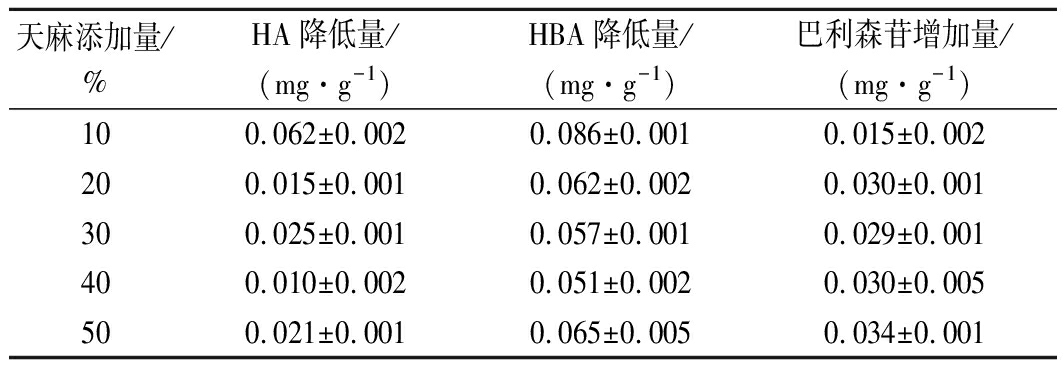
天麻添加量/%HA降低量/(mg·g-1)HBA降低量/(mg·g-1)巴利森苷增加量/(mg·g-1)100.062±0.0020.086±0.0010.015±0.002200.015±0.0010.062±0.0020.030±0.001300.025±0.0010.057±0.0010.029±0.001400.010±0.0020.051±0.0020.030±0.005500.021±0.0010.065±0.0050.034±0.001
3 结论
以贵州特色药食同源作物苦荞、薏仁米等为主要基质,接种灰树花作为发酵菌种,灰树花在此基质上能够正常的生长代谢,灰树花能够有效分解利用苦荞及薏仁米等基质,试研发创新一种新的适合灰树花菌丝体生长的培养基质。以不同比例的中药天麻参与灰树花的固态发酵,研究天麻对发酵基质中主要活性成分含量的影响。结果表明,不同比例的天麻参与固态发酵,对灰树花菌丝体的生长没有明显的抑制作用,同时天麻的加入能够不同程度地促进灰树花对基质中总黄酮物质的分解,通过提高总黄酮类物质的分解能力,提高大分子黄酮类物质转化为小分子黄酮苷类物质,并且增加其水溶性和分子利用程度,进而提高菌质食药用价值,并且灰树花也能够对天麻所含主要成分GA、HA、HBA等物质进行分解,与未发酵组相比都存在不同程度的分解,后期的研究重点主要为总黄酮类和3种主要天麻活性成分的具体转化物质。发酵体系中巴利森苷的含量与未发酵组相比反而有所提高,表明通过灰树花的发酵,可以进行巴利森苷成分的生物合成和富集。试验验证了灰树花在非传统基质上仍然能够进行正常的生长,并且能够分解总黄酮类物质,改变基质的表观和内部结构,天麻参与其发酵能够促进其分解总黄酮类物质。本研究拓展了中药资源与大型真菌共发酵的思路和前景,为创新药物菌质的品种提供了参考。
[1] HE X R, WANG X X, FANG J C, et al.Polysaccharides in Grifola frondosa mushroom and their health promoting properties:A review[J].International Journal of Biological Macromolecules, 2017, 101:910-921.
[2] LU H Y, LOU H H, HU J J, et al.Macrofungi:A review of cultivation strategies, bioactivity, and application of mushrooms[J].Comprehensive Reviews in Food Science and Food Safety, 2020,19(5):2 333-2 356.
[3] ZHANG Z Q, LIU L P, LEI L, et al.Antioxidative and immunomodulatory activities of the exopolysaccharides from submerged culture of hen of the woods or Maitake culinary-medicinal mushroom, Grifola frondosa (Agaricomycetes) by addition of Rhizoma gastrodiae extract and its main components[J].International Journal of Medicinal Mushrooms, 2019,21(8):825-839.
[4] GUO W L, DENG J C, PAN Y Y, et al.Hypoglycemic and hypolipidemic activities of Grifola frondosa polysaccharides and their relationships with the modulation of intestinal microflora in diabetic mice induced by high-fat diet and streptozotocin[J].International Journal of Biological Macromolecules, 2020,153:1 231-1 240.
[5] LIU Z J, JIAO Y C, LU H Y, et al.Chemical characterization, antioxidant properties and anticancer activity of exopolysaccharides from Floccularia luteovirens[J].Carbohydrate Polymers, 2020,229:115 432.
[6] ZHANG W W, JIANG X Z, ZHAO S, et al.A polysaccharide-peptide with mercury clearance activity from dried fruiting bodies of maitake mushroom Grifola frondosa[J].Scientific Reports, 2018,8(1):17 630.
[7] YEH J Y, HSIEH L H, WU K T, et al.Antioxidant properties and antioxidant compounds of various extracts from the edible basidiomycete Grifola frondosa (Maitake)[J].Molecules, 2011,16(4):3 197-3 211.
[8] BAYER E, MCLNTYRE G.Magic mushroom[J].Science, 2009,326(5 959):1 463.
[9] QIN P Y, WANG Q, SHAN F, et al.Nutritional composition and flavonoids content of flour from different buckwheat cultivars[J].International Journal of Food Science & Technology, 2010,45(5):951-958.
[10] BOYLE S, DOBSON V, DUTHIE S, et al.Bioavailability and efficiency of rutin as an antioxidant:A human supplementation study[J].European Journal of Clinical Nutrition, 2000,54(10):774-782.
[11] CHIANG H, LU H F, CHEN Y H, et al.Adlay seed (Coix lacryma-jobi L.) extracts exhibit a prophylactic effect on diet-induced metabolic dysfunction and nonalcoholic fatty liver disease in mice[J].Evidence-Based Complementary and Alternative Medicine, 2020:1-12.DOI:10.1155/2020/9519625.
[12] YIN H M, ZHONG Y D, XIA S K, et al.Effects of fermentation with lactobacillus plantarum NCU137 on nutritional, sensory and stability properties of Coix( Coix lachryma-jobi L.)seed[J].Food Chemistry, 2019, 314:126 037.
[13] 李旭,徐天娇,刘立琨,等.天麻素联合异钩藤碱抑制MPP+诱导的PC12细胞凋亡的抗氧化机制[J].中国中药杂志,2021,46(2):420-425.
LI X, XU T J, LIU L K, et al.Antioxidant mechanism of gastrodin combined with isorhynchophylline in inhibiting MPP+-induced apoptosis of PC12 cells[J].China Journal of Chinese Materia Medica,2021,46(2):420-425.
[14] 田孟华, 袁天军, 周瑞, 等.不同产地及变型天麻有效成分差异性分析[J].中成药, 2020,42(7):1 824-1 829.
TIAN M H, YUAN T J, ZHOU R, et al.Difference analysis of effective constituents in different growing areas and varieties of Gastrodia elata[J].Chinese Traditional Patent Medicine, 2020,42(7):1 824-1 829.
[15] XIAO M M, ZHANG Y Q, WANG W T, et al.Gastrodin protects against chronic inflammatory pain by inhibiting spinal synaptic potentiation[J].Scientific Reports, 2016,6:37 251.
[16] 朱俊杰, 吴天祥, 吴彩云, 等.对羟基苯甲醇对灰树花产胞外多糖的影响及其发酵动力学[J].食品科学, 2016,37(19):123-127.
ZHU J J, WU T X, WU C Y, et al.Effect of p-hydroxybenzyl alcohol on the biosynthesis of exopolysaccharide by submerged culture of Grifola frondosa and fermentation kinetics[J].Food Science,2016,37(19):123-127.
[17] 吴彩云, 吴天祥, 朱俊杰, 等.对羟基苯甲醛等3种天麻成分对灰树花胞外多糖生物合成的影响[J].食品科学, 2016,37(7):83-87.
WU C Y, WU T X, ZHU J J, et al.Effect of p-hydroxylbenzaldehyde and other main ingredients of Rhizoma gastrodiae on the biosynthesis of exopolysaccharide by Grifola frondosa in submerged culture[J].Food Science,2016,37(7):83-87.
[18] 钟敏, 吴天祥, 聂文强, 等.灰树花菌丝体β-葡聚糖提取工艺优化[J].中国酿造, 2017,36(8):90-94.
ZHONG M, WU T X, NIE W Q, et al.Optimization of extraction technology of β-glucan from Grifola frondosa mycelium[J].China Brewing, 2017,36(8):90-94.
[19] 芦红云, 吴天祥, 钟敏, 等.天麻提取物及其3种主要成分对灰树花产胞外漆酶和菌丝体的影响[J].食品科学, 2018,39(6):101-106.
LU H Y, WU T X, ZHONG M, et al.Effect of Rhizoma gastrodiae extract and its three main components on production of laccase and mycelial biomass by submerged fermentation of Grifola frondosa[J].Food Science,2018,39(6):101-106.
[20] WANG J, MA Y L, WU X Y, et al.Selective hydrolysis by commercially available hesperidinase for isoquercitrin production[J].Journal of Molecular Catalysis B:Enzymatic, 2012,81(5):37-42.
[21] WANG J, GONG A, YANG C F, et al.An effective biphase system accelerates hesperidinase-catalyzed conversion of rutin to isoquercitrin[J].Scientific Reports, 2015,5(5):8 682-8 689.
[22] 雷露, 吴天祥, 王川南.天麻和苦荞复配液对灰树花胞外多糖合成的影响及其发酵动力学研究[J].食品科学技术学报, 2020,38(1):53-59.
LEI L, WU T X, WANG C N, et al.Effect of Gastrodia elata and Fagopyrum tataricum compound solution on synthesis of extracellular polysaccharide from Grifola frondosa and its fermentation kinetics[J].Journal of Food Science and Technology,2020,38(1):53-59.
[23] 许玉林, 郑月霞, 叶冰莹, 等.一株纤维素降解真菌的筛选及鉴定[J].微生物学通报, 2013,40(2):220-227.
XU Y L, ZHENG Y X, YE B Y, et al.Isolation and identification of a cellulose degrading fungi[J].Microbiology China,2013,40(2):220-227.
[24] SANJUKTA S, RAI A K, MUHAMMED A, et al.Enhancement of antioxidant properties of two soybean varieties of Sikkim Himalayan region by proteolytic Bacillus subtilis fermentation[J].Journal of Functional Foods, 2015,14:650-658.
[25] LIM N R I, PE
N R I, PE AS E, TORINO M I, et al.Fermentation enhances the content of bioactive compounds in kidney bean extracts[J].Food Chemistry, 2015,172:343-352.
AS E, TORINO M I, et al.Fermentation enhances the content of bioactive compounds in kidney bean extracts[J].Food Chemistry, 2015,172:343-352.
[26] ABD RAZAK D L, ABD RASHID N Y, JAMALUDDIN A, et al.Enhancement of phenolic acid content and antioxidant activity of rice bran fermented with Rhizopus oligosporus and Monascus purpureus[J].Biocatalysis and Agricultural Biotechnology, 2015,4(1):33-38.