根据白酒行业的报告,2019年中国白酒排行前50中,浓香型白酒占比54%,占据了中国白酒的大半江山[1],而浓香型白酒的酿造离不开中高温大曲的参与[2]。大曲俗称“酒之骨”,为中国白酒发酵提供多种微生物。其中,以霉菌和酵母菌为主的真菌,是白酒发酵的重要功能微生物,可以分泌淀粉酶、蛋白酶、纤维素酶等多种酶[3]。传统中高温大曲的生产是自然接种的自发固态发酵过程[4]。在发酵过程中,未经高压灭菌的原料在从原料到成熟大曲的阶段会暴露于许多环境(例如空气、地面等)中[5]。因此,原材料和加工环境都是大曲菌群的重要来源。
随着现代分子技术的发展,研究者可以借助高通量测序技术,进一步深入分析中高温大曲微生物群落结构[6]。杨旭等[7]利用高通量测序技术,发现中高温大曲在发酵开始及结束时,细菌的结构组成变化不大,乳杆菌属(Lactobacillus)是整个大曲制作过程的优势菌属,而当曲温达到顶温时,克罗彭斯特菌属(Kroppenstedtia)成为明显优势菌群。在发酵前期真菌以根霉属(Rhizopus)、假丝酵母属(Candida)及曲霉属(Aspergillus)为主,发酵后期以毛霉属(Mucor)和曲霉属为主。李静心等[8]使用高通量测序技术解析中高温大曲与高温大曲真菌群落的结构差异,发现中高温大曲的真菌以酵母菌为主,霉菌仅占25%左右。其中,东方伊萨酵母(Issatchenkia orientalis)、热带假丝酵母(Candida tropicalis)、阿氏丝孢酵母(Trichosporon asahii)等真菌为中高温大曲所特有。目前利用高通量测序技术解析中高温大曲菌群结构的研究已经大量涌现,极大的扩展我们对于中高温大曲的认识。然而,关于中高温大曲微生物菌群溯源仍缺乏系统性的研究。
针对以上问题,我们以中高温大曲为对象,采用高通量扩增子测序技术解析了大曲制作过程、原料及多种环境中的微生物菌群结构组成,并采用微生物溯源分析手段分析了大曲微生物的来源。这项研究对于认识中高温大曲的微生物来源提供了新见解,为制曲工艺的优化提供了科学参考。
1 材料与方法
1.1 样品采集
样品收集于安徽省某酒厂,选择3个曲房作为平行跟踪采集样本。在大曲制作之前,采集环境样本,分别从室外地面(HSD)、室内空气(HKQ)、室内草席(HCX)、室内墙壁(HQB)、室内曲架(HQJ)、室内屋顶(HWD),6个位置采集环境样品(图1),具体环境样品的采集方法参考DU等[9]的取样方法。大曲样本分别在大曲发酵开始与发酵结束时采集,每个曲房约500 g。原料样本从仓库中随机收集原料样品(500 g)。最后,将所有27个样品,包括6组环境样品、原料样品(YXM)、发酵开始大曲(YQ)、发酵结束大曲(MQ),一式三份转移到冰上的实验室中,并在-80 ℃下保存直至提取DNA。

图1 环境样品采集示意图
Fig.1 Schematic diagram of environmental sample collection
1.2 试剂与仪器
氯化钠、三氯甲烷、乙醇、异戊醇,国药集团化学试剂(北京)有限公司;饱和酚溶液,生工生物工程(上海)股份有限公司。
NanoDrop蛋白核酸测定分光光度计,Thermo FisherScientific公司;高速冷冻离心机,Eppendorf 公司;Illumina MiSeq PE300、HiSeq测序平台,Illumina公司。
1.3 核酸提取及测序
大曲环境及原料样品基因组总DNA提取参考SONG等[10]的方法。使用NanoDrop仪器检测基因组总DNA的浓度,并将提取的基因组DNA贮存在-80 ℃的冰箱中,以进行后续实验。将每个样品的基因组DNA进行3次PCR扩增,PCR反应体系和反应条件参考HERTZ等[11]的方法。混合同一个样本的PCR产物后用2%琼脂糖凝胶电泳检测。然后构建MiSeq文库,并使用Illumina MiSeq PE300测序平台进行测序,以获得样品中微生物群落的扩增子基因序列。
1.4 生物信息学分析
通过QIIME软件分析和处理样品微生物群落的扩增子基因序列,去除质量较差和含嵌合体的序列,并将相似度>97%的序列聚类为1个操作分类单元(operational taxonomic unit,OTU)。通过NCBI BLAST软件将代表性的OTU基因序列与数据库中的序列进行比较,以获得OTU物种信息。然后,通过NCBI的BLAST软件将高质量的基因序列与数据库中的序列进行比较,以获得该基因序列的物种信息。
1.5 数据分析及绘图
统计分析采用 SPSS v.22进行,显著性水平设定在0.05;Source Tracker(0.9.8)用于预测大曲中微生物群落的来源[12];采用Origin 9.0绘图,Adobe Illustrator CC 2019进行图片整合。
2 结果与分析
2.1 大曲、原料及制作环境的微生物多样性分析
本研究通过丰富度指数(Chao1)、系统发育多样性指数(phylogenetic diversity (PD) whole tree)评价大曲、原料与环境的微生物多样性。如图2所示,在环境样品中,室外地面中微生物的多样性最高,室内屋顶中微生物的多样性最低。我们发现从曲房室外到曲房室内环境样品中微生物的多样性都是逐渐降低的,因此得出从曲室外到曲室内是微生物菌种选择富集的过程。
图2-a、图2-b表明发酵结束时大曲中的细菌多样性比发酵开始时显著提高(P<0.05),也高于环境样品及原料。从发酵开始到发酵结束,大曲细菌群落的多样性增加。而图2-c、图2-d表明,发酵结束时大曲中的真菌多样性低于发酵开始时的真菌多样性。其中,细菌多样性的变化与DU等[9]关于中温大曲的研究结果一致,而真菌多样性的变化则与之相反,这可能是不同品温大曲制作过程中环境差异导致[13]。
2.2 细菌属水平分析
高通量测序显示所有样品(大曲、原料及环境样品)中在细菌属水平共检测到461个属,大曲(发酵开始及发酵结束的大曲)中检测到338个属。其中,发酵结束时大曲中可检测到334个属,发酵开始大曲中仅有111个属,而123个属仅在制曲原料或环境样品中能检测到。
为了进一步分析大曲中细菌微生物群落,本研究将大曲、环境及原料中相对丰度>4%的属定义为优势属,得到其属水平信息如图3-a所示,大曲、制曲原料及环境中的细菌主要归属于19个属,且不同样品中占据主要丰度的细菌几乎均不相同。其中,环境样品中室外地面检测到的细菌以考克氏菌属[Kocuria,(17.44±0.05)%]为主;在室内空气和室内曲架检测到的细菌以链霉属(Streptomyces)为主,分别占(40.66±0.37)%、(79.40±0.01)%;室内草席检测到的细菌中葡萄球菌属[Staphylococcus,(58.32±0.01)%]的丰度最高;室内墙壁检测到的细菌以放线孢菌属[Actinomycetospora,(41.51±0.14)%]为主;室内屋顶检测到的细菌糖多孢菌属[Saccharopolyspora,(66.36±0.19)%]的丰度最高。而原料中检测到的细菌拟诺卡氏菌属[Nocardiopsis,(53.15±0.17)%]的丰度最高。早期研究表明,葡萄球菌属、拟诺卡氏菌属等在多种大曲中都有报道,是大曲中重要的功能细菌属[14]。同时,中高温大曲的生产原料主要以小麦为主,大部分不添加陈曲[15],因此制曲环境在中高温大曲的制作过程中起着至关重要的作用。
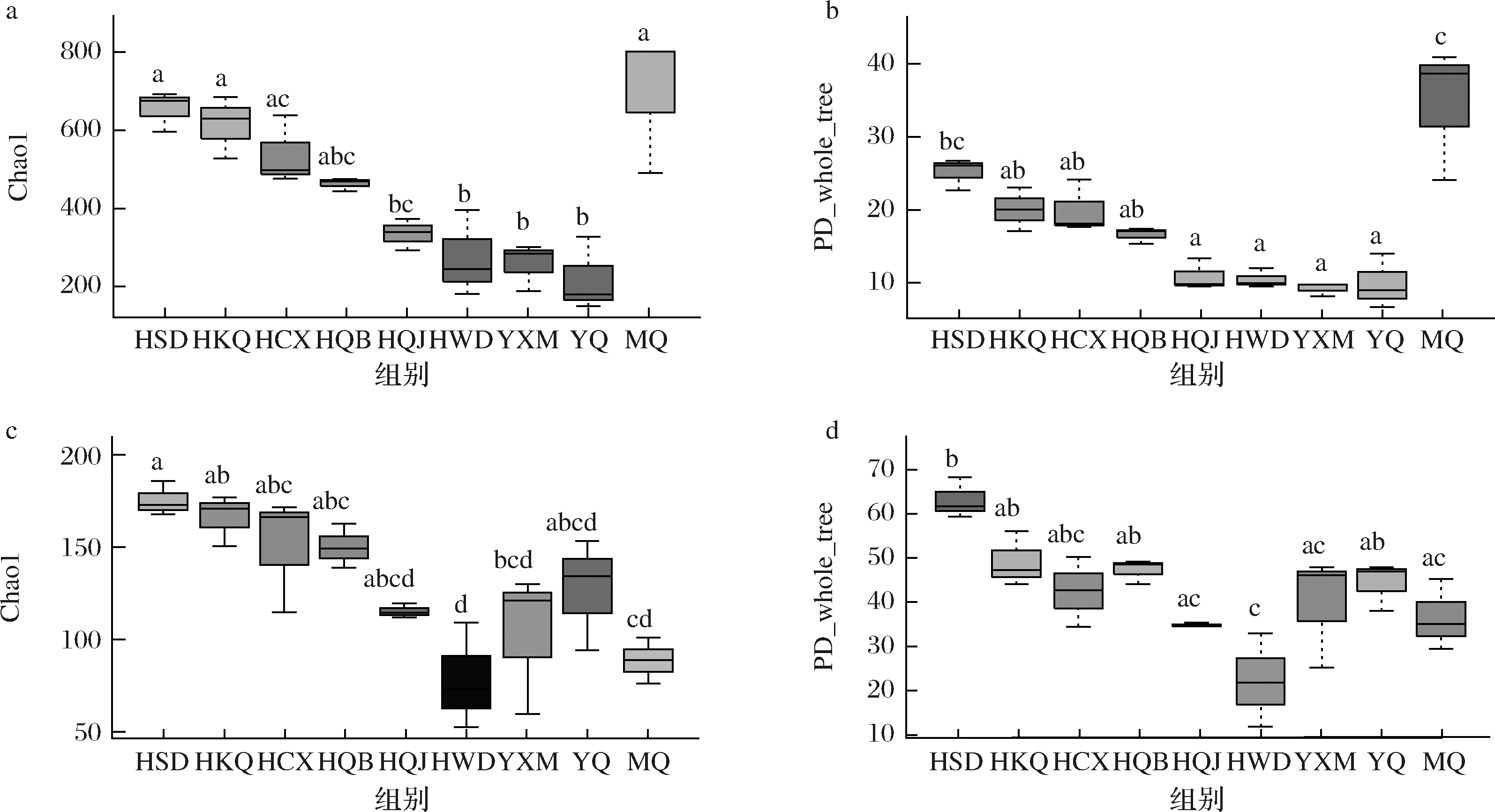
a、b-细菌的alpha多样性;c、d-真菌的alpha多样性
图2 大曲、原料及制作环境微生物的多样性
Fig.2 The diversity of microorganisms in Daqu, raw materials and environmental samples
注:图中不同小写字母表示具有显著性差异(P<0.05)
在发酵开始时大曲检测到的细菌以魏斯氏菌属[Weissella,(44.57±0.09)%]为主,发酵结束时大曲中细菌则以乳杆菌属[(24.47±0.13)%]为主。这种变化可能是大曲制作过程中曲中含水量、酸度、温度等理化性质变化对微生物的筛选作用导致的[16]。此外,发酵结束时大曲中魏斯氏菌属[(3.32±0.12)%]、芽孢杆菌属[(1.102±0.01)%]、葡萄球菌属(Staphylococcus,(0.3272±0.02)%)等也占据较高的丰度,而已有研究表明乳杆菌属、葡萄球菌属、芽孢杆菌属、魏斯氏菌属等是大曲中重要的功能细菌[17]。其中葡萄球菌属可代谢产生3-甲基-1-丁醇及乙偶姻等多种风味物质,为白酒中风味物质提供合成前体[18]。乳杆菌属、魏斯氏菌属等可代谢产生乳酸、乙酸等多种有机酸,这些物质在白酒中是重要的风味成分[14]。而芽孢杆菌属能代谢淀粉酶、蛋白酶等多种水解酶,在维持大曲生态平衡中起着重要作用[19]。同时我们发现,海命菌属(Marivita)、原绿球藻(Prochlorococcus)仅在发酵开始和发酵结束的大曲中检测到,其他环境样品及原料均未发现,可能来源于大曲用水。
为更直观地说明大曲与原料及制曲环境中细菌的关系,本研究分别通过基于weighted UniFrac距离的主坐标分析(principal coordinate analysis,PCoA)和基于Bray-Curtis距离的层次聚类分析(hierarchical clustering analysis,HCA)进一步表征它们的关系(图3-b,图3-c)。PCoA结果显示前2个坐标轴可代表细菌群落的44.29%,而且PCoA与HCA分析结果与群落结构结果一致,室内草席、室内空气、室外地面、室内墙壁细菌群落距离较近,室内曲架、室内屋顶的细菌群落距离较近,发酵开始大曲与原料的细菌群落距离较近,而发酵结束大曲与其他任何样品都距离较远。因此,我们推测原料是发酵开始大曲中细菌群落的主要来源,经过大曲的制作过程,发酵开始时大曲中的细菌逐渐演替为发酵结束时大曲中的细菌。
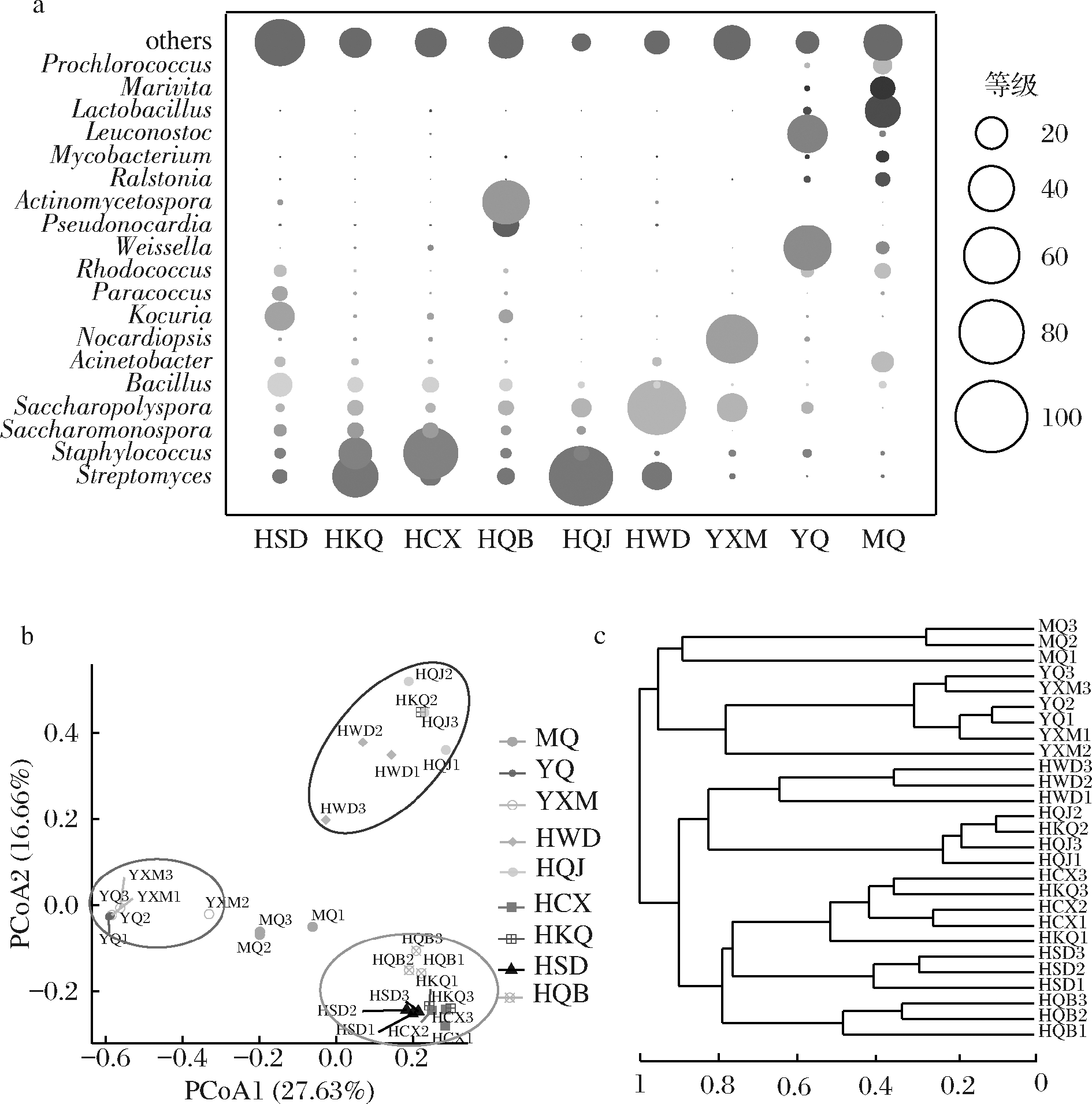
a-属水平大曲优势细菌分布(平均丰度>4%);b-基于weighted
UniFrac距离的细菌主坐标分析;c-细菌层次聚类分析
图3 大曲、原料及环境样品细菌群落结构
Fig.3 Bacterial community compositions of Daqu,
raw materials and environmental samples
注:图a中圆大小根据平均丰度的开方值设置(图4同)
2.3 真菌属水平分析
高通量测序显示所有样品中在真菌属水平共检测到69个属,大曲中可检测到31个属。其中发酵结束大曲中可检测到31个属,发酵开始大曲中仅有25个属,多的6个属则可能来自制曲环境或者原料。已有研究共检测到中温大曲真菌79个属[9],这可能是中高温大曲与中温大曲制作环境与程序差异导致的。
由于真菌属水平数量较少,为和上文细菌优势属数目一致,本研究将大曲、环境及原料中相对丰度>2%的属定义为优势种属,得到其水平信息如图4-a所示,曲霉属和根霉属,在所有样品中均占据极高的丰度。而早期研究证明,根霉属和曲霉属可以代谢产生大量的高活性蛋白酶和葡糖淀粉酶,为大曲中酶的主要来源[20]。在发酵开始时大曲中曲霉属[(39.14±0.21)%]、假丝酵母属[(6.39±0.31)%]、根霉属[(0.3739±0.01)%]为优势真菌属。这与杨旭等[7]解析的河南地区中高温大曲发酵前期结果相似,都以假丝酵母属、根霉属和曲霉属为主。在发酵结束时,大曲中除了根霉属[(30.65±0.53)%]、假丝酵母属[(23.68±0.11)%]、曲霉属[(12.9±0.32)%]之外,嗜热子囊菌属[Thermoascus,(23.96±0.01)%]也逐渐成为优势真菌属。其中,假丝酵母属真菌可以代谢产生乙酸乙酯、4-羟基-2丁酮等多种风味物质,是白酒发酵中的重要功能微生物[21]。以前的研究表明,在河南地区的中高温大曲处于发酵后期时,真菌以毛霉属和曲霉属为主[7],这可能是两地区制曲用水及原料不同导致的。同时与其他样品中某一种真菌占据高的丰度相比,在发酵结束时大曲检测到的真菌结构较为均匀,这说明在大曲制作过程中真菌微生物发生了生物筛选。
使用PCoA与HCA分析结果进一步表明大曲、原料及环境中检测到的真菌群落分布规律(图4-b、图4-c)。室内草席、室内空气、室外地面、室内曲架的真菌群落结构较为相似;而与室内墙壁、室内的真菌群落结构存在较大差异。
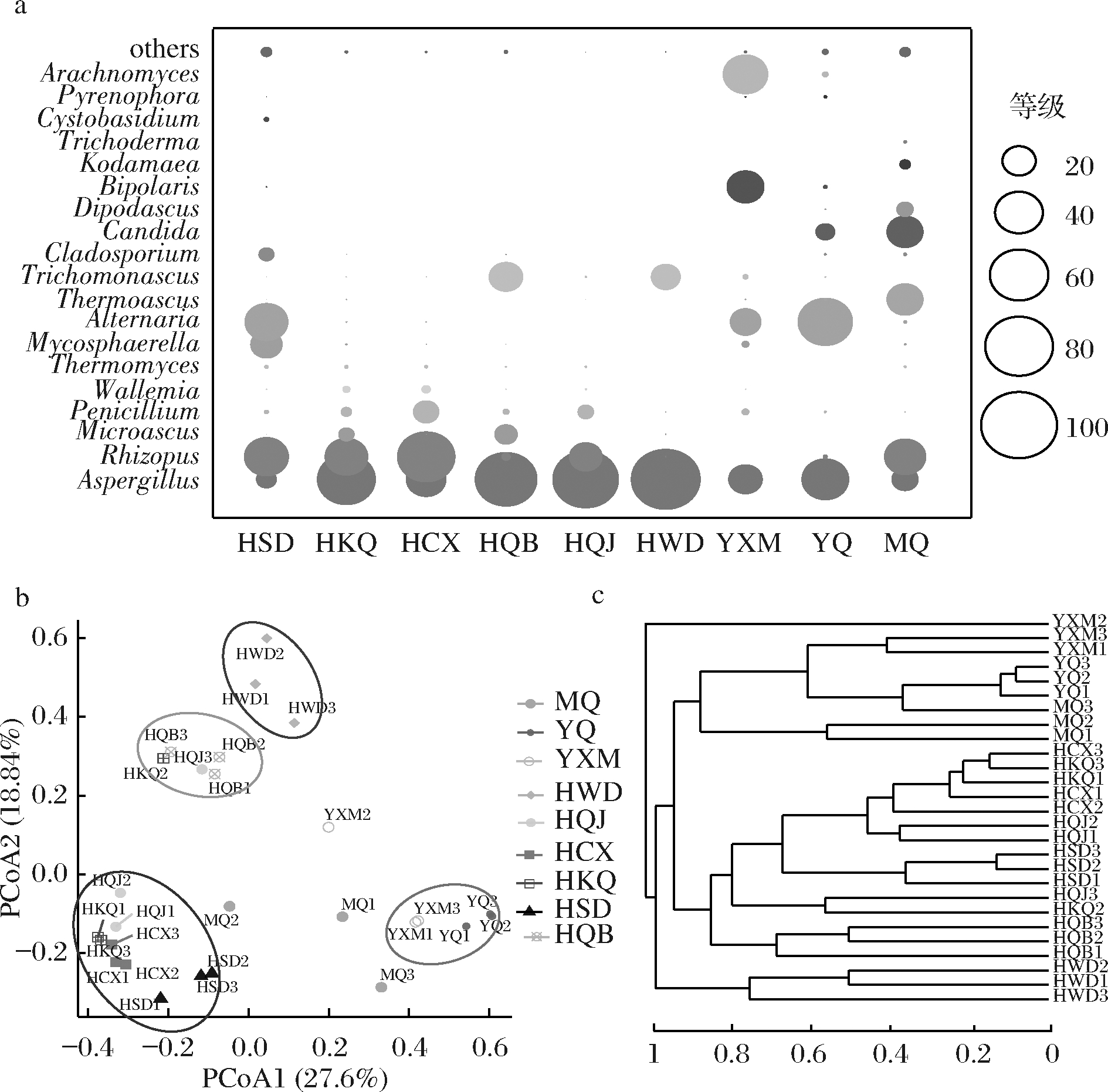
a-属水平大曲优势真菌分布(平均丰度>2%);b-基于weighted
UniFrac距离的真菌主坐标分析;c-真菌层次聚类分析
图4 大曲、制曲原料及环境真菌群落结构
Fig.4 Fungal community compositions of Daqu,
raw materials and environmental samples
2.4 大曲中的优势微生物来源分析
利用SourceTracker,以大曲生产的原料及制曲环境的优势属微生物为来源端,以发酵开始时大曲的优势属微生物为接受端,追踪发酵开始大曲中微生物的来源,并依此判断发酵开始时大曲中微生物的来源(图5)。
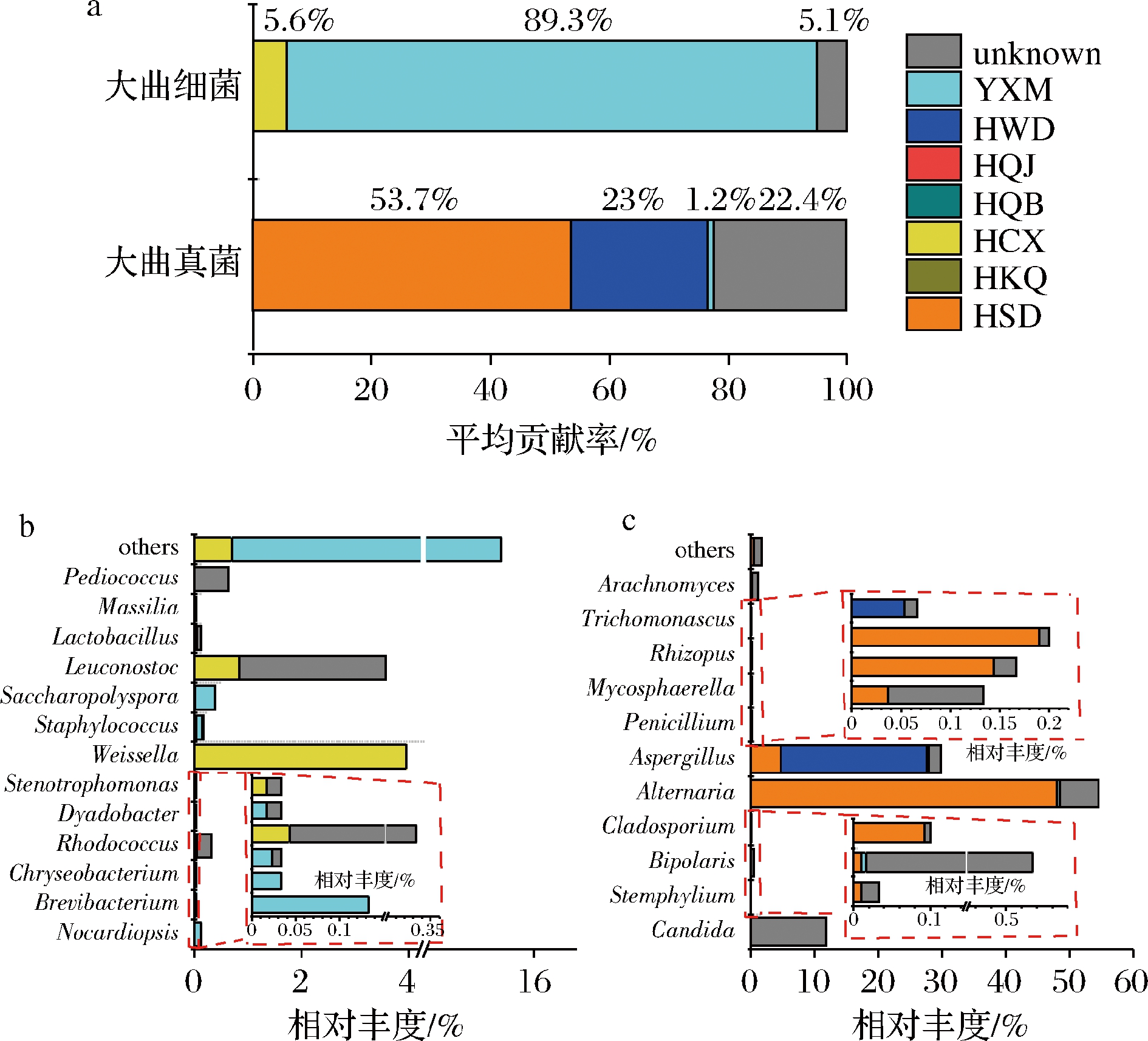
a-发酵开始大曲微生物不同来源分析;b-发酵开始大曲细菌的
溯源分析;c-发酵开始大曲真菌的溯源分析
图5 发酵开始大曲优势微生物溯源分析
Fig.5 Source tracking analysis of dominant microorganisms
in new Daqu
图5-a显示,发酵开始时大曲中细菌89.3%来自于原料小麦。其中原料是发酵开始时大曲中糖多孢菌属、葡萄球菌属、拟诺卡氏菌属、短杆菌属等的主要来源(图5-b)。早期研究表明,这些细菌在小麦内生菌中也是主要的种群[22]。同时,室内草席还对发酵开始时大曲中细菌贡献了5.6%。其中,室内草席是魏斯氏菌属、串珠菌(Leuconostoc)等的主要来源。以上分析结果表明,制曲原料是发酵开始大曲中细菌主要来源,而制曲的环境对细菌贡献较少。
发酵开始大曲中的真菌主要来自于室外地面,贡献了53.7%的微生物(图5-c)。其中,发酵开始大曲中链格孢属(Alternaria)、枝孢菌(Cladosporium)、根霉属等真菌主要来源于室外地面。此外,发酵开始大曲中的真菌23%来源于室内屋顶。其中,发酵开始大曲中曲霉属、Trichomonascus等主要来源于室内屋顶。以上分析结果表明,制曲的环境是发酵开始大曲中真菌主要来源,而原料对真菌的贡献不大。
3 结论
本研究主要解析了环境及原料对中高温大曲的影响。研究结果表明,从曲房外到曲房内环境样品中微生物的多样性都是逐渐降低的,这是微生物菌种选择、富集的过程。从大曲发酵开始到结束,细菌群落多样性增加,而真菌群落多样性降低。发酵开始时大曲中检测到111个细菌属,主要以魏斯氏菌属为主;结束时大曲中可检测到334个细菌属,主要以乳杆菌属为主。发酵开始时大曲中检测到25个真菌属,结束时曲中检测到31个真菌属,而发酵开始和结束大曲中的真菌主要以曲霉属和根霉属为主。基于Source Tracker计算的结果,发酵开始大曲中89.3%的细菌来自于原料,5.6%来自于室内草席;发酵开始时大曲中真菌53.7%来源于室外地面,室内屋顶贡献了23.0%。综上所述,本研究强调中高温大曲的制造环境(主要是室外地面和室内屋顶)是大曲真菌群落的主要来源,而原材料则是细菌群落的主要来源,从生物学的角度为制曲工艺的调整、优化甚至现代化提供参考依据。
[1] 独活. 2019年度白酒品牌排行[J].互联网周刊, 2020 (4):60-61.
DU H.2019 Baijiu brand ranking[J].China Internet Week, 2020 (4):60-61.
[2] TAN Y W, ZHONG H P, ZHAO D, et al.Succession rate of microbial community causes flavor difference in strong-aroma Baijiu making process[J].International Journal of Food Microbiology, 2019, 311:108 350.
[3] WANG B W, WU Q, XU Y, et al.Specific volumetric weight-driven shift in microbiota compositions with saccharifying activity change in starter for Chinese Baijiu fermentation[J].Frontiers in Microbiology, 2018, 9:2 349.
[4] 彭璐, 明红梅, 董异, 等.不同曲层中高温大曲质量差异性研究[J].食品与发酵工业, 2020, 46(3):58-64.
PENG L, MING H M, DONG Y, et al.Study on the quality of medium-high temperature Daqu in different curved layers[J].Food and Fermentation Industries, 2020, 46(3):58-64.
[5] HUANG Y H, YI Z L, JIN Y L, et al.Metatranscriptomics reveals the functions and enzyme profiles of the microbial community in Chinese nong-flavor liquor starter[J].Frontiers in Microbiology, 2017, 8:1 747.
[6] LIU J J, CHEN J Y, FAN Y, et al.Biochemical characterisation and dominance of different hydrolases in different types of Daqu-a Chinese industrial fermentation starter[J].Journal of the Science of Food and Agriculture, 2018, 98(1):113-121.
[7] 杨旭, 马歌丽, 王光路, 等.高通量测序解析白酒中高温大曲细菌和真菌群落结构[J].中国酿造, 2020, 39(6):119-123.
YANG X, MA G L, WANG G L, et al.Analysis of bacterial and fungal community structure in medium-high temperature Daqu of Baijiu by high-throughput sequencing[J].China Brewing, 2020, 39(6):119-123.
[8] 李静心, 王艳丽, 何宏魁, 等.基于高通量测序技术解析高温大曲和中高温大曲的真菌群落结构[J].食品与发酵工业, 2018, 44(12):52-59.
LI J X, WANG Y L, HE H K, et al.High-throughput sequencing revealed fungal community structures at high temperature Daqu and medium temperature Daqu[J].Food and Fermentation Industries, 2018, 44(12):52-59.
[9] DU H, WANG X S, ZHANG Y H, et al.Exploring the impacts of raw materials and environments on the microbiota in Chinese Daqu starter[J].International Journal of Food Microbiology, 2019, 297:32-40.
[10] SONG Z W, DU H, ZHANG Y, et al.Unraveling core functional microbiota in traditional solid-state fermentation by high-throughput amplicons and metatranscriptomics sequencing[J].Frontiers in Microbiology, 2017, 8:1 294.
[11] HERTZ M, JENSEN I R, JENSEN L Ø, et al.The fungal community changes over time in developing wheat heads[J].International Journal of Food Microbiology, 2016, 222:30-39.
[12] KNIGHTS D, KUCZYNSKI J, CHARLSON E S, et al.Bayesian community-wide culture-independent microbial source tracking[J].Nature Methods, 2011, 8(9):761-763.
[13] JIN G Y, ZHU Y, XU Y.Mystery behind Chinese liquor fermentation[J].Trends in Food Science & Technology, 2017, 63:18-28.
[14] LI X R, MA E B, YAN L Z, et al.Bacterial and fungal diversity in the starter production process of Fen liquor, a traditional Chinese liquor[J].Journal of Microbiology, 2013, 51(4):430-438.
[15] ZHANG H M, HE H K, YU X J, et al.Employment of near full-length ribosome gene TA-cloning and Primer-Blast to detect multiple species in a natural complex microbial community using species-specific primers designed with their genome sequences[J].Molecular Biotechnology, 2016, 58(11):729-737.
[16] XIAO C, LU Z M., ZHANG X J, et al.Bio-heat is a key environmental driver shaping the microbial community of medium-temperature Daqu[J].Applied and Environmental Microbiology, 2017, 83(23).DOI:10.1128/AEM.01550-17.
[17] YAN S B, CHEN X S, GUANG J Q.Bacterial and fungal diversity in the traditional Chinese strong flavour liquor Daqu[J].Journal of the Institute of Brewing, 2019, 125(4):443-452.
[18] GAO W J, FAN W L, XU Y.Characterization of the key odorants in light aroma type Chinese liquor by gas chromatography-olfactometry, quantitative measurements, aroma recombination, and omission studies[J].Journal of Agricultural and Food Chemistry, 2014, 62(25):5 796-5 804.
[19] WANG X S, DU H, ZHANG Y, et al.Environmental microbiota drives microbial succession and metabolic profiles during Chinese liquor fermentation[J].Applied and Environmental Microbiology, 2018, 84(4).DOI:10.1128/AEM.02369-17.
[20] LI P, LIN W F, LIU X, et al.Effect of bioaugmented inoculation on microbiota dynamics during solid-state fermentation of Daqu starter using autochthonous of Bacillus, Pediococcus, Wickerhamomyces and Saccharomycopsis[J].Food Microbiology, 2017, 61:83-92.
[21] LI H, HUANG J, LIU X P, et al.Characterization of interphase microbial community in Luzhou-flavored liquor manufacturing pits of various ages by polyphasic detection methods[J].Journal of Microbiology and Biotechnology, 2017, 27(1):130-140.
[22] PATEL J K, ARCHANA G.Diverse culturable diazotrophic endophytic bacteria from Poaceae plants show cross-colonization and plant growth promotion in wheat[J].Plant and Soil, 2017, 417(1-2):99-116.