大豆蛋白作为一种重要的食品成分,是目前最丰富的具有重要商业价值的植物蛋白来源之一,由于其具有显著的营养和功能特性、对健康的积极作用且低成本容易获取而被广泛应用于食品加工中[1]。大豆蛋白的生理、功能和营养特性对加工利用具有重要意义,因此通常经由化学、物理和酶处理大豆蛋白以改善其特性[2]。其中,利用酶水解蛋白制备具有多种生物活性功能(抗氧化性[3]、血管紧张素转换酶抑制活性[4]、降血压、降胆固醇、细胞保护作用[5]等)的蛋白肽受到越来越多的关注和研究。因此,酶法生产大豆蛋白肽已成为功能性食品配料、化妆品和药品开发中公认的工艺[6-7]。蛋白质水解物通常是大量肽片段的混合物,因此需要进行分离以得到目标肽,目前几种有效的分离肽的技术包括:高效液相色谱法(HPLC)[8-9]、超滤法[10]、体积排阻色谱法(size exclusion chromatography,SEC)[11]。然而,这些技术在使用中存在一些问题,如膜污染、操作繁琐、成本高等[12]。
表没食子儿茶素-3-没食子酸酯(epigallocatechin-3-gallate,EGCG)是绿茶中含量最丰富的儿茶素,也是已知的能够捕获大多数活性氧,如超氧化物、单线态氧、羟基自由基最有效的的茶多酚[13]。同时,EGCG还因其潜在的抗病毒、抗菌和神经保护等药理作用而引起人们的关注。流行病学研究表明,摄入EGCG可以降低心血管疾病、神经退行性疾病、糖尿病和肥胖的风险[14]。近年来,多酚-蛋白质相互作用被广泛研究,即多酚通过共价或非共价作用络合蛋白质,进而影响蛋白质的结构、功能及营养特性[15]。WEI等[16]研究发现EGCG和乳球蛋白之间的相互作用改变了乳球蛋白的结构、功能和生物活性。DING等[17]研究表明,EGCG的加入使大豆蛋白油脂体的稳定性显著提高,并减缓油脂释放速率。此外,除了形成可溶的络合物,多酚与蛋白质相互作用也会形成不可溶的聚集体[18-19]。EGCG与富含脯氨酸的蛋白质有很强的相互作用,导致蛋白质聚集[20-21]。
本研究是根据EGCG与大豆分离蛋白(soy protein isolate,SPI)酶解物复合会形成不溶性肽聚集物,考察利用EGCG从大豆分离蛋白酶解液(soy protein hydrolysate,SPHs)中回收多肽的作用,并对大豆多肽与EGCG复合物性质进行表征,考察了EGCG浓度和pH值对总肽提取率的影响,通过对复合物的结构、功能的变化以及抗氧化活性的分析进一步评估回收肽的质量。
1 材料与方法
1.1 材料与试剂
SPI,实验室自制;EGCG(纯度98%),西安通泽生物技术公司;碱性蛋白酶(Alcalase 2.4 L,2.4 AU/g),诺维信公司;盐酸、氢氧化钠(均为分析纯),天津基准化学试剂有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
CJJ-6磁力搅拌器,纳丽雅有限公司;Eppendorf 5 424R冷冻离心机,Eppendorf德国公司;PHS-25数显台式酸度计,上海雷磁公司;HH420光合水箱水浴锅,光合有限公司;2500C高速研磨机,艾泽拉有限公司。
1.3 实验方法
1.3.1 SPI的制备
参考ZHANG等[22]的方法稍加修改。将大豆磨粉过60目筛,与正己烷混合(质量比1∶3)进行3次脱脂得到脱脂豆粉。将脱脂豆粉溶于去离子水中(质量比1∶10),并用2 mol/L NaOH调节pH至8.0。所得浆液在45 ℃条件下连续搅拌2 h,并在10 000×g离心30 min后收集上清液。用2 mol/L HCl调节上清液pH至4.5沉淀蛋白质,然后在6 500×g下离心20 min 收集沉淀。将得到的沉淀水洗3次,并用2 mol/L NaOH调节pH至中性后冷冻干燥得到大豆分离蛋白粉末。
1.3.2 SPI酶解物的制备
将冻干大豆分离蛋白粉末溶于去离子水中(质量浓度为40 g/L),于50 ℃下加热搅拌20 min以达到碱性蛋白酶(Alcalase 2.4 L)最适温度。在SPI溶液中加入Alcalase 2.4 L(质量浓度为10 g/L)分别持续酶解30、60、90 min,并在酶解过程中用2 mol/L NaOH始终保持SPI溶液的pH为8.5。将所有样品在85 ℃的水浴中加热10 min,并立即在冰浴中冷却至室温终止反应。将酶解后的混合物调节pH至中性,然后在3 000×g下离心20 min。将含有大部分大豆分离蛋白酶解物的上清液分离。
1.3.3 SPHs的分子质量分布
参考ZHANG等[3]的方法对大豆蛋白酶解产物的分子质量分布进行测定。采用岛津LC 20 A型高效液相色谱仪利用体积排阻色谱(SEC-HPLC)法进行测定,检测器为紫外检测器(ultraviolet detector,UVD),色谱柱为AdvanceBio SEC柱(300 mm×4.6 mm,2.70 μm)。将样品溶于PBS(0.01 mol/L,pH 7.0)中,配制质量浓度为1 mg/mL 的溶液,过0.45 μm微孔滤膜,进样体积10 μL。流动相为磷酸盐缓冲溶液(0.1 mol/L,pH 7.0),洗脱速度0.30 mL/min,检测波长为220 nm。分别以牛γ-血球蛋白(158 kDa)、牛血清白蛋白(66 kDa)、鸡卵白蛋白(44 kDa)、马肌红蛋白(17 kDa)和维生素B12(1.35 kDa)作为标准品得到各个蛋白的保留时间与相对分子质量间的回归方程,进而计算大豆蛋白酶解物的分子质量分布。
1.3.4 EGCG沉降SPHs
量取等量SPHs分别调节pH值至4.5和7.0,将0、0.05%、0.10%、0.20%(质量分数)EGCG分别加入SPHs溶液(pH 4.5和7.0)中,并在室温下避光搅拌30 min。随后,在4 ℃下用去离子水透析24 h后将混合物以10 000×g离心20 min,收集沉淀冷冻干燥后进行分析。肽回收率根据公式(1)计算:
肽回收率![]()
(1)
式中:P′为上清液中肽含量,P为SPHs中肽含量。
1.3.5 SPHs-EGCG的红外光谱分析
参考JIANG等[23]的方法,称取一定量的SPHs-EGCG复合物样品与溴化钾粉末混合后压片,两者配比为1∶100(质量比),红外光谱仪分辨率设置为4 cm-1,扫描次数设置为32次,扫描波数谱段范围设置为400~4 000 cm-1。随后用Peakfit 4.12软件对谱图进行分析,并通过积分面积来计算肽的二级结构组分的百分含量占比。
1.3.6 SPHs-EGCG的表面疏水性分析
使用荧光探针ANS-方法测量表面疏水[24]。在室温下用10 mmol/L的PBS稀释样品使其质量浓度达0.04~0.2 g/L,将4 mL样品溶液与20 μL ANS(0.008 mol/L)混合反应15 min后置于石英比色皿中进行荧光光谱测定光谱测定条件设置为:激发波长390 nm,发射波长为470 nm,激发狭缝为5 nm,发射狭缝宽为5 nm,重复扫描3次。
1.3.7 SPHs-EGCG的抗氧化活性分析
样品溶液与等体积的DPPH原液(0.20 mmol/L,体积分数95%的乙醇溶液)混合。室温下在黑暗中孵育30 min后,用酶标仪(Tecan Infinite M200酶标仪,Tecan Inc.,Maennedorf,Switzerland)在517 nm处测量混合物的吸光度。空白用乙醇代替DPPH溶液,对照用乙醇代替样品溶液。根据公式(2)计算自由基清除率:
DPPH自由基清除率![]()
(2)
式中:A样品,A空白,A对照分别为样品、空白和对照品的吸光度。
1.3.8 统计分析
每组试验至少需要进行重复3次。采用SPSS 16.0对数据进行ANOVA分析,结果以平均值±标准差(SD)表示,当P<0.05时为显著性差异。
2 结果与分析
2.1 SPHs的分子质量分布分析
通过排阻色谱测定的SPHs分子质量分布如表1所示。未进行酶处理的样品中,主要成分为分子质量为5~10 kDa的肽或蛋白小分子,占比85.33%;分子质量>10 kDa的肽含量占13.63%,此时分子质量为1~5 kDa内未发现肽。随着酶解时间的增加,分子质量>10 kDa的肽含量逐渐减少,形成更小的多肽。CHABANON等[25]研究发现油菜籽蛋白在Alcalase 2.4 L酶解过程中,随着水解度的增加,完整的蛋白或大分子质量的多肽(>10 kDa)逐渐消失,形成更小的多肽。在酶解时间60 min及以后,分子质量5~10 kDa和分子质量<1 kDa的肽含量逐渐下降直至检测不到,而中间分子质量1~5 kDa的肽含量随时间延长而增加,这说明酶解作用在整个蛋白上,导致中间肽的出现比例很高(96.96%)[26]。
表1 大豆分离蛋白酶解物的分子质量分布
Table 1 Molecular weight distribution of SPHs

样品分子质量分布/%>10 kDa5~10 kDa1~5 kDa<1 kDa未处理13.63±0.15a85.33±0.22b -1.04±0.07a30 min5.26±1.30b94.66±0.06a -0.08±0.05b60 min4.20±0.07c -95.78±0.04b0.07±0.01b90 min3.02±0.02d -96.96±0.23a -
注:所有样品均测定3次取平均值;不同字母表示样品间差异显著(P<0.05)(下同)
2.2 肽回收率分析
不同pH、EGCG添加量、酶解时间条件下的肽回收率如图1所示。在pH 4.5、7.0时,EGCG的加入使蛋白质回收率增加且聚集体的量与EGCG的浓度呈正相关。CHARLTON等[27]表示多酚可以与肽相互作用形成聚集体并从水溶液中沉淀。当接近蛋白质等电点时,在pH 4.5的条件下,EGCG更容易沉淀多肽。RAWEL等[28]的研究得到相似的结论,在牛血清白蛋白(BSA)的等电点附近,阿魏酸与BSA之间的亲和力较高。当EGCG添加量为为0.20%时,pH 4.5 的条件下肽的最大回收率为48.3%。在pH 4.5时,随着酶解时间的增加肽回收率呈先降低后升高趋势,且加入EGCG的SPHs在30 min时回收率比其他两个时间点较高,说明EGCG可能与分子质量5~10 kDa的肽更易生成沉淀。
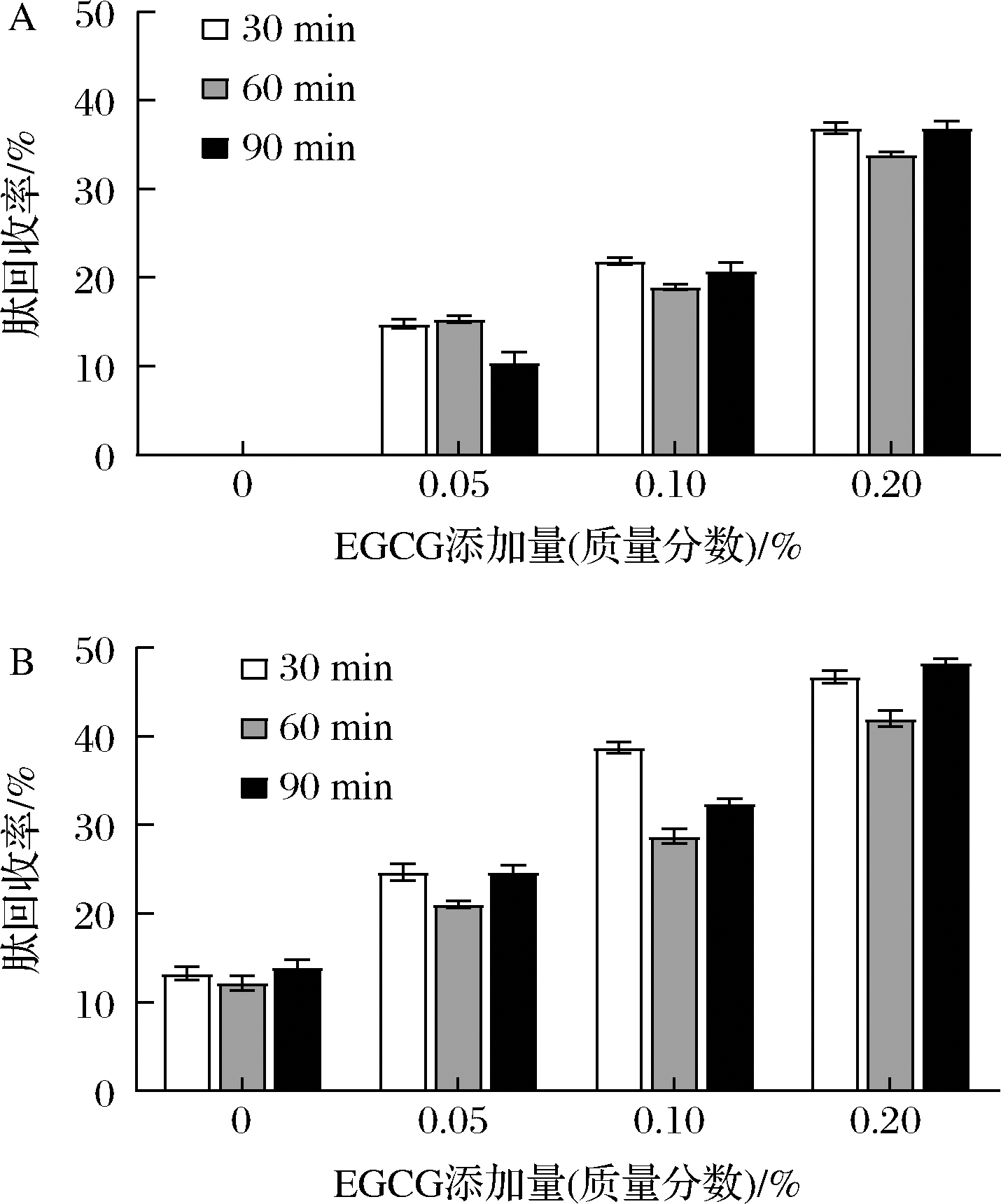
A-pH 7.0;B-pH 4.5
图1 不同pH值、EGCG添加量、酶解时间的条件下肽回收率
Fig.1 Peptide recovery rate under different pH value,
EGCG concentration and enzymolysis time
2.3 SPHs-EGCG红外光谱分析
表2展示了不同pH条件下生成的SPHs-EGCG复合物的二级结构含量变化。当pH值为7.0时,无论EGCG添加量为多少,SPHs-EGCG复合物的α-螺旋和β-折叠含量仅发生轻微的变化。当pH值调为4.5时,随着EGCG量的增加,SPHs-EGCG复合物的二级结构发生明显变化,表现出α-螺旋和β-转角含量升高,β-折叠含量降低的现象。与ZHOU等[13]研究一致,EGCG的加入改变了蛋白质的二级结构,使其α-螺旋和β-转角含量升高,β-折叠含量降低。β-折叠含量的降低表明EGCG与蛋白质的结合可以改变蛋白质的构象,蛋白质肽链与多酚相互作用后发生松动,蛋白质被拉伸。同时,KANAKIS等[29]报道多酚可以改变蛋白质的构象,主要体现在α-螺旋、β-转角含量的增加,与本研究结果一致。
表2 SPHs-EGCG的二级结构变化
Table 2 Secondary structure content of SPHs-EGCG

样品含量/%α-螺旋β-折叠β-转角无规则卷曲pH 4.5, 018.86±0.45d47.52±0.77a13.85±0.65d19.77±0.21bpH 4.5, 0.0521.41±0.76c44.98±0.82b15.58±0.49c18.03±0.59bpH 4.5, 0.1022.43±0.69b40.45±0.64c17.23±0.73b19.89±0.99bpH 4.5, 0.2023.22±0.75a38.56±1.13d18.31±0.71a19.91±0.38bpH 7.0, 0.0520.94±0.88c41.90±0.55c15.84±0.38c21.32±0.25apH 7.0, 0.1021.55±0.33b41.78±0.46c16.95±0.66bc19.72±0.63bpH 7.0, 0.2021.72±0.23b40.81±0.67c17.24±1.07b20.23±0.04a
2.4 SPHs-EGCG表面疏水性分析
蛋白质表面疏水性的变化将明显影响蛋白质的界面性质,而界面性质在稳定食品配方(如分散剂、泡沫和乳剂)方面起着重要作用[30]。因此蛋白质的疏水基团的暴露(蛋白质三级结构的指示)使用荧光探针(ANS)的信号增强进行测量。图2为不同EGCG添加量、不同pH值条件生成的SPHs-EGCG复合物的表面疏水性。由图2可知,EGCG的加入可使蛋白质的表面疏水性降低,且EGCG的添加量和蛋白质表面疏水性值成反比。这可以归因于酚类化合物内部的极性基团,EGCG引入的亲水性羧基和羟基对蛋白质的疏水性产生了负面影响[28]。此外,SPHs-EGCG表面疏水性的降低可能是由于EGCG交联蛋白中一些埋藏在肽链内部的疏水性基团,降低了荧光探针结合位点的可及性,由此也改变了蛋白质的空间结构[31]。此外。在EGCG添加量相同的条件下,pH 4.5的表面疏水性高于pH 7.0,表明SPHs-EGCG在酸处理期间的暴露出疏水基团,表面疏水性增加。酸性pH处理促进蛋白质结构展开,导致蛋白质的表面疏水性显著增加[32]。
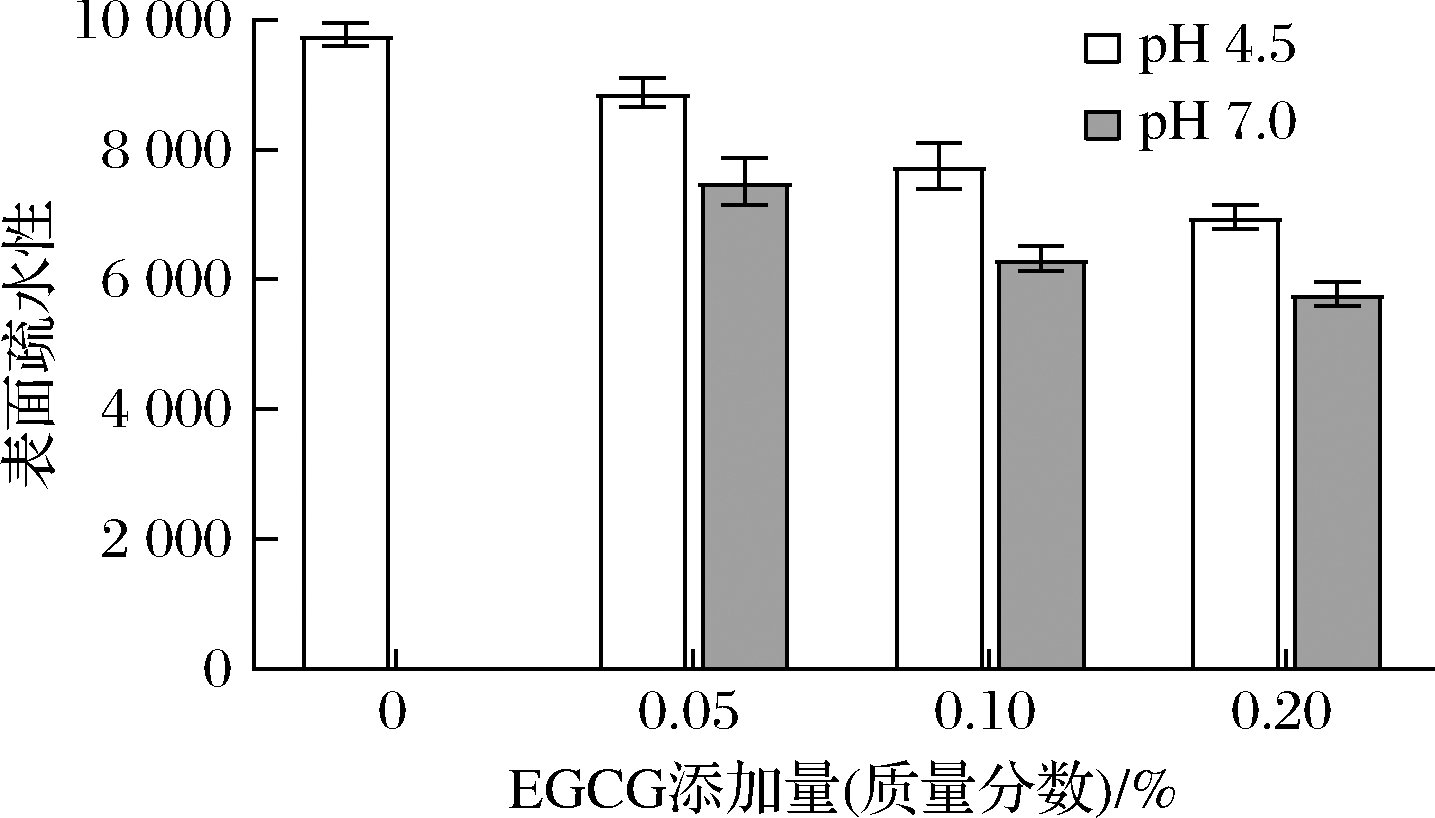
图2 不同pH值、EGCG添加量条件下SPHs-EGCG
表面疏水性
Fig.2 Surface hydrophobicity of SPHs-EGCG at
different pH value and EGCG concentration
2.5 SPHs-EGCG抗氧化能力分析
自由基清除能力是使用酚类化合物作为功能性添加剂的食品货架稳定性以及对健康有益的重要指标。本文采用DPPH自由基清除法检测SPHs-EGCG,SPHs的抗氧化活性。如图3所示,未结合EGCG的SPHs具有20%~40%的自由基清除率,而SPHs的抗氧化活性归因于其组成部分多肽的抗氧化活性[33]。此外,SPHs清除DPPH自由基的能力随水解时间的延长而提高。抗氧化能力的提高是由于大豆蛋白水解后暴露了隐藏的氨基酸残基和具有抗氧化能力的侧链(通常隐藏在蛋白质分子的三维结构中)[34]。YAN等[35]的研究表明EGCG通过范德华力和疏水相互作用与蛋白质结合,保护其复合物免受降解,从而提高其抗氧化特性并提高生物利用度,与该研究结果一致。随着EGCG添加量的增加,SPHs-EGCG复合物呈现出更高的抗氧化活性,这是由于EGCG的加入引入了许多酚羟基或者与多肽的协同作用[16]。

A-pH 7.0;B-pH 4.5
图3 SPHs-EGCG的自由基清除能力
Fig.3 DPPHs scavenging ability of SPHs-EGCG
3 结论
本研究考察了利用EGCG从大豆分离蛋白酶解液中回收多肽的作用,并对大豆多肽与EGCG复合物性质进行了研究。结果表明,在大豆分离蛋白酶解物中,随着酶解时间的增延长,中间肽的出现比例增加(96.96%)。EGCG的加入使多肽回收率增加,且聚集体的量与EGCG的添加量呈正相关。随着酶解时间的添加量,肽回收率先降低后升高,且在30 min时回收率最高,表明EGCG可能与分子质量5~10 kDa的肽更容易生成沉淀。通过红外光谱分析,EGCG的加入使蛋白质的二级结构发生改变,其α-螺旋和β-转角含量升高,β-折叠含量降低。EGCG的加入会降低蛋白质的表面疏水性,且EGCG的添加量与蛋白质表面疏水性值成反比。通过DPPH自由基清除法检测证明EGCG添加量的增加会提高SPHs-EGCG复合物的抗氧化活性。
[1] HU H, WU J H, LI-CHAN E C Y, et al.Effects of ultrasound on structural and physical properties of soy protein isolate (SPI) dispersions[J].Food Hydrocolloids, 2013, 30(2):647-655.
[2] LAMSAL B, JUNG S, JOHNSON L.Rheological properties of soy protein hydrolysates obtained from limited enzymatic hydrolysis[J].LWT-Food Science and Technology, 2007, 40(7):1 215-1 223.
[3] ZHANG Q Z, TONG X H, SUI X N, et al.Antioxidant activity and protective effects of alcalase-hydrolyzed soybean hydrolysate in human intestinal epithelial Caco-2 cells[J].Food Research International, 2018, 111:256-264.
[4] ZHANG Y H, SUN W Z, ZHAO M M, et al.Improvement of the ACE-inhibitory and DPPH radical scavenging activities of soya protein hydrolysates through pepsin pretreatment[J].International Journal of Food Science & Technology, 2015, 50(10):2 175-2 182.
[5] COSCUETA E R, CAMPOS D A, OS RIO H, et al.Enzymatic soy protein hydrolysis:A tool for biofunctional food ingredient production[J].Food Chemistry:X, 2019, 1:100006.
RIO H, et al.Enzymatic soy protein hydrolysis:A tool for biofunctional food ingredient production[J].Food Chemistry:X, 2019, 1:100006.
[6] SINGH B P, VIJ S, HATI S.Functional significance of bioactive peptides derived from soybean[J].Peptides, 2014, 54:171-179.
[7] ZHAO G L, LIU Y, ZHAO M M, et al.Enzymatic hydrolysis and their effects on conformational and functional properties of peanut protein isolate[J].Food Chemistry, 2011, 127(4):1 438-1 443.
[8] PARK S Y, LEE J S, BAEK H H, et al.Purification and characterization of antioxidant peptides from soy protein hydrolysate[J].Journal of Food Biochemistry, 2010, 34:120-132.
[9] PARK S Y, AHN C B, JE J Y.Antioxidant and anti-inflammatory activities of protein hydrolysates from Mytilus edulis and ultrafiltration membrane fractions[J].Journal of Food Biochemistry, 2014, 38(5):460-468.
[10] ZHANG Q Z, TONG X H, QI B K, et al.Changes in antioxidant activity of Alcalase-hydrolyzed soybean hydrolysate under simulated gastrointestinal digestion and transepithelial transport[J].Journal of Functional Foods, 2018, 42:298-305.
[11] BEERMANN C, EULER M, HERZBERG J, et al.Anti-oxidative capacity of enzymatically released peptides from soybean protein isolate[J].European Food Research and Technology, 2009, 229(4):637-644.
[12] XU Z J, HAO N R, LI L W, et al.Valorization of soy whey wastewater:How epigallocatechin-3-gallate regulates protein precipitation[J].ACS Sustainable Chemistry & Engineering, 2019, 7(18):15 504-15 513.
[13] ZHOU S D, LIN Y F, XU X, et al.Effect of non-covalent and covalent complexation of (-)-epigallocatechin gallate with soybean protein isolate on protein structure and in vitro digestion characteristics[J].Food Chemistry, 2020, 309:125718.
[14] DEKA A, VITA J A.Tea and cardiovascular disease[J].Pharmacological Research, 2011, 64(2):136-145.
[15] BOSE A.Interaction of tea polyphenols with serum albumins:A fluorescence spectroscopic analysis[J].Journal of Luminescence, 2016, 169:220-226.
[16] WEI Z H, YANG W, FAN R, et al.Evaluation of structural and functional properties of protein-EGCG complexes and their ability of stabilizing a model β-carotene emulsion[J].Food Hydrocolloids, 2015, 45:337-350.
[17] DING J, XU Z J, QI B K, et al.Physicochemical and oxidative stability of a soybean oleosome-based emulsion and its in vitro digestive fate as affected by (-)-epigallocatechin-3-gallate[J].Food & Function, 2018, 9(12):6 146-6 154.
[18] ![]() A, HEEGER A, UDRISARD I, et al.Phenolic compounds of grape stems and their capacity to precipitate proteins from model wine[J].Journal of Food Science and Technology, 2020, 57(2):435-443.
A, HEEGER A, UDRISARD I, et al.Phenolic compounds of grape stems and their capacity to precipitate proteins from model wine[J].Journal of Food Science and Technology, 2020, 57(2):435-443.
[19] CHUNG S Y, CHAMPAGNE E T.Reducing the allergenic capacity of peanut extracts and liquid peanut butter by phenolic compounds[J].Food Chemistry, 2009, 115(4):1 345-1 349.
[20] CANON F, PATÉ F, CHEYNIER V, et al.Aggregation of the salivary proline-rich protein IB5 in the presence of the tannin EgCG[J].Langmuir, 2013, 29(6):1 926-1 937.
[21] JÖBSTL E, O'CONNELL J, FAIRCLOUGH J P A, et al.Molecular model for astringency produced by polyphenol/protein interactions[J].Biomacromolecules, 2004, 5(3):942-949.
[22] ZHANG Y, CHEN S, QI B K, et al.Complexation of thermally-denatured soybean protein isolate with anthocyanins and its effect on the protein structure and in vitro digestibility[J].Food Research International, 2018, 106:619-625.
[23] JIANG L Z, LIU Y J, LI L, et al.Covalent conjugates of anthocyanins to soy protein:Unravelling their structure features and in vitro gastrointestinal digestion fate[J].Food Research International, 2019, 120:603-609.
[24] JU M N, ZHU G, HUANG G, et al.A novel pickering emulsion produced using soy protein-anthocyanin complex nanoparticles[J].Food Hydrocolloids, 2020, 99:105329.
[25] CHABANON G, CHEVALOT I, FRAMBOISIER X, et al.Hydrolysis of rapeseed protein isolates:Kinetics, characterization and functional properties of hydrolysates[J].Process Biochemistry, 2007, 42(10):1 419-1 428.
[26] MOLINA ORTIZ S E, CRISTINA AN M.Analysis of products, mechanisms of reaction, and some functional properties of soy protein hydrolysates[J].Journal of the American Oil Chemists′ Society, 2000, 77(12):1 293-1 301.
[27] CHARLTON A J, BAXTER N J, KHAN M L, et al.Polyphenol/peptide binding and precipitation[J].Journal of Agricultural and Food Chemistry, 2002, 50(6):1 593-1 601.
[28] RAWEL H M, MEIDTNER K, KROLL J.Binding of selected phenolic compounds to proteins[J].Journal of Agricultural and Food Chemistry, 2005, 53(10):4 228-4 235.
[29] KANAKIS C, HASNI I, BOURASSA P, et al.Milk β-lactoglobulin complexes with tea polyphenols[J].Food Chemistry, 2011, 127(3):1 046-1 055.
[30] CHANDRAPALA J, ZISU B, PALMER M, et al.Effects of ultrasound on the thermal and structural characteristics of proteins in reconstituted whey protein concentrate[J].Ultrasonics Sonochemistry, 2011, 18(5):951-957.
[31] LI D, ZHAO Y, WANG X, et al.Effects of (+)-catechin on a rice bran protein oil-in-water emulsion:Droplet size, zeta-potential, emulsifying properties, and rheological behavior[J].Food Hydrocolloids, 2020, 98:105306.
[32] JIANG J, CHEN J, XIONG Y L.Structural and emulsifying properties of soy protein isolate subjected to acid and alkaline pH-shifting processes[J].Journal of Agricultural and Food Chemistry, 2009, 57(16):7 576-7 583.
[33] ZHANG Y H, ZHAO M M, NING Z X, et al.Development of a sono-assembled, bifunctional soy peptide nanoparticle for cellular delivery of hydrophobic active cargoes[J].Journal of Agricultural and Food Chemistry, 2018, 66(16):4 208-4 218.
[34] TIAN R, FENG J R, HUANG G, et al.Ultrasound driven conformational and physicochemical changes of soy protein hydrolysates[J].Ultrasonics Sonochemistry, 2020, 68:105202.
[35] YAN S Z, XU J W, ZHANG X Y, et al.Effect of pH-shifting treatment on the structural and functional properties of soybean protein isolate and its interactions with (-)-epigallocatechin-3-gallate[J].Process Biochemistry, 2021, 101:190-198.