赤藓糖醇广泛存在于酵母、蘑菇、藻类等微生物和多种水果中,作为四碳多元醇甜味剂,具有一定的抗氧化活性且热量低、无吸湿性、稳定性高[1]。赤藓糖醇在人体代谢中不改变血糖和胰岛素水平[2],作为功能性代糖更适合肥胖症和糖尿病患者[3-4];一般不被口腔细菌利用不引起龋齿,被广泛应用于医药和食品行业[5-6]。赤藓糖醇主要由耐高渗酵母菌,如毕赤酵母属(Pichia),亚罗酵母属(Yarrowia),假丝酵母属(Candida)等作为生产菌株[7-9],以葡萄糖为底物发酵,后续经过滤分离纯化等步骤得到赤藓糖醇,具备较高的生产效率、反应温和且成本低[10]。酵母菌在需氧条件下主要通过磷酸戊糖途径合成赤藓糖醇,葡萄糖经己糖激酶催化生成6-磷酸葡萄糖,再在转酮酶催化下转化为4-磷酸赤藓糖,由4-磷酸赤藓糖激酶去磷酸化生成赤藓糖,最后由赤藓糖还原酶催化加氢生成赤藓糖醇[11-12]。
解脂亚罗酵母(Yarrowia lipolytica)是一种非常规酵母,常用表达载体均为整合型载体,能将目的基因整合到酵母基因组保证遗传的稳定性[13],已完成全基因组和线粒体基因序列测序,部分基因功能得到注释,设计有成熟的组成型和诱导型启动子[14-15],便于进行基因操作,且已经建立了成熟的工业化发酵体系,可利用碳源范围广泛并分泌大量代谢产物如脂质、多元醇、有机酸等,能够定向分流代谢途径生产具有一定价值的化合物[16],所以解脂亚罗酵母逐步发展为一种外源蛋白表达宿主[17]。pINA系列质粒用于整合解脂亚罗酵母,hp4d强启动子由4个连续的UAS1激活序列和最小的Leu2启动子重组构成,它介导的异源蛋白基因在稳定期前期启动表达,这种生长与表达非偶联的方式可避免外源蛋白对细胞的毒害作用[18]。
利用代谢工程技术在鉴定新基因和研究解脂亚罗酵母赤藓糖醇合成途径方面取得了比较广泛的进展。JANEK等[19]在解脂亚罗酵母中过表达YALI0F18590g基因可能编码的赤藓糖还原酶(erythrose reductase,ER),其中ER的氨基酸序列与已知赤藓糖醇生产菌的高度相似,该研究首次鉴定、过表达赤藓糖醇合成途径中涉及的天然赤藓糖还原酶基因最终使赤藓糖醇产率提高。CARLYA等[20]过表达甘油激酶GUT1基因和转酮酶TKL1基因,并破坏分解代谢中赤藓酮糖激酶EYK1基因,获得的菌株赤藓糖醇产率比野生型高75%,培养时间减少40%,且菌株不消耗自身产生的赤藓糖醇,能够进一步提高生产效率,在后续的研究中[21]分离并鉴定了YALI0F01650g基因,认为该基因编码赤藓糖醇脱氢酶重命名为EYD1,在破坏EYK1基因的解脂亚罗酵母菌中过表达EYD1,从赤藓糖醇得到赤藓糖。
本研究基于前期对1株酵母Zygoascus hellenicus全基因组测序获得的一段含有核苷酸结合域的可能具有糖激酶功能的开放阅读框(open reading frame,ORF)序列,该序列与已知编码赤藓糖醇代谢途径中相关激酶的序列相比同源性较低。鉴于目前对于赤藓糖醇合成相关途径糖磷酸化酶的研究较为欠缺,本研究尝试将该基因克隆到解脂亚罗酵母菌中进行表达,对该基因的功能进行初步验证,并考察基因转化对酵母碳源同化能力的影响,为进一步优化解脂亚罗酵母糖醇代谢工程改造开拓新的方向。
1 材料与方法
1.1 菌种与质粒
解脂亚罗酵母Po1g、Zygoascus hellenicus酵母、pINA1269质粒、大肠杆菌DH5α均由所在实验室保藏。
1.2 培养基与试剂
LB培养基(g/L):酵母提取物5,蛋白胨10,氯化钠10,灭菌条件为121 ℃,20 min;YPD培养基(g/L):酵母提取物10,蛋白胨20,葡萄糖20;YNB培养基(g/L):酵母含氮碱基(不含氨基酸)6.7,葡萄糖20。其中,固体培养基添加2%(质量分数)琼脂,在接种和涂板前按需在培养基中加入相应抗生素或营养元素(50~100 μg/mL氨苄或0.1 g/L亮氨酸),培养基中含葡萄糖时,灭菌条件为115 ℃,25 min,酵母含氮碱基采用过滤除菌。发酵种子液培养基(g/L):酵母提取物3,蛋白胨5,葡萄糖50;发酵培养基(g/L):葡萄糖100,酵母提取物5,柠檬酸三铵5,硫酸镁0.25,磷酸二氢钾0.25[22],木糖醇、山梨糖醇、甘油、赤藓糖醇、D-木糖、核糖、D-阿拉伯糖、甘露糖醇10,灭菌条件115 ℃,20 min。赤藓糖醇母液发酵培养基(g/L):20%(质量分数)赤藓糖醇分离液(母液),酵母提取物5,柠檬酸三铵5。
DNA限制性内切酶,NEB公司;T4 DNA连接酶、Taq DNA聚合酶和克隆载体pMD18-T Vector,TaKaRa公司;Pfu DNA聚合酶、50X TAE缓冲液,上海生工生物工程股份有限公司;质粒提取试剂盒、酵母基因组提取试剂盒、DNA Maker,天根生化科技有限公司;琼脂糖凝胶回收试剂盒,Omega Bio-Tek公司;PEG 4000,北京博奥拓达科技有限公司;其他常规试剂采用进口或国产分析纯。引物合成和测序由上海生工生物工程股份有限公司完成。
1.3 仪器与设备
Agilent 1260高效液相色谱仪,安捷伦科技有限公司;Carbomix Ca-Np强阳离子钙型色谱交换柱,Sepax Technologies公司;Tanon 1600全自动数码凝胶图像分析仪,上海天能公司;Bio-rad C1000梯度PCR仪,美国伯乐公司;BG-Power 600通用电泳仪,北京百晶生物技术有限公司。
1.4 实验方法
1.4.1 目的基因片段的克隆
首先提取出发菌株Z.hellenicus希腊接合酵母的基因组DNA作为模板,根据目的基因序列结合pINA1269的多克隆位点,设计扩增目的片段的正向引物spx-F携带Pml I酶切位点,反向引物spx-R携带Kpn I 酶切位点,引物序列如表1所示。PCR反应体系50 μL,反应程序为:94 ℃预变性3 min;94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸1 min 45 s,30个循环;72 ℃延伸7 min。
表1 用于PCR扩增目的基因的引物
Table 1 Primers used for PCR amplification of target genes

引物名称酶切位点引物序列(5′-3′)spx-FPml I5′-AGCACGTGATGTCAGATTCAAACGGCCCTCTTTAT-3′spx-RKpn I5′-CGGGTACCTTATACAAGCCGAGACTCCATCTG-3′
1.4.2 解脂亚罗酵母表达载体的构建
琼脂糖凝胶电泳检测扩增产物,凝胶回收后连接到pMD18-T克隆载体上,转化至大肠杆菌DH5α感受态细胞,涂布在含氨苄抗性的LB固体平板,37 ℃培养过夜,挑转化板上单菌落,接种到含氨苄抗性的LB液体培养基,37 ℃,200 r/min振荡培养12 h后提取质粒DNA,双酶切鉴定,琼脂糖凝胶电泳验证酶切片段,经验证构建成功的重组克隆T载体送至上海生工生物工程股份有限公司测序。
将解脂亚罗酵母表达载体pINA1269与构建成功的重组克隆T载体分别经Pml I、Kpn I双酶切,琼脂糖凝胶电泳后回收线性化质粒和目的片段,用T4 DNA连接酶16 ℃过夜连接并转化大肠杆菌DH5α感受态细胞,涂布到含氨苄抗性的LB固体平板37 ℃培养过夜,挑取长出的单菌落接入LB氨苄液体培养基摇床培养12 h,提取质粒DNA,经PCR验证和双酶切验证,双重验证后的阳性克隆子送至上海生工生物工程股份有限公司测序,即为所要构建的解脂亚罗酵母表达载体。重组载体构建流程如图1所示。

图1 pINA1269-spx重组载体的构建
Fig.1 Construction of pINA1269-spx
1.4.3 醋酸锂化学转化以及重组菌的鉴定
制备宿主菌解脂亚罗酵母细胞感受态,解脂亚罗酵母菌株Po1g划线于YPD固体培养基,30 ℃培养2 d 后,挑取单菌落于YPD液体培养基,30 ℃,220 r/min 摇床培养18 h,接种到50 mL YPD培养基中(使初始OD600在0.15左右),30 ℃振荡培养4 h(至OD600=0.4~0.6),将菌液分装后4 000 r/min 离心5 min,弃上清液,收集菌体,用100 mmol/L LiAc溶液重悬,即为酵母感受态细胞。
用限制性内切酶Not I线性化处理验证正确的重组表达载体pINA1269-spx,凝胶回收即得待转化的酶切纯化载体,将其导入宿主菌解脂亚罗酵母感受态细胞中,转化体系为100 ng酶切纯化载体,600 μL 50%PEG4000,10 μL灭活的鲑鱼精DNA,100 μL酵母感受态,轻轻混匀后30 ℃孵育30 min,42 ℃热激15 min,期间每隔5 min轻轻颠倒混匀,将处理后的酵母转化体系混合液离心弃上清液,用100 μL培养基重悬涂布于YNB固体筛选培养基,28 ℃倒置培养3 d,挑取在筛选培养基上生长的酵母转化子,以spx-F和spx-R为引物进行菌落PCR初步验证,同时接种至YPD液体培养基30 ℃,220 r/min活化培养18 h,并提取阳性转化子基因组,以spx-F和spx-R为引物再次验证,收集菌液用甘油冷冻管保藏。验证为阳性的转化子,送样测序,得到成功导入目的基因片段的解脂亚罗酵母重组菌株。
1.4.4 解脂亚罗酵母重组菌株的培养以及对碳源的利用和转化实验
1.4.4.1 解脂亚罗酵母的培养与同化实验
将未改造的宿主菌株和已验证的重组菌株甘油管菌液分别划线于YPD和YNB固体培养基,28 ℃倒置培养。用接种环挑取单菌落分别接种到2.5 mL发酵种子液培养基,28 ℃,220 r/min摇床培养24 h,随后将种子液以10%的接种量转接入25 mL的8种不同碳源发酵培养基(质量分数为1%木糖醇、1%山梨糖醇、1%甘油、1%赤藓糖醇、1%D-木糖、1%核糖、1%D-阿拉伯糖、1%甘露糖醇,发酵培养基其他成分相同),28 ℃,280 r/min 摇瓶培养72 h,获得发酵液。
1.4.4.2 分析方法
发酵液经稀释过滤,以高效液相色谱法检测糖和糖醇含量。HPLC色谱条件,色谱仪:安捷伦Agilent 1260;检测器:RID-G1362A示差检测器;色谱柱:Carbomix Ca-Np;检测池温度:室温;分离柱温:80 ℃;流动相:超纯水;流速:0.7 mL/min;进样器:G1329A/B自动进样器;进样体积:10 μL(根据发酵液稀释倍数)。观察重组工程菌株生长特征,用高效液相色谱法对发酵代谢底物、产物进行检测分析。
1.4.5 解脂亚罗酵母重组菌株对赤藓糖醇母液的利用和转化实验
将未改造的宿主菌株和已验证的重组菌株甘油管菌液分别划线与YPD和YNB固体培养基,28 ℃倒置培养。用接种环挑取单菌落分别接种到2.5 mL发酵种子液培养基,28 ℃,220 r/min摇床培养24 h,随后将种子液以10%的接种量转接入赤藓糖醇母液发酵培养基,28 ℃,280 r/min 摇瓶培养72 h,获得发酵液,适当稀释过滤后,以高效液相色谱法检测代谢物中糖和糖醇的含量。
2 结果与分析
2.1 源基因的分析
在对希腊接合酵母全基因组的分析中获得了一段长度为1 680 bp的新功能基因序列,命名为spx,通过对核酸保守区域比对和结构域的预测(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi),此序列中至少包含2个功能域:糖结合功能域和ATP结合功能域,可能与戊糖或己糖激酶基因家族有关,在基因中该序列无内含子,其5′-端的序列为ATGTCAGATTCAAACGGCCCTCTTTATC-,3′-端的序列为-TTTGAGCAGATGGAGTC-TCGGCTTGTATAA。图2是spx与真核生物木酮糖激酶cd07776的前165个氨基酸序列的对比结果,该基因属于FGGY糖激酶家族,可催化ATP对木酮糖的磷酸化反应,因此推定新基因也为具有糖磷酸化功能的基因。

图2 spx和cd07776氨基酸序列的比对
Fig.2 Alignment of spx and cd07776 amino acid sequence
注:红色代表相同的氨基酸残基
2.2 表达载体的构建与解脂亚罗酵母重组菌株的鉴定
2.2.1 克隆载体与表达载体的构建与鉴定
按照1.4.1中所述方法进行PCR扩增目的基因,琼脂糖凝胶电泳,结果表明PCR扩增获得的目的片段大小为1 680 bp,与预期片段大小相符(图3)。按照1.4.2的实验方法,将目的基因片段进行TA克隆(original TA cloning),提取重组克隆T载经酶切验证并测序获得正确的目的序列(图4)。TA克隆连接效率高,易于操作,因PCR为体外扩增碱基突变几率大,而单克隆菌体自身的修复机制可以保证序列的准确性,测序正确的克隆子在宿主中扩增有利于目的片段的富集,且便于目的片段的长期保存[23]。将含有目的基因的重组克隆T载与表达载体pINA1269分别进行双酶切,在T4 DNA连接酶作用下构建含目的片段的重组表达载体,并通过PCR验证和双酶切验证(图5、图6),测序后得构建成功的解脂亚罗酵母表达载体。

M-DL 2000 DNA Maker;1、2、3-目的基因PCR产物
图3 目的基因PCR扩增
Fig.3 PCR amplification of target gene

M-DL 5000 DNA Maker;1-重组克隆载体质粒;
2、3-重组克隆T载双酶切
图4 重组克隆T载体的双酶切验证
Fig.4 Enzyme digestion of recombinant cloned T vector
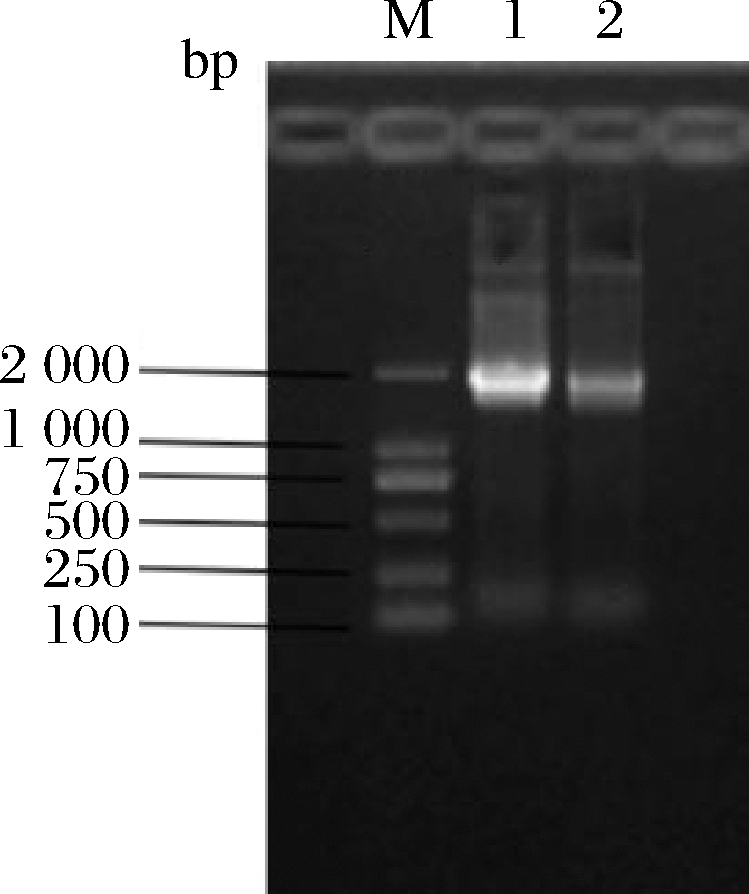
M-DL 2000 DNA Maker;1、2-以重组表达载体为模板的PCR产物
图5 重组表达载体的PCR验证
Fig.5 The verification of recombinant expression vector by PCR

M-DL 15000 DNA Maker;1、2-重组表达载体双酶切
图6 重组表达载体的双酶切验证
Fig.6 Enzyme digestion of recombinant expression vector
2.2.2 解脂亚罗酵母重组菌株的鉴定
所用的pINA1269为整合质粒,是携带有pBR322同源序列的单拷贝质粒,通过同源交换的方式实现整合。在酵母表达系统启动子hp4d和终止子XPR2的控制下,目的基因片段在解脂亚罗酵母中实现异源表达[24]。本身宿主菌是Leu-营养缺陷型,在葡萄糖培养基上生长受到抑制,构建的pINA1269-spx重组表达载体带有Leu基因,因此重组载体成功转化解脂亚罗酵母Po1g后获得的酵母转化子可以在YNB筛选培养基上生长(图7)。提取阳性转化子的基因组,用spx-F和spx-R为引物进行PCR扩增验证,阳性酵母转化子可以扩增出一条1 680 bp大小的片段,与目的功能基因的大小相符(图8),回收纯化后测序验证序列同源性,表明重组载体成功整合到宿主解脂亚罗酵母菌的基因组,获得解脂亚罗酵母重组菌株。

图7 解脂亚罗酵母重组菌株在YNB筛选平板上的生长
Fig.7 Growth of the recombinant Yarrowia lipolytica strains on
YNB selective medium

M-DL 5000 DNA Maker;1-以重组载体为模板的PCR产物;
2、3、4、5-以解脂亚罗酵母重组菌基因组为模板的PCR产物
图8 解脂亚罗酵母菌转化子的PCR鉴定
Fig.8 Screening of Yarrowia lipolytica transformants by PCR
2.3 重组菌株对碳源的利用与转化
碳源是发酵培养基的主要组成成分,能为细胞生长代谢提供能量,为菌株合成次生代谢产物提供不同碳架。表2为供试的木糖醇、甘油、山梨糖醇、赤藓糖醇、D-木糖、核糖、D-阿拉伯糖和甘露糖醇标样在Sepax Carbomix Ca-Np色谱柱上的保留时间,证明在该色谱条件下可有效实现对样品的分离和定量。
表2 HPLC不同碳源单标保留时间表
Table 2 Single standard retention schedule for different
carbon sources by HPLC

序号单标类型保留时间/min10.5%葡萄糖8.41820.2%D-木糖9.25430.2%D-阿拉伯糖10.60840.24%赤藓糖醇12.43750.5%甘油13.02460.2%甘露糖醇14.03670.1%木糖醇17.09380.5%山梨糖醇17.39090.2%核糖17.851
解脂亚罗酵母重组菌株在摇瓶发酵实验中表现出与亲本不同的碳源同化能力(表3)。试验表明对解脂亚罗酵母,除了不能同化的品种,无论是重组菌株还是亲本菌株在对不同碳源的同化方式方面,葡萄糖与其他碳源之间的异步利用现象并不明显,而以甘油的利用效率最高。对于重组菌株,与亲本在同化能力上的最大差异表现在对赤藓糖醇的利用上,重组菌株在基质中同时存在葡萄糖和赤藓糖醇的情况下同化能力至少为亲本菌株的2倍,同样的情况也发生在核糖上,初步表明该基因与磷酸戊糖途径合成赤藓糖醇的代谢通路有关。
表3 重组菌株的混合糖同化特性 单位:g/100mL
Table 3 Mixed sugar assimilation characteristics of
recombinant strains

发酵培养基成分空白培养基亲本菌株重组菌株同化特性葡萄糖10.901±0.015.987±0.107.039±0.12木糖醇1.283±0.010.902±0.020.905±0.03葡萄糖13.837±0.035.826±0.045.963±0.11甘油1.490±0.0100+葡萄糖11.380±0.015.638±0.106.918±0.30山梨糖醇1.347±0.010.886±0.030.828±0.01葡萄糖8.642±0.026.235±0.067.368±0.16赤藓糖醇1.116±0.010.555±0.040+葡萄糖7.908±0.015.833±0.076.778±0.08D-木糖0.715±0.020.724±0.010.730±0.01葡萄糖7.547±0.025.929±0.147.230±0.12核糖0.628±0.010.233±0.020+葡萄糖8.290±0.015.7411±0.056.883±0.12D-阿拉伯糖1.154±0.011.201±0.011.171±0.01葡萄糖8.502±0.015.847±0.067.093±0.07甘露糖醇1.402±0.021.003±0.020.881±0.01
注:+表示对该培养基成分具有同化能力
图9是目前已经确定的酵母赤藓糖醇关键合成路线,其中的主要关键酶都已获得确认,只有催化4-磷酸赤藓糖去磷酸生成赤藓糖的4-磷酸赤藓糖激酶(erythritose 4-phosphate kinase,EP)没有查明,本研究所克隆的spx基因是否就是该基因有待在后续的研究中加以确认。

图9 酵母菌赤藓糖醇的合成路线
Fig.9 Synthetic route of yeast erythritol
2.4 重组菌株对含有混合多元醇的赤藓糖醇结晶母液的转化
在工业生产赤藓糖醇过程中,酵母菌种在将底物转化为赤藓糖醇的同时还产生多种混合糖醇,经菌体分离、脱色、净化除杂、浓缩结晶、重结晶分离赤藓糖醇后得到的母液成分复杂,且黏度很高,其中的有用成分进一步分离和利用都很困难[25]。通过HPLC分析,赤藓糖醇结晶母液中主要含有未发酵利用的葡萄糖、未结晶分离的赤藓糖醇和残留在母液中的甘露糖醇、核糖醇、甘油等成分(图10)。经过重组菌株的发酵,结晶母液中的组分比例发生显著变化(表4),处理后的母液黏度也明显降低,其原因可能是母液中有原发酵菌种不能利用的双糖——麦芽糖的残留被充分同化而且浓度降低了。经过处理,母液中的残留赤藓糖醇可以进行再次浓缩后结晶分离出来,而且由于解脂亚罗酵母为一种富含油脂的酵母,利用母液培养增殖的酵母生物质也可能获得综合利用。
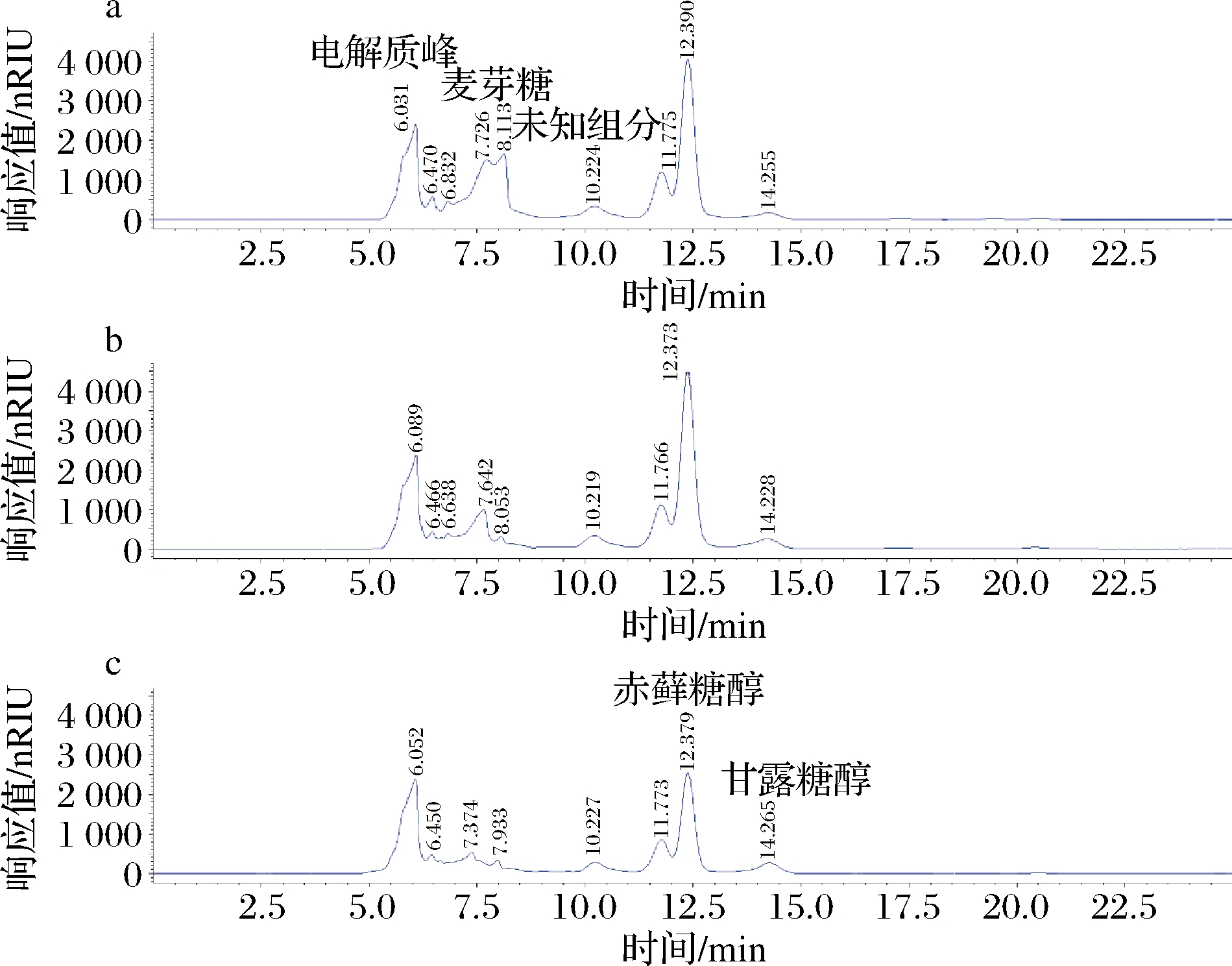
a-母液空白培养基;b-亲本菌株;c-重组菌株
图10 赤藓糖醇母液HPLC色谱图
Fig.10 HPLC chromatogram of erythritol mother liquor
表4 重组菌株对赤藓糖醇结晶母液的转化单位:g/100mL
Table 4 Transformation of erythritol crystallization waste liquor by recombinant strain
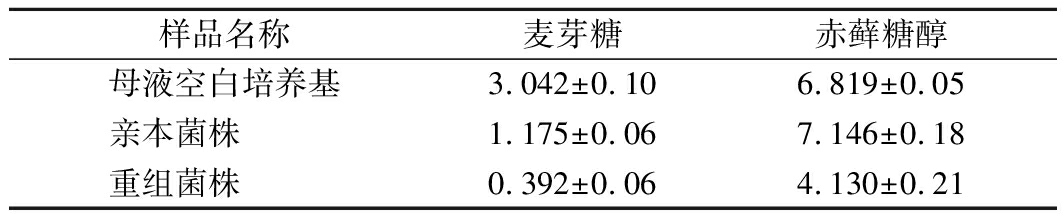
样品名称麦芽糖赤藓糖醇母液空白培养基3.042±0.106.819±0.05亲本菌株 1.175±0.067.146±0.18重组菌株 0.392±0.064.130±0.21
3 结论与展望
赤藓糖醇是一种重要的低热量甜味剂,由于其超过90%的理论转化率使得对其合成途径的深度改造获得很大的关注[26]。本研究构建了携带新目的基因的解脂亚罗酵母表达载体pINA1269-spx,并通过同源交换的方式整合到解脂亚罗酵母基因组进行表达。结果表明,表达此基因的解脂亚罗酵母重组菌株与未经改造的亲本菌株相比对赤藓糖醇和核糖的同化能力出现差异,说明该基因具有调控赤藓糖醇合成及戊糖代谢功能。未来可通过改造和调控赤藓糖醇发酵菌种的相关同工酶来进一步提高赤藓糖醇的产率,拓展赤藓糖醇发酵的碳源利用谱。本研究在赤藓糖醇结晶母液处理方面提供了一个新的解决方案,为资源节约、减轻环境负荷,促进产业的绿色发展创造了新的可能。
[1] 肖素荣, 李京东.赤藓糖醇的特性及应用[J].中国食物与营养, 2008(5):26-28.
XIAO S R, LI J D.Characteristics and application of erythritol[J].Food and Nutrition in China, 2008(5):26-28.
[2] WEN H, TANG B, STEWART A J, et al.Erythritol attenuates postprandial blood glucose by inhibiting α-glucosidase[J].Journal of Agricultural & Food Chemistry, 2018,66(6):1 401-1 407.
[3] REGNAT K, MACH R L, MACH-AIGNER A R.Erythritol as sweetener-wherefrom and whereto?[J].Applied Microbiology & Biotechnology, 2018,102(2):587-595.
[4] HOOTMAN K C, TREZZI J, KRAEMER L, et al.Erythritol is a pentose-phosphate pathway metabolite and associated with adiposity gain in young adults[J].Proceedings of the National Academy of Sciences of the United States of America, 2017,114(21):E4 233-E4 240.
[5] 高蕾蕾, 刘峰, 栾庆民, 等.赤藓糖醇生产与应用研究进展[J].精细与专用化学品, 2020,28(3):1-4.
GAO L L, LIU F, LUAN Q M, et al.The research progress in erythritol production technology and application[J].Fine and Specialty Chemicals, 2020,28(3):1-4.
[6] 徐莹, 李景军, 何国庆.赤藓糖醇研究进展及在食品中的应用[J].中国食品添加剂, 2005(3):92-95;54.
XU Y, LI J J, HE G Q.Research progress on erythritol and application in food science[J].China Food Additives, 2005(3):92-95;54.
[7] KOBAYASHI Y, IWATA H, MIZUSHIMA D, et al.Erythritol production by Moniliella megachiliensis using nonrefined glycerol waste as carbon source[J].Letters in Applied Microbiology, 2015,60(5):475-480.
[8] WANG S Q, WANG H W, LYU J Y, et al.Highly efficient erythritol recovery from waste erythritol mother liquor by a yeast-mediated biorefinery process[J].Journal of Agricultural and Food Chemistry, 2017,65(50):11 020-11 028.
[9] 裴疆森, 黄玲, 张露, 等.解脂亚罗酵母赤藓糖醇发酵过程的研究[J].食品与发酵工业, 2015,41(4):28-33.
PEI J S, HUANG L, ZHANG L, et al.Erythritol production with Yarrowia lipolitica[J].Food and Fermentation Industries, 2015,41(4):28-33.
[10] RZECHONEK D A, DOBROWOLSKI A, RYMOWICZ W, et al.Recent advances in biological production of erythritol[J].Critical Reviews in Biotechnology, 2018,38(4):620-633.
[11] 刘俊梅, 王辉, 李琢伟, 等.赤藓糖醇合成途径及关键酶的研究进展[J].粮油加工(电子版), 2015(5):58-61;65.
LIU J M, WANG H, LI Z W, et al.Research progress of erythritol biosynthetic pathway and key enzymes[J].Cereals and Oils Processing(Electronic Version), 2015(5):58-61;65.
[12] 程磊, 宗朕, 陈卓静, 等.酵母菌发酵生产赤藓糖醇的研究进展[J].中国调味品, 2018,43(12):181-186.
CHENG L, ZONG Z, CHEN Z J, et al.Research progress on erythritol production by yeast fermentation[J].China Condiment, 2018,43(12):181-186.
[13] 殷晓霞. 代谢工程改造解脂亚洛酵母产α-酮戊二酸[D].无锡:江南大学, 2012.
YIN X X.Metabolic engineering of Yarrowia lipolytica for α-ketoglutarate production[D].Wuxi:Jiangnan University, 2012.
[14] MADZAK C, TRÉTON B, BLANCHIN-ROLAND S.Strong hybrid promoters and integrative expression/secretion vectors for quasi-constitutive expression of heterologous proteins in the yeast Yarrowia lipolytica[J].Journal of Molecular Microbiology and Biotechnology, 2000,2(2):207.
[15] MADZAK C.Yarrowia lipolytica:Recent achievements in heterologous protein expression and pathway engineering[J].Applied Microbiology and Biotechnology, 2015,99(11):4 559-4 577.
[16] 赵鹤云, 黄瑛, 杨江科, 等.解脂耶氏酵母表达系统研究进展[J].生物加工过程, 2008(3):10-16.
ZHAO H Y, HUANG Y, YANG J K, et al.Review of Yarrowia lipolytica expression system[J].Chinese Journal of Bioprocess Engineering, 2008(3):10-16.
[17] MARKHAM K A, ALPER H S.Synthetic biology expands the industrial potential of Yarrowia lipolytica[J].Trends in Biotechnology, 2018,36(10):1 085-1 095.
[18] MADZAK C, GAILLARDIN C, BECKERICH J.Heterologous protein expression and secretion in the non-conventional yeast Yarrowia lipolytica:A review[J].Journal of Biotechnology, 2004,109(1-2):63-81.
[19] JANEK T, DOBROWOLSKI A, BIEGALSKA A, et al.Characterization of erythrose reductase from Yarrowia lipolytica and its influence on erythritol synthesis[J].Microbial Cell Factories, 2017,16(118).DOI:10.1186/s12934-017-0733-6.
[20] CARLYA F, VANDERMIES M, TELEK S, et al.Enhancing erythritol productivity in Yarrowia lipolytica using metabolic engineering[J].Metabolic Engineering, 2017,42:19-24.
[21] CARLY F, STEELS S, TELEK S, et al.Identification and characterization of EYD1, encoding an erythritol dehydrogenase in Yarrowia lipolytica and its application to bioconvert erythritol into erythrulose[J].Bioresource Technology, 2018,247:963-969.
[22] 田强, 秦海青, 邱学良, 等.Yarrowia lipolytica酵母产赤藓糖醇的工艺研究[J].中国食品添加剂, 2015(9):121-124.
TIAN Q, QIN H Q, QIU X L, et al.Research on the process for erythritol production by Yarrowia lipolytica yeast[J].China Food Additives, 2015(9):121-124.
[23] 田生礼, 梁秀怡, 梁志成, 等.T载体的应用及研究进展[J].科学技术与工程, 2014, 14(30):102-108.
TIAN S L, LIANG X Y, LIANG Z C, et al.Application and research progress of T vector[J].Science Technology and Engineering, 2014,14(30):102-108.
[24] 楼佳佳, 韦柳静, 花强.解脂耶氏酵母异源合成番茄红素的初步研究[J].华东理工大学学报(自然科学版), 2015,41(3):314-320.
LOU J J, WEI L J, HUA Q.Metabolic engineering study of heterologous production of lycopene in Yarrowia lipolytica[J].Journal of East China University of Science and Technology (Natural Science Edition), 2015,41(3):314-320.
[25] 赵祥颖, 张立鹤, 杨丽萍, 等.赤藓糖醇生产母液中糖醇组分的定性鉴定[J].食品与发酵工业, 2014,40(10):200-204.
ZHAO X Y, ZHANG L H, YANG L P, et al.Identification of the components in the erythritol mother liquor[J].Food and Fermentation Industries, 2014,40(10):200-204.
[26] NAKAGAWA Y, KASUMI T, OGIHARA J, et al.Erythritol:Another C4 platform chemical in biomass refinery[J].ACS Omega, 2020,5(6):2 520-2 530.