白藜芦醇是植物体内用于抵抗病原侵染的一种二苯乙烯非黄酮类多酚物质,是一种天然的芪类化合物[1]。1940年日本学者首次从毛叶藜醇的根部分离得到白藜芦醇[2],白藜芦醇一直是研究的热点。如杨兰泽等[3]经过实验得出白藜芦醇可以清除体内过多的氧自由基,有效地延缓衰老。近年来对白藜芦醇的药理研究发现其具有抗肿瘤[4-5]、降低血糖[6]、保护心血管[7]、抗氧化[8]、抗真菌和抗炎等作用[9-12]。研究者还发现白藜芦醇对SARS-cov-2引起的肺炎有抗病毒活性[13],研究表明白藜芦醇具有能直接或间接作用于肿瘤发生、发展和转移各个过程中多种途径的关键靶点[14]。因此,它被誉为继紫杉醇之后的又一个绿色抗癌药物。
目前从植物提取白藜芦醇主要来源于虎杖、桑葚、花生和葡萄等[15-17]。研究显示花生在发芽后,其白藜芦醇含量增大,如TONG等[18]采用木屑为培养基,培养Palgwang品种的花生到45 d,测得反式白藜芦醇的含量为19.62 μg/g;康洁等[19]研究发现,花生萌发后在胚轴为3和5 cm时白藜芦醇含量增加最大;付诗鸣等[20]研究发现花生发芽后总酚的含量是发芽前的1.7倍。对植物种子萌发的前处理会影响种子萌发率、自身活性物质含量等[21],常用的前处理方式有:超声处理、微波处理、激素处理[22]、干旱胁迫和盐胁迫处理等[23]。于淼[24]采用超声胁迫提高了花生种子中白藜芦醇合成酶的活性和基因表达,促进了白藜芦醇的生成。目前还无综合研究微波、植物激素和盐胁迫对花生萌芽期白藜芦醇变化的文献报道。我国花生资源十分丰富,并且廉价易得,故研究花生发芽期其白藜芦醇含量变化和各种胁迫方式对其影响,探寻提高花生白藜芦醇含量的培养条件具有广阔的应用前景。本文采用高效液相色谱法监测花生发芽期其白藜芦醇的含量变化,采用微波、植物激素和盐胁迫等方式研究花生发芽期间其白藜芦醇含量变化,并用得到的最佳条件培养10种不同产地的花生,得出白藜芦醇含量最高的花生品种。
1 材料与方法
1.1 材料与试剂
供试材料:10种花生采购于电商,置于-18 ℃下贮存,备用。
白藜芦醇标准品(纯度>98%),阿拉丁公司;色谱甲醇,美国天地公司;无水乙醇,分析纯,国药集团;吲哚乙酸、吲哚丁酸、水杨酸、阿魏酸、丁香酸、KCl、CaCl2、ZnCl2、CuCl2、NH4Cl、FeSO4、K2SO4、ZnSO4、Na2SO4、NaH2PO4、NaHCO3、Na2CO3和(NH4)2S2O8皆为国产分析纯,实验用水为超纯水。
1.2 仪器与设备
高效液相色谱仪(包括UV230II紫外-可见检测器、P230II高压恒流泵、LU230II低压梯度混合器),大连依利特分析仪器有限公司;UPWS超纯水器,杭州永洁达净化科技有限公司;LG10-2.4A高速离心机,北京时代北利离心机有限公司;L6S紫外分光光度计,上海仪电分析仪器有限公司;PL402-L电子天平,梅特勒-托利多仪器有限公司;JK-100超声波清洗器,合肥金尼机械制造有限公司;C型30玻璃仪器快速烘干器,长城科工贸有限公司;DGG-9140A电热恒温鼓风干燥箱,上海森信实验仪器有限公司。
1.3 实验方法
1.3.1 白藜芦醇色谱测定
白藜芦醇高效液相色谱条件[25]:色谱柱:C18柱(250 mm×4.6 mm,5.0 μm);流动相为水∶甲醇(体积比55∶45);检测波长:306 nm;柱温:室温;进样量:10 μL。
1.3.2 白藜芦醇标准曲线的绘制
准确称取白藜芦醇标准品5.0 mg,用甲醇溶解并定容至10 mL,即为500 mg/L的储备液。标准使用液:将标准储备液逐级稀释成0.5、1.0、5.0、25.0和50.0 mg/L的白藜芦醇标准使用液。在“1.3.1”色谱条件下,测各浓度标准使用液的峰面积,以浓度为横坐标,峰面积为纵坐标,绘制标准曲线。
1.3.3 花生芽中白藜芦醇的提取
采用农业标准 NY/T 2641—2014 植物源性食品中白藜芦醇的测定高效液相色谱法[25]进行处理:称取经拭干水的30 g花生芽样品,加入60 mL无水乙醇后在高速组织捣碎机中提取2 min,将混合液倒入烧杯中超声再提取30 min后,倒入离心管中4 000 r/min的离心机中离心10 min,取上层清液,用0.22 μm滤膜过滤,待测。
1.3.4 不同发芽时间花生芽中白藜芦醇含量变化
取适量山东改良海花1号花生经消毒后在40 ℃下泡种2 h,将发芽盒盒底铺上1层纱布,花生平行设置3组,每组750 g,置于温度为30 ℃,湿度为60%的暗环境下发芽,每天浇水,取样,按照1.3.3方法提取其中的白藜芦醇,按照1.3.1色谱条件测定含量。
1.3.5 微波辐射胁迫对花生芽中白藜芦醇含量影响
取适量山东改良海花1号花生经消毒后在40 ℃下泡种2 h,将发芽盒盒底铺上1层纱布,花生平行设置3组,每组180 g,置于温度为30 ℃,湿度为60%的暗环境下发芽,每天浇水,在第4天时各取30 g用110 W微波[20]0,30,60,90,120,150 s进行辐射,第2天取样,按照1.3.3方法提取其中的白藜芦醇,按照1.3.1色谱条件测定含量。
1.3.6 植物激素诱导对花生发芽期白藜芦醇含量影响[26]
考察常见的植物激素如吲哚乙酸、吲哚丁酸、水杨酸、阿魏酸和丁香酸对花生的萌发影响,尤其是花生发芽期白藜芦醇含量的变化,以及找到花生发芽期白藜芦醇含量最高的激素种类及浓度。取适量山东改良海花1号花生经消毒后在40 ℃下泡种2 h,将发芽盒盒底铺上1层纱布,花生平行设置3组,每组450 g,置于温度为30 ℃,湿度为60%的暗环境下发芽,每组每天淋相应浓度(25~500 mg/L)生长激素溶液,在第5天取样,按照1.3.3方法提取其中的白藜芦醇,按照1.3.1色谱条件测定含量。
1.3.7 盐胁迫对花生发芽期间白藜芦醇含量影响
分别将KCl、CaCl2、ZnCl2、CuCl2、NH4Cl、FeSO4、K2SO4、ZnSO4、Na2SO4、NaH2PO4、NaHCO3、Na2CO3和(NH4)2S2O8配制成0.5 g/L溶液,取适量山东改良海花1号花生经消毒后在40 ℃下泡种2 h,将发芽盒盒底铺上1层纱布,花生平行设置3组,每组450 g,置于温度为30 ℃,湿度为60%的暗环境下发芽,每组每天淋相应浓度盐溶液,在第5天取样,按照1.3.3方法提取其中的白藜芦醇,按照1.3.1色谱条件测定含量。
1.3.8 不同盐浓度胁迫对花生发芽期间白藜芦醇含量影响
经上述1.3.7下13种盐胁迫实验,得到最佳的胁迫盐种类,进行不同浓度盐胁迫因素实验,配制含该盐0、0.5、1.5、2.0、2.5和3.0 g/L的溶液,取适量山东改良海花1号花生经消毒后在40 ℃下泡种2 h,将发芽盒盒底铺上1层纱布,花生平行设置3组,每组540 g,置于温度为30 ℃,湿度为60%的暗环境下发芽,每组每天淋相应浓度盐溶液,在第5天取样,按照1.3.3方法提取其中的白藜芦醇,按照1.3.1色谱条件测定含量。
1.3.9 最佳胁迫因素下对花生发芽期间白藜芦醇含量影响
通过对比植物激素胁迫和盐胁迫对花生芽中白藜芦醇含量的大小,选取最佳的胁迫方式和参数,对采集到的10种花生品种进行胁迫培养实验,在同一条件下培养到第5天时取样,按照1.3.3方法提取其中的白藜芦醇,按照1.3.1色谱条件测定含量。
1.4 数据分析
以上指标均取3个平行样品,重复测定3次。采用Excel软件统计进行数据处理和Origin绘制图形。
2 结果与分析
2.1 白藜芦醇标准曲线的绘制
通过实验求得各浓度下的标准品浓度与峰面积之间的关系,为y=71.127x-33.678,线性拟合结果R2=0.999,结果表明该标准曲线线性较好,白藜芦醇质量浓度在0.5~50 mg/mL线形良好。
2.2 发芽时间对发芽花生中白藜芦醇含量的影响
通过24 d的监测,计算得出山东改良海花1号花生芽白藜芦醇含量随发芽时间变化的曲线,如图1所示。由图1可知,该种花生芽在生长到第19天到第23天期间白藜芦醇含量明显高于其他时期,其中第20天白藜芦醇含量出现最大值,达到了5.3 mg/100g,其次是第22天,白藜芦醇含量达到了5.1 mg/100g。同时发现,在发芽时间为第5天时出现了一个前18 d发芽期的高峰,白藜芦醇含量达到了1.51 mg/100g,本研究基于培养消耗成本及时间成本考虑,选定培养花生发芽测定其中白藜芦醇的的最佳时间为发芽的第5天。本项目后续测量各种胁迫因素影响花生芽中白藜芦醇含量的时间为发芽期第5天。
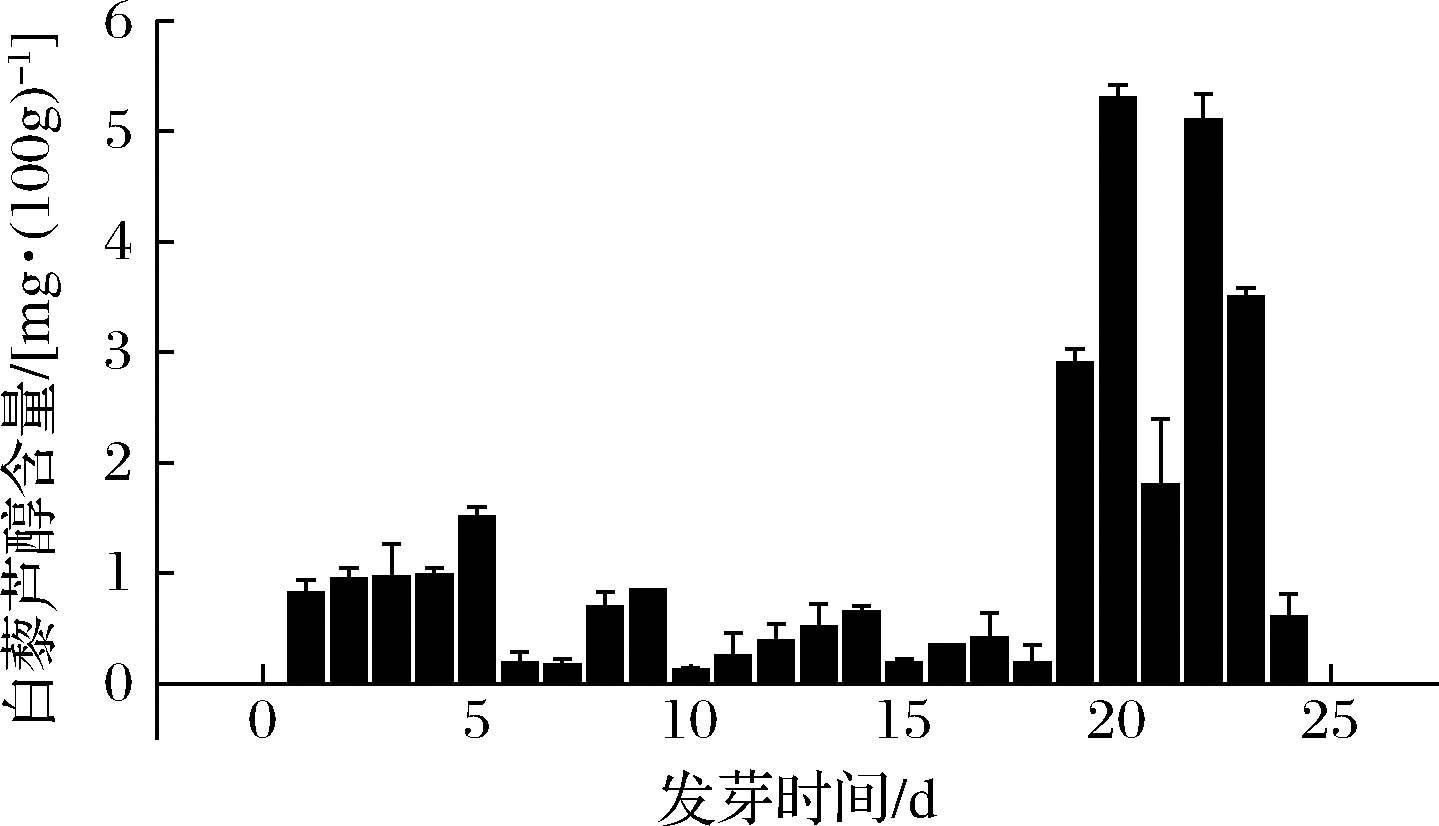
图1 白藜芦醇含量随花生发芽时间变化的影响
Fig.1 Effect of peanut germination time on
resveratrol content
2.3 微波辐射胁迫对花生芽中白藜芦醇含量的影响
微波辐射胁迫对花生芽中白藜芦醇含量影响结果如图2所示。经发芽培养的花生芽样品经过功率为100 W,时间为30~150 s微波处理后,测定得到花生芽中的白藜芦醇含量为1.2~1.6 mg/100g,相比于未经微波处理的花生芽白藜芦醇含量(1.5 mg/100g)无显著提高,证明微波促进作用甚微,从培养成本考虑,本研究后续的实验皆不采用微波胁迫方法。

图2 微波时间对花生发芽白藜芦醇含量影响
Fig.2 Effect of microwave time on resveratrol content during
peanut germination
2.4 植物激素诱导对花生发芽期白藜芦醇含量的影响
各不同质量浓度的阿魏酸、水杨酸、丁香酸、吲哚乙酸和吲哚丁酸对花生发芽期间白藜芦醇含量的影响见图3~图7。5种酸的单因素试验结果表明:阿魏酸在200 mg/L时白藜芦醇含量最高为1.71 mg/100g;水杨酸在100 mg/L时白藜芦醇含量最高为1.74 mg/100g;丁香酸在200 mg/L时白藜芦醇含量最高为1.71 mg/100g;吲哚乙酸在300 mg/L时白藜芦醇含量最高为1.71 mg/100g;吲哚丁酸在100 mg/L 时白藜芦醇含量最高为1.7 mg/100g。而不添加上述植物激素溶液的花生芽对照样品中白藜芦醇的含量为1.51 mg/100g,采用水杨酸在100 mg/L浓度胁迫的花生芽中白藜芦醇含量是对照样品的1.15倍。由此可见,这些植物激素皆能促进花生发芽期间白藜芦醇含量的增加。变化趋势是白藜芦醇的峰面积先随植物激素浓度升高而升高,后随其浓度升高而下降。表明适当的植物激素浓度能刺激花生芽白藜芦醇的产生,而过高的浓度则会抑制花生芽代谢生成白藜芦醇。
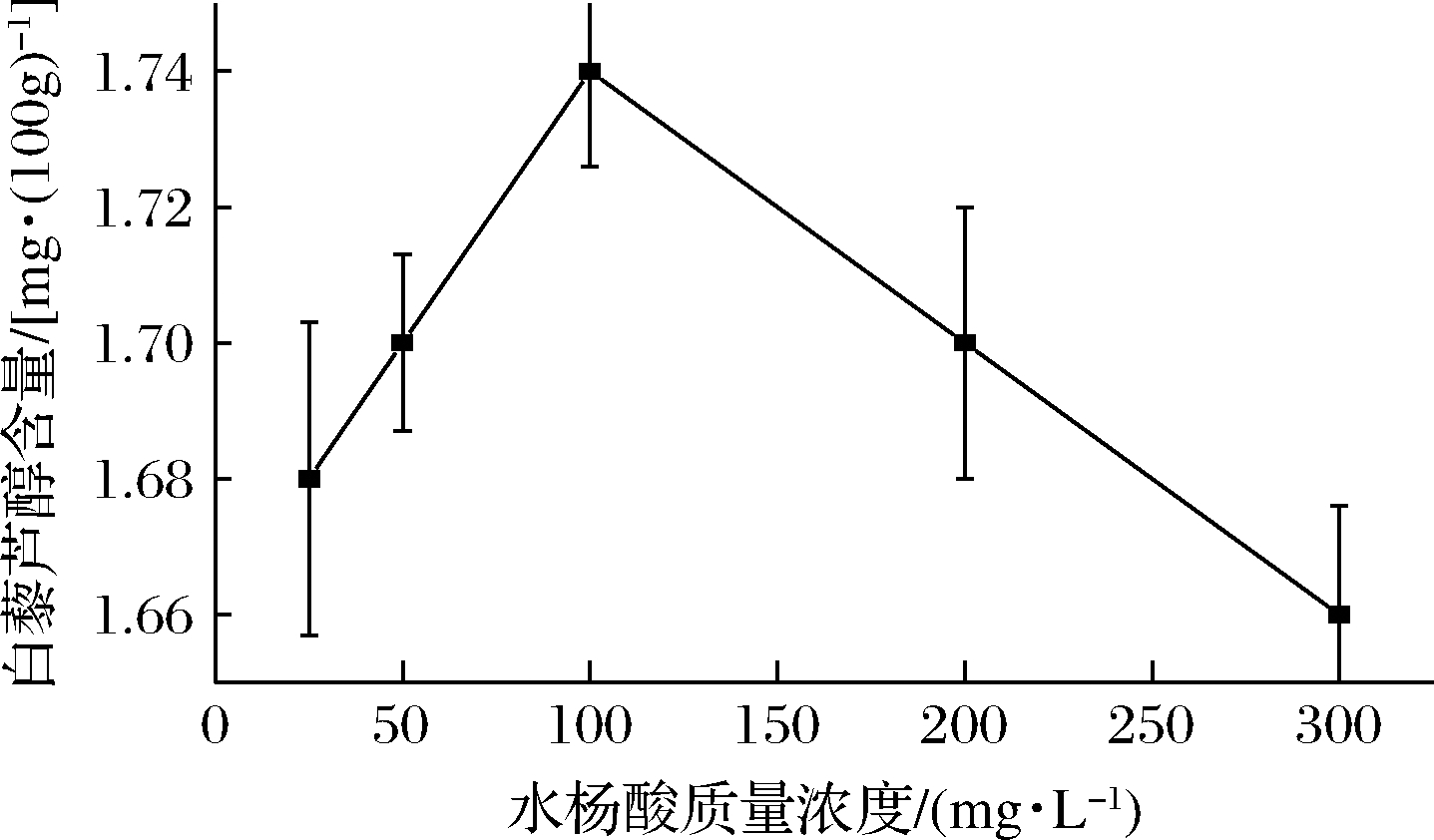
图3 水杨酸质量浓度对花生发芽白藜芦醇含量影响
Fig.3 Effect of salicylic acid concentration on resveratrol
content during peanut germination
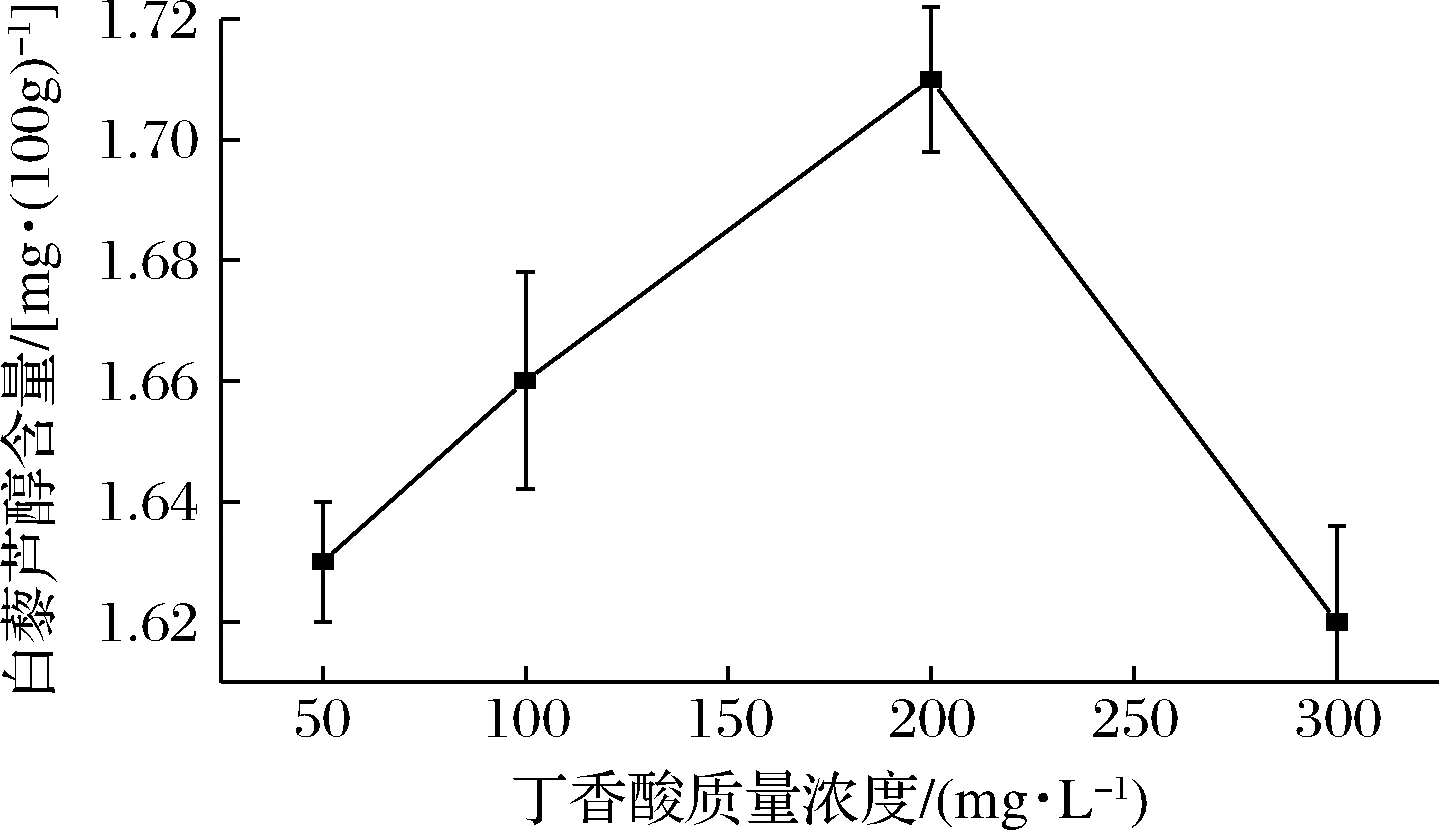
图4 丁香酸质量浓度对花生发芽白藜芦醇含量影响
Fig.4 Effect of syringic acid concentration on resveratrol
content during peanut germination

图5 吲哚乙酸质量浓度对花生发芽白藜芦醇含量影响
Fig.5 Effect of indoleacetic acidconcentration on resveratrol
content during peanut germination

图6 吲哚丁酸质量浓度对花生发芽白藜芦醇含量影响
Fig.6 Effect of indolebutyric acid concentration on
resveratrol content duringpeanut germination
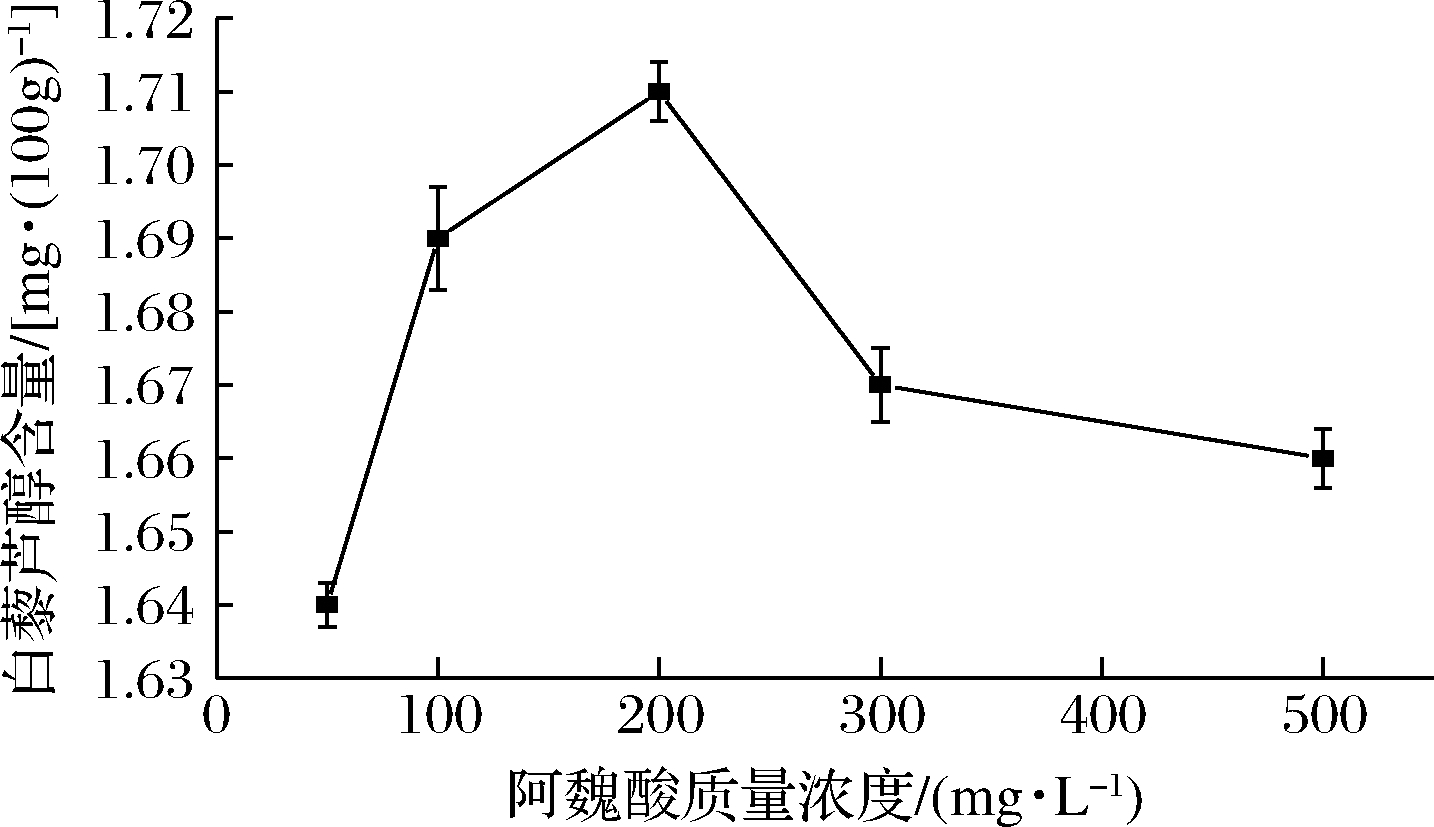
图7 阿魏酸质量浓度对花生发芽白藜芦醇含量影响
Fig.7 Effect of ferulic acid concentration on resveratrol
content during peanut germination
2.5 盐胁迫对花生发芽期间白藜芦醇含量影响
本实验选取了5种盐酸盐、4种硫酸盐和2种碳酸盐以及1个磷酸盐和1个过硫酸盐来进行盐胁迫实验。由表1可知,不同种类的盐溶液对花生发芽到第5天时的生长状态不尽相同,KCl、CaCl2、K2SO4和Na2SO4培养的花生芽在颜色和光泽和不用盐胁迫培养的花生芽基本一致,为白色浅绿。而CuCl2和FeSO4培养的花生芽一个呈浅灰黑色,一个表皮黑色。其他盐类多浅绿色。从芽的形态和状态看,除了ZnCl2、CuCl2、Na2SO4培养的花生芽相对对照芽显得芽头小,而FeSO4盐胁迫的花生芽芽干细长、发芽率低。而(NH4)2S2O8胁迫培养的花生芽芽干粗壮,发芽率高。从白藜芦醇含量来看,经各盐胁迫后,花生芽中的白藜芦醇含量普遍得到增加。采用同浓度的CuCl2与(NH4)2S2O8溶液培养花生种子时,花生中的白藜芦醇含量增加最多,约为正常培养的花生的1.2倍。但由于CuCl2含重金属离子Cu2+,具有毒性,且培养的花生芽十分短小,而(NH4)2S2O8为氧化剂,且培养出来的花生芽较为粗壮,考虑到环境及在花生中的残留问题,我们采用(NH4)2S2O8做后续的浓度实验。
表1 不同盐类处理对花生发芽白藜芦醇含量影响
Table 1 Effects of different salt treatments on resveratrol
content during peanut germination
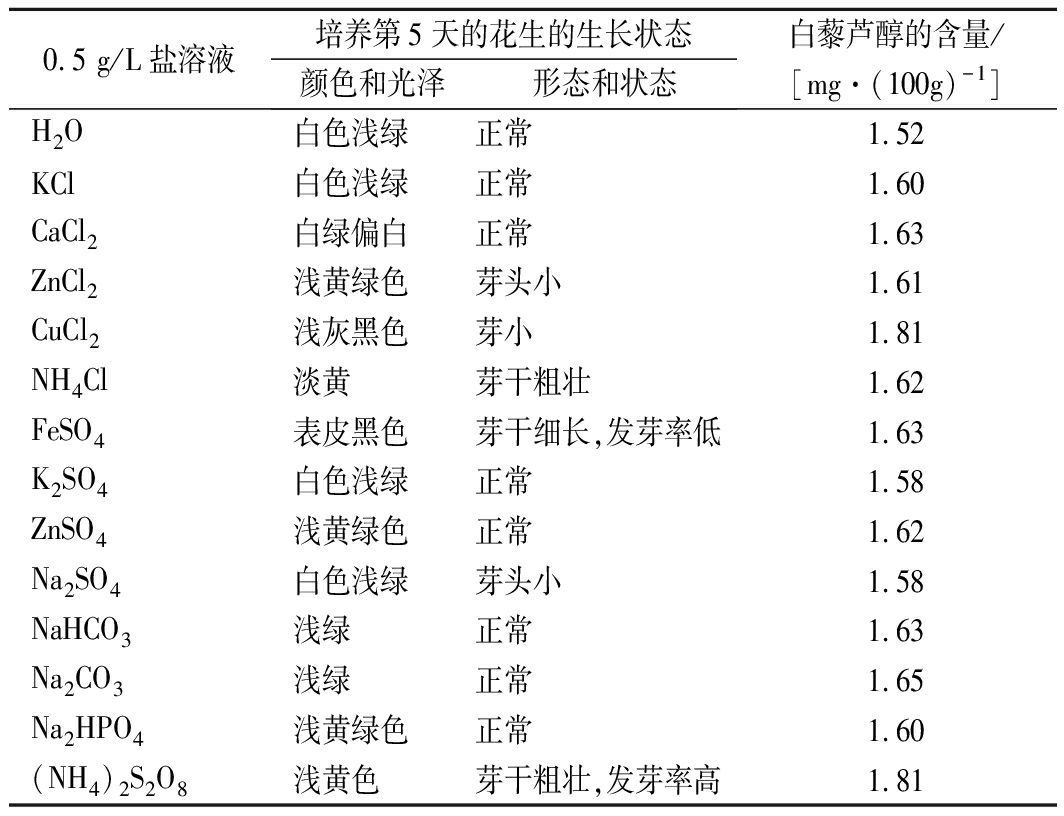
0.5 g/L盐溶液培养第5天的花生的生长状态颜色和光泽形态和状态白藜芦醇的含量/[mg·(100g)-1]H2O白色浅绿正常1.52KCl白色浅绿正常1.60CaCl2白绿偏白正常1.63ZnCl2浅黄绿色芽头小1.61CuCl2浅灰黑色芽小1.81NH4Cl淡黄芽干粗壮1.62FeSO4表皮黑色芽干细长,发芽率低1.63K2SO4白色浅绿正常1.58ZnSO4浅黄绿色正常1.62Na2SO4白色浅绿芽头小1.58NaHCO3浅绿正常1.63Na2CO3浅绿正常1.65Na2HPO4浅黄绿色正常1.60(NH4)2S2O8浅黄色芽干粗壮,发芽率高1.81
2.6 不同浓度(NH4)2S2O8对花生发芽期间白藜芦醇含量的影响
得到最佳盐种类之后,配制质量浓度为0、0.5、1.5、2.0、2.5和3.0 g/L的(NH4)2S2O8溶液,并分组进行培养该花生种子,提取,进样。由图8可知,促进白藜芦醇含量增加的最佳盐溶液的质量浓度为2.5 g/L,白藜芦醇的含量为同批次正常花生的3.5倍。
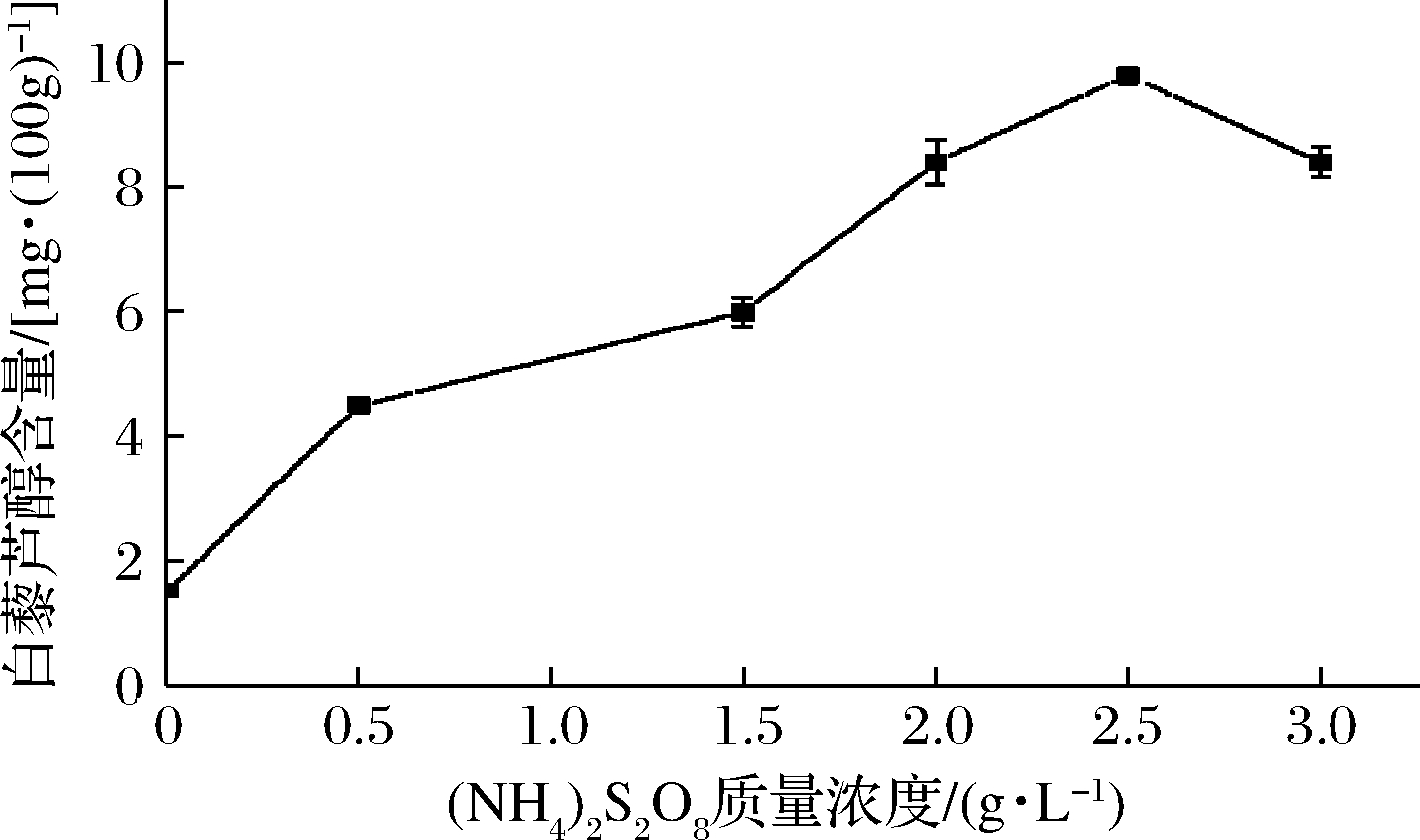
图8 过硫酸铵浓度对花生芽白藜芦醇含量变化影响
Fig.8 Effect of ammonium persulfate concentration on
resveratrol content during peanut germination
2.7 用所得最佳条件培养10种不同产地的花生发芽白藜芦醇含量结果
综合上述微波胁迫、植物激素种类胁迫和盐种类胁迫结果,本实验采用配制2.5 g/L的(NH4)2S2O8溶液来对采集到的10种花生进行发芽培养。由表2可知,采用2.5 g/L的(NH4)2S2O8溶液胁迫培养的花生芽中白藜芦醇含量为8.22~13.32 mg/100g。各品种花生芽白藜芦醇含量与品种纬度无明显关联。而江苏省大白沙花生的白藜芦醇含量最高达到了13.32 mg/100g,是云南红皮花生的白藜芦醇含量8.22 mg/100g的1.62倍。山东平度富硒黑皮花生及云南七彩花生虽粒径较小,但总体上含量均高于其他品种花生。
表2 用2.5 g/L的 (NH4)2S2O8溶液培养
10种花生白藜芦醇含量
Table 2 resveratrol content of culture by ten peanut species with
mass fraction of 2.5 g/L (NH4)2S2O8solution
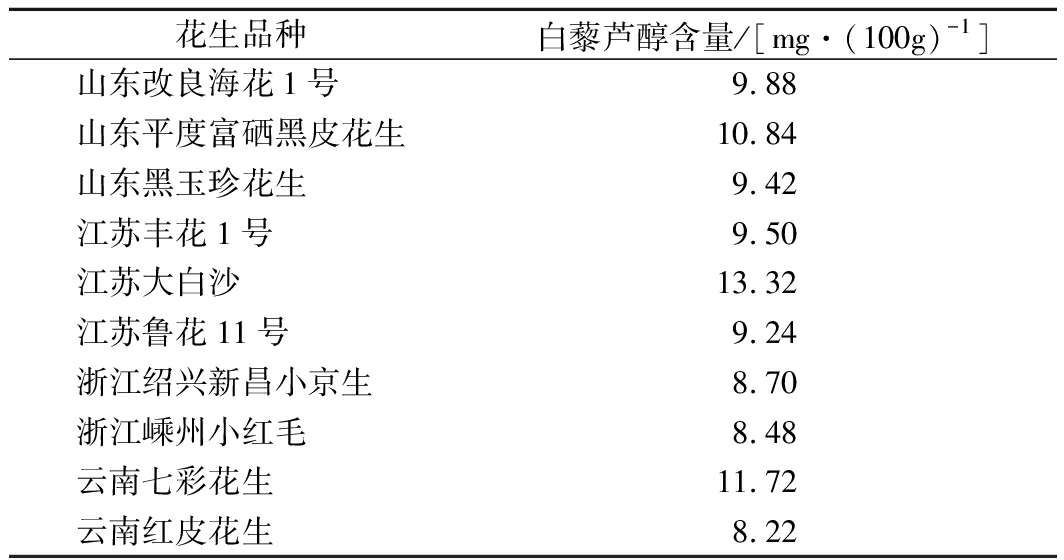
花生品种白藜芦醇含量/[mg·(100g)-1]山东改良海花1号9.88山东平度富硒黑皮花生10.84山东黑玉珍花生9.42江苏丰花1号9.50江苏大白沙13.32江苏鲁花11号9.24浙江绍兴新昌小京生8.70浙江嵊州小红毛8.48云南七彩花生11.72云南红皮花生8.22
3 结论
花生发芽期间的白藜芦醇含量随时间有变化:结果表明,在花生生长第20天白藜芦醇含量出现最大值,并且在第5天出现小峰值。该文通过单因素试验探究了微波辐射对花生发芽期间白藜芦醇含量的影响,结果表明微波辐射对促进白藜芦醇含量的效果一般。此外,通过单因素试验研究了不同浓度的5种激素对花生中白藜芦醇含量的影响差异,得出激素处理促进白藜芦醇含量增加的最佳条件为:水杨酸在100 mg/L质量浓度胁迫的花生芽中白藜芦醇含量是对照样品的1.15倍。该文还研究了13种盐类对花生发芽期间白藜芦醇含量的影响,基于绿色环保的理念,得出最佳盐类为(NH4)2S2O8及其最佳质量浓度为2.5 g/L,该条件下培养的花生中白藜芦醇含量是正常花生中的3.5倍。采用2.5 g/L的(NH4)2S2O8溶液培养10个品种的花生,江苏省高产大白沙花生发芽期的白藜芦醇含量最高,达到13.32 mg/100g。
[1] 付元庆, 李铎.白藜芦醇[J].营养学报, 2014, 36(1):13-16.
FU Y Q, LI D.Resveratrol[J].Acta Nutrimenta Sinica, 2014, 36(1):13-16.
[2] TAKAOKA M J.Of the phenolic substances of white hellebore (Veratrum grandiflorum Loes.Fil.)[J].Nippon Kagaku Kaishi, 1940, 3:1-16.
[3] 杨兰泽, 王宜娟, 李三强, 等.白藜芦醇的抗衰老作用[J].中国老年学杂志, 2013, 33(2):268-269.
YANG L Z, WANG Y J, LI S Q, et al.Anti-aging effect of resveratrol[J].Chinese Journal of Gerontology, 2013, 33(2):268-269.
[4] MOHAMED E, YERU C, XIU J W, et al.Resveratrol:An overview of its anti-cancer mechanisms[J].Life Sciences, 2018, 207:340-349.
[5] KO J H, SETHI G, UM J Y, et al.The role of resveratrol in cancer therapy[J].International Journal of Molecular Sciences, 2017, 18(12):1-36.
[6] EBRU O, AYSE K K A, MUKERREM B Y, et al.Resveratrol and diabetes:A critical review of clinical studies[J].Biomedicine & Pharmacotherapy, 2017, 95:230-234.
[7] HUIGE L, NING X, SOLVEIG H, et al.Resveratrol and vascular function[J].International Journal of Molecular Scineces, 2019, 20(9):2 155-2 171.
[8] JOSEPH M W, WANG Z R, HSIEH T C, et al.Mechansim of cardioprotection by resveratrol, a phenolic antioxidant present in red wine(Review)[J].International Journal of Molecular Medicine, 2001, 8:3-17.
[9] ALICE C, CHRISTIAN C, JOSEP M.Resvertrol, metabolic syndrome, and gut microbiota[J].Nutrients, 2018, 10(1 651):1-29.
[10] BERMAN A Y, MOTECHIN R A, WIESENFELD M Y, et al.The therapeutic potential of resveratrol:A review of clinical trials[J].Npj Precision Oncology, 2017, 1(35):1-9.
[11] LUCIA M.Influence of resveratrol on the immune response[J].Nutrients, 2019, 11(946):1-24.
[12] DOMINIQUE B R.Resveratrol and cardiovascular diseases[J].Nutrients, 2016, 8(250):1-24.
[13] SIMONE F, MARISA D P, PAOLA M, et al.Therapeutic potential of resveratrol against emerging respiratory viral infections[J].Pharmacology & Therapeutics, 2020, 214:1-7.
[14] 段雨婷, 蒙凌华.多靶点抗肿瘤天然产物研究进展[J/OL].药学学报.https:// doi.org /10.16438 /j.0513-4870.2020-1224.
DUAN Y T, MENG L H.Research progress in multi-targeted anti-tumor natural products[J/OL].Acta Pharmaceutica Sinica.https://doi.org/10.16438/j.0513-4870.2020-1224.
[15] 王新萍, 郭芹, 李甜, 等.植物中白藜芦醇提取和检测方法研究进展[J].食品安全质量检测学报, 2020, 21(11):7 957-7 965.
WANG X P, GUO Q, LI T, et al.Research progress on extraction and detection methods of resveratrol in plants[J].Journal of Food Safety and Quality, 2020, 21(11):7 957-7 965.
[16] YANG W Q, LI F L, XING X Y.Study in pesticide activities of Polygonum cuspidatum extracts and its active ingredient resveratrol[J].Natural Product Communications, 2019, 14(7):1-6.
[17] 董洁琼, 王意敏, 李建霞, 等.白藜芦醇含量影响及虎杖根中白藜芦醇闪提工艺优化[J].食品工业科技, 2016, 37(21):210-215.
DONG J Q, WANG Y M, LI J X, et al.Effect of phytohormones induced and abiotic stresses on reveratrol content and optimization of resveratrol flash-extraction in Polygonum cuspidatum roots[J].Science and Technology of Food Industry, 2016, 37(21):210-215.
[18] TONG L, LI L, SUNA K, et al.Trans-resveratrol extraction from peanut sprouts cultivated using fermented sawdust medium and its antioxidant activity[J].Journal of Food Science, 2020, 85(3):639-646.
[19] 康洁, 余慧琳.花生芽白藜芦醇的影响因素及分子结构研究[J].农产品加工, 2019(5):56-58.
KANG J, YU H L.Study on the influencing factors and molecular structure of resveratrol from peanut buds[J].Farm Products Procesing, 2019(5):56-58.
[20] 付诗鸣, 郑心, 伍辰光, 等.花生发芽前后酚类物质的提取工艺优化及其抗氧化活性比较[J].食品工业, 2019, 40(9):140-143.
FU S M, ZHENG X, WU C G, et al.Optimization of extraction technology and antioxidat activity of phenolic compounds from peanut before and after germination[J].The Food Industry, 2019, 40(9):140-143.
[21] 程建军, 徐丽, 欧才智, 等.优化催芽温度及CaCl2溶液浓度提高发芽小米中γ-氨基丁酸含量[J].农业工程学报, 2019, 35(2):301-308.
CHENG J J, XU L, OU C Z, et al.Optimization of germination temperature and CaCl2concentration to improve γ-amino butyric acid content in germination millet[J].Transaction of the Chinese Society of Agricultural Engineering, 2019, 35(2):301-308.
[22] 于国栋, 李莲芳, 孙昂, 等.微波辐射和IBA浸种对云南松种子发芽的影响[J].种子, 2014, 33(5):8-12.
YU G D, LI L F, SUN A, et al.Effects of microwave radiation and IBA presoaking seeds on germination parameters of Pinus yunnanensis[J].Seed, 2014, 33(5):8-12.
[23] 何建军, 姚立蓉, 汪军成, 等.干旱和盐胁迫对盐生植物盐生草种子萌发特性的影响[J].草业学报, 2020, 29(11):129-140.
HE J J, YAO L R, WANG J C, et al.Effects of drought and salt stress on seed germination characteristics of Halogeton glomeratus[J].Acta Prataculturae Sinica, 2020, 29(11):129-140.
[24] 于淼. 花生发芽过程中白藜芦醇富集技术与机理研究[D].沈阳:沈阳农业大学, 2016.
YU M.Research on resveratrol accumulation and regulation mechanism in the process of peanut germination[D].Shengyang:Shengyang Agricultural University, 2016.
[25] 中华人民共和国农业农村部.NY/T 2641—2014 植物源性食品中白藜芦醇和白藜芦醇苷的测定 高效液相色谱法[S].北京:中国农业出版社, 2015.
Ministry of Agriculture and Rural Affairs of the People′s Republic of China.NY/T 2641—2014 Determination of resveratrol and polydatin in plant origin products-high performance liquid chromatograp- hy[S].Beijing:China Agricultural Press, 2015.
[26] 鲍雪纤, 郑书绿, 李莲芳, 等.微波和激素处理对滇青冈幼苗根叶生长及生物量的影响[J].西部林业科学, 2016, 45(2):83-88.
BAO X X, ZHENG S L, LI L F, et al.Effects of microwave and hormone treatments on seedling root, leaf and biomass of Cyclobalanopsis glaucoides[J].Journal of West China Forestry Science, 2016, 45(2):83-88.