炎症性肠病(inflammatory bowel disease,IBD)是一种慢性的、反复发作的肠道炎症疾病。IBD主要包括克罗恩病(Crohn’s disease,CD)和溃疡性结肠炎(ulcerative colitis,UC)两种表型[1]。IBD发病机制是多因素的,包括肠上皮屏障破坏、免疫应答紊乱、肠道菌群变化等[2],但具体发病机制仍不清楚。在治疗IBD过程中服用的药物会引起多种副作用[3]。因此,研究IBD发病机制并探索降低治疗副作用的方法至关重要。
益生菌是缓解IBD的有效途径。益生菌可通过改善肠道屏障、降低肠道pH、调节肠道菌落组成等方式缓解结肠炎症状[4]。益生菌摄入可调整肠道菌群多样性,改善结肠炎引发的生态失调[5-6]。但高剂量摄入益生菌会加重小鼠结肠炎[7]。益生菌调节肠道菌群对机体产生影响的机理尚不清楚。结肠炎发病过程中,肠道受到外来物或致病菌刺激,导致肠道屏障、炎症水平等发生显著改变。抗生素通过干扰肠道菌群,改变肠道敏感性,降低肠道菌群复杂性,达到治疗疾病的目的,但抗生素的摄入会干扰肠道菌群定殖能力,与益生菌联合服用可能导致复杂的相互作用,改变肠道代谢及免疫[8-9]。
前期研究表明,植物乳杆菌AR113可以较好地缓解葡聚糖硫酸钠(dextran sulfate sodium,DSS)诱导的结肠炎症状,通过调节TLR4-NF-κB途径降低肠道炎症水平,改善肠道菌群组成,维持肠道屏障完整性[10]。本文考察青霉素干预及青霉素与植物乳杆菌AR113联合处理对小鼠结肠炎的影响,为解析植物乳杆菌AR113缓解结肠炎奠定基础。
1 实验材料
1.1 实验动物
C57BL/6 J小鼠,SPF级,日龄28~35 d,由上海杰斯捷实验动物有限公司(中国上海)提供,许可证号:SCXK(沪)2013—0006。
1.2 实验菌株
植物乳杆菌AR113筛选自四川泡菜,保藏于中国普通微生物菌种保藏管理中心(CGMCC),菌种保藏号:No.13909。
1.3 实验主要试剂
葡聚糖硫酸钠(MW:36 000~50 000),MP Biomedicals;便隐血试剂盒,贝索企业;5-氨基水杨酸,源叶生物;青霉素G钠盐、Trizol,生工生物;髓过氧化物酶(myeloperoxidase,MPO)试剂盒,南京建成;反转录试剂盒,南京诺唯赞;qPCR SYBR Green Master Mix,翊圣生物;引物由华大基因合成。
1.4 主要仪器设备
RM 2016病理切片机,德国Leica;JK-6组织摊烤片机,武汉俊杰;E100显微镜,尼康;550D数码单反相机,佳能;L500低速离心机,湖南湘仪;Nano Drop 2 000分光光度计,Thermo Scientific;S1000梯度PCR仪,美国伯乐Bio-rad;LightCycler96实时荧光定量PCR仪,罗氏制药。
2 实验方法
2.1 动物分组及处理
雄性C57BL/6J小鼠适应性喂养一周,每笼8只,饲养温度(22 ± 2)℃,相对湿度(50±5)%,循环12 h光照/黑暗。动物实验选用3% DSS造模。48只小鼠随机分为6组,分别为正常组(Control)、模型组(DSS)、阳性对照组(DSS+5-ASA)、AR113组(DSS+AR113)、青霉素干预组(DSS+Pen)、青霉素与AR113联合组(DSS+Pen+AR113)(青霉素干预后灌胃植物乳杆菌AR113)。
小鼠适应1周后,青霉素干预组、青霉素与AR113联合组自由饮用1 g/L的青霉素钠盐水溶液3周,其余各组饮用无菌水3周。随后所有实验组自由饮用无菌水3 d后,小鼠自由饮用3% DSS水溶液造模7 d,造模第5天开始到第14天,阳性对照组灌胃5-氨基水杨酸(5 g/L),AR113组、青霉素与AR113联合组灌胃植物乳杆菌AR113(1×109 CFU/mL),其余各组灌胃无菌水。本研究遵循动物试验委员会所制订的伦理学标准,批准文号为伦审-KYSB-2016-97。实验流程如图1所示:
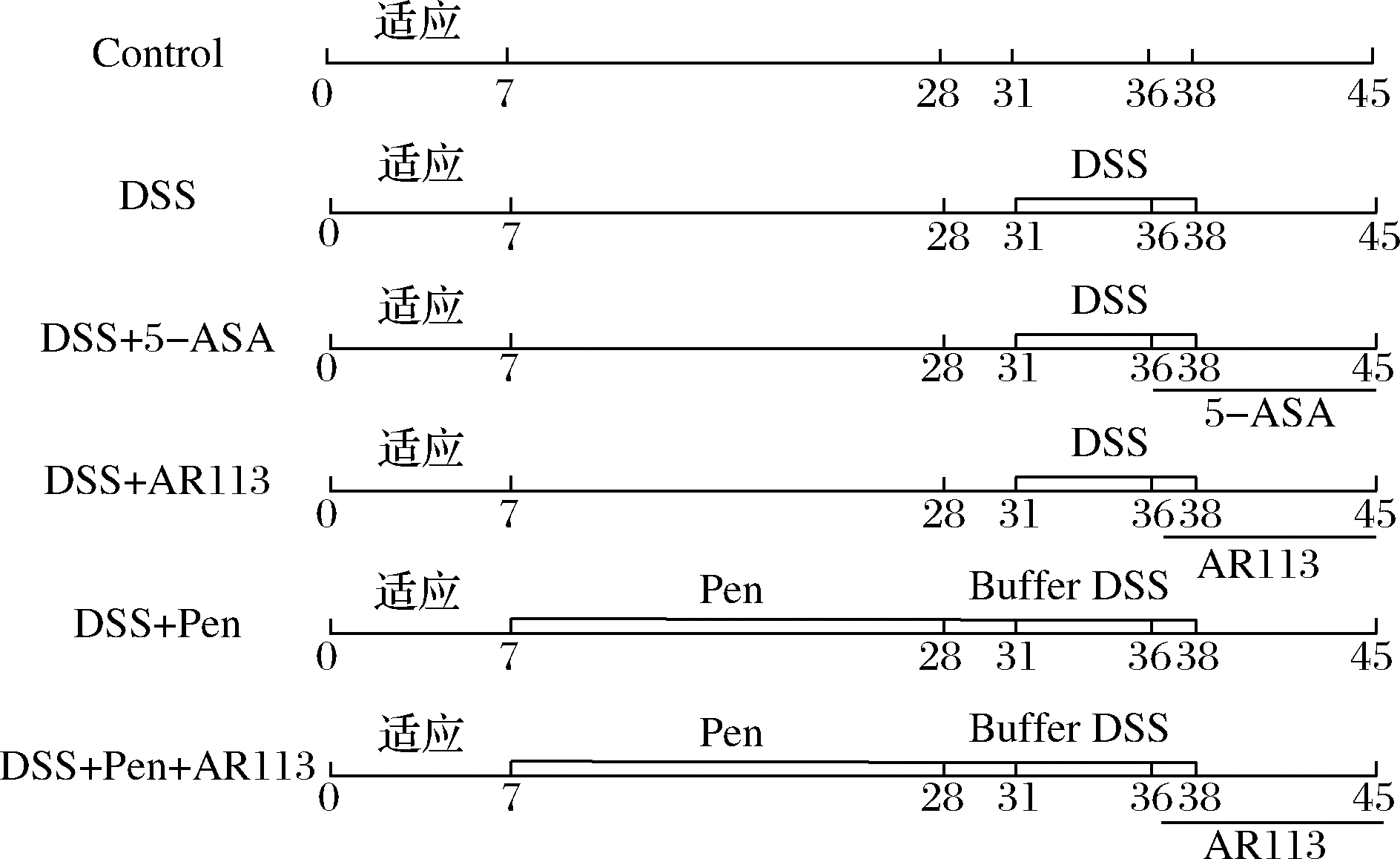
图1 实验流程图
Fig.1 Experimental protocols
2.2 小鼠疾病活动指数(disease activity index,DAI)的测定
DAI评分基于 MURTHY 评分系统[11]。DAI 包括3个部分:体重变化、便血情况和粪便性状。选用便隐血试剂盒测粪便中的潜血。具体评分标准如表1所示:
表1 疾病活动指数评分标准
Table 1 Disease activity index scoring standards

体重下降/%大便性状隐血/肉眼血便分数0正常隐血阴性01~5松散隐血阴性16~10松散隐血阳性211~15稀便隐血阳性3>15稀便肉眼血便4
2.3 苏木精-伊红(hematoxylin-eosin,H&E)染色及阿利新蓝染色
采用阿利新蓝将结肠黏液层的黏蛋白染成蓝色,评估结肠黏蛋白变化[12]。H&E 对结肠染色进行形态学评估[13]。根据炎症、隐窝损伤程度、黏膜损伤和病变范围对H&E染色照片进行组织损伤评分。组织损伤评分标准如表2所示:
表2 组织损伤评分标准
Table 2 Histological score standards

炎症病变深度隐窝破坏病变范围/%分数无无无无0轻黏膜层1/31~251中黏膜下层2/326~502重肌层和浆膜层100%51~753--全部隐窝和肠上皮破坏76~1004
2.4 MPO测定
根据南京建成MPO试剂盒说明书进行测定。
2.5 结肠组织mRNA表达量测定
Trizol法提取结肠组织总RNA,根据反转录试剂盒说明书合成cDNA。根据qPCR SYBR Green Master Mix使用说明对肠道相关基因进行PCR扩增和检测。所涉及的引物序列如表3所示,以β-actin作为内参,采用2-ΔΔCt法计算基因相对表达量。
表3 引物序列
Table 3 Primer sequence
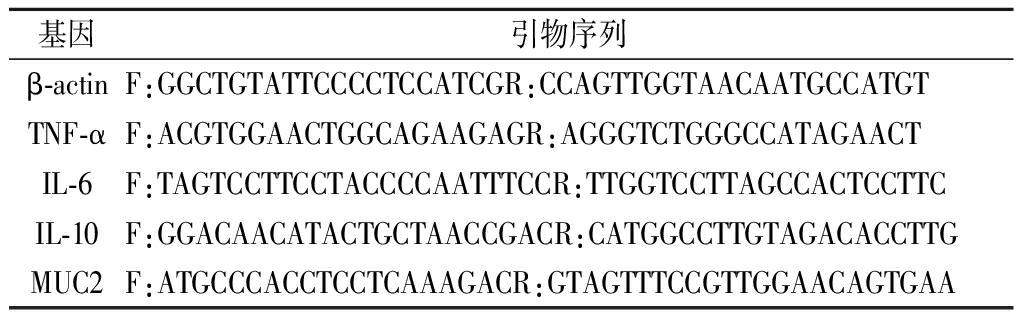
基因引物序列β-actinF:GGCTGTATTCCCCTCCATCGR:CCAGTTGGTAACAATGCCATGTTNF-αF:ACGTGGAACTGGCAGAAGAGR:AGGGTCTGGGCCATAGAACTIL-6F:TAGTCCTTCCTACCCCAATTTCCR:TTGGTCCTTAGCCACTCCTTCIL-10F:GGACAACATACTGCTAACCGACR:CATGGCCTTGTAGACACCTTGMUC2F:ATGCCCACCTCCTCAAAGACR:GTAGTTTCCGTTGGAACAGTGAA
2.6 统计学分析
采用SPSS 17.0统计软件分析数据,实验结果均采用均值±标准偏差(Mean±SD)表示,组间比较采用单因素方差分析,P<0.05表示差异有统计学意义。
3 结果与讨论
3.1 小鼠DAI与体重变化
DAI表征小鼠结肠炎发展状况。研究结果显示(图2),随着DSS摄入,模型组小鼠体重逐渐降低,AR113组与阳性对照组能够显著减缓小鼠体重降低。但青霉素干预组与联合处理组在实验周期内体重无显著降低,变化趋势与正常组小鼠一致(图2-a)。与模型组小鼠相比,AR113组能够显著降低结肠组织DAI评分,而青霉素干预组以及联合处理组DAI评分变化无显著差异,显著低于模型组以及AR113组,变化趋势与正常组接近(图2-b),这与体重监测结果一致。实验结束时,各组小鼠体重与DAI存在显著差异(图2-c、d)。
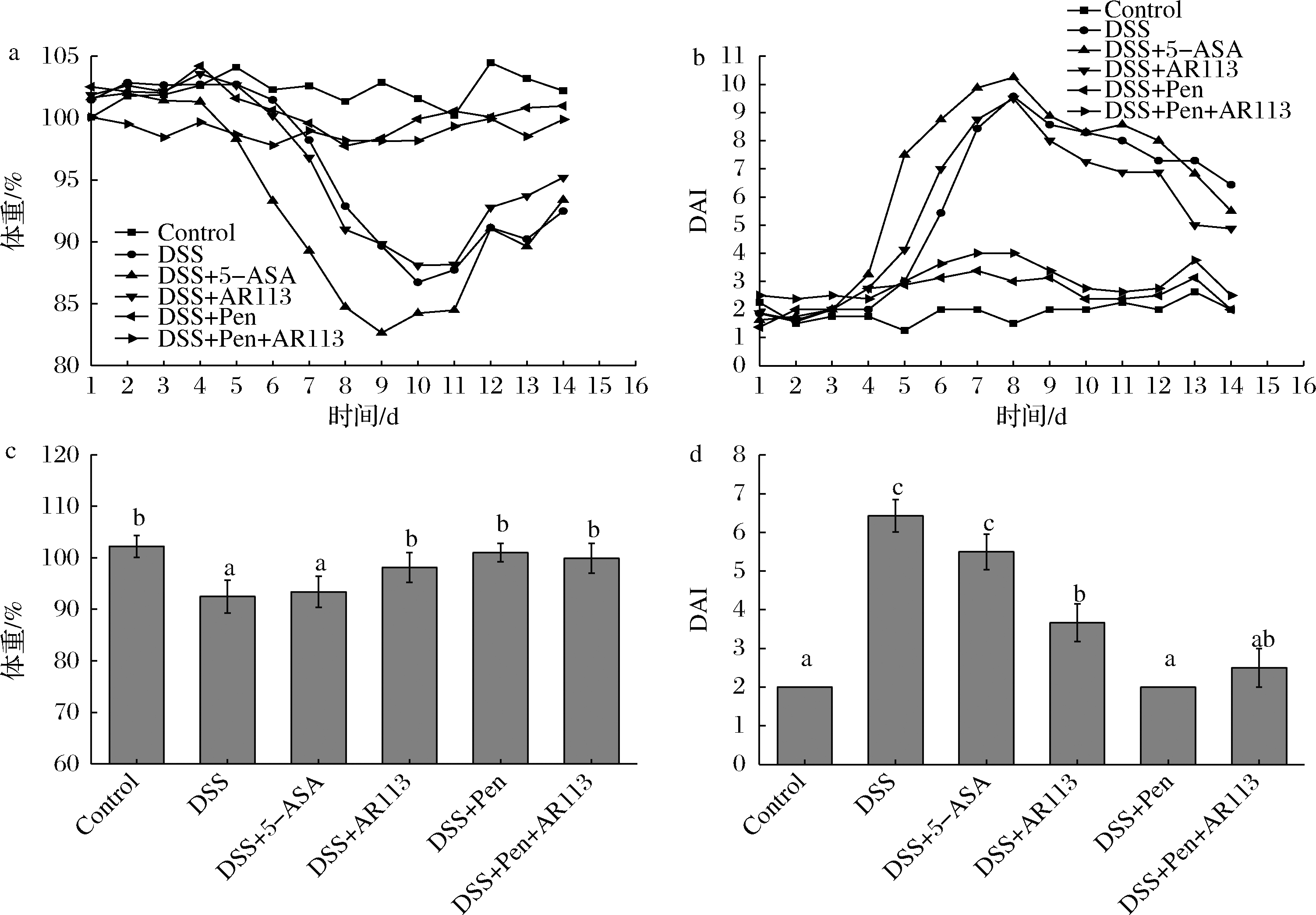
a-实验周期内小鼠体重变化;b-实验周期内小鼠DAI变化;c-实验结束时各组小鼠体重差异;d-实验结束时各组小鼠DAI差异
图2 青霉素与植物乳杆菌AR113对小鼠体重及疾病活动指数的影响
Fig.2 Effects of penicillin and Lactobacillus plantarum AR113 on body weight and disease activity index of mice
3.2 青霉素及植物乳杆菌AR113对肠道活性及结肠长度影响
MPO是只存在于中性粒细胞和单核细胞中的颗粒血红素酶。中性粒细胞是急性炎症的标志,当病原体侵入时,中性粒细胞将病原体吞噬,保证机体的正常运行[14]。故检测结肠中MPO活性表征小鼠结肠炎症程度。研究结果表明,模型组小鼠MPO活性显著升高,AR113组MPO活性最低;青霉素干预组与联合处理组也能够显著降低MPO活性,可使其恢复到正常组水平且两组间无显著差异(图3-a)。结肠长度变化可表征小鼠炎症程度。模型组小鼠结肠长度显著降低,与MPO结果相一致,青霉素干预组以及联合处理组得到有效缓解,结肠长度恢复到正常水平(图3-b)。

a-小鼠结肠MPO活性;b-结肠长度
图3 青霉素与植物乳杆菌AR113对小鼠结肠MPO 活性及结肠长度的影响
Fig.3 Effects of penicillin and L.plantarum AR113 on MPO activity and colon length in mouse colon
3.3 结肠组织H&E染色及组织损伤评分
小鼠摄入DSS后引起结肠组织发生炎症反应,如图4-a所示。模型组结肠上皮组织结构破坏,中性粒细胞数量增多,出现隐窝消失。灌胃AR113后,小鼠结肠上皮组织结构恢复良好,显著减少中性粒细胞数量,与DIN等[15]研究结果一致。青霉素干预组以及联合处理组小鼠结肠组织同样得到良好恢复。组织评分显示(图4-b),模型组组织损伤评分显著高于对照组,灌胃AR113后组织损伤程度降低,而经过青霉素以及联合治疗后,小鼠结肠组织损伤程度最低,且两者无显著差异。
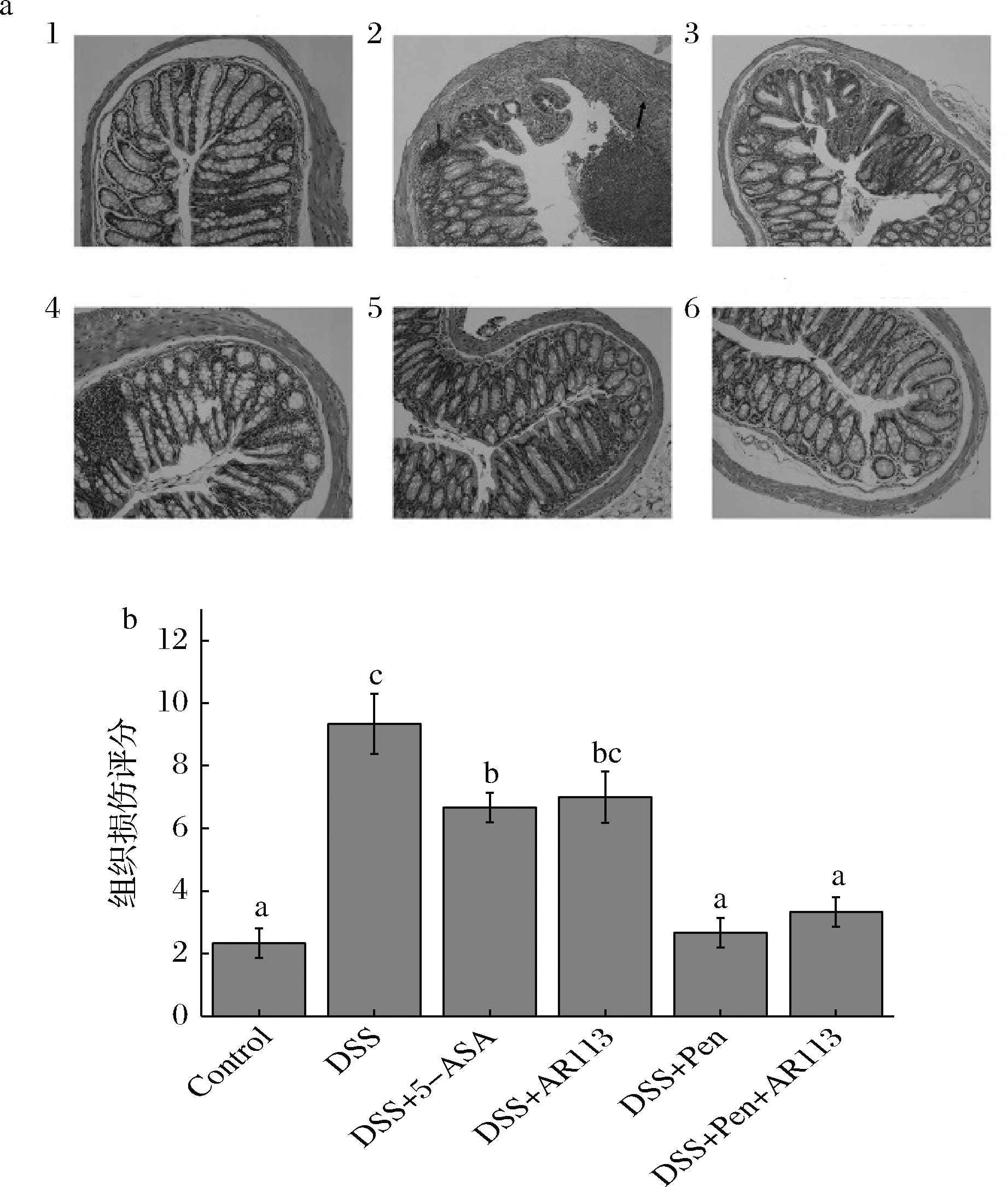
a-结肠HE染色图;b-结肠组织损伤评分 1-正常组;2-模型组;3-阳性对照;4-AR113组;5-青霉素干预; 6-青霉素与AR113联合
图4 青霉素与植物乳杆菌AR113对小鼠结肠组织的影响
Fig.4 Effects of penicillin and L.plantarum AR113 on mouse colon tissue
3.4 青霉素及植物乳杆菌AR113对肠道上皮黏液层影响
肠道上皮黏液层对肠道组织具有保护作用,是一个由黏液蛋白组成的复杂结构。其中黏蛋白MUC2是由肠道上皮组织杯状细胞分泌,用于保护肠道及维持肠道稳态[16]。阿利新蓝可与MUC2结合,表征肠道上皮黏蛋白含量[17]。由图5-a可知,由于模型组结肠上皮组织结构被破坏,大量杯状细胞损伤,导致黏蛋白分泌量明显减少,与H&E染色与组织损伤评分结果一致。灌胃AR113后,结肠组织结构恢复,黏蛋白MUC2含量明显增加;与模型组相比,青霉素干预组与联合处理组黏蛋白MUC2含量也出现增加,但是含量低于AR113组。qPCR结果显示(图5-b),灌胃AR113黏蛋白合成基因MUC2表达量显著上升,且表达量在各组中最高,黏蛋白含量显著增加。青霉素干预组以及联合处理组经过治疗后,黏蛋白合成基因MUC2表达量恢复到正常水平,且两组间无显著差异。抗生素处理后,服用植物乳杆菌AR113不会干扰肠道上皮细胞黏液层恢复,但抗生素会降低黏液层的恢复效果。

a-结肠阿利新蓝染色;b-结肠MUC2蛋白相对表达水平 1-正常组;2-模型组;3-阳性对照;4-AR113组;5-青霉素干预; 6-青霉素与AR113联合
图5 青霉素与植物乳杆菌AR113对小鼠结肠黏液层的影响
Fig.5 Effects of penicillin and L.plantarum AR113 on mucus layer of mouse colon
3.5 青霉素及植物乳杆菌AR113对结肠炎症因子水平影响
机体正常状态下,免疫系统维持稳态。当机体受到外界干扰时,免疫细胞受刺激,释放炎症因子作为信号分子,刺激相关细胞调节机体免疫,使机体恢复正常状态[18-19]。如图6所示,DSS造模后,模型组小鼠结肠组织损伤,促炎因子TNF-α、IL-6表达显著增加(图6-a、b),抑炎因子IL-10表达量有一定降低(图6-c),但不显著。灌胃AR113后,小鼠促炎因子TNF-α、IL-6表达显著降低(图6-a、b),抑炎因子IL-10表达显著升高(图6-c)。青霉素干预组以及联合处理组治疗后,炎症因子变化趋势无显著差异,两组均能够显著降低TNF-α基因表达量(图6-a),且表达水平显著低于AR113组,但是抑炎因子IL-10表达水平显著低于AR113组(图6-c)。利用无菌小鼠进行DSS造模,小鼠无明显结肠炎症状,而正常小鼠则出现严重结肠炎症状,说明肠道菌群可能介导小鼠结肠炎发病[20]。SOVRAN等[21]研究表明,抗生素可显著影响真菌对DSS诱导小鼠肠炎模型的治疗效果。分析肠道菌群显示,真菌治疗效果受肠杆菌影响。万古霉素处理小鼠后,杀灭肠道中的肠杆菌,造成小鼠对DSS诱导不敏感,降低结肠炎发病率。因此,青霉素摄入可能通过有效降低促炎菌群,从而抑制促炎因子的表达,降低炎症水平[22]。
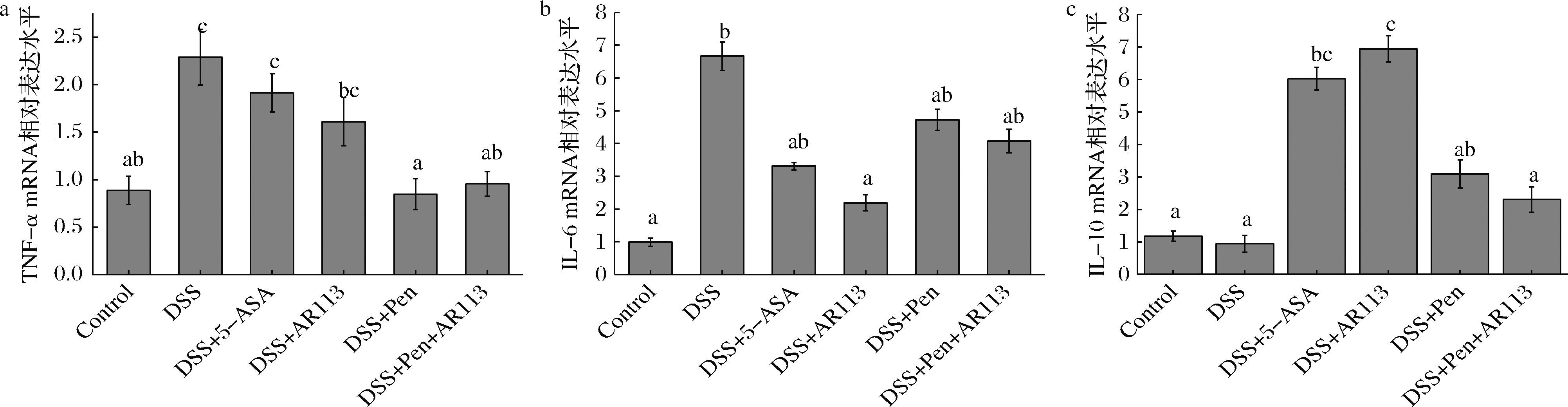
a-TNF-α mRNA相对表达水平;b-IL-6 mRNA相对表达水平; c-IL-10 mRNA相对表达水平
图6 青霉素与植物乳杆菌AR113对小鼠结肠炎症因子表达水平的影响
Fig.6 Effects of penicillin and L.plantarum AR113 on the expression of inflammatory factors in the colon of mice
4 结论
益生菌与抗生素常用于炎症性肠病缓解治疗,两者治疗肠炎作用机制有所差异。植物乳杆菌AR113可以有效缓解小鼠结肠炎症,恢复损伤的杯状细胞,增加黏蛋白MUC2分泌,同时显著提升小鼠结肠抑炎因子IL-10表达,激活肠道免疫系统。青霉素干预组与联合处理组小鼠结肠症状以及大部分指标并无明显差异,均能够有效降低结肠促炎因子TNF-α表达,恢复肠道黏液层。青霉素干预处理在一定程度上钝化DSS诱导结肠炎敏感性。但与灌胃AR113相比,青霉素处理会降低杯状细胞恢复,影响黏蛋白MUC2分泌,并降低结肠抑炎因子表达。益生菌摄入能够有效恢复结肠炎症状,在一定程度上能够替代抗生素对结肠炎的治疗。
[1] CHEN S N,ZHAO H A,CHENG N,et al.Rape bee pollen alleviates dextran sulfate sodium (DSS)-induced colitis by neutralizing IL-1β and regulating the gut microbiota in mice[J].Food Research International,2019,122:241-251.
[2] TIAN X L,PENG Z L,LUO S P,et al.Aesculin protects against DSS-Induced colitis though activating PPAR γ and inhibiting NF-кB pathway[J].European Journal of Pharmacology,2019,857.DOI:10.1016/j.ejphar.2019.172453.
[3] KIM W S,SONG H Y,HAN J M,et al.GLM,a novel luteolin derivative,attenuates inflammatory responses in dendritic cells:Therapeutic potential against ulcerative colitis[J].Biochemical and Biophysical Research Communications,2019,518(1):87-93.
[4] SILVA D R,SARDI J D C O,PITANGUI N D S,et al.Probiotics as an alternative antimicrobial therapy:Current reality and future directions[J].Journal of Functional Foods,2020,73.DOI:10.1016/j.jff.2020.104080.
[5] RODR GUEZ-NOGALES A,ALGIERI F,GARRIDO-MESA J,et al.Intestinal anti-inflammatory effect of the probiotic Saccharomyces boulardii in DSS-induced colitis in mice:Impact on microRNAs expression and gut microbiota composition[J].The Journal of Nutritional Biochemistry,2018,61:129-139.
GUEZ-NOGALES A,ALGIERI F,GARRIDO-MESA J,et al.Intestinal anti-inflammatory effect of the probiotic Saccharomyces boulardii in DSS-induced colitis in mice:Impact on microRNAs expression and gut microbiota composition[J].The Journal of Nutritional Biochemistry,2018,61:129-139.
[6] GHYSELINCK J,VERSTREPEN L,MOENS F,et al.A 4-strain probiotic supplement influences gut microbiota composition and gut wall function in patients with ulcerative colitis[J].International Journal of Pharmaceutics,2020,587.DOI:10.1016/j.ijpharm.2020.119648.
[7] KOMAKI S,HAQUE A,MIYAZAKI H,et al.Unexpected effect of probiotics by Lactococcus lactis subsp.lactis against colitis induced by dextran sulfate sodium in mice[J].Journal of Infection and Chemotherapy,2020,26(6):549-553.
[8] LI L Y,WANG Q,GAO Y Y,et al.Colistin and amoxicillin combinatorial exposure alters the human intestinal microbiota and antibiotic resistome in the simulated human intestinal microbiota[J].Science of the Total Environment,2021,750.DOI:10.1016/j.scitotenv.2020.141415.
[9] SUEZ J,ZMORA N,ZILBERMAN-SCHAPIRA G,et al.Post-antibiotic gut mucosal microbiome reconstitution is impaired by probiotics and improved by autologous FMT[J].Cell,2018,174(6):1 406-1 423.
[10] XIA Y J,CHEN Y,WANG G Q,et al.Lactobacillus plantarum AR113 alleviates DSS-induced colitis by regulating the TLR4/MyD88/NF-κB pathway and gut microbiota composition[J].Journal of Functional Foods,2020,67.DOI:10.1016/j.jff.2020.103854.
[11] MURTHY S N S,COOPER H S,SHIM H,et al.Treatment of dextran sulfate sodium-induced murine colitis by intracolonic cyclosporin[J].Digestive Diseases and Sciences,1993,38(9):1 722-1 734.
[12] STEEDMAN H F.Alcian blue 8GS:A new stain for mucin[J].The Quarterly Journal of Microscopical Science,1950,91(4):477-479.
[13] ALEX P,ZACHOS N C,NGUYEN T,et al.Distinct cytokine patterns identified from multiplex profiles of murine DSS and TNBS-induced colitis[J].Inflammatory Bowel Diseases,2009,15(3):341-352.
[14] CHAMI B,MARTIN N J J,DENNIS J M,et al.Myeloperoxidase in the inflamed colon:A novel target for treating inflammatory bowel disease[J].Archives of Biochemistry and Biophysics,2018,645:61-71.
[15] DIN A U,HASSAN A,ZHU Y,et al.Inhibitory effect of Bifidobacterium bifidum ATCC 29521 on colitis and its mechanism[J].The Journal of Nutritional Biochemistry,2020,79.DOI:10.1016/j.jnutbio.2020.108353.
[16] LIU Y,YU X J,ZHAO J X,et al.The role of MUC2 mucin in intestinal homeostasis and the impact of dietary components on MUC2 expression[J].International Journal of Biological Macromolecules,2020,164:884-891.
[17] 王俊通. 产共轭亚油酸乳酸菌对DSS诱导小鼠结肠炎的改善作用[D].无锡:江南大学,2016.
WANG J T.Ameliorating effects of CLA-producing lactic acid bacteria on DSS-induced colitis in mice[D].Wuxi:Jiangnan University,2016.
[18] ![]() T J.Cells of the innate and adaptive immunity and their interactions in inflammatory bowel disease[J].Advances in Medical Sciences,2017,62(1):1-16.
T J.Cells of the innate and adaptive immunity and their interactions in inflammatory bowel disease[J].Advances in Medical Sciences,2017,62(1):1-16.
[19] FLOREAN C,DICATO M,DIEDERICH M.Immune-modulating and anti-inflammatory marine compounds against cancer[J].Seminars in Cancer Biology,2020.DOI:10.1016/j.semcancer.2020.02.008.
[20] HERN NDEZ-CHIRLAQUE C,ARANDA C J,OC
NDEZ-CHIRLAQUE C,ARANDA C J,OC N B,et al.Germ-free and antibiotic-treated mice are highly susceptible to epithelial injury in DSS colitis[J].Journal of Crohn’s and Colitis,2016,10(11):1 324-1 335.
N B,et al.Germ-free and antibiotic-treated mice are highly susceptible to epithelial injury in DSS colitis[J].Journal of Crohn’s and Colitis,2016,10(11):1 324-1 335.
[21] SOVRAN B,PLANCHAIS J,JEGOU S,et al.Enterobacteriaceae are essential for the modulation of colitis severity by fungi[J].Microbiome,2018,6(1):1-16.
[22] HAO W Z,LI X J,ZHANG P W,et al.A review of antibiotics,depression,and the gut microbiome[J].Psychiatry Research,2020,284.DOI:10.1016/j.psychres.2019.112691.