肝素属于糖胺聚糖家族,是一种硫酸多糖。各种分子质量肝素作为主要的抗凝药物应用于抗血栓基本的治疗。目前的肝素主要来源于猪、牛等陆地动物,但存在疯牛病事件、杂质污染事件及宗教信仰等问题,以及出血、骨质疏松症、血小板减少症等副作用,因此寻找陆地动物源肝素替代物质变得迫切[1]。与传统肝素相比,海洋生物硫酸多糖来源相对清洁,而且具有作用途径多样、副作用较小的抗血栓活性,是替代传统肝素的潜力来源[2-5]。
海蚌学名“西施舌”(Coelomactra antiquata),隶属于软体动物门的瓣鳃纲,真瓣鳃目,蛤蜊科,腔蛤蜊属,在我国山东至广东沿海等地均有分布。海蚌不仅具有较高的营养价值,也具有一定的保健价值。研究表明,海蚌具有抗氧化、降血脂[6]、降血糖[7]、抗肿瘤[8-9]、溶菌[10]活性。此外,本课题组前期通过酶解提取,大孔阴离子交换树脂纯化得到了一种具有高硫酸基含量、良好纤溶活性、强抗凝活性的大分子质量肝素G2[11]。但大分子质量肝素具有黏度大、溶解性差,生物利用度低等缺点[12],且肝素的抗血栓活性与分子质量有关,低分子质量肝素相比普通分子质量肝素,其抗血栓活性具有作用多途径、多靶点、副作用少等特点[2]。因此,本文对海蚌肝素G2及其降解产物DG1、DG2进行结构表征,并研究其抗凝血、纤溶活性,以期为拓宽肝素的海洋生物来源提供理论依据。
1 材料与方法
1.1 材料与试剂
海蚌,广东省湛江市水产品批发市场;2709碱性蛋白酶、木瓜蛋白酶、PBS磷酸盐粉剂、琼脂糖、绵羊血浆,上海源叶生物科技有限公司;Amberlite FPA98Cl型离子交换树脂、Na2SO4,上海麦克林生化科技有限公司;肝素(Mw:3.5 k、5 k、8 k、15 k、30 kDa),北京阿斯雷尔生物技术有限公司;肝素标准品(heparin,HP,190 IU/mg)、低分子质量肝素标准品(low molecular weight heparin,LMWH),抗Ⅱa、Ⅹa因子效价分别为571 IU/安瓿、1 497 IU/安瓿、凝血酶(1 000 U)、尿激酶(50 U/mg)、牛纤维蛋白原,中国食品药品检定研究所;部分凝血活酶时间(activated partial thromboplastin time,APTT)、凝血酶原时间(prothrombin time,PT)和血浆凝血酶时间(thrombin time,TT)试剂盒,武汉中太生物技术有限公司;甲醇(色谱纯),赛默飞世尔科技公司;无水乙醇、NaCl等其他试剂,西陇科学股份有限公司。
1.2 仪器与设备
HH-8数显恒温水浴锅,常州国华电器有限公司;Sorvall Lynx6000高速落地离心机,赛默飞世尔科技公司;N-4000旋转蒸发仪,东京理化器械株式会社;FD8508型真空冷冻干燥机,韩国ilShin公司;Agilent1200高效液相色谱仪,美国安捷伦公司;Bruker Tensor-27傅里叶红外光谱仪、Bruker Dimension Edge原子力显微镜,德国Bruker公司;Varioskan Flash多功能酶标仪器;Chirascan圆二色光谱仪,英国应用光物理公司;JEM-7610-F扫描电子显微镜,日本JEOL公司;XN06半自动凝血分析仪,武汉景川诊断技术股份有限公司。
1.3 实验方法
1.3.1 不同分子质量海蚌肝素的制备
参考文献[11]并略作修改,将海蚌去壳,匀浆。料液比1∶10(g∶mL),6 mg/mL的NaCl溶液,5.4 mg/mL的木瓜蛋白酶和5.4 mg/mL的2709碱性蛋白酶(pH 8.0,50 ℃),酶解20 h,沸水浴灭酶10 min,冷却后离心(8 000 r/min,30 min),取上清液浓缩得海蚌肝素酶解液;以FPA98 CI大孔离子交换树脂层析柱(26 cm×100 cm)对海蚌肝素进行分离纯化,动态吸附上样后,用0、0.5、1、1.5 mol/L的NaCl溶液进行梯度洗脱,收集1.5 mol/L的NaCl溶液的洗脱液,每管均收集10 mL,以阿利新蓝比色法检测肝素含量,以收集管数为横坐标,吸光度值(A490 nm)为纵坐标绘洗脱曲线。根据峰型收集洗脱液,浓缩后加入0.4倍体积的无水乙醇醇沉,透析(3 kDa)、冻干后得海蚌肝素G2。
采用H2O2-维生素C降解法降解G2获得DG1、DG2。DG1降解剂为4 mmol/L H2O2和5 mmol/L 维生素C,DG2降解剂为64 mmol/L H2O2和5 mmol/L 维生素C,样品浓度均为5 mg/mL。
1.3.2 不同分子质量海蚌肝素的分子质量测定
通过高效凝胶色谱法测定样品分子质量。用流动相把海蚌肝素样品和肝素分子质量窄标(平均分子质量分别为3.55 k、5.2 k、7.4 k、15 k、30 kDa)配制成为5 mg/mL的溶液,用0.22 μm的滤膜过滤后待用。采用Waters Ultra hydrogel TM500色谱柱(10 μm,7.8 mm×300 mm),在流动相为0.2 mol/L Na2SO4溶液,流速0.5 mL/min,柱温35 ℃,进样量10 μL的条件下以1200示差折光检测器检测肝素分子质量窄标和海蚌肝素样品的高效凝胶色谱法图,记录保留时间后进行数据处理。
1.3.3 不同分子质量海蚌肝素的结构分析
1.3.3.1 傅里叶红外光谱分析
将海蚌肝素样品与KBr(质量比1∶100)混匀,研磨后压制成半透明薄片,采用傅里叶红外光谱在4 000~400 cm-1处进行扫描。
1.3.3.2 圆二色谱分析
将海蚌肝素样品配制成0.5 mg/mL的溶液。在25 ℃条件下,以圆二色谱仪在190~240 nm波长范围进行扫描。
1.3.3.3 扫描电镜分析
将适量海蚌肝素样品置于铜片上,粘贴固定,镀金,在30 kV条件下对海蚌肝素的表面形态进行观察并拍照。
1.3.3.4 原子力显微镜分析
海蚌肝素样品溶液(10 μg/mL)以0.45 μm一次性滤器过滤,取5~10 μL滴在云母片表面上,室温下干燥过夜后以原子力显微镜观测其微观形貌。
1.3.4 不同分子质量海蚌肝素的抗凝血与纤溶活性分析
1.3.4.1 抗凝效价测定
按照中国药典中肝素钠效价的测定方法进行测定[13]。
1.3.4.2 体外抗凝血活性评价
采用APTT、PT、TT试剂盒分析海蚌肝素样品的体外抗凝血活性。所用血浆购自试剂公司的新鲜羊血浆。阴性对照为生理盐水,阳性对照为肝素钠标准品。
1.3.4.3 纤溶活性评价
海蚌肝素的体外纤维蛋白溶解活性通过琼脂糖-纤维蛋白平板法测定[11]。
1.4 统计学处理
试验结果均以平均数±标准偏差![]() 表示;组间差异采用t检验及方差分析进行统计分析。检验水平为P<0.05有统计学意义。
表示;组间差异采用t检验及方差分析进行统计分析。检验水平为P<0.05有统计学意义。
2 结果与分析
2.1 不同分子质量海蚌肝素分子质量测定结果
采用H2O2-维生素C降解法制备不同分子质量海蚌肝素。H2O2作为强氧化剂,可以产生大量的强氧化性的自由基,它可以破坏糖苷键,降解多糖[14]。由图1可知,随着H2O2浓度增大,降解产物分子质量先急速下降后缓慢下降。当H2O2浓度达到16 mmol/L时,H2O2浓度的增加对降解产物的分子质量影响不明显。这是因为过量的H2O2可能会被各种机制消耗并破坏刚刚形成的OH·[15]。因此,为了得到不同分子质量的海蚌肝素,本实验以G2为原料,通过控制H2O2浓度获得DG1、DG2。通过高效凝胶色谱对G2、DG1、DG2的分子质量进行分析。结果如图2所示,G2、DG1、DG2的色谱峰单一,且峰形随着分子质量的降低变得狭窄,说明不同分子质量海蚌肝素纯度均较高,降解使海蚌肝素质量分布更为均一。肝素标准品分子质量的对数(y)与保留时间(x)的线性方程为:y=-0.306 6x+9.970 1(R2=0.997 6),以此计算出G2、DG1、DG2的分子质量分别为60.25 k、24.48 k、6.75 kDa。

图1 H2O2浓度对降解产物分子质量的影响
Fig.1 Effect of H2O2concentration on molecular weight of degraded products
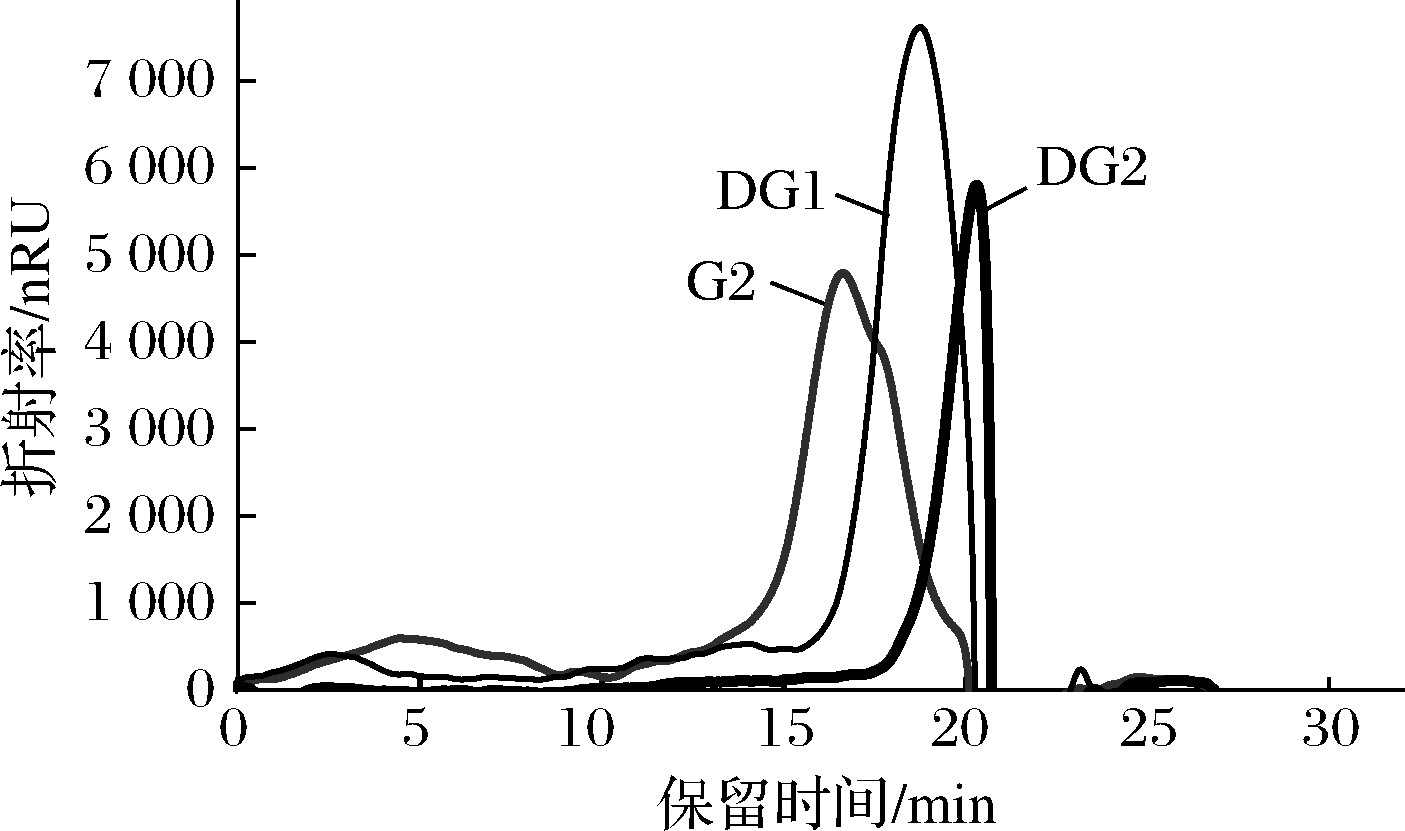
图2 不同分子质量海蚌肝素的高效凝胶色谱图
Fig.2 HPGPC chromatogram of clam heparin with different molecular weights
2.2 不同分子质量海蚌肝素的结构分析
2.2.1 红外色谱分析
对G2、DG1、DG2进行红外光谱扫描,结果如图3所示,890、940 cm-1左右出现了肝素的特征峰,1 240 cm-1左右呈现O—S键伸缩振动峰,800~850 cm-1处呈现了氨基己糖上硫酸基团的C—O—S系统伸缩振动峰[1,16]。G2、DG1、DG2的红外色谱图基本相似,特征吸收峰和重要官能团种类未发生变化,但随着分子质量的降低,光谱峰峰值增加,说明G2、DG1、DG2在官能团上无明显差异,符合肝素的红外色谱特征,且H2O2-维生素C降解法降解海蚌肝素的过程对基本结构和活性基团没有影响,可能只是糖苷键断裂,暴露取代基,降低分子质量的过程,而使相应红外吸收信号增强[17-19]。
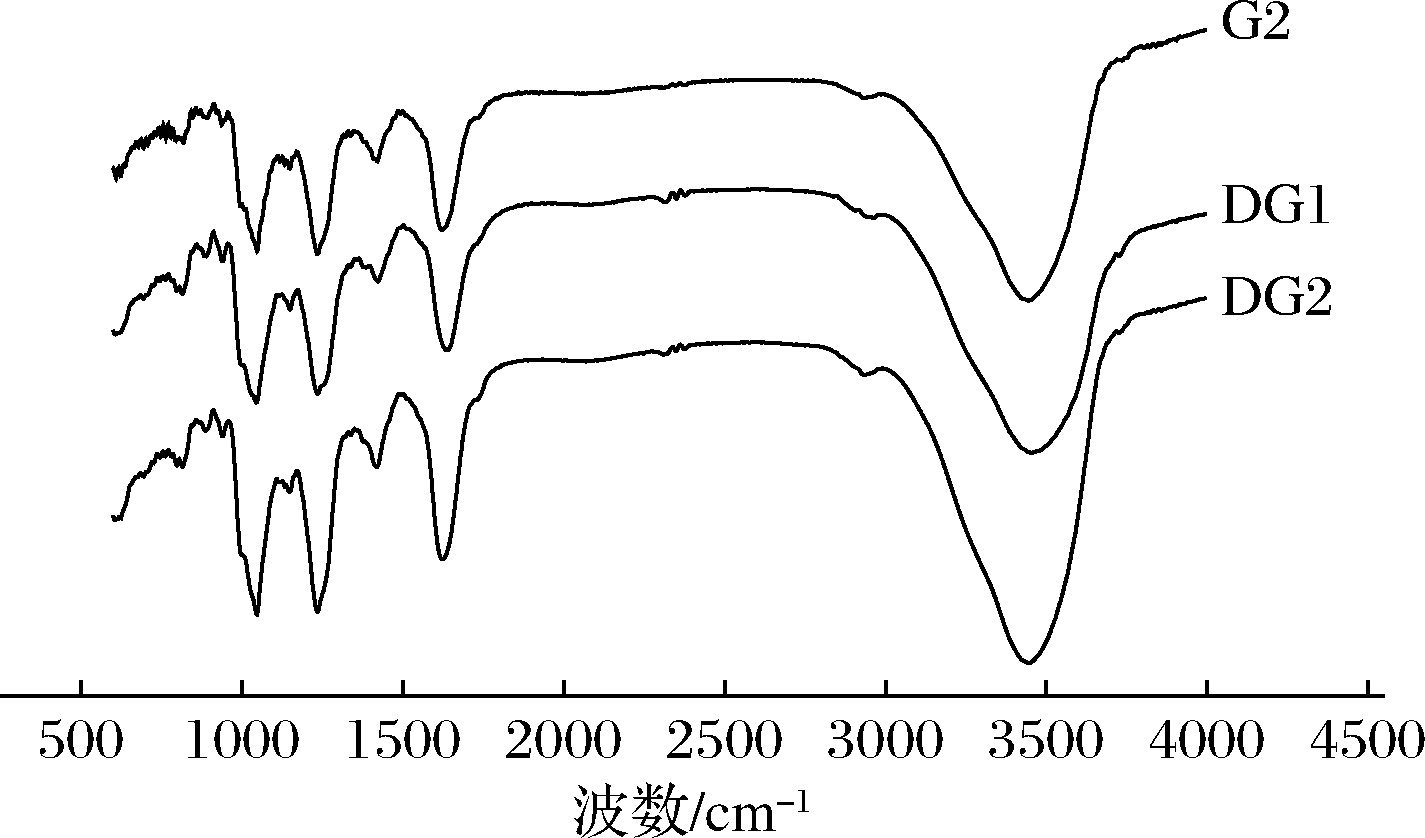
图3 不同分子质量海蚌肝素的红外光谱图
Fig.3 Fourier transform infrared spectrogram of clam heparin with different molecular weights
2.2.2 圆二色谱分析
圆二色谱是研究化合物三维结构的有效方法。G2、DG1、DG2及HP、LMWH在190~260 nm处的圆二色谱如图4所示。它们峰值均出现在210 nm左右,但峰值不同。商品肝素与海蚌肝素的色谱峰均随着分子质量的降低,峰值变小。这些结果表明,降解可能在一定程度上影响肝素的结构[20]。

a-HP和LMWH;b-不同分子质量海蚌肝素
图4 HP、LMWH及不同分子质量海蚌肝素的圆二色谱图
Fig.4 CD chromatogram of HP,LMWH and clam heparin with different molecular weights
2.2.3 扫描电镜分析
对3种分子质量的海蚌肝素分别进行扫描电镜观察,结果如图5所示。在1 000、3 000、10 000倍镜下进行观察,发现海蚌肝素G2呈表面粗糙、多孔的片状结构。而DG1、DG2在1 000倍下进行观察,发现随着分子质量的降低,碎片状结构和球状结构增加。这可能与降解后分子质量降低[21-22]或海蚌肝素的分子极性变化有关[23]。
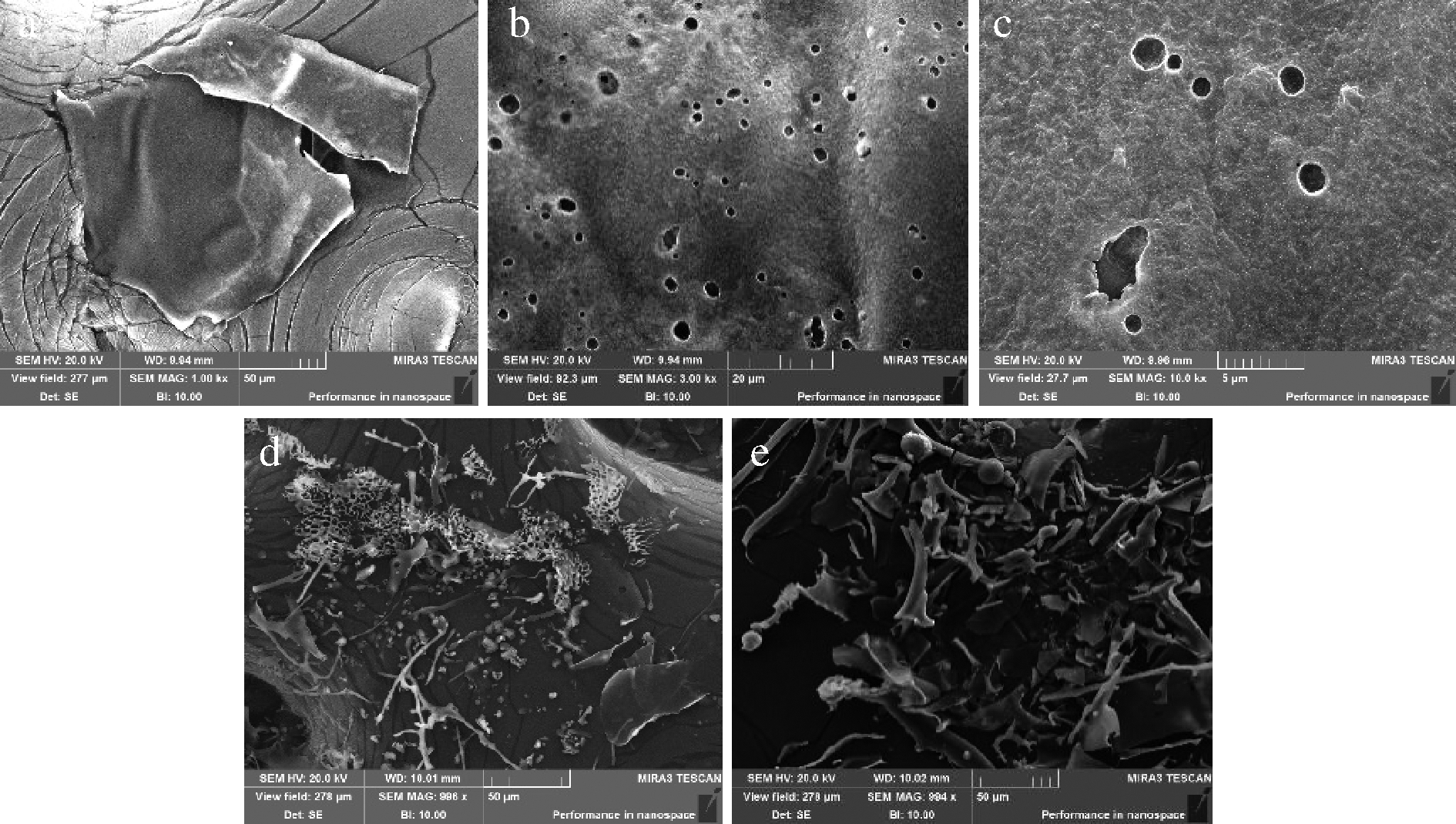
a-G2(×1 000);b-G2(×3 000);c-G2(×10 000); e-DG1(×1 000);f-DG2(×1 000)
图5 不同分子质量海蚌肝素的扫描电镜图
Fig.5 Scanning electron microscope graphs of clam heparin with different molecular weights
2.2.4 原子力显微镜分析
图6显示了在原子力显微镜下不同分子质量海蚌肝素的分子形态。在平面图像中G2呈现网链状结构,每个环状结构的侧链情况均清晰可见;DG1呈分散的链状结构;DG2呈现颗粒状结构,降解前后海蚌肝素的分子形态有很明显的变化。原子力显微镜分析结果和扫描电镜分析结果是一致的。

a-G2;b-DG1;c-DG2
图6 不同分子质量海蚌肝素的原子力显微镜图
Fig.6 Atomic force microscope graphs of clam heparin with different molecular weights
2.3 不同分子质量海蚌肝素的抗凝血与纤溶活性分析
2.3.1 抗凝效价测定结果
肝素的抗凝血活性与它的分子质量和活性五糖序列有关。HP、LMWH均具有活性五糖序列,HP可抑制凝血因子Xa、Ⅱa活性而起抗凝活性,而LMWH仅能作用于Xa。肝素分子质量越大,抗Ⅱa效价越高,而抗Xa效价越低。此外,当肝素的活性五糖序列受到破坏,其抗凝活性将明显降低[2]。有研究表明肝素抗Xa/IIa值越大,其抗血栓活性越强[1]。因此,抗Xa效价、抗IIa效价和它们的比值常用来比较不同分子质量肝素的抗凝活性。不同分子质量海蚌肝素抗凝血效价如表1所示,海蚌肝素的抗IIa效价随着分子质量的降低而降低,而抗Xa效价随着分子质量的降低先上升后降低,DG1抗Xa效价比G2高,DG2比DG1、G2都低。于DG2而言,分子质量的降低并没有提高它的抗Xa效价,这可能是因为降解程度过大破坏了肝素的活性五糖结构域。此外,在抗Xa/IIa比值上,DG2 表1 不同分子质量海蚌肝素抗凝血效价分析 样品名称抗Xa效价/(UI·mg-1)抗IIa效价/(UI·mg-1)抗Xa/IIa值G2102.9389.491.15DG1137.2664.342.13DG236.9538.370.96 2.3.2 抗凝血活性 研究者们经常通过测定APTT、PT、TT来研究样品的抗凝活性及其作用途径。APTT、PT、TT分别反映内源凝血途径、外源凝血途径和共同凝血途径的凝血情况。由图7可知,在试验浓度范围内G2和DG1的APTT、TT、PT均与生理盐水有显著差异,具有剂量依赖效应,且相近;而DG2的APTT、TT、PT相对于G2、DG1明显降低,且在低浓度时与生理盐水无显著差异;与肝素标准品相比,即使质量浓度达到10 μg/mL时,G2、DG1、DG2抗凝活性依旧明显弱于肝素。 通过结果来看,推断G2与DG1的抗凝血活性接近且均能通过内源、外源和共同凝血途径发挥抗凝血活性,而DG2的抗凝活性与G2相比较低。这可能是因为DG1的分子质量接近于普通分子质量肝素,DG2的分子质量接近于低分子质量肝素。此外不同分子质量的海蚌肝素的抗凝血活性都较为缓和,可能具有较低的出血副作用。 a-PT;b-TT;c-APTT 2.3.3 纤溶活性 采用琼脂糖凝胶纤溶平板法评价不同分子质量海蚌肝素的纤溶活性。不同浓度尿激酶产生的溶圈大小(x)与纤溶活性(y)的指数方程为y=0.058 5e1.243 6x,R2=0.994 3,相关性良好。测得不同分子质量海蚌肝素与商品肝素的纤溶活性如表2所示。海蚌肝素和商品肝素的纤溶活性均随着分子质量的降低而增大。测得海蚌肝素中DG2纤溶活性最强,DG1次之,G2最小;商品肝素LMWH的纤溶活性远高于HP,约为HP的6倍。DG2的纤溶活性约为HP的77%,而远低于LMWH,仅为LMWH的13%。 表2 不同分子质量海蚌肝素纤溶活性分析 样品名称HPLMWHG2DG1DG2纤溶活性/(U·mg-1)13.807±0.71980.675±1.3466.109±0.3407.931±0.12610.690±0.909 冠心病、脑卒中等血栓性疾病已经成为严重的公共卫生问题[24]。正常生理状态下,血液处于凝结与纤溶的动态平衡中,而当疾病、药物和不合理膳食等危险因素出现而使内皮细胞损伤时,血液成分和血液流变学性质发生变化,血液倾向于凝结而形成血栓。故抗血栓活性的研究常从纤溶与抗凝血活性的角度进行。肝素的抗血栓活性与分子质量有关,不同分子质量的肝素的抗血栓活性具有不同的作用途径及特点,可应用于不同血栓性疾病的治疗。此外,肝素是一种多糖,活性也受结构的影响[25]。 本文对不同分子质量海蚌肝素G2、DG1、DG2的结构特性和抗凝血、纤溶活性进行了研究。结果表明海蚌肝素G2、DG1、DG2的重均分子质量分别为60.25 kDa(大分子质量)、24.48 kDa(普通分子质量)、6.75 kDa(低分子质量);红外色谱显示,降解前后海蚌肝素的官能团结构变化不明显,但随着分子质量的降低,官能团或特征峰峰值增加,降解并没有破坏海蚌肝素的基本结构和活性基团;降解前后海蚌肝素的高级结构变化明显,随着分子质量降低,海蚌肝素的圆二色谱峰峰值变小,扫描电镜图谱显示海蚌肝素的碎片状结构及球状结构增加,原子力显微镜图显示海蚌肝素的网线状结构先被降解成链状结构,后聚集成颗粒结构;DG1的抗Xa/IIa比值最大,为2.13;通过测定APTT、TT、PT值,发现DG2与G2的抗凝血活性接近,但DG2的抗凝活性显著降低,这可能与不同海蚌肝素的分子质量有关,此外G2、DG1、DG2的抗凝活性明显弱于肝素,提示不同分子质量海蚌肝素可能具有较低的出血副作用;随着分子质量的降低,纤溶活性升高,DG2的纤溶活性约为HP的77%,LMWH的13%。综上所述,不同分子质量的海蚌肝素的基本结构和活性基团一致,但具有不同的高级结构特征,缓和的抗凝血活性和良好的纤溶活性,可能具有较低的出血副作用和作用途径不同的更强的抗血栓活性,有利于开发更为安全的抗血栓活性物质。今后将进一步分析不同分子质量海蚌肝素的体外抗血小板聚集和体内抗血栓活性,为寻找更加安全、有效的抗血栓药物提供一定的理论依据。 [1] 凌沛学, 何兆雄,姬胜利.肝素[M].北京:中国轻工业出版社,2015:264-271. LING P X,HE Z X,JI S L.Heparin[M].Beijing:China Light Industry Press,2015:264-271. [2] 史旭波, 胡大一.肝素的抗凝机制及临床相关问题[J].临床荟萃,2007,22(18):1 293-1 295. SHI X B,HU D Y.Anticoagulant mechanism of heparin and related clinical problems[J].Clinical Focus,2007,22(18):1 293-1 295. [3] MOURAO P A.Perspective on the use of sulfated polysaccharides from marine organisms as a source of new antithrombotic drugs[J].Marine Drugs,2015,13(5):2 770-2 784. [4] CARVALHAL F,CRISTELO R R,RESENDE D I,et al.Antithrombotics from the sea:Polysaccharides and beyond[J].Marine Drugs,2019,17(3):170. [5] 杜振兴, 周斯仪,钟赛意,等.海洋生物源肝素的研究进展[J].广东海洋大学学报,2018,38(4):92-98. DU Z X,ZHOU S Y,ZHONG S Y,et al.Advance in the study of heparin-like compounds from marine organisms[J].Journal of Guangdong Ocean University,2018,38(4):92-98. [6] 孟学平, 程汉良,董志国.我国西施舌研究现状及展望 (综述)[J].河北科技师范学院学报,2005,19(4):71-75. MENG X P,CHENG H L,DONG H G.The study status quo and prospect of Coelomactra antiquata in China (summary)[J].Journal of Hebei Normal University of Science & Technology,2005,19(4):71-75. [7] 孟学平, 高如承,董志国,等.西施舌营养成分分析与评价[J].海洋科学,2007,31(1):17-22. MENG X P,GAO R C,DONG Z G,et al.Analysis and evaluation of nutritive composition in edible part of Coelomactra antiquata[J].Marine Sciences,2007,31(1):17-22. [8] 李振华, 陈月忠,周永东,等.福建长乐海蚌保护区海蚌软体部的营养成分分析与评价[J].食品科学,2014,35(5):176-182. LI Z H,CHEN Y Z,ZHOU Y D,et al.Analysis and evaluation of nutritional composition of edible part of Coelomactra antiquata (Spengler) in nature sanctuary of Coelomactra antiquata of Fujian province[J].Food Science,2014,35(5):176-182. [9] 孟学平, 郝珏,梁猛,等.西施舌可食部分微量元素分析与评价[J].食品科学,2012,33(4):167-172. MENG X P,HAO Y,LIANG M,et al.Analysis and evaluation of trace elements in edible parts of Coelomactra antiquata[J].Food Science,2012,33(4):167-172. [10] 温扬敏, 罗彩林,陈淑增,等.西施舌提取物对正常小鼠体内抗氧化功能的影响[J].食品工业科技,2011,32(5):371-372. WEM Y N,LUO C L,CHEN S Z,et al.Effect of extract from Coelomactra antiquata on antioxidant ability of normal mice[J].Science and Technology of Food Industry,2011,32(5):371-372. [11] DU Z X,JIA X J,CHEN J,et al.Isolation and characterization of a heparin-like compound with potent anticoagulant and fibrinolytic activity from the clam Coelomactra antiquata[J].Marine Drugs,2020,18(1):6. [12] FANG G H,TANG B.Advanced delivery strategies facilitating oral absorption of heparins[J].Asian Journal of Pharmaceutical Sciences,2020,15(4):449-460. [13] 国家药典委员会. 中华人民共和国药典[M].四部.北京:中国医药科技出版社,2015:514-519. National Pharmacopoeia Commission.Chinese pharmacopoeia[M].Four-part.Beijing:China Medical Science and Technology Press,2015:514-519. [14] 廖敏. 不同分子量马尾藻岩藻聚糖硫酸酯对血栓及血管内皮细胞作用的研究[D].湛江:广东海洋大学,2017. LIAO M.Study on effect of different molecular weight sargssum fucoidan on thrombosis and vascular endothelial cells[D].Zhanjiang:Guangdong Ocean University,2017. [15] LI M,MA F M,LI R,et al.Degradation of Tremella fuciformis polysaccharide by a combined ultrasound and hydrogen peroxide treatment:process parameters,structural characteristics,and antioxidant activities[J].International Journal of Biological Macromolecules,2020,160:979-990. [16] 陈菁, 杜振兴,陈建平,等.虾头类肝素的制备、理化性质及抗凝血活性评价[J].食品科学,2021,42(11):71-77. CHEN J,DU Z X,CHEN J P,et al.Preparation,physicochemical properties and anticoagulant activity evaluation of heparinoid from shrimp head[J].Food Science,2021,42(11):71-77. [17] 姜慧, 孔立敏,王翀,等.条斑紫菜多糖的降解条件优化及其生物活性[J].食品科学,2021,42(3):38-47. JIANG H,KONG L M,WANG C,et al.Optimization of degradation conditions of polysaccharides from Porphyra yezoensis and changes in biological activities after degradation[J].Food Science,2021,42(3):38-47. [18] 邹籽华. 硫酸软骨素的降解及其产物的抗氧化活性研究[D].西安:西北大学,2019. ZOU Z H.Study on degradation of chondroitin sulfate and antioxidant activity of its products[D].Xi'an:Northwestern University,2019. [19] YANG J,WANG Y H,JIANG T F,et al.Depolymerized glycosaminoglycan and its anticoagulant activities from sea cucumber Apostichopus japonicus[J].International Journal of Biological Macromolecules,2015,72:699-705. [20] ZHANG W J,HUANG J,WANG W,et al.Extraction,purification,characterization and antioxidant activities of polysaccharides from Cistanche tubulosa[J].International Journal of Biological Macromolecules,2016,93:448-458. [21] CHEN Y,WANG Y J,XU L L,et al.Ultrasound-assisted modified pectin from unripe fruit pomace of raspberry (Rubus chingii Hu):structural characterization and antioxidant activities[J].LWT-Food Science and Technology,2020,134(12):110 007. [22] 刘宏, 陈晓琳,孙雨豪,等.蜈蚣藻多糖的降解及其体外抗氧化活性研究[J].海洋科学,2020,44(8):186-196. LIU H,CHEN X L,SUN Y H,et al.Degradation of sulfated polysaccharides from Grateloupia filicina and their antioxidant activities in vitro[J].Marine Sciences,2020,44(8):186-196. [23] ZHENG L,MA Y H,ZHANG Y J,et al.Increased antioxidant activity and improved structural characterization of sulfuric acid-treated stepwise degraded polysaccharides from Pholiota nameko PN-01[J].International Journal of Biological Macromolecules,2021,166:1 220-1 229. [24] ZHOU M G,WANG H D,ZENG X Y,et al.Mortality,morbidity,and risk factors in China and its provinces,1990—2017:A systematic analysis for the Global Burden of Disease Study 2017[J].The Lancet,2019,394(10 204):1 145-1 158. [25] 刘淑贞,周文果,叶伟建,等.活性多糖的生物活性及构效关系研究进展[J].食品研究与开发,2017,38(18):211-218. LIU S Z,ZHOU W G,YE W J,et al.Research advance on biological activity and structure-activity relationships of bioactive polysaccharide[J].Food Research and Development,2017,38(18):211-218.
Table 1 Anticoagulant titer analysis of mussel heparin with different molecular weights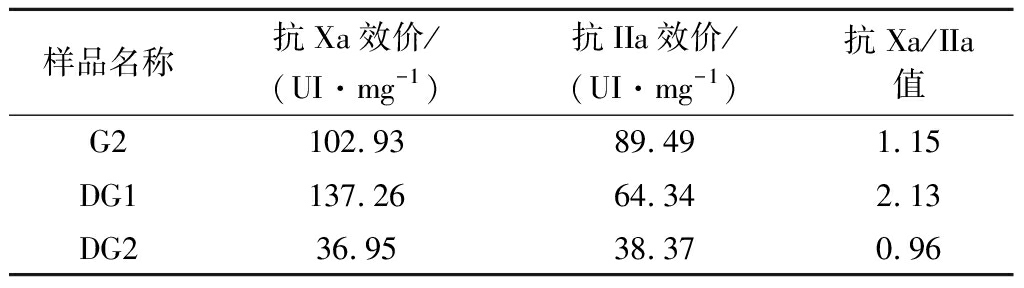

图7 不同分子质量海蚌肝素的抗凝血活性
Fig.7 Anticoagulant activity of mussel heparin with different molecular weights 注:与生理盐水相比,*表示差异显著,P<0.05;**表示差异极显著,P<0.01
Table 2 Analysis of fibrinolytic activity of mussel heparin with different molecular weights![]()
3 结论与讨论