氧化应激是由于生物系统中自由基的增加而发生的。在正常情况下,需氧生物通过组织良好的酶和非酶的自我防御系统来维持细胞稳态[1]。然而,由于自由基的过度表达,机体的抗氧化能力降低,细胞分子受损,最终导致多种疾病的发生[2]。对细胞系统造成严重损害的自由基大部分是氧自由基,通常称为活性氧(reactive oxygen species,ROS)。它们的普遍存在源自不平衡的氧稳态,导致细胞内氧化应激的产生[3]。H2O2是造成氧化损伤的主要因素之一,它与诱导内源性氧化应激有关,从而导致细胞的致癌、突变和细胞毒性[4]。
近年来,研究发现巨噬细胞是研究抗氧化的合适模型。有研究表明,一些细菌的毒性是由于它们能够通过刺激ROS的产生触发活化巨噬细胞的死亡[5]。过量的ROS很容易转化为H2O2,并通过血红素催化的Fenton反应生成活性高、毒性强的·OH,最终导致巨噬细胞死亡[6-7]。巨噬细胞参与宿主防御,是促氧化剂作用的主要靶点,在识别和清除微生物病原体的宿主防御系统中起着至关重要的作用[7]。鉴于巨噬细胞在免疫系统中的重要性及其易受ROS影响,利用巨噬细胞作为药物筛选模型可以为研究天然产物在免疫系统中的抗氧化作用提供直观的科学平台。H2O2通常用于研究巨噬细胞凋亡或氧化应激介导的细胞损伤[8]。当机体受到氧化应激时,抗氧化剂可以延缓细胞损伤程度。目前,天然高效抗氧化剂的开发与应用受到越来越多的科研人员的关注。
中华管鞭虾(Solenocera crassicornis),俗名红虾,在海捕虾中占有十分重要的地位[9],其加工过程中虾头、虾壳等副产物大量废弃。虾类加工副产物富含多种氨基酸,其氨基酸比例与人体肌肉成分极为接近,可以作为很好的蛋白质资源。有效地利用虾类加工副产物制备活性肽,对于提高大宗海产品资源利用率具有非常重要的意义。近年来,越来越多的研究发现海洋源活性肽具有抗氧化活性,这为抗氧化剂的开发提供了新的思路。如从贻贝、罗非鱼、蓝斑黄貂鱼等提取的肽具有抗氧化性[10-12],从海参、安康鱼肌肉中提取的多肽被发现能有效清除自由基和![]() 对H2O2诱导损伤的RAW 264.7细胞具有显著的保护作用[13-14]。研究表明虾肽具有抗氧化[15]、抗骨质疏松[16]、降血压[17]和改善小鼠肝毒性[18]等多种生物学功能,然而当前虾肽对RAW 264.7细胞氧化损伤的保护作用缺乏相关的研究。因此,本研究通过采用H2O2诱导RAW 264.7细胞构建细胞氧化应激损伤模型,研究不同浓度虾肽对H2O2所引起的氧化损伤的保护作用,为虾肽营养干预氧化应激相关疾病以及功能性食品开发提供理论基础。
对H2O2诱导损伤的RAW 264.7细胞具有显著的保护作用[13-14]。研究表明虾肽具有抗氧化[15]、抗骨质疏松[16]、降血压[17]和改善小鼠肝毒性[18]等多种生物学功能,然而当前虾肽对RAW 264.7细胞氧化损伤的保护作用缺乏相关的研究。因此,本研究通过采用H2O2诱导RAW 264.7细胞构建细胞氧化应激损伤模型,研究不同浓度虾肽对H2O2所引起的氧化损伤的保护作用,为虾肽营养干预氧化应激相关疾病以及功能性食品开发提供理论基础。
1 材料与方法
1.1 材料与试剂
虾肽(peptides from Solenocera crassicornis by-products,SCBP),实验室自行制备,原料为舟山市越洋食品有限公司提供的红虾加工副产物虾头虾壳,分子质量:250~1 000 Da,蛋白质量分数:61%。
小鼠单核巨噬细胞RAW 264.7,中国科学院上海细胞库;高糖杜尔伯科改良依格尔培养基(Dulbecco’s modified Eagle’s medium,DMEM)、澳洲胎牛血清(fetal bovine serum,FBS)、双抗,美国Gibco公司;超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、过氧化氢酶(catalase,CAT)试剂盒,南京建成生物工程研究所;反转录试剂盒、SYBR Premix Ex Taq(Tli RNaseH Plus)试剂,TaKaRa公司; H2O2,美国Sigma;TRIzol试剂、CCK-8试剂盒、核因子E2相关因子2(nuclear factor E2-related factor 2,Nrf2)抗体、Kelch样环氧氯丙烷相关蛋白1(Kelch like-ECH-associated protein 1,Keap1)抗体,上海碧云天生物有限公司。其他试剂均为国药试剂分析纯。
1.2 仪器与设备
电子天平(BP211D),美国Sartorius公司;pH计(PHS-3S),上海虹益仪器仪表有限公司;全自动酶标仪(Multiskan FC),美国Thermo Scientific科技有限公司;超纯水仪(AdvantageA10),美国Milli-Qplus公司;超低温冰箱(902-ULTS),美国Thermo Scientific科技有限公司;低温高速离心机(TG20-WS),长沙湘智离心机仪器有限公司;核酸蛋白定量仪(ND-2000),美国Nanodrop公司;PCR仪(My Cycler),美国Bio-Rad公司;ABI 实时荧光定量PCR仪(ViiATM7),美国Applied Biosystems公司。
1.3 实验方法
1.3.1 虾肽的制备
按料液比1∶10(g∶mL)向红虾原料中加入95%乙醇混合,室温下搅拌脱脂8 h,过滤,取滤渣,45 ℃烘干,备用。按料液比1∶2(g∶mL)向滤渣中加入蒸馏水,pH调至7.2,加入质量分数2%碱性蛋白酶,于55 ℃下搅拌酶解5 h,90 ℃灭酶20 min,过滤取上清液。将酶解液进行 0.5 μm 孔径无机陶瓷膜分离。收集透过液依次通过1 000和 250 Da的超滤膜,收集透过液和截留液,得到250~1 000 Da组分,冷冻干燥,即得虾肽。
1.3.2 试验细胞培养及处理
RAW 264.7用体积分数10%胎牛血清的DMEM(高糖)完全培养液于37 ℃在体积分数5%CO2细胞培养箱中传代培养。取指数生长期的RAW 264.7细胞用于实验,预热PBS洗3次,反复轻柔吹打,收集细胞,细胞计数板计数,根据实验需要调整细胞浓度进行种板,用于实验。
1.3.3 CCK-8法测定细胞毒性
收集细胞,制成适宜浓度的细胞悬液,通过细胞计数板在显微镜下计数,而后用完全培养基稀释到浓度为4×103 /mL接种至96孔板,每孔100 μL,置于5%CO2、37 ℃孵箱中培养12 h;待细胞充分贴壁后,分组加入不同浓度的药物,每组设置3~6个复孔,同时设置空白组(不加药物),培养24 h后,避光每孔加入10 μL CCK-8试剂,孵育1~4 h,待空白对照组达到橙黄色时结束,用酶标仪测定450 nm处的OD值。细胞存活率按公式(1)计算:
细胞的存活率/%=实验组OD值/空白组OD值×100
(1)
1.3.4 虾肽对H2O2损伤的RAW 264.7活力的影响
用不同质量浓度的SCBP(200、400和600 μg/mL)预处理RAW 264.7细胞24 h,温热的PBS洗3次。除对照组外,其他组的细胞加入包含500 μmol/L H2O2的DMEM培养基中12 h,然后每孔加入CCK-8 10 μL,继续培养4 h后,用酶标仪测定450 nm处各孔的OD值。
1.3.5 氧化因子测定
6孔板接种对数生长期RAW 264.7细胞密度为2.5×104/mL,孵育24 h。去培养基,加入含有不同浓度SCBP的培养基孵育24 h,然后更换至500 μmol/L H2O2处理12 h。收集培养基上清液测定SOD,CAT和谷胱甘肽过氧化酶(GSH-Px)的含量。
1.3.6 细胞因子 mRNA 表达水平的测定
6孔板接种对数生长期RAW 264.7细胞密度为2.5×104/mL,孵育24 h。去培养基,加入含有不同浓度SCBP的培养基孵育24 h,然后更换至500 μmol/L H2O2处理12 h。用1 mL PBS吹打下细胞,PBS洗3遍后转移至无RNA酶的EP管中,加入1 mL预冷的TRIzol试剂,反复吹打裂解细胞,根据GenBank基因序列,用Primer Premier 5.0设计相应特异性引物,并由上海生物工程公司合成,按TRIzol试剂法提取细胞总RNA。用核酸蛋白定量仪检测A260/A280、A260/A230及RNA浓度,使用琼脂糖凝胶电泳检测所提RNA的纯度。检测后的总RNA根据反转录试剂盒说明书反转录合成cDNA。按照TaKaRa公司的荧光定量试剂盒说明书配制反应体系,进行PCR反应。荧光的采集与溶解曲线的制作按照实时荧光定量PCR仪的说明进行。每个样品靶基因的相对mRNA表达水平用2-ΔΔCt计算,以甘油醛-3-磷酸脱氢酶(GAPDH)基因为内参。
1.3.7 Western Blotting法检测Nrf2、Keap1蛋白表达
6孔板接种对数生长期 RAW 264.7 细胞2.5×104细胞/孔,孵育24 h。去培养基,加入含有不同浓度SCBP的培养基孵育24 h,然后更换至500 μmol/L H2O2处理12 h。用1 mL PBS吹打下细胞,收集细胞于1.5 mL EP管中,每管加入RIPA裂解液40 μL,吹打数次,置冰上裂解15 min。12 000 r/min、4 ℃,离心10 min,取上清液,按照BCA蛋白浓度测定试剂盒说明书进行蛋白浓度测定。调整蛋白至相同浓度按比例加入蛋白上样缓冲液,煮沸10 min,12 000 r/min、4 ℃,高速离心2 min,取上清液进行SDS-PAGE电泳及转膜。转膜后,用脱脂乳粉配制质量分数5%的复原乳封闭1 h,4 ℃下分别孵育Nrf2、Keap1一抗过夜,再与HRP-二抗室温孵育2 h。使用碧云天BeyoECL Star(特超敏ECL化学发光试剂盒)显影,将膜置于显影液中,使用化学发光成像仪,观察条带,并拍照分析。
1.4 统计与分析
数据应用GraphPad Prism 10.01软件进行统计学分析,数据均用平均值±标准差表示,采用单因素方差(One-way ANOVA)多重比较进行差异显著性检验,P<0.05认为差异具有统计学意义。
2 结果与分析
2.1 SCBP对RAW 264.7细胞活力的影响
为了评估SCBP对RAW 264.7细胞增殖活力的影响,使用不同浓度的SCBP对细胞进行处理,并采用CCK-8法测定细胞的存活率。由图1可知,ρ(SCBP)<600 μg/mL时对RAW 264.7细胞的存活率没有影响(P>0.05),说明其对RAW 264.7细胞的代谢生长无明显的毒性,但超过该浓度会降低细胞存活率(P>0.05)。因此,SCBP质量浓度选择200、400和600 μg/mL进行后续实验。
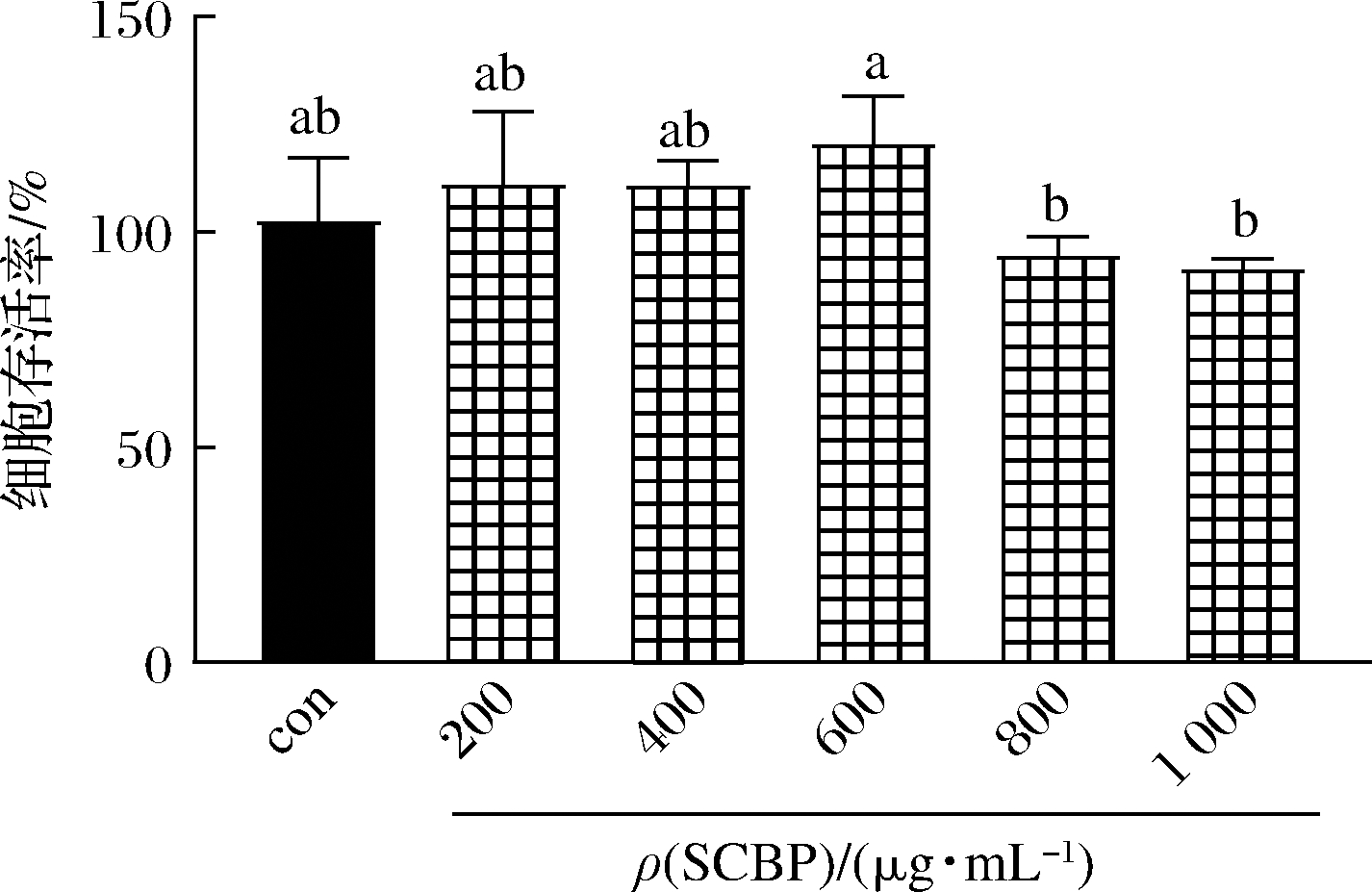
图1 SCBP质量浓度对RAW 264.7细胞活力的影响
Fig.1 Effect of SCBP on the viability of RAW 264.7 cells 注:组间不同小写字母代表差异显著(P<0.05)
2.2 SCBP对H2O2诱导RAW 264.7细胞活力的影响
H2O2可直接渗入细胞膜,导致氧化应激、线粒体损伤和细胞结构破坏。为了评估SCBP对H2O2诱导的RAW 264.7细胞氧化损伤的保护作用,采用CCK-8法检测细胞活力。结果表明(图2),仅用500 μmol/L的H2O2处理RAW 264.7细胞的存活率与对照组相比明显降低(P<0.05),这表明H2O2诱导RAW 264.7细胞构建的氧化应激模型成功;然而用SCBP预处理的RAW 264.7细胞,与单独用500 μmol/L H2O2处理的RAW 264.7细胞相比,细胞存活率显著提高(P<0.05),表明SCBP对RAW 264.7细胞有明显保护作用,能缓解H2O2对RAW 264.7细胞的氧化应激损伤。
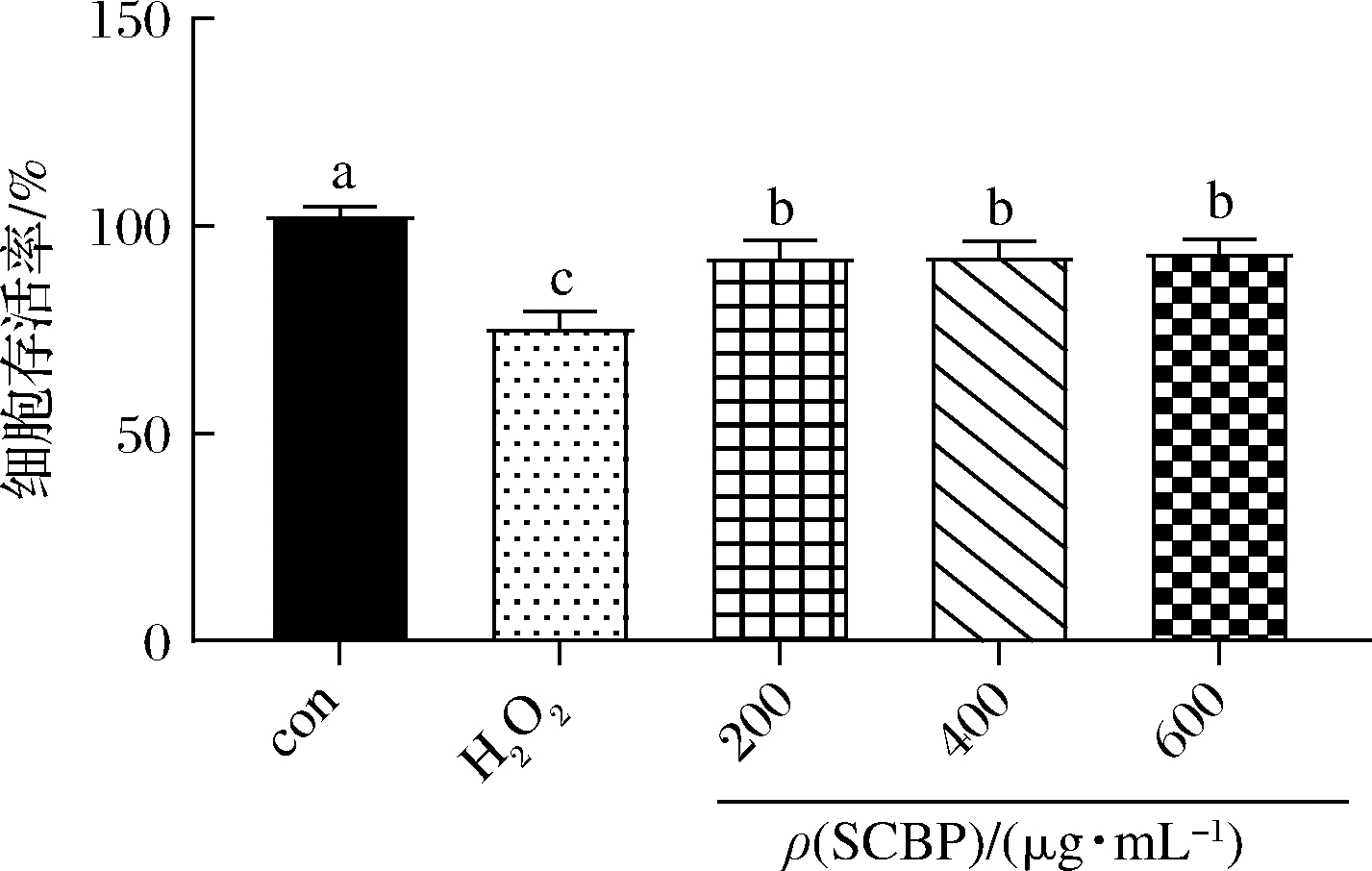
图2 SCBP预处理对H2O2诱导损伤的RAW 264.7 细胞活力的影响
Fig.2 Effect of SCBP pretreatment on the viability of H2O2-induced RAW 264.7 cells
2.3 抗氧化酶的测定
SOD、CAT和GSH-Px是细胞内抗氧化酶,能抑制自由基对细胞膜的攻击,维持细胞健康。为检测SCBP的抗氧化活性,研究了SCBP预处理对H2O2诱导的细胞GSH-Px、SOD和CAT水平的影响。由图3可知,仅用500 μmol/L H2O2处理12 h后,CAT、GSH-Px和SOD水平与正常组相比均显著降低(P<0.05),表明H2O2诱导巨噬细胞内抗氧化酶受到严重破坏;与单独H2O2组作用相比,虾肽低、中、高剂量组的SOD、CAT活力均显著升高(P<0.05),虾肽各剂量组的GSH-Px活力有所增高,但无显著性关系,说明虾肽可减少氧化应激损伤并减轻脂质过氧化,虾肽高剂量组减轻H2O2对细胞损伤效果较好。
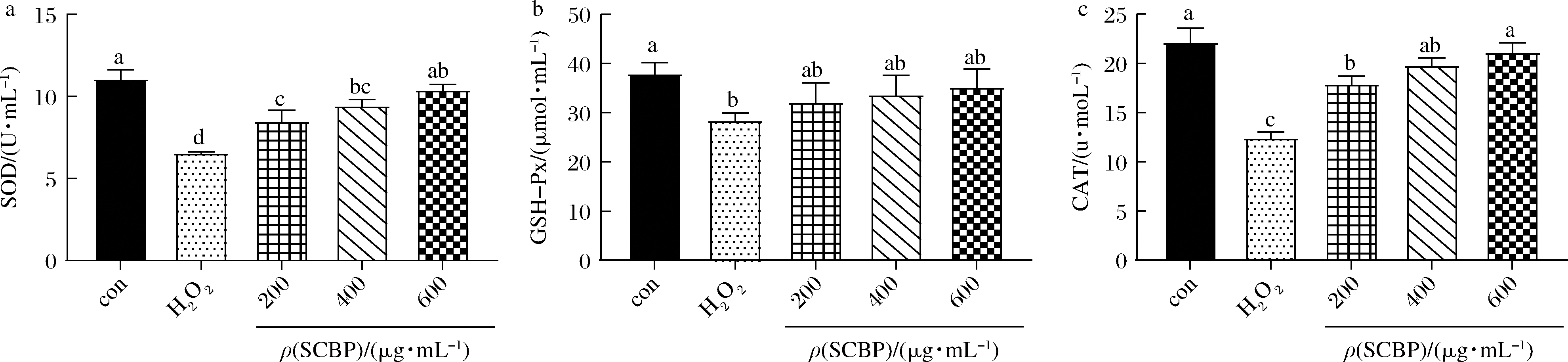
图3 SCBP对RAW 264.7细胞的SOD(a)、GSH-Px(b)和CAT(c)水平的影响
Fig.3 Effects of SCBP on the levels of SOD(a),GSH-Px(b)and CAT(c)in RAW 264.7 cells.
2.4 SCBP对GPX1/SOD1/NQO1/HO-1/Nrf2基因转录表达的影响
为研究SCBP保护氧化损伤RAW 264.7细胞的作用机制,测定了细胞内SOD1、GPX1、Nrf2等 mRNA表达水平,结果如图4。与空白组相比,单独H2O2处理的细胞的SOD1、GPX1、Nrf2、NQO1、HO-1 mRNA的表达量均显著降低(P<0.05)。与模型组相比,虾肽高剂量组(600 μg/mL)改善效果较好,虾肽各剂量组细胞的SOD1、GPX1、HO-1 mRNA的表达量显著提高(P<0.05);虾肽中、高剂量组细胞的Nrf2、NQO1 mRNA的表达量显著提高(P<0.05),低剂量组(200 μg/mL)没有显著性差异(P>0.05)。
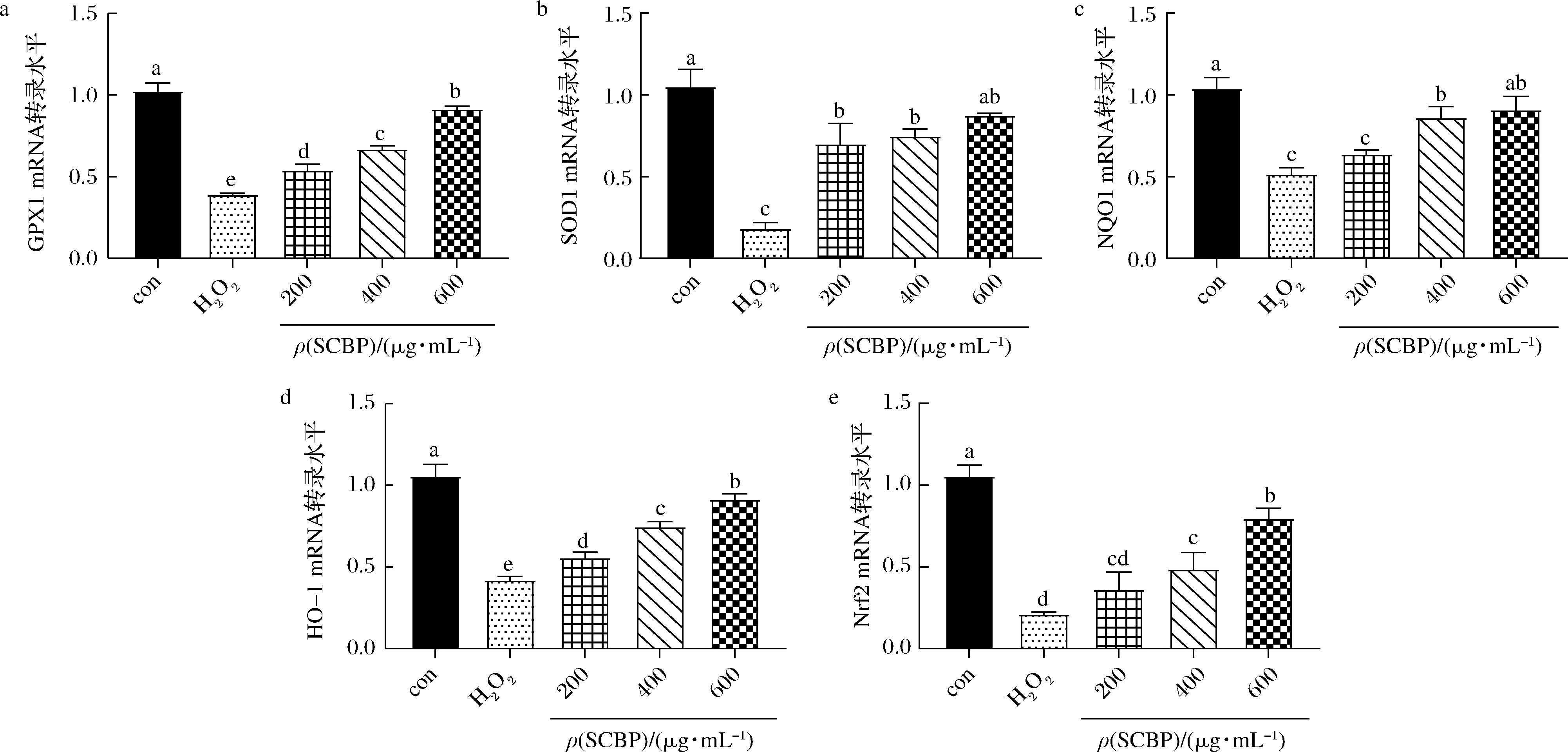
图4 SCBP对RAW 264.7细胞的GPX1(a)、SOD1(b)、NQO1(c)、HO-1(d)、Nrf2(e)mRNA表达水平的影响
Fig.4 Effect of SCBP on the mRNA expression of GPX 1(a)、SOD1 (b)、NQO1(c)、HO-1(d)、Nrf2(e)in RAW 264.7 cells.
2.5 SCBP对Keap1-Nrf2信号通路的影响
通过Western Blotting检测Nrf2以及Keap1的蛋白表达,探讨SCBP抗氧化作用的分子机制。结果见图5。与空白组相比,模型组的Nrf2的相对表达量显著增加,而Keap1的相对表达量显著降低(P<0.05)。不同剂量的SCBP均显著地上调了Nrf2的表达,同时使Keap1的表达降低(P<0.05),其中SCBP为600 μg/mL时较其他剂量组显著增加Nrf2的表达量,显著减少Keap1的表达量(P<0.05)。说明SCBP通过调节Nrf2-Keap1信号通路来护H2O2诱导的细胞凋亡,具有剂量依赖性。

图5 SCBP对RAW 264.7细胞Nrf2(a)和Keap1(b)蛋白表达的影响
Fig.5 Effect of SCBP on protein expression of Nrf2 (a) and Keap1 (b) in RAW 264.7 cells
3 结论与讨论
本研究通过H2O2处理RAW 264.7细胞来建立氧化应激损伤模型,探讨虾肽对细胞氧化损伤的保护作用。CCK-8试验结果表明,当细胞用500 μmol/L H2O2培养12 h,细胞存活率显著下降。此外,与H2O2单独处理组相比,虾肽预处理组的细胞存活率显著增加。测定了细胞中GSH-Px、SOD和CAT抗氧化酶的活力,这些抗氧化酶都在维持机体氧化稳态和自由基的动态平衡中发挥重要作用。GSH-Px是体内重要的抗脂质过氧化物酶之一,具有清除H2O2和脂质过氧化物的能力,保护细胞形态。SOD是唯一能够清除![]() 等自由基的生物酶,是抗氧化损伤的主要屏障。CAT是一种重要的抗氧化酶,能解毒H2O2,保护细胞免受氧化损伤[19-21]。本实验结果表明H2O2处理组的细胞GSH-Px、SOD和CAT活性显著降低(P<0.05),虾肽预处理组细胞SOD和CAT活性显著提高(P<0.05),GSH-Px活力有所增加,说明虾肽能通过提高细胞中抗氧化酶的活性清除有毒有害物质,减轻细胞损伤。
等自由基的生物酶,是抗氧化损伤的主要屏障。CAT是一种重要的抗氧化酶,能解毒H2O2,保护细胞免受氧化损伤[19-21]。本实验结果表明H2O2处理组的细胞GSH-Px、SOD和CAT活性显著降低(P<0.05),虾肽预处理组细胞SOD和CAT活性显著提高(P<0.05),GSH-Px活力有所增加,说明虾肽能通过提高细胞中抗氧化酶的活性清除有毒有害物质,减轻细胞损伤。
Nrf2作为一种转录因子,在调节体内抗氧化基因的产生和表达中起着关键作用。ARE是HO-1、SOD、CAT、GPx和NQO1等基因的上游启动子区域,Nrf2通常与ARE结合,酶复合物上调了组织中内源性抗氧化基因的表达,从而维持细胞氧化和抗氧化水平的平衡[22]。研究表明HO-1等细胞内氧化还原基因是受Nrf2-ARE信号通路调控的主要内源性保护基因[23]。HO-1具有多种作用,HO-1的高表达可显著降低多种炎症反应,减少组织损伤[24]。HO-1还可以调节血管平滑肌增生,维持血小板聚集和血管张力[25]。ARE激活后可诱导NQO1,对氧化应激反应具有保护作用[26]。SOD是细胞内主要的抗氧化酶,也是细胞内主要的自由基清除剂,具有保护细胞免受氧自由基侵害的作用。SOD的水平可以反映内源性氧自由基清除系统的功能[27]。Keap1-Nrf2信号通路在保护细胞免受内源性和外源性应激的影响中起着重要作用[28]。细胞质蛋白Keap1与Nrf2相互作用并抑制其功能。在非应激细胞中,Nrf2与其抑制蛋白Keap1形成复合物,从而使其在细胞质中失活并被阻断。然而,当细胞暴露于轻度氧化应激时,Nrf2在其特定丝氨酸或苏氨酸残基处被磷酸化,从Keap1解离并转移到细胞核中[29]。在本研究中,不同浓度虾肽能促进抗氧化基因SOD1、GPX1、Nrf2、NQO1、HO-1的mRNA水平表达,其表达水平随着浓度的增加而有所增强,质量浓度为600 μg/mL时具有较好的促进作用。各剂量组虾肽均能显著增加Nrf2的蛋白表达,减少Keap1的蛋白表达,高剂量虾肽效果显著。表明虾肽预处理可使H2O2刺激后的细胞抗氧化基因表达增加,增加Nrf2蛋白表达量,减少Keap1蛋白表达量,从而缓解氧化应激。
综上,虾肽能缓解H2O2所引起的RAW 264.7细胞存活率降低,提高细胞内SOD、GSH-Px、CAT活力,增加SOD1、GPX1、Nrf2等抗氧化基因的表达量,上调Nrf2的蛋白表达,下调Keap1的蛋白表达,说明虾肽对H2O2引起的RAW264.7细胞氧化损伤具有一定的保护作用,与Nrf2/Keap1信号通路的激活有关,为开发天然抗氧化剂奠定了基础。
[1] WOJTOVICH A P,BERRY B J,GALKIN A.Redox signaling through compartmentalization of reactive oxygen species:Implications for health and disease[J].Antioxidants and Redox Signaling,2019,31(9):591-593.
[2] DI MEO S,VENDITTI P.Evolution of the knowledge of free radicals and other oxidants[J].Oxidative Medicine and Cellular Longevity,2020,2020:9 829 176.
[3] LI Y,LI J,LIN S J,et al.Preparation of antioxidant peptide by microwave-assisted hydrolysis of collagen and its protective effect against H2O2-induced damage of RAW 264.7 cells[J].Marine Drugs,2019,17(11):E642.
[4] HU D,SUN X Y,LIAO X D,et al.Alpha-synuclein suppresses mitochondrial protease ClpP to trigger mitochondrial oxidative damage and neurotoxicity[J].Acta Neuropathologica,2019,137(6):939-960.
[5] ROBINSON N,GANESAN R,HEGEDÜS C,et al.Programmed necrotic cell death of macrophages:Focus on pyroptosis,necroptosis,and parthanatos[J].Redox Biology,2019,26:101 239.
[6] MORE G K,MAKOLA R T.In-vitro analysis of free radical scavenging activities and suppression of LPS-induced ROS production in macrophage cells by Solanum sisymbriifolium extracts[J].Scientific Reports,2020,10:6 493.
[7] GROM A A,MELLINS E D.Macrophage activation syndrome:advances towards understanding pathogenesis[J].Current Opinion in Rheumatology,2010,22(5):561-566.
[8] WANG X,MA J,BAI X,et al.Antioxidant properties of astaxanthin produced by cofermentation between Spirulina platensis and recombinant Saccharomyces cerevisiae against mouse macrophage RAW 264.7 damaged by H2O2[J].Food and Bioproducts Processing,2019,118:318-325.
[9] 江杨阳,杨水兵,余海霞,等.不同冻结方式对红虾肌肉品质的影响[J].现代食品科技,2017,33(10):142-148;116.
JIANG Y Y,YANG S B,YU H X,et al.Effects of different freezing methods on the quality of red shrimp[J].Modern Food Science and Technology,2017,33(10):142-148;116.
[10] ZHANG Z W,JIANG S Q,ZENG Y,et al.Antioxidant peptides from Mytilus coruscus on H2O2-induced human umbilical vein endothelial cell stress[J].Food Bioscience,2020,38:100 762.
[11] 邢瀚文,韩玮,施文正,等.固态发酵法制备罗非鱼皮胶原蛋白肽及其抗氧化活性研究[J].食品与发酵工业,2020,46(19):104-110.
XING H W,HAN W,SHI W Z,et al.Tilapia skin collagen peptides prepared by solid-state fermentationand its antioxidant activity[J].Food and Fermentation Industries,2020,46(19):104-110.
[12] WONG F C,XIAO J B,ONG M G L,et al.Identification and characterization of antioxidant peptides from hydrolysate of blue-spotted stingray and their stability against thermal,pH and simulated gastrointestinal digestion treatments[J].Food Chemistry,2019,271:614-622.
[13] LI Y,LI J,LIN S J,et al.Preparation of antioxidant peptide by microwave-assisted hydrolysis of collagen and its protective effect against H2O2-induced damage of RAW 264.7 cells[J].Marine Drugs,2019,17(11):642.
[14] TIAN X X,ZHENG J W,XU B G,et al.Optimization of extraction of bioactive peptides from Monkfish (Lophius litulon) and characterization of their role in H2O2-induced lesion[J].Marine Drugs,2020,18(9):468.
[15] LAN C,ZHAO Y Q,LI X R,et al.High Fischer ratio oligopeptides determination from Antartic krill:Preparation,peptides profiles,and in vitro antioxidant activity[J].Journal of Food Biochemistry,2019,43(5):e12 827.
[16] 韩立华,王菲,戴宇峰,等.南极磷虾肽对去卵巢骨质疏松症小鼠肠钙吸收的改善作用研究[J].中国海洋药物,2017,36(5):42-48.
HAN L H,WANG F,DAI Y F,et al.The improvement of peptide from Antarctic krill on intestinal calcium absorption in ovariectomized mice with osteoporosis[J].Chinese Journal of Marine Drugs,2017,36(5):42-48.
[17] JI W,ZHANG C H,JI H W.Two novel bioactive peptides from Antarctic krill with dual angiotensin converting enzyme and dipeptidyl peptidase IV inhibitory activities[J].Journal of Food Science,2017,82(7-9):1 742-1 749.
[18] JIANG S Q,ZHANG Z W,YU F M,et al.Ameliorative effect of low molecular weight peptides from the head of red shrimp (Solenocera crassicornis) against cyclophosphamide-induced hepatotoxicity in mice[J].Journal of Functional Foods,2020,72:104 085.
[19] XU G X,CUI L J,LIN Y,et al.Protective effect of haliotidis on the oxidative damage in the human lens epithelial cells[J].Chinese Journal of Ophthalmology,2013,49(9):817-821.
[20] FANG Y,SU T,QIU X R,et al.Protective effect of alpha-mangostin against oxidative stress induced-retinal cell death[J].Scientific Reports,2016,6:21 018.
[21] WANG Z C,WANG Z,HUANG W H,et al.Antioxidant and anti-inflammatory activities of an anti-diabetic polysaccharide extracted from Gynostemma pentaphyllum herb[J].International Journal of Biological Macromolecules,2020,145:484-491.
[22] HOU Y N,LI X M,PENG S J,et al.Lipoamide ameliorates oxidative stress via induction of Nrf2/ARE signaling pathway in PC12 cells[J].Journal of Agricultural and Food Chemistry,2019,67(29):8 227-8 234.
[23] LOBODA A,DAMULEWICZ M,PYZA E,et al.Role of Nrf2/HO-1 system in development,oxidative stress response and diseases:an evolutionarily conserved mechanism[J].Cellular and Molecular Life Sciences,2016,73(17):3 221-3 247.
[24] BAO L P,LI J S,ZHA D Q,et al.Chlorogenic acid prevents diabetic nephropathy by inhibiting oxidative stress and inflammation through modulation of the Nrf2/HO-1 and NF-κB pathways[J].International Immunopharmacology,2018,54:245-253.
[25] YANG S B,ZHENG Y,HOU X H.Lipoxin A4 restores oxidative stress-induced vascular endothelial cell injury and thrombosis-related factor expression by its receptor-mediated activation of Nrf2-HO-1 axis[J].Cellular Signalling,2019,60:146-153.
[26] ZHANG C Y,REN X M,LI H B,et al.Simvastatin alleviates inflammation and oxidative stress in rats with cerebral hemorrhage through Nrf2-ARE signaling pathway[J].European Review for Medical and Pharmacological Sciences,2019,23(14):6 321-6 329.
[27] FENG S,XU Z F,WANG F,et al.Sulforaphane prevents methylmercury-induced oxidative damage and excitotoxicity through activation of the Nrf2-ARE pathway[J].Molecular Neurobiology,2017,54(1):375-391.
[28] SCHMIDLIN C J, DODSON M B, MADHAVAN L,et al.Redox regulation by NRF2 in aging and disease[J].Free Radical Biology and Medicine,2019,134:702-707.
[29] ZHANG Y,WANG G Y,WANG T R,et al.Nrf2-Keap1 pathway-mediated effects of resveratrol on oxidative stress and apoptosis in hydrogen peroxide-treated rheumatoid arthritis fibroblast-like synoviocytes[J].Annals of the New York Academy of Sciences,2019,1 457(1):166-178.