明胶是胶原蛋白部分水解后的产物,是一种重要的生物聚合物,因其具有凝胶性、增稠性、乳化性、成膜性等多种功能特性,被广泛应用于食品、医药和摄影等行业[1]。目前,全球98.5%的商业明胶来源于哺乳动物,但受到口蹄疫、疯牛病和非洲猪瘟等哺乳动物疾病的影响,其食用安全性备受质疑;此外,社会文化和宗教信仰等原因也使哺乳动物明胶的应用市场受到了限制[2]。因此,开发可替代哺乳动物明胶的新型明胶原料成为明胶领域研究的热点和难点之一。
鱼明胶(fish gelatin,FG)是从鱼类加工副产物(鱼鳞、鱼皮、鱼骨和鱼鳔)中提取的胶原蛋白水解产物,因其具有类似哺乳动物明胶的多功能物理特性,被认为是一种潜在优良的哺乳动物明胶替代品[3]。但与哺乳动物明胶相比,FG的凝胶强度和流变学特性较差,这主要是因为FG的脯氨酸和羟脯氨酸含量较低,无法形成充足的氢键来稳定明胶胶体的三股螺旋结构,使其应用范围受到限制。所以,如何有效提高FG的凝胶特性是明胶领域的研究热点之一[4]。目前,有关FG凝胶性的改善方法主要有生物酶交联[4]、磷酸化修饰[4-5]、戊二醛交联[6]和辐照[7-9]等,但这些改善方法存在生物酶交联极易形成热不可逆凝胶[10],戊二醛具有一定的神经毒性[11],磷酸化和辐照修饰效果不够明显[12]等问题。研究表明,基于静电相互作用的离子多糖(anionic polysaccharide,AP)能有效改善FG的凝胶性能[13-15],并且应用方法简单,无毒性,可以食用。然而这种改性的程度与AP种类、添加量相关,有关此类报道却较少。因此,本文主要通过对比研究阿拉伯胶(arabic gum,AG)、黄原胶(xanthan gum,XG)和κ-卡拉胶(κ-carrageenan,κC)对FG的凝胶强度、质构特性和流变学等凝胶特性的影响,并结合傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)初探改性的机理,旨在为开发高品质FG提供技术指导和理论依据。
1 材料与方法
1.1 材料与试剂
FG(来源于鱼鳞和鱼皮),上海源叶生物科技有限公司;AG,法国Nexira公司;κC、XG,上海阿拉丁生化科技股份有限公司;其余试剂均为分析纯。
1.2 主要仪器
TA.XT Plus 质构分析仪,Stable Micro Systems 公司;DHR-2 流变仪,TA Instruments Inc 公司;FT/IR-4700 红外吸收光谱仪,Jasco Corp 公司;Quanta200F 环境扫描电子显微镜,美国 FEI 公司。
2 实验方法
2.1 样品制备
参照HUANG等[5]的方法略作修改,制备FG-AP复合溶液,其总固形物含量为60 mg/mL。按照FG∶AP为179∶1、35∶1、17∶1、11∶1、8∶1(m∶m)的比例称取适量的干燥FG于超纯水中,40 ℃水浴加热至完全溶解,冷却至室温,随后向FG溶液中分别添加适量的AG、κC和XG,250 r/min下搅拌混匀,分别配制成FG-AG复合体、FG-κC复合体和FG-XG复合体,置于冰箱备用。
2.2 凝胶强度的测定
参照KAEWRUANG等[16]的方法,利用质构仪对胶体进行凝胶强度测试。将混合溶液倒入25 mL的玻璃杯中,10 ℃孵化16~17 h。采用直径为1.25 cm的P/0.5探头对胶体进行凝胶强度测试,测前、测试、测后速度均为1 mm/s。以探头进入胶体深度为4 mm时所受的最大力定义为凝胶强度。每组样品平行测定3次。
2.3 质构特性的测定
参照HUANG等[5]的方法对胶体进行质构分析。将制备好的复合体溶液倒入模具中,10 ℃孵化16~17 h。取出胶体并切成直径为2.5 cm,高度为1.5 cm的圆柱体小胶体。利用质构仪进行质构检测,探头为P/50,行变量为40%,循环测量2次,测前、测中、测后探头移动速度均为1.0 mm/s。每组样品平行测定3次。
2.4 流变学测试
2.4.1 凝胶动力学测试
参照HUANG等[5]的方法对制备的样品进行凝胶动力学测试。移取3 mL的胶体溶液于流变仪平台上,使用60 mm探头,40 ℃保持5 min,设置最终温度为4 ℃,系统自动降温至4 ℃,保持3 h,频率为 1 Hz,应变力为0.5%。构建储能模量(storage modulus,G′)随时间动态变化方程为凝胶动力学方程,如公式(1)所示。
Gt=kgelln(tgel-A)+C
(1)
式中:Gt,t(s)时刻G′的值;tgel,凝胶时间;kgel,凝胶速率;C,常数。
2.4.2 温度测试
参照HUANG等[5]的方法对胶体进行温度测试。FG溶液先从40 ℃降温至5 ℃,再从5 ℃升温至40 ℃,速率均为0.5 ℃/min,应变力为0.5%,频率为1 Hz。
2.4.3 黏度测试
参照HUANG等[5]的方法对胶体溶液进行剪切速率测试,测试温度为25 ℃,剪切速率为0.01~1 000 s-1。
2.5 FTIR扫描
参照NAGARAJAN等[17]的方法,使用FTIR分析复合体的基团吸收峰特性。取冻干后的复合胶体与适量KBr粉末混合,充分研磨并压片。在4 000~400 cm-1的范围内进行光谱扫描,分辨率为4 cm-1。所有的样品光谱图以KBr为背景。
2.6 环境扫描电镜
参照ROUSI等[18]的方法,将冷冻干燥后的FG样品置于样品台上并用导电胶带固定,利用环境扫描电镜(environment scanning electron microscope,ESEM)在低真空模式下观测胶体的凝胶网络结构。测试电压为10 kV,放大倍数为300倍。
2.7 数据处理
每组试验重复3次以上,数据以平均值±标准差表示。使用Origin 8.0作图,采用SPSS 21.0软件处理分析数据,其中不同字母表示显著差异(P<0.05)。
3 结果与分析
3.1 不同离子多糖对鱼明胶凝胶强度和质构特性的影响
凝胶强度是破断力和破断距离的乘积,质构测试可以模拟胶体在人体口腔咀嚼过程中的品质变化,两者均是评价凝胶品质的重要指标[5,17]。不同含量的AG、κC和XG对FG凝胶强度和质构特性的影响如表1所示。与原样相比,在FG-AG和FG-XG复合凝胶体系中,复合胶体的凝胶强度和硬度均随着AG和XG含量的增加呈现先增加后降低的趋势,且均在比例为35∶1(m∶m)时,凝胶强度最高。结果表明,加入一定量的AG和XG可以提高复合胶体的凝胶强度和硬度,但过量的AG和XG反而会降低复合胶体的凝胶强度和硬度。FG和AP可以通过静电相互作用形成FG-AP复合体,该体系的分子形成3种复合体:FG-FG、FG-AP和AP-AP。当AP含量低时,FG-FG复合体占主导地位,FG-AP复合体进一步增强胶体的网状结构。当AP含量较高时,AP-AP复合体占主导地位,FG-AP复合体增强胶体的凝胶特性[19]。由于AG和XG是弱凝胶,所以当其含量过高时,AP-AP复合体占据主导地位,胶体的凝胶强度和硬度降低(P<0.05)。这可能是由于形成的FG-AP复合体抑制FG凝胶化过程中三股螺旋的形成,降低凝胶特性[19]。然而,在FG-κC复合凝胶体系中,凝胶强度随着κC比例的增加而显著提高,这可能是因为FG的脯氨酸残基和κC分子上的半乳糖硫酸盐残基能紧密结合,增强体系的凝胶网状结构,可以有效提高FG的凝胶强度[20-21]。此外,FG与AG/XG分子间可形成氢键,有助于增强复合胶体的网络结构[14]。复合胶体黏性和咀嚼性的变化趋势和凝胶强度和硬度的趋势保持一致。此外,随着κC和XG含量的增大,FG-κC和FG-XG复合胶体的恢复力逐渐降低,FG-κC复合体的弹性和凝聚力也逐渐降低,而FG-AG复合体的恢复力、弹性和凝聚力却无显著性变化。这种差异性可能与多糖自身特性的不同有关。
表1 不同FG-AP复合体凝胶强度和质构特性分析
Table 1 Gel strength and texture profile characteristics of various FG-AP complexes
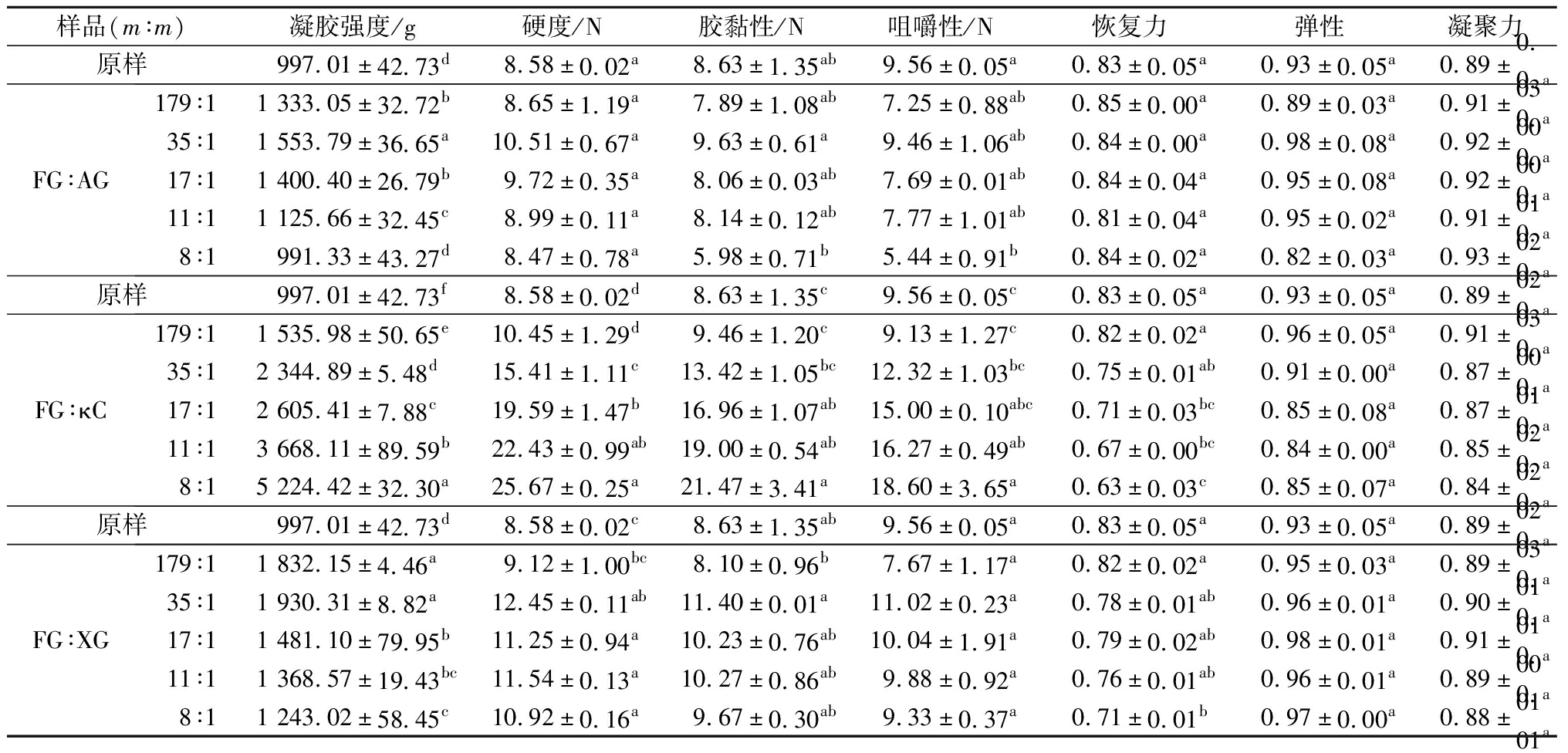
样品(m∶m)凝胶强度/g硬度/N胶黏性/N咀嚼性/N恢复力弹性凝聚力原样997.01±42.73d8.58±0.02a8.63±1.35ab9.56±0.05a0.83±0.05a0.93±0.05a0.89±0.03aFG∶AG179∶11 333.05±32.72b8.65±1.19a7.89±1.08ab7.25±0.88ab0.85±0.00a0.89±0.03a0.91±0.00a35∶11 553.79±36.65a10.51±0.67a9.63±0.61a9.46±1.06ab0.84±0.00a0.98±0.08a0.92±0.00a17∶11 400.40±26.79b9.72±0.35a8.06±0.03ab7.69±0.01ab0.84±0.04a0.95±0.08a0.92±0.01a11∶11 125.66±32.45c8.99±0.11a8.14±0.12ab7.77±1.01ab0.81±0.04a0.95±0.02a0.91±0.02a8∶1991.33±43.27d8.47±0.78a5.98±0.71b5.44±0.91b0.84±0.02a0.82±0.03a0.93±0.02a原样997.01±42.73f8.58±0.02d8.63±1.35c9.56±0.05c0.83±0.05a0.93±0.05a0.89±0.03aFG∶κC179∶11 535.98±50.65e10.45±1.29d9.46±1.20c9.13±1.27c0.82±0.02a0.96±0.05a0.91±0.00a35∶12 344.89±5.48d15.41±1.11c13.42±1.05bc12.32±1.03bc0.75±0.01ab0.91±0.00a0.87±0.01a17∶12 605.41±7.88c19.59±1.47b16.96±1.07ab15.00±0.10abc0.71±0.03bc0.85±0.08a0.87±0.02a11∶13 668.11±89.59b22.43±0.99ab19.00±0.54ab16.27±0.49ab0.67±0.00bc0.84±0.00a0.85±0.02a8∶15 224.42±32.30a25.67±0.25a21.47±3.41a18.60±3.65a0.63±0.03c0.85±0.07a0.84±0.02a原样997.01±42.73d8.58±0.02c8.63±1.35ab9.56±0.05a0.83±0.05a0.93±0.05a0.89±0.03aFG∶XG179∶11 832.15±4.46a9.12±1.00bc8.10±0.96b7.67±1.17a0.82±0.02a0.95±0.03a0.89±0.01a35∶11 930.31±8.82a12.45±0.11ab11.40±0.01a11.02±0.23a0.78±0.01ab0.96±0.01a0.90±0.01a17∶11 481.10±79.95b11.25±0.94a10.23±0.76ab10.04±1.91a0.79±0.02ab0.98±0.01a0.91±0.00a11∶11 368.57±19.43bc11.54±0.13a10.27±0.86ab9.88±0.92a0.76±0.01ab0.96±0.01a0.89±0.01a8∶11 243.02±58.45c10.92±0.16a9.67±0.30ab9.33±0.37a0.71±0.01b0.97±0.00a0.88±0.01a
注:同列不同小写字母表示组间差异显著(P<0.05)(下同)
3.2 不同离子多糖对鱼明胶流变学特性的影响
3.2.1 凝胶动力学分析
为了研究时间对不同离子多糖对FG凝胶形成的影响,采用流变学中的时间扫描研究不同离子多糖对FG凝胶过程中G′和损耗模量(loss modulus,G″)的影响,从而对其凝胶形成动力学和凝胶力学稳定性进行评价[22]。如图1所示,前1 000 s时,所有凝胶体系的G′和G″以较快的速度增长,随后以较小的速度继续增加。在凝胶化过程中,当G′>G″时,预示着胶体正在形成。明胶的凝胶过程是明胶分子由无规则卷曲到三股螺旋转变的过程,主要受pH、明胶的浓度、温度等的影响。一旦胶体网络结构形成,随着时间的延长,G′继续以较小的速度增加,预示着三股螺旋的继续生成,凝胶网络结构正在增强[19]。
明胶的凝胶化速率可被应用于了解明胶凝胶过程中模量的变化,推测三股螺旋的生成情况[5,19,23]。每个凝胶体系的凝胶动力学分析数据如表2所示,原样的凝胶速率(k)为(1 433.60±29.02),高于FG-AG和FG-XG复合体体系,这可能是由于AG和XG与FG通过静电相互作用生成的复合体会掩盖三股螺旋结合位点,抑制了三股螺旋的生成[14,24]。此外,由于AG和XG属于阴离子多糖,引入的负电荷增大了复合体系中的静电斥力,降低了FG分子的流动性[14,18,25-27]。然而,在FG-κC复合体体系中,FG:κC比例为179∶1和35∶1(m∶m)时,k低于原样;当FG∶κC为17∶1、11∶1和8∶1(m∶m)时,k高于原样,且随着κC含量的增加而增大。这可能是由于κC含量过高时,FG三螺旋和κC双螺旋之间产生了互补作用,导致FG-κC体系具有更多的物理凝胶结合连接区[28],呈现出较高的凝胶强度和硬度(表1)。
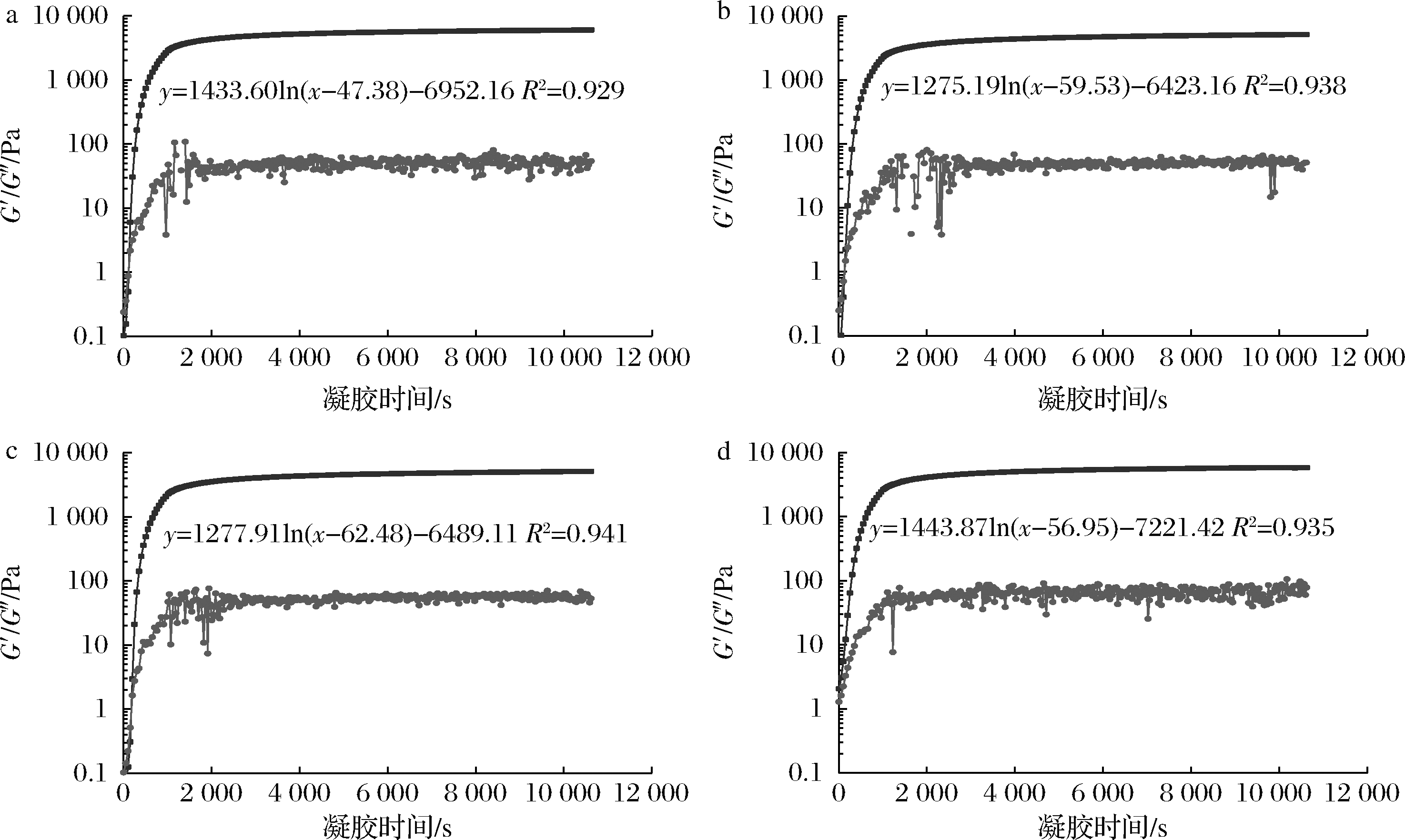
a-原样;b-FG∶AG=179∶1;c-FG∶κC=179∶1;d-FG∶XG=179∶1
图1 不同FG-AP复合体系凝胶动力学分析
Fig.1 Gelation kinetic analysis of various FG-AP complexes
表2 不同FG-AP复合体流变学特性分析
Table 2 Rheological characteristics of various FG-AP complexes
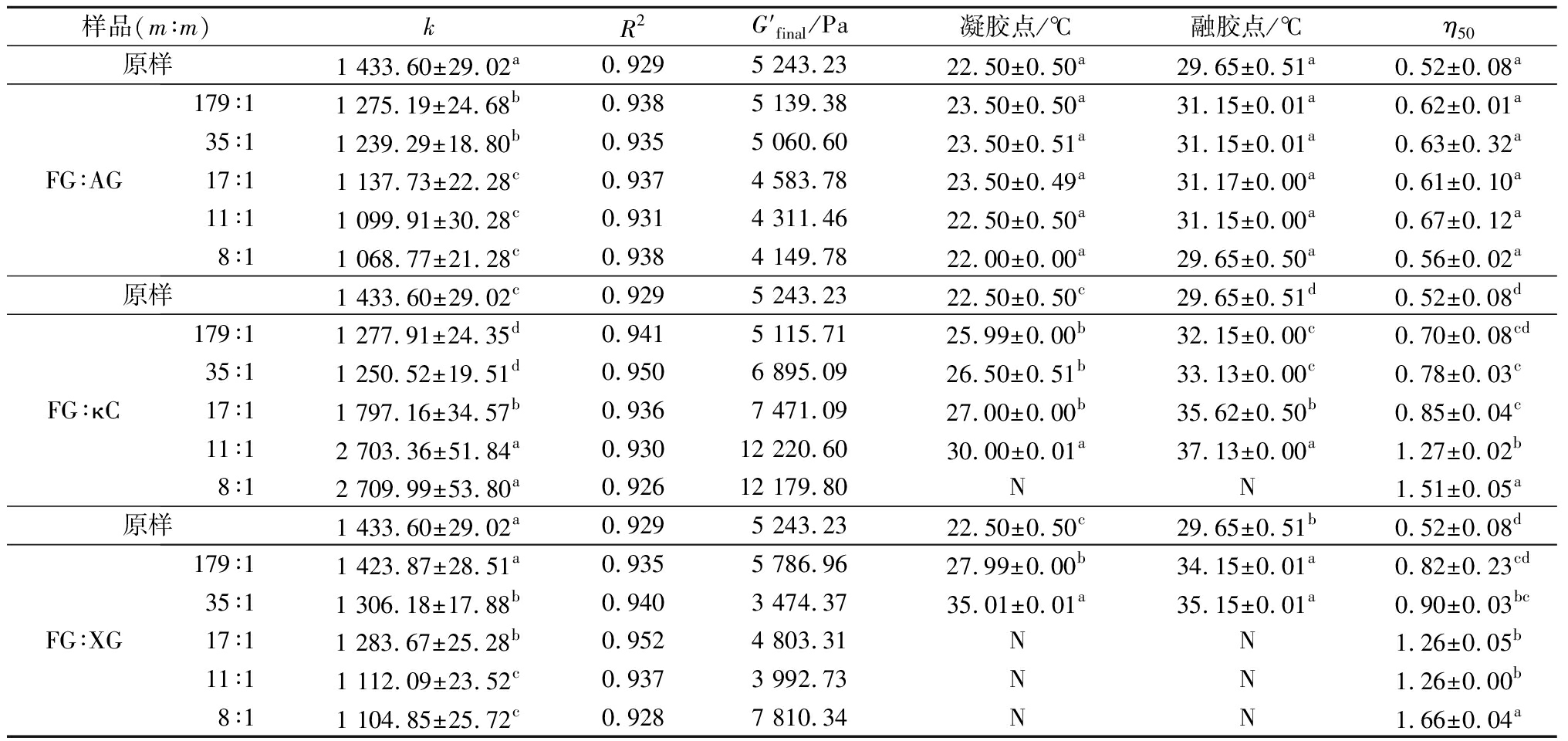
样品(m∶m)kR2G′final/Pa凝胶点/℃融胶点/℃η50原样1 433.60±29.02a0.9295 243.2322.50±0.50a29.65±0.51a0.52±0.08aFG∶AG179∶11 275.19±24.68b0.9385 139.3823.50±0.50a31.15±0.01a0.62±0.01a35∶11 239.29±18.80b0.9355 060.6023.50±0.51a31.15±0.01a0.63±0.32a17∶11 137.73±22.28c0.9374 583.7823.50±0.49a31.17±0.00a0.61±0.10a11∶11 099.91±30.28c0.9314 311.4622.50±0.50a31.15±0.00a0.67±0.12a8∶11 068.77±21.28c0.9384 149.7822.00±0.00a29.65±0.50a0.56±0.02a原样1 433.60±29.02c0.9295 243.2322.50±0.50c29.65±0.51d0.52±0.08dFG∶κC179∶11 277.91±24.35d0.9415 115.7125.99±0.00b32.15±0.00c0.70±0.08cd35∶11 250.52±19.51d0.9506 895.0926.50±0.51b33.13±0.00c0.78±0.03c17∶11 797.16±34.57b0.9367 471.0927.00±0.00b35.62±0.50b0.85±0.04c11∶12 703.36±51.84a0.93012 220.6030.00±0.01a37.13±0.00a1.27±0.02b8∶12 709.99±53.80a0.92612 179.80NN1.51±0.05a原样1 433.60±29.02a0.9295 243.2322.50±0.50c29.65±0.51b0.52±0.08dFG∶XG179∶11 423.87±28.51a0.9355 786.9627.99±0.00b34.15±0.01a0.82±0.23cd35∶11 306.18±17.88b0.9403 474.3735.01±0.01a35.15±0.01a0.90±0.03bc17∶11 283.67±25.28b0.9524 803.31NN1.26±0.05b11∶11 112.09±23.52c0.9373 992.73NN1.26±0.00b8∶11 104.85±25.72c0.9287 810.34NN1.66±0.04a
注:N,样品为半固体凝胶,无法测试其凝胶点和溶胶点
3.2.2 温度扫描分析
明胶的凝胶点和融胶点可以通过分析流变学温度扫描过程中G′和G″的变化得到[5,29]。在40 ℃时,样品为溶液状态,G′和G″的值较低,且G″>G′;在降温过程中,G′和G″均随着温度的降低而升高,且当G′和G″形成交点时,所对应的温度即是凝胶点,预示着凝胶正式开始生成;升温过程中,G′和G″均随着温度的升高而降低,且当G′和G″形成交点时,所对应的温度即是融胶点,预示着胶体开始融化[5,29]。一般而言,FG的胶融温度(11~28 ℃)普遍低于哺乳动物明胶(28~31 ℃)[19],因此限制了FG的应用范围。如表2所示,在相同的测试方法和参数下,适量的AG、XG和而增加κC有助于提高FG的凝胶点和融胶点:FG-AG复合胶体的凝胶点和融胶点均随着AG含量的增加而增加,且当FG∶AG超过11∶1(m∶m)后,凝胶点和融胶点均逐渐降低;而FG-κC和FG-XG复合胶体的凝胶点和融胶点均随着多糖含量的增加而逐渐升高,且当其含量达到一定时,溶液呈现为弱凝胶状。不同多糖对FG凝胶点和融胶点影响的不同与多糖自身分子形态、构象、分子质量大小等有关[19]。κC是硫酸阴离子多糖,易与蛋白质通过静电相互作用生成稳定的复合体[28,30],而XG侧链含有可电离的三糖基团,表现出极强的聚电解质行为[14-15,24,27],易与FG分子通过分子间的静电相互作用生成稳定的复合体,有助于FG凝胶点和融胶点的提高。明胶的胶融温度主要受氨基酸组成、α链/β链的比例、分子质量分布、电荷密度等因素影响[19]。因此,加入κC和XG可显著提高FG的胶融温度,改善其胶融温度低的缺点。
3.2.3 表观黏度分析
黏度是评价明胶品质的关键指标之一,可以反映明胶产品的加工特性。黏度主要受到剪切速率、pH、温度、剪切压力和时间等的影响[5,31]。如图2所示,相较于原样,FG-XG和FG-κC复合体体系均具有较高的黏度,且黏度随着XG和κC含量的增加而增加,而FG-AG复合体体系呈现相反的趋势。在FG-AP复合体体系中存在着3种类型的分子复合体:FG-FG、AP-AP、FG-AP。当FG过量时,体系黏度主要由FG-FG结构主导,FG-AP复合体进一步提高复合体体系的黏度;在FG含量较低时,体系黏度主要受AP-AP复合体的影响[19]。单纯AP溶液的黏度为XG>κC>AG[14]。XG是线性高分子(2×106~2×107 Da),分子链显著高于AG(4×105 Da)和κC(102~106 Da),且具有更多的流体力学体积,很容易发生分子间的交联,因此FG-XG复合体具有较高的黏度[14]。

a-FG∶AG;b-FG∶κC;c-FG∶XG
图 2 不同FG-AP复合体系的流体特性分析
Fig.2 Flow behavior analysis of various FG-AP complexes
剪切速率为50 s-1时所对应的黏度值(η50)被认为与食品的黏度、润滑性等品质相关[19]。如表2所示,FG-AG、FG-κC和FG-XG复合体体系的η50值均高于原样。这可能是由于FG的分子质量ɑ/β链比较低[1-2]。除此之外,与FG-AG复合体相比,FG-XG和FG-κC复合体体系均表现出较高的η50值。随着AG含量的增加,FG-AG系统的η50值呈先上升后下降的趋势;而对于另2个复合体体系而言,η50值均随着XG和κC的含量增加而上升。这种差异可能是受多糖分子自身特征的差异影响,如分子质量、分子构象和电荷密度等[14]。因此,XG和κC更能赋予FG更好的感官品质。
3.3 FTIR
FTIR可以分析附着在蛋白质骨架上的官能团信息的变化,反映蛋白质的结构变化[31-33]。为了更好地了解3种多糖(AG、XG和κC)对FG结构的影响,在4 000~400 cm-1记录了其FTIR光谱。如图3所示,原样、FG-AG、FG-XG和FG-κC都显示4个特征峰:酰胺A(3 400~3 300 cm-1),酰胺I(1 600~1 700 cm-1),酰胺II(1 560~1 550 cm-1)和酰胺III(1 250~1 230 cm-1),这些典型的峰值范围与URIARTE等[34]的研究结果相一致,故不同离子多糖的添加不会破坏典型的FG官能团。酰胺I峰表示C![]() O拉伸或氢键与COO耦合,其峰值大小和波数与蛋白质构象和氢键有关[17,34]。如图3和表3所示,FG-AG和FG-XG复合体体系的酰胺I波数均高于原样,这与ROUSI等[18]的研究相一致,这是因为在复合凝聚过程中,AG和XG是羧基多糖[18],FG的蛋白质中的氢键与AG和XG的羧基之间发生静电相互作用,使C
O拉伸或氢键与COO耦合,其峰值大小和波数与蛋白质构象和氢键有关[17,34]。如图3和表3所示,FG-AG和FG-XG复合体体系的酰胺I波数均高于原样,这与ROUSI等[18]的研究相一致,这是因为在复合凝聚过程中,AG和XG是羧基多糖[18],FG的蛋白质中的氢键与AG和XG的羧基之间发生静电相互作用,使C![]() O向高波段移动。针对FG-κC复合体体系,酰胺I波数与原样一致,这可能是因为κC的结构中并不含有C
O向高波段移动。针对FG-κC复合体体系,酰胺I波数与原样一致,这可能是因为κC的结构中并不含有C![]() O和羧基[14],因此酰胺I的波数没有变化。酰胺II是由N—H弯曲振动和C—N拉伸振动引起的[16-17]。所有样品的酰胺II波数均为1 550.50 cm-1,表明了3种AP的加入对FG的酰胺II带没有影响。酰胺III峰主要与C—N拉伸振动、酰胺键的N—H变形和甘氨酸和脯氨酸的CH2基团的摇摆振动有关[16-17]。
O和羧基[14],因此酰胺I的波数没有变化。酰胺II是由N—H弯曲振动和C—N拉伸振动引起的[16-17]。所有样品的酰胺II波数均为1 550.50 cm-1,表明了3种AP的加入对FG的酰胺II带没有影响。酰胺III峰主要与C—N拉伸振动、酰胺键的N—H变形和甘氨酸和脯氨酸的CH2基团的摇摆振动有关[16-17]。
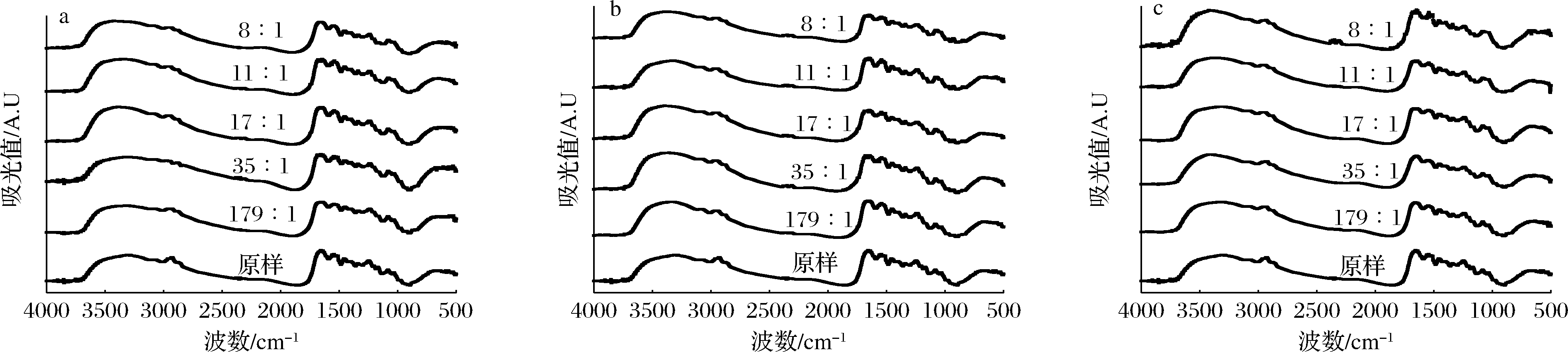
a-FG∶AG;b-FG∶κC;c-FG∶XG
图 3 不同FG-AP复合体FTIR分析
Fig.3 FTIR analysis of various FG-AP complexes
3种FG-AP复合体体系酰胺III的波数均低于原样,表明了FG的β-转角含量逐渐降低。此外,酰胺A反映N—H拉伸,然而FG-AP复合体体系的酰胺A波数明显高于原样,表明了3种多糖AG、XG和κC和FG生成了氢键。因此,加入AG、XG和κC这3种多糖会改变FG的二级结构,从而影响其凝胶特性。
表3 不同FG-AP复合体的FTIR分析 单位:cm-1
Table 3 FTIR analysis of various FG-AP
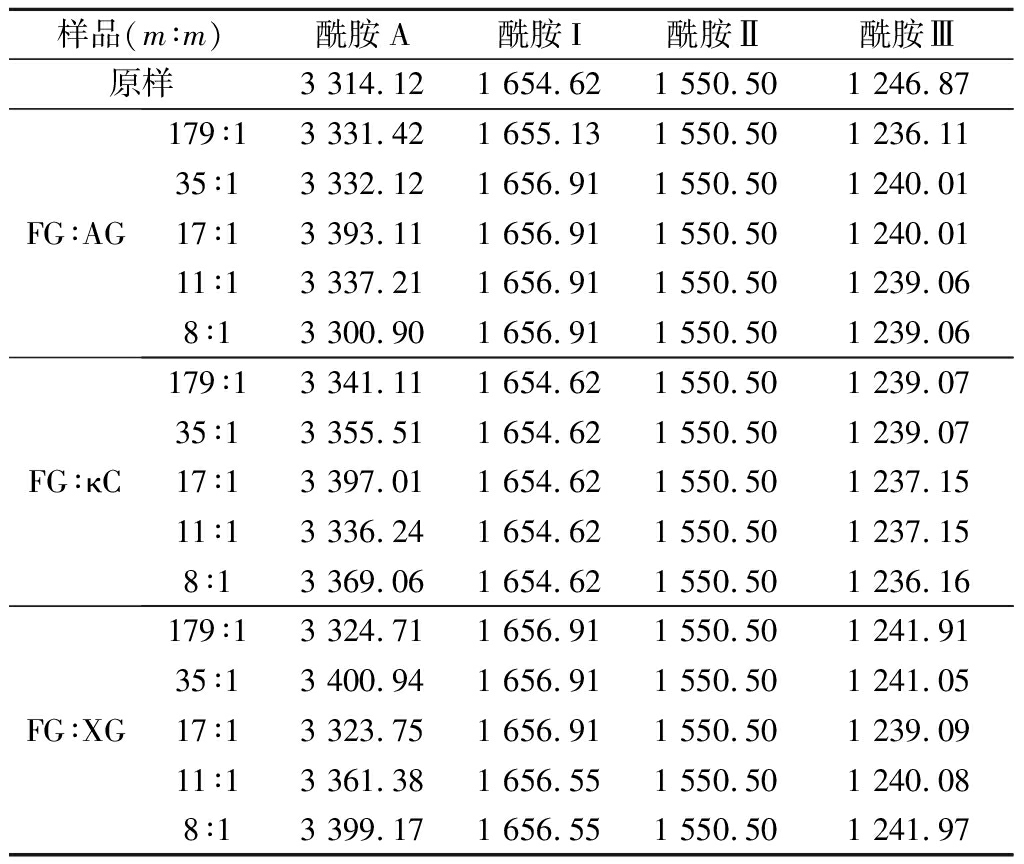
样品(m∶m)酰胺A酰胺I酰胺Ⅱ酰胺Ⅲ原样3 314.121 654.621 550.501 246.87FG∶AG179∶13 331.421 655.131 550.501 236.1135∶13 332.121 656.911 550.501 240.0117∶13 393.111 656.911 550.501 240.0111∶13 337.211 656.911 550.501 239.068∶13 300.901 656.911 550.501 239.06FG∶κC179∶13 341.111 654.621 550.501 239.0735∶13 355.511 654.621 550.501 239.0717∶13 397.011 654.621 550.501 237.1511∶13 336.241 654.621 550.501 237.158∶13 369.061 654.621 550.501 236.16FG∶XG179∶13 324.711 656.911 550.501 241.9135∶13 400.941 656.911 550.501 241.0517∶13 323.751 656.911 550.501 239.0911∶13 361.381 656.551 550.501 240.088∶13 399.171 656.551 550.501 241.97
3.4 ESEM
不同种类的AP对FG空间结构的影响如图4所示,未修饰的FG胶体呈现块状和空隙;当FG∶AP=35∶1(m∶m)时,3种复合胶体的结构发生了相似的改变,FG胶体呈现致密的网状结构。其中,FG∶κC=35∶1(m∶m)时,胶体的结构呈现小而密的网状结构,这与其凝胶性结构分析相一致,且与FG-AG和FG-XG复合体相比较,κC对FG结构改善效果更好。因此,适量的多糖有助于增强复合胶体的网状结构,胶体呈现出较高的凝胶特性,且κC的效果更好。
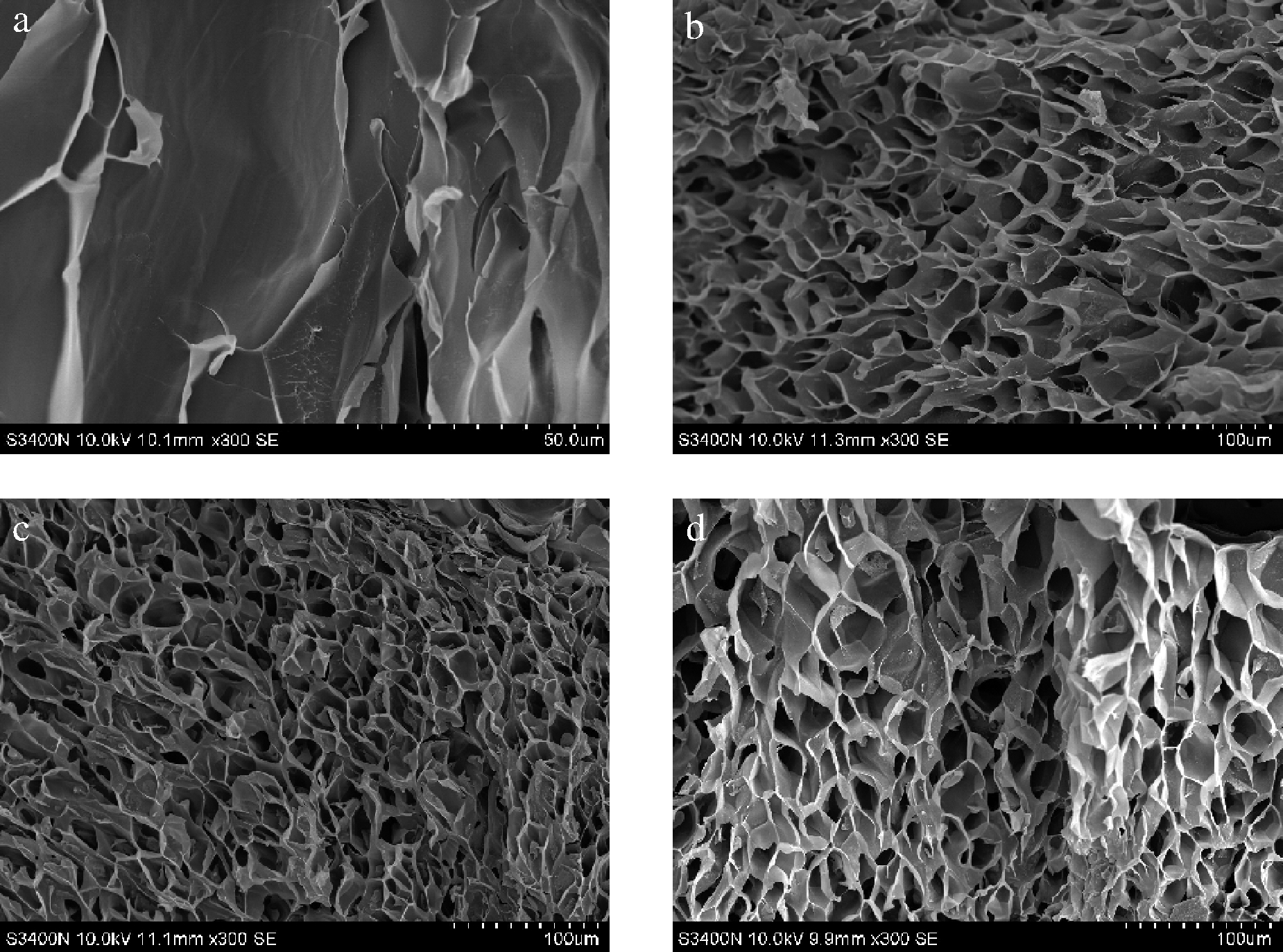
a-原样;b-FG∶AG=35∶1;c-FG∶κC=35∶1; d-FG∶XG=35∶1
图4 不同FG-AP复合体SEM结果分析
Fig.4 SEM analysis of various FG-AP complexes
4 结论
本研究探讨了不同含量(FG∶AP=179∶1、35∶1、17∶1、11∶1、8∶1)的AG、XG和κC对FG凝胶特性和流变学特性的影响,为生产安全高品质的鱼明胶产品提供了有效的理论依据。结果表明,适量的AG、XG和κC能有效提高FG的凝胶强度、硬度、凝胶温度和胶融温度,且在FG∶AG和FG∶XG为35∶1(m∶m),FG∶κC为8∶1(m∶m)时,复合胶体具有更高的凝胶强度和硬度。凝胶动力学结果表明,AG、XG和低含量的κC会降低复合胶体的凝胶速率;剪切速率分析表明3种AP均会提高复合胶体的表观黏度,其中高含量的XG和κC更加显著地提高复合胶体的黏度。FTIR结果表明,加入的AP并不会破坏典型的FG官能团,但是FG与AP可通过氢键的形成改变酰胺A的波数。ESEM分析表明,在FG∶AP=35∶1(m∶m)时,加入的AG、XG和κC能有效改善复合胶体凝胶网络结构,其中FG-κC复合胶体的网络结构更加致密。总而言之,综合凝胶强度、质构和流变学分析,高含量的κC更能高效地提高复合胶体的凝胶特性和黏度。
[1] HUANG T,TU Z C,SHANGGUAN X C,et al.Fish gelatin modifications:A comprehensive review[J].Trends in Food Science & Technology,2019,86:260-269.
[2] ALFARO A D T,BALBINOT E,WEBER C T,et al.Fish gelatin:Characteristics,functional properties,applications and future potentials[J].Food Engineering Reviews,2015,7(1):33-44.
[3] KARIM A A,BHAT R.Fish gelatin:Properties,challenges,and prospects as an alternative to mammalian gelatins[J].Food Hydrocolloids,2009,23(3):563-576.
[4] 赵慧竹,林俊杰,李卓恒,等.动态高压微射流协同谷氨酰胺转氨酶复合修饰对鱼明胶凝胶特性和结构的影响[J].核农学报,2020,34(9):1 990-1 995.
ZHAO H Z,LIN J J,LI Z H,et al.Combination modification of dynamic high pressure microfluidization and transglutaminase influence gel and structural properties of fish gelatin[J].Journal of Nuclear Agricultural Sciences,2020,34(9):1 990-1 995.
[5] HUANG T,TU Z C,SHANGGUAN X C,et al.Rheological behavior,emulsifying properties and structural characterization of phosphorylated fish gelatin[J].Food Chemistry,2018,246:428-436.
[6] FARRIS S,SONG J H,HUANG Q R.Alternative reaction mechanism for the cross-linking of gelatin with glutaraldehyde[J].Journal of Agricultural Food Chemistry,2010,58(2):998-1 003.
[7] BENBETTAIEB N,KARBOWIAK T,BRACHAIS C H,et al.Impact of electron beam irradiation on fish gelatin film properties[J].Food Chemistry,2016,195:11-18.
[8] HUANG T,FANG Z X,ZHAO H Z,et al.Physical properties and release kinetics of electron beam irradiated fish gelatin films with antioxidants of bamboo leaves[J].Food Bioscience,2020,36:100 597.
[9] WU C K,TSAI J S,SUNG W C.Functional characteristics of ultraviolet-irradiated tilapia fish skin gelatin[J].Molecules,2019,24(2).DOI:10.3390/molecules24020254.
[10] 谭碧君. 固定化酶制备及应用的研究进展[J].上海畜牧兽医通讯,2011(1):12-15.
TAN B J.Research progress on preparation and application of curing enzyme[J].Shanghai Journal of Animal Husbandry and Veterinary Medicine,2011(1):12-15.
[11] 许崇辉, 刘慧智,温巧玲,等.戊二醛急性毒性研究[J].检验检疫学刊,2012,22(4):22-24.
XU C H,LIU H Z,WEN Q L,et al.Acute toxicity study for glutaraldehyde[J].Journal of Inspection and Quarantine,2012,22(4):22-24.
[12] 耿胜荣, 廖涛,李新,等.60Co-γ不同剂量辐照对明胶特性的影响[J].食品科学技术学报,2013,31(4):28-31.
GENG S R,LIAO T,LI X,et al.Effect of different irradiation dosage of 60Co-γ on properties of gelatin[J].Journal of Food Science and Technology,2013,31(4):28-31.
[13] ANVARI M,JOYNER M.Effect of fish gelatin-gum arabic interactions on structural and functional properties of concentrated emulsions[J].Food Research International,2017,102:1-7.
[14] HUANG T,TU Z C,SHANGGUAN X C,et al.Characteristics of fish gelatin-anionic polysaccharide complexes and their applications in yoghurt:Rheology and tribology[J].Food Chemistry,2021,343.DOI:10.1016/j.foodchem.2020.128413
[15] LII C Y,LIAW S C,LAI V M F,et al.Xanthan gum-gelatin complexes[J].European Polymer Journal,2002,38(7):1 377-1 381.
[16] KAEWRUANG P,BENJAKUL S,PRODPRAN T.Characteristics and gelling property of phosphorylated gelatin from the skin of unicorn leatherjacket[J].Food Chemistry,2014,146:591-596.
[17] NAGARAJAN M,BENJAKUL S,PRODPRAN T,et al.Characteristics and functional properties of gelatin from splendid squid (Loligo formosana) skin as affected by extraction temperatures[J].Food Hydrocolloids,2012,29(2):389-397.
[18] ROUSI Z,MALHIAC C,FATOUROS D G,et al.Complex coacervates formation between gelatin and gum arabic with different arabinogalactan protein fraction content and their characterization[J].Food Hydrocolloids,2019,96:577-588.
[19] 黄涛. 蛋白质修饰技术改善鱼明胶理化特性及其应用的研究[D].南昌:南昌大学,2018.
HUANG T.Study on the protein modification techniques improving the physicochemical properties of fish gelatin by and its application[D].Nanchang:Nanchang University,2018.
[20] 胡亚芹, 竺美.卡拉胶及其结构研究进展[J].海洋湖沼通报,2005(1):94-102.
HU Y Q,ZHU M.Study progress of carrageenan and their structure[J].Transation of Oceanology and Limnology,2005 (1):94-102.
[21] 魏玉, 王元兰,何新建.低分子量k-卡拉胶的制备分子修饰及其生物活性研究进展[J].食品工业科技,2009,30 (4):344-348.
WEI Y,WANG Y L,HE X J.Research progress of preparation for low-molecular-weight k-carrageenan,molecular modification and biological activity[J].Science and Technology of Food Industry,2009,30 (4):344-348.
[22] HUANG T,TU Z C,WANG H,et al.Comparison of rheological behaviors and nanostructure of bighead carp scales gelatin modified by different modification methods[J].Journal Food Science & Technologists,2017,54(5):1 256-1 265.
[23] HUANG T,TU Z C,ZOU Z Z,et al.Glycosylated fish gelatin emulsion:Rheological,tribological properties and its application as model coffee creamers[J].Food Hydrocolloids,2020,102:105 552.
[24] DE OLIVEIRA L C,BARBOSA J R,RIBEIRO SDCA,et al.Improvement of the characteristics of fish gelatin-gum arabic through the formation of the polyelectrolyte complex[J].Carbohydrate Polymers,2019,223:115 068.
[25] SABET S,RASHIDINEJAD A,MELTON L D,et al.The interactions between the two negatively charged polysaccharides:Gum Arabic and alginate[J].Food Hydrocolloids,2021,112:106 343.
[26] SARIKA P R,PAVITHRAN A,JAMES N R.Cationized gelatin/gum arabic polyelectrolyte complex:Study of electrostatic interactions[J].Food Hydrocolloids,2015,49:176-182.
[27] WANG C S,VIRGILIO N,WOOD-ADAMS P,et al.A mechanism for the synergistic gelation properties of gelatin B and xanthan gum aqueous mixtures[J].Carbohydrate Polymers,2017,175:484-492.
[28] NGUYEN B T,NICOLAI T,BENYAHIA L,et al.The effect of the competition for calcium ions between κ-carrageenan and β-lactoglobulin on the rheology and the structure in mixed gels[J].Colloids and Surfaces
a:Physicochemical and Engineering Aspects,2015,475:9-18.
[29] ZHANG Y Y,LI M J,YOU X R,et al.Impacts of guar and xanthan gums on pasting and gel properties of high-amylose corn starches[J].International Journal of Biological Macromolecules,2020,146:1 060-1 068.
[30] HORINAKA J I,URABAYASHI Y,WANG X C,et al.Molecular weight between entanglements for kappa-and iota-carrageenans in an ionic liquid[J].International Journal of Biological Macromolecules,2014,69:416-419.
[31] HUANG S,TU Z C,SHA X M,et al.Gelling properties and interaction analysis of fish gelatin-low-methoxyl pectin system with different concentrations of Ca2+[J].LWT,2020,132:109 826.
[32] DE ALC NTARA M G,DE FREITAS ORTEGA N,SOUZA C J F,et al.Electrostatic hydrogels formed by gelatin and carrageenan induced by acidification:Rheological and Structural Characterization[J].Food Structure,2020,24:100 137.
NTARA M G,DE FREITAS ORTEGA N,SOUZA C J F,et al.Electrostatic hydrogels formed by gelatin and carrageenan induced by acidification:Rheological and Structural Characterization[J].Food Structure,2020,24:100 137.
[33] ESPINOSA-ANDREWS H,SANDOVAL-CASTILLA O,VAZQUEZ-TORRES H,et al.Determination of the gum Arabic-chitosan interactions by Fourier transform infrared spectroscopy and characterization of the microstructure and rheological features of their coacervates[J].Carbohydrate Polymers,2010,79(3):541-546.
[34] URIARTE-MONTOYA M H,SANTACRUZ-ORTEGA H,CINCO-MOROYOQUI F J,et al.Giant squid skin gelatin:Chemical composition and biophysical characterization[J].Food Research International,2011,44(10):3 243-3 249.