脂肪氧合酶(EC 1.13.11.12 lipoxygenase,LOX)能催化氧化含顺,顺-1,4-戊二烯的多不饱和脂肪酸生成共轭氢过氧化脂肪酸(hydroperoxide,HPOD)[1-4]。HPOD及其衍生物可作为药物和香料生产的中间体[5-7],具有较大的商业价值。LOX热稳定性差,而且由于脂肪酸与水不互溶,导致该酶催化反应的底物浓度很低[8-12],这也是限制LOX工业化应用的两大瓶颈。若能开发一条工艺简单、底物浓度高、收率高、可规模化的LOX酶催化制备HPOD的方法将具有重要的工业价值。
超声波辐射是一种提高液-液非均相体系中传质效果的有用手段,能加速许多化学反应[13],已被证明是某些酶反应中的有用工具,可在不改变体系物理量的情况下介入反应,具有简单,廉价和绿色的优点。超声波辐射能发挥多方面作用:使底物更容易访问活性中心口袋,通过高空化能增加底物与酶的界面面积,减少传质限制,改善酶的性能等。但目前超声波辐射在酶催化反应中的应用并不广泛,多集中在酶催化合成生物柴油上,可使得反应时间明显缩短[14-17]。在LOX酶促反应中,底物脂肪酸与LOX酶液不混溶,超声有望以其空穴效应改善体系的传质问题而提高催化效率,以解决氢过氧化速率较低的问题,是一个值得探索的研究方向。目前几乎没有关于超声波辐射在LOX酶促反应中的应用报道。
LOX广泛存在于动植物中,尤以新鲜大豆中活力最高。我国豆粕资源丰富,成本低廉,具有广泛的工业应用前景。课题组前期利用脱脂豆粕为直接催化剂,将LOX的提取、固定化和催化耦合于同一过程中,对豆油的催化氧化进行了系统研究,在较高底物浓度下实现了较好的收率(60%)[18]。大豆油与豆粕的生物转化不仅减少了工艺步骤,还提高了总收率。本文以亚油酸为底物,期望利用新鲜豆粕耦合超声技术开发一条高底物浓度下生产氢过氧化亚油酸(linoleic acid hydroperoxide,LA-HPOD)的新工艺。
1 材料与方法
1.1 试剂与仪器
新鲜大豆(12个品种),2019年10月,黑龙江农科院惠赠;亚油酸(67.1%),苏州天然乳化剂公司赠送;二甲酚橙、过氧化氢异丙苯,Sigma-Aldrich上海贸易有限公司。乙醇、硼酸、硼砂、磷酸氢二钠、磷酸二氢钠、乙醚、石油醚、氢氧化钠,浓硫酸、硫酸钠等其他试剂均为分析纯,国药试剂。
1.2 脱脂豆粕的制备
用蒸馏水冲洗大豆,晾干备用。豆粕去皮后,用石油醚脱脂8次,然后磨细,用50目筛进行筛分。
1.3 LA-HPOD的合成
将适量亚油酸和无水乙醇加入到空气/液体反应器(100 mL)中,并置于恒温水浴。在强磁搅拌下加入缓冲液,使混合物乳化。之后,将O2(15 mL/min)引入反应体系中。5 min后加入适量脱脂豆粕开始反应。滴入1 mol/L H2SO4至pH 3停止酶反应。用乙醚(3×体积)萃取LA-HPOD。通过水洗涤乙醚提取物来去除蛋白质等杂质。LA-HPOD经硫酸钠干燥、乙醚蒸发后,用乙醇稀释以进一步测定摩尔数。所用缓冲溶液由0.2 mol/L磷酸钠(pH 5~8)和0.2 mol/L硼酸钠(pH 9~10)配制。
1.4 超声辅助LA-HPOD的合成
将空气/液体反应器(100 mL)固定在在超声波清洗机的中心。超声波清洗仪的功率为100 W,频率为40 kHz。超声波浴容量为9.1 L,内部尺寸为27 cm×21 cm×16 cm。浴液温度可保持在±1 ℃内。
1.5 脂氧合酶活性测定
每隔一段时间从充分混合的反应介质中吸取0.3 mL小样,以监测氢过氧化反应过程中LOX活性的变化。将取出的小样反应液在15 000 r/min下离心5 min。吸取20 μL上清液,用pH 9硼酸盐缓冲液稀释至25 mL,进一步测定脂氧酶活性。1个单位的LOX酶活力定义为在234 nm处,1 min内,3 mL的脂氧酶液反应增加0.001光密度的活性[19]。
1.6 LA-HPOD的定量分析
用二甲酚橙法测定LA-HPOD的摩尔量。该指示剂由113 μmol/L二甲酚橙、250 μmol/L六水硫酸铁铵、25 mmol/L硫酸和4 mmol/L 2,6-叔丁基-4-甲基苯酚在V(甲醇):V(水)=9:1中组成。在加入甲醇-水后立即加入H2SO4,显色45 min,在590 nm处测定吸光度。由于甲基橙的灵敏度随着时间的增加而降低,所以通常需要当天配制后使用。采用氢过氧化异丙苯的新鲜溶液来绘制甲基橙的校准曲线[20]。通过比较测定的产品中LA-HPOD实际摩尔数与反应的理论平衡产物数,LA-HPOD的产率按公式(1)计算:
LA-HPOD收率![]()
(1)
式中:N,反应混合物中检测到的LAHPOD摩尔量,mol;m,亚油酸的初始质量,g;M,亚油酸的分子质量,g/mol;原料中亚油酸质量分数为67.1%,其余为油酸。
2 结果与分析
2.1 大豆品种的筛选
豆科植物种子如大豆、蚕豆等中富含脂氧酶,特别是从大豆中提取的脂氧酶活性较高。大豆中的蛋白含量为40%左右,成熟种子中脂氧酶占总蛋白的1%~2%,是大豆中比较活跃的酶。但是不同种类大豆中的脂氧酶活性差异尚未知晓。本实验以酶活性为衡量指标,从12种大豆中筛选出脂氧酶活力较高的品种用于后续研究。由图1可知,各种大豆中脂氧酶活性差异并不显著,分布于3×104~5×104 U,其中黑河38中LOX的活性最高,用于后续实验。
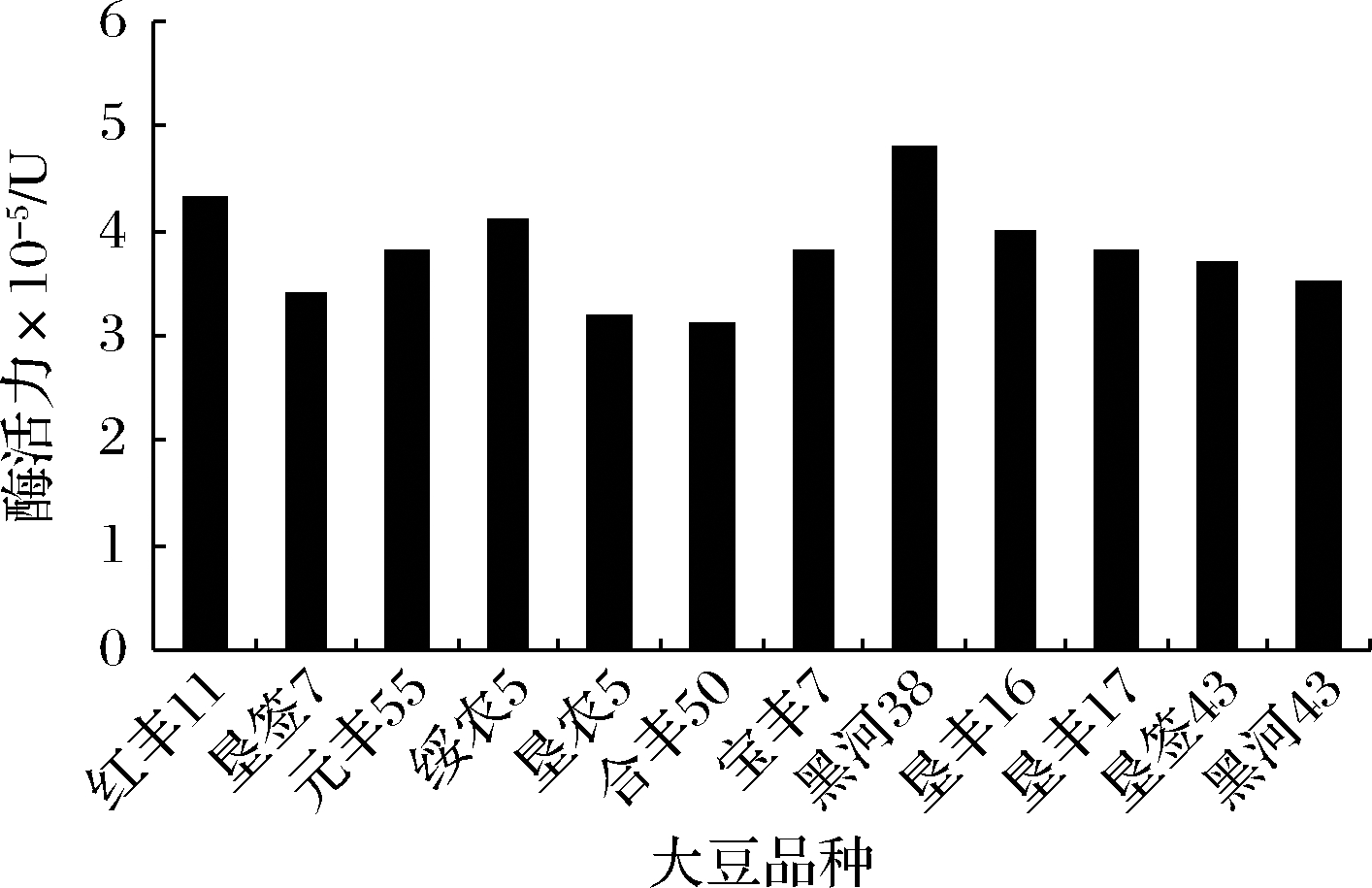
图1 不同品种大豆的脂氧酶活性
Fig.1 The LOX enzyme acivity of different kinds of soybean
2.2 pH和温度的影响
温度和pH是影响酶催化反应的两大因素,它们对LA-HPOD产率的影响曲线如图2所示。在1.5 g亚油酸,1 g豆粕体系中,以0.5 mL乙醇作助溶剂,分散在7.5 mL缓冲液中反应2.5 h。LOX稳定性差,低温下活性更高,通常在0~5 ℃进行脂氧合反应,但较高的温度有利于互溶和传质,体系的最佳温度取决于两者的平衡。本实验中豆粕的最佳反应温度为15 ℃,豆粕中的LOX具有更好的温度耐受性,而且较高的温度可以降低体系黏度,有利于传质。体系pH值会影响酶的解离状态和构象。pH可以改变酶蛋白的微环境,导致其催化行为也有所调整。考察pH对体系产率的影响,结果显示pH值为9时,LA-HPOD产率最高,与LOX酶的最佳pH值一致。
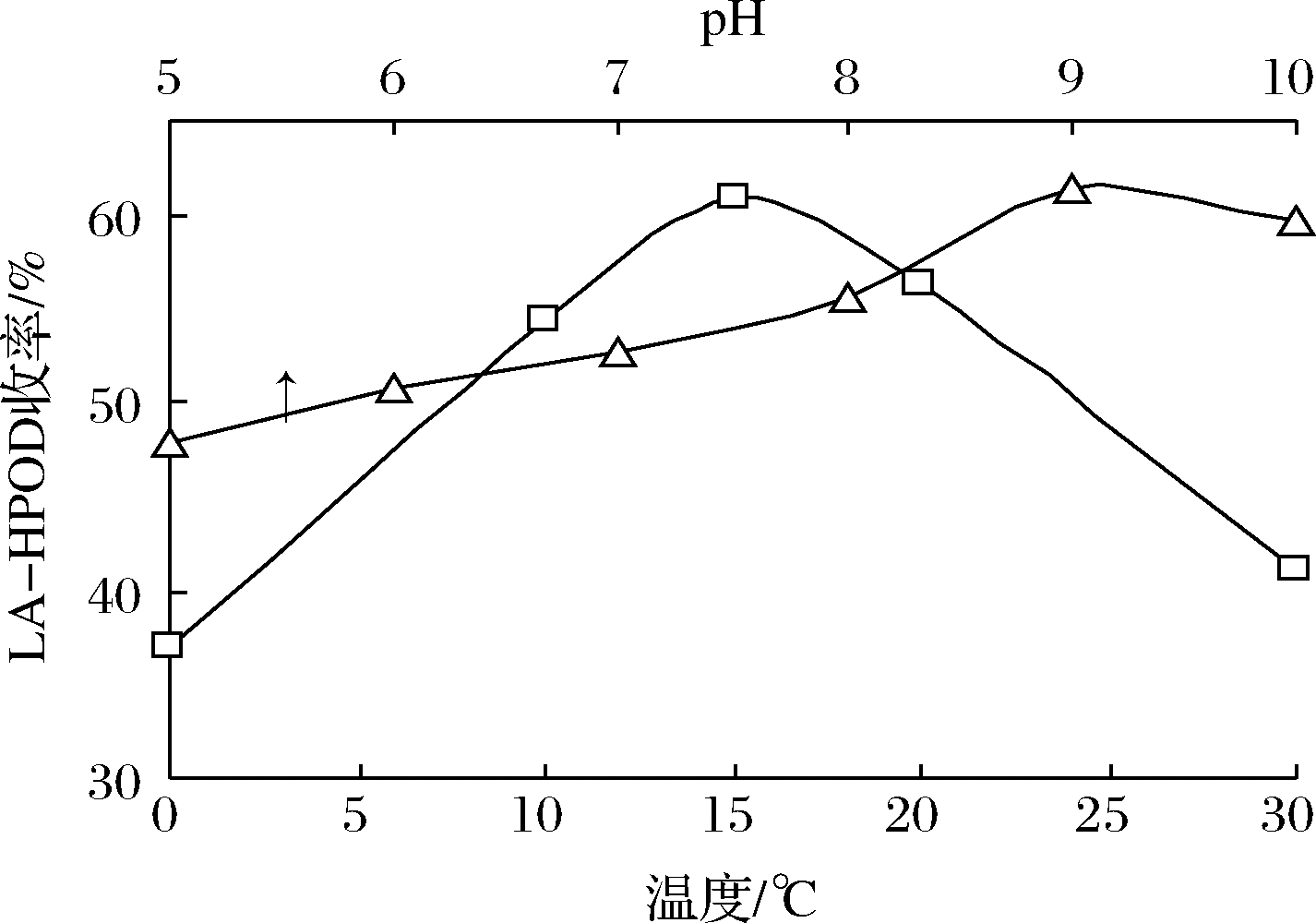
图2 pH和温度对LA-HPOD收率的影响
Fig.2 Effects of pH and temperature on yield of LA-HPOD
2.3 豆粕和底物用量的影响
如图3所示,显示了催化剂豆粕和底物亚油酸用量对脂氧合酶反应收率的影响。在15 ℃下,1.5 g亚油酸,0.5 mL乙醇,7.5 mL pH 9缓冲液体系中,对不同用量的豆粕(0.2~2 g)进行研究,反应时间为2.5 h。豆粕用量决定体系黏度和LOX活性大小。豆粕中的某些溶出物对亚油酸有一定乳化作用,加强了酶与底物的接触,此外溶出物提高了体系的黏度,延长了氧气停留时间。过高的豆粕用量不利于反应进行。豆粕用量为1.5 g时LA-HPOD产量最高可达68%。在上述体系中,设定豆粕用量为1.5 g,考察不同底物用量下的收率,当亚油酸的用量在1~1.5 g时,获得了满意的产率。为提高效能,后续实验采用底物用量为1.5 g。
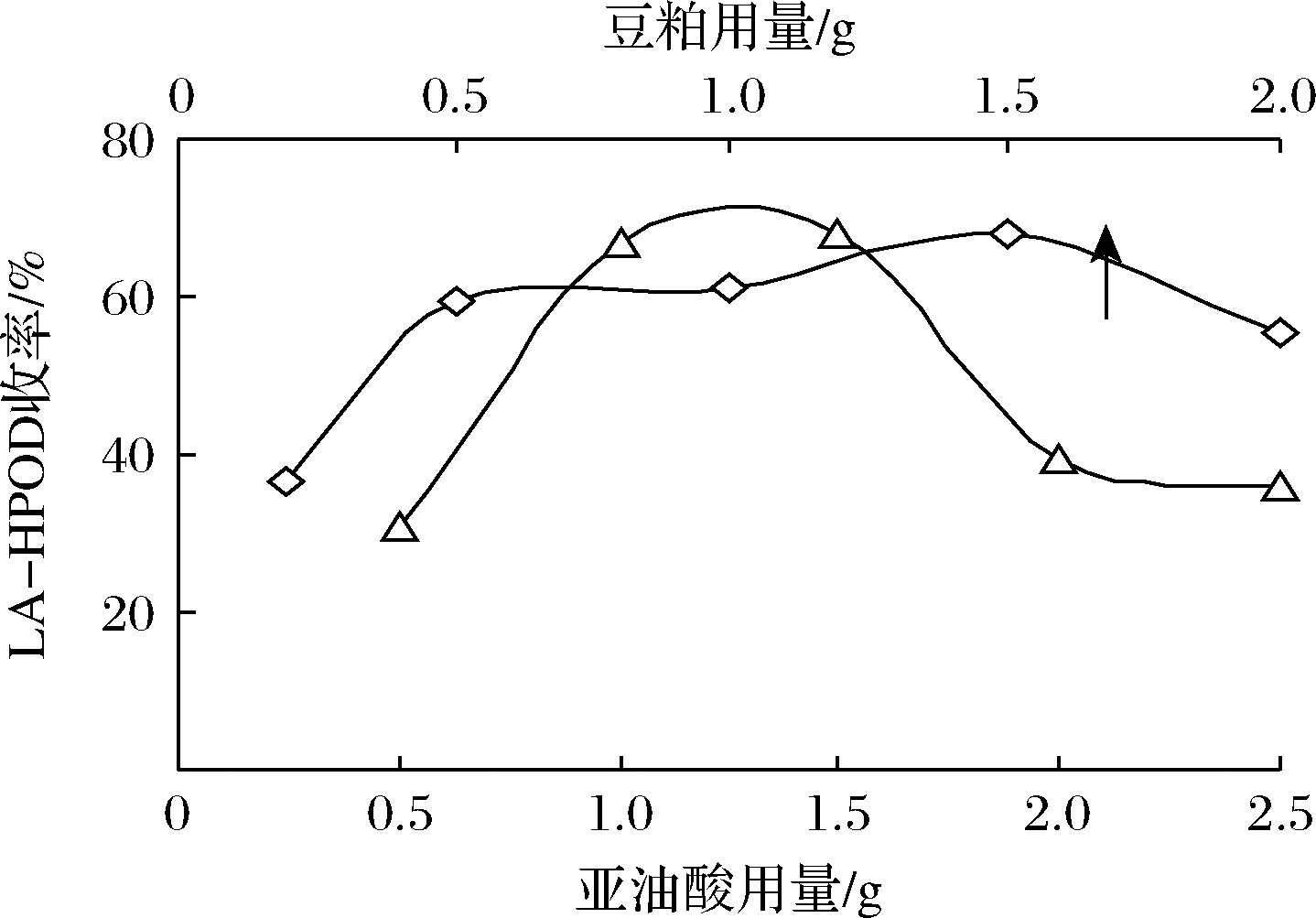
图3 豆粕和亚油酸用量对LA-HPOD收率的影响
Fig.3 Effects of soymeal and substrate dosage on yield of LA-HPOD
2.4 乙醇和缓冲液体积的影响
图4显示了在15 ℃,pH 9条件下,1.5 g豆粕和1.5 g亚油酸体系中,乙醇和缓冲液体积对LA-HPOD收率的影响。乙醇一定程度上可以提高底物的溶解度,增大LOX酶与底物的接触机率。由于酶在与反应环境的不同组分相互作用时,构象发生了变化,导致活性也有所调整[3]。乙醇体积在0~0.05 mL内,LA-HPOD产率随乙醇体积比的增大而逐渐增大。继续加大乙醇用量,反应收率不再提高。过大量的乙醇会降低LOX的活性,导致LA-HPOD提取困难。综上合适的乙醇用量为0.5 mL。最佳缓冲液体积比为0.75,LA-HPOD产率达68%。
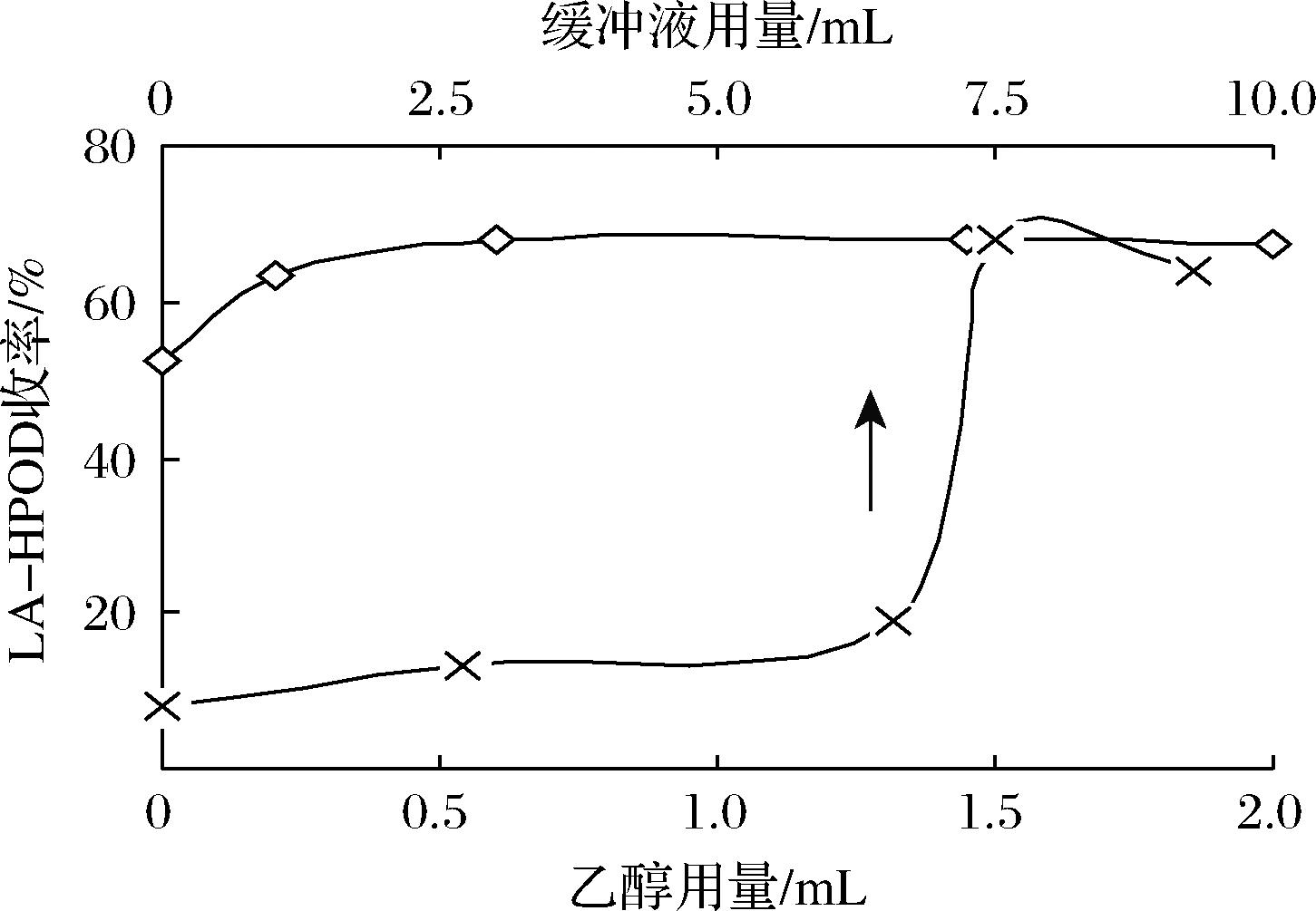
图4 乙醇和缓冲液体积对LA-HPOD收率的影响
Fig.4 Effects of ethanol and buffer volume on yield of LA-HPOD
2.5 豆粕加入策略
之前有报道LOX酶的自催化失活,即氧化过程中LOX出现活性降低现象,需要补充新鲜酶来恢复活性。本节考察若在反应后期补足更高的LOX酶活力,是否会提高氢过氧化物的产率。如何补充需要结合考虑LOX酶促反应进程中对LOX活力的实际需求。考虑到豆粕的黏度较高,释放的LOX酶又是热不稳定的,因此设计了梯度加入豆粕的策略,以使豆粕得以最佳利用。15 ℃下,3 g亚油酸,1 mL乙醇,15 mL pH 9的缓冲液体系中,结果如图5所示。未添加新鲜豆粕时,LOX活性在1 h后开始下降。策略C的反应收率最低,其余4个策略差别不大,以策略D的LA-HPOD收率最高,达70%。根据反应时间进程,豆粕用量和LOX活性在反应初始1 h对反应影响最大。溶解出的蛋白质和磷脂等能使体系较快的乳化,加快了反应进程。亚油酸在缓冲相中的不溶性阻碍了脂氧酶过氧化反应的进行,而豆粕的存在提供了更多的LOX活性,并形成了对LOX活性有利的微异质界面。
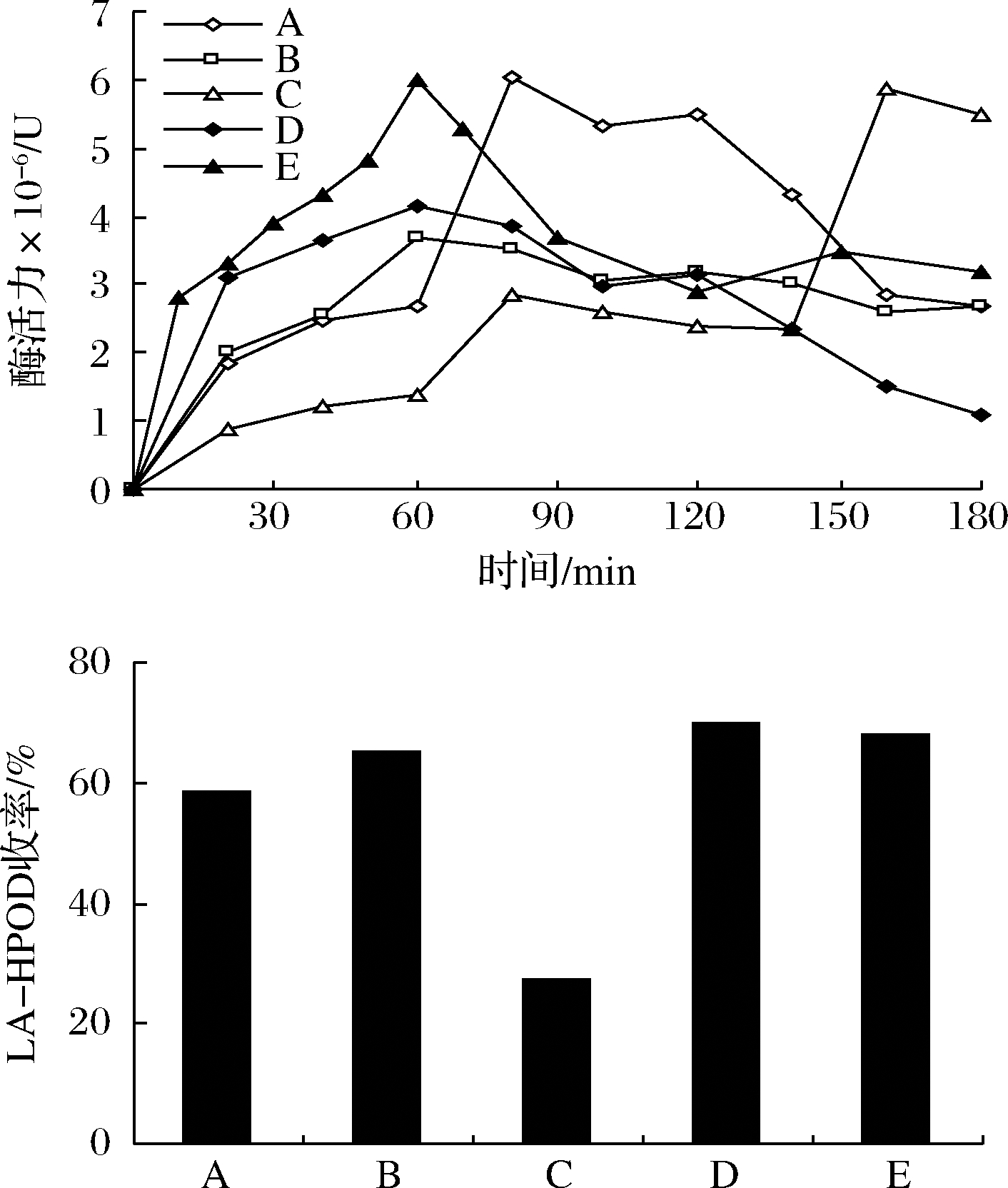
A-1.5 g(0 h)+1.5 g(1 h),即初始添加1.5 g豆粕,1 h后再添加 1.5 g豆粕;B-2 g(0 h)+0.5 g(1 h)+0.5 g(2 h);C-0.5 g(0 h)+ 0.5 g(1 h)+2 g(2 h);D-2 g(0 h)+1 g(2 h);E-3 g(0 h)
图5 豆粕加入策略
Fig.5 Addition strategy of soymeal
2.6 超声波强化传质
在上述优化的最佳条件(1.5 g豆粕、1.5 g亚油酸、0.5 mL乙醇、7.5 mL pH 9硼酸缓冲液、15 ℃)的基础上,将超声波辐射引入到LOX脂氧化过程中,以期在2个不相容相之间提供足够的接触。如预期的那样,超声波将最终产率从70%提高到89%,平衡时间从2.5 h缩短至40 min(图6)。表明超声波作用明显加快了LOX酶催化亚油酸体系的反应进程,同时提高了反应产率。超声波辐射可增加亚油酸与LOX活性中心的接触几率,加快产物与酶的解离和活性中心的再生。其空化作用产生的局部微环境很可能影响了反应平衡,促使过氧化反应进行得更彻底。因此豆粕与超声波联用是制备LA-HPOD的一种很有前途的技术。
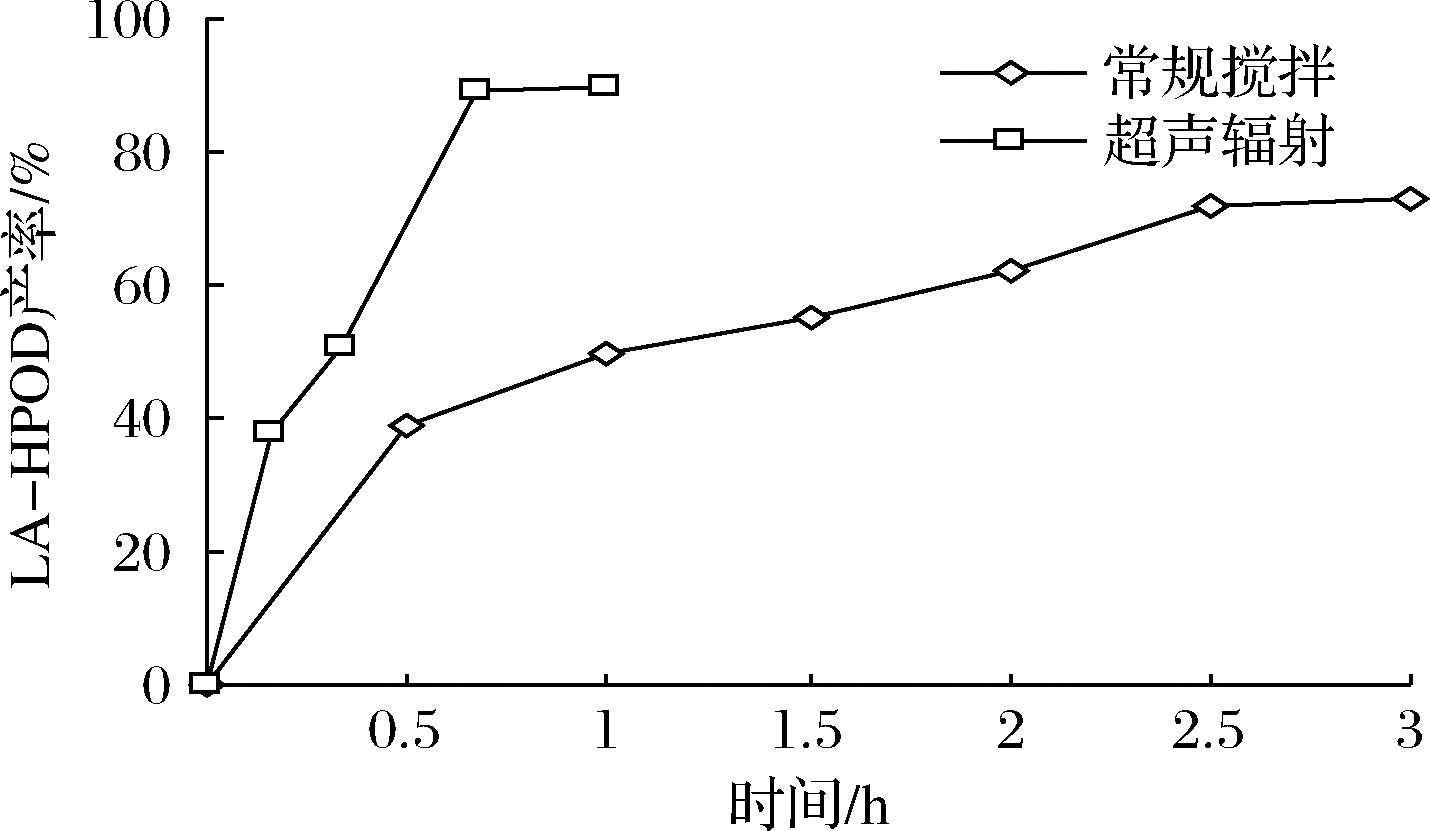
图6 超声波辐射对LA-HPOD收率的影响
Fig.6 Effects of ultrasonic radiation on yield of LA-HPOD
3 结论
LOX酶促反应的产物氢过氧化脂肪酸是重要的药物合成和香料生产的中间产物,具有较大的商业价值。但由于LOX热稳定性差,反应时底物浓度很低,极大地限制了LOX的工业化应用。为解决上述问题,本文利用富含LOX的新鲜豆粕耦合绿色的超声波技术,试图开发一条工艺简单、底物浓度高、收率高、可规模化制备HPOD的方法,以实现良好的反应效率和产率。本实验的最佳条件为:40 kHz,100 W超声波辐射下,15 ℃,1.5 g豆粕和1.5 g亚油酸,0.5 mL乙醇,7.5 mL pH 9硼酸盐缓冲液体系,超声技术将产率从70%提高到89%,平衡时间从2.5 h缩短至40 min(以传统搅拌体系做参照)。超声辅助豆粕反应体系提供了一种高底物浓度下绿色、快速、高效的合成氢过氧化脂肪酸的方法,大大降低成本和能耗,更适合于工业化生产。
[1] KESSLER A.Silencing the jasmonate cascade:Induced plant defenses and insect populations[J].Science,2004,305(5 684):665-668.
[2] MASHIMA R,OKUYAMA T.The role of lipoxygenases in pathophysiology;new insights and future perspectives[J].Redox Biology,2015,6:297-310.
[3] NEWCOMER M E,BRASH A R.The structural basis for specificity in lipoxygenase catalysis[J].Protein Science,2015,24(3):298-309.
[4] MARTINI D,IACAZIO G,FERRAND D,et al.Optimization of large-scale preparation of 13-(S)-hydroperoxy-9Z,11E-octadecadienoic acid using soybean lipoxygenase.Application to the chemoenzymatic synthesis of (+)-coriolic acid[J].Biocatalysis,1994,11(1):47-63.
[5] GAFFNEY B J.Connecting lipoxygenase function to structure by electron paramagnetic resonance[J].Accounts of Chemical Research,2014,47(12):3 588-3 595.
[6] HU S S,OFFENBACHER A R,LU E D,et al.Comparative kinetic isotope effects on first-and second-order rate constants of soybean lipoxygenase variants uncover a substrate-binding network[J].Journal of Biological Chemistry,2019,294(48):18 069-18 076.
[7] SOLER J,SAURA P,GARC A-L
A-L PEZ D,et al.How can linoleic acid be the preferential substrate of the enzyme 15-lipoxygenase-1? A QM/MM approach[J].The Journal of Physical Chemistry B,2016,120(8):1 950-1 960.
PEZ D,et al.How can linoleic acid be the preferential substrate of the enzyme 15-lipoxygenase-1? A QM/MM approach[J].The Journal of Physical Chemistry B,2016,120(8):1 950-1 960.
[8] ZHAO J H,WU J N,CHEN Y.Gel properties of soy protein isolate modified by lipoxygenase-catalyzed linoleic acid oxidation and their influence on pepsin diffusion and in vitro gastric digestion[J].Journal of Agricultural and Food Chemistry,2020,68(20):5 691-5 698.
[9] ZHAO J,SU G W,ZHAO M M,et al.Physicochemical changes and in vitro gastric digestion of modified soybean protein induced by lipoxygenase catalyzed linoleic acid oxidation[J].Journal of Agricultural and Food Chemistry,2019,67(50):13 978-13 985.
[10] PERRY S C,KALYANARAMAN C,TOURDOT B E,et al.15-Lipoxygenase-1 biosynthesis of 7S,14S-diHDHA implicates 15-lipoxygenase-2 in biosynthesis of resolvin D5[J].Journal of Lipid Research,2020,61(7):1 087-1 103.
[11] PAVLENKO I M,KUPTSOVA O S,KLYACHKO N L,et al.The lipase/lipoxygenase bienzyme system in AOT reversed micelles in octane[J].Russian Journal of Bioorganic Chemistry,2002,28(1):44-49.
[12] OFFENBACHER A R,SHARMA A,DOAN P E,et al.The soybean lipoxygenase-substrate complex:Correlation between the properties of tunneling-ready states and ENDOR-detected structures of ground states[J].Biochemistry,2020,59(7):901-910.
[13] CHAVAN P,BANGALE S,PANSARE D,et al.Synthesis of substituted pyrimidine using ZnFe2O4nanocatalyst via one pot multi-component reaction ultrasonic irradiation[J].Journal of Heterocyclic Chemistry,2020,57(9):3 326-3 333.
[14] PASCOAL C V P,OLIVEIRA A L L,FIGUEIREDO D D,et al.Optimization and kinetic study of ultrasonic-mediated in situ transesterification for biodiesel production from the almonds of Syagrus cearensis[J].Renewable Energy,2020,147:1 815-1 824.
[15] BHANGU S K,GUPTA S,ASHOKKUMAR M.Ultrasonic enhancement of lipase-catalysed transesterification for biodiesel synthesis[J].Ultrasonics Sonochemistry,2017,34:305-309.
[16] ZHANG F,HE Z,TU R,et al.Influence of ultrasonic/torrefaction assisted deep eutectic solvents on the upgrading of bio-oil from corn stalk[J].ACS Sustainable Chemistry & Engineering,2020,8(23):8 562-8 576.
[17] FALLAH KELARIJANI A,GHOLIPOUR ZANJANI N,KAMRAN PIRZAMAN A.Ultrasonic assisted transesterification of rapeseed oil to biodiesel using nano magnetic catalysts[J].Waste and Biomass Valorization,2020,11(6):2 613-2 621.
[18] CAI Y,LIU Y J,XU H,et al.Soymeal-catalyzed facile and economic bioproduction of soybean oil hydroperoxide[J].Biocatalysis and Biotransformation,2011,29(1):31-36.
[19] SURREY K.Spectrophotometric method for determination of lipoxidase activity[J].Plant Physiology,1964,39(1):65-70.
[20] GAY C,COLLINS J,GEBICKI J M.Hydroperoxide assay with the ferric-xylenol orange complex[J].Analytical Biochemistry,1999,273(2):149-155.