在体内条件下,微粒形态可以保护生物分子不被降解,并且有选择性地达到控制释放,同时也降低了免疫反应的风险[1]。近几十年来,微粒被广泛应用于食品、医药、化妆品等行业[2]。蛋白质和多肽作为重要的壳材料,在临床中得到广泛应用[3]。大豆分离蛋白(soybean protein isolate,SPI)具有良好的理化性质和功能性质[4]。作为微粒的单一或复合壳材料,SPI已被广泛使用。自组装[5]、乳化[6]以及喷雾干燥[7]等是目前常用的制备微粒的方法,但是这些方法一般难以控制粒径,且难以保持蛋白的品质。目前,一种以CaCO3为模板制备微球的方式十分流行。
CaCO3由于制备过程简单和温和的分解条件,常用于多层胶囊的制造。制备的CaCO3颗粒是粒径均一、多孔的球体[8]。利用静电吸附作用也可以实现多种蛋白质微球的制备。如利用CaCO3制备花青素微球,改善花青素的递送和消化规律[9]。通过CaCO3的模板作用改进阿霉素-壳聚糖微球,改善阿霉素在体内的消化特性等[10]。
槲皮素是对人体十分有益的物质。然而,槲皮素的水溶性低,生物利用度差,以及在生理介质中的不稳定性,限制了槲皮素作为健康促进剂的应用。本研究首次将SPI应用到CaCO3模板上,制备大豆蛋白微球,通过包埋率的计算、扫描电镜、冷冻电镜等方法,对SPI包埋特性以及蛋白微球性能进行分析。并以槲皮素为例,制备槲皮素-蛋白质复合微球,探究其对槲皮素模拟体外释放特性的影响,以期该大豆蛋白微球为营养物质、药物等在体内递送提供新型的运输载体。
1 材料与方法
1.1 材料与仪器
大豆,黑龙江省农业科学院;无水氯化钙、无水碳酸钠,恒兴化学试剂制造有限公司;实验中所用试剂均为分析纯。
UV-2600紫外分光光度计,上海美谱达仪器有限公司;Microfuge 20R冷冻离心机,美国贝克曼公司;S-3400 N SEM场发射扫描电子显微镜,日本日立公司;Mastersizer 2000激光粒度仪,英国马尔文仪器有限公司;rf-6000荧光谱仪,日本岛津公司。
1.2 实验方法
1.2.1 大豆分离蛋白的制备
参考鞠梦楠等[11]的方法,将脱脂豆粉分散在蒸馏水中,用2 mol/L NaOH溶液调节pH值至8.0,并离心,收集上清液并用2 mol/L HCl溶液将pH值调节至4.5,离心收集沉淀物并用2 mol/L NaOH溶液调至中性,然后水洗除去杂质,将此蛋白溶液冷冻干燥后得到SPI,经研磨后放入干燥器备用。
1.2.2 SPI-CaCO3复合微球的制备
参考VOLODKIN等[12]的方法稍作修改,将10 mL 0.33 mol/L的Na2CO3溶液分别加入到含有不同质量浓度SPI(0、1、3、5 mg/mL)的10 mL 0.33 mol/L的CaCl2溶液中。混合溶液用磁力搅拌器在1 000 r/min下搅拌30 min。然后将所得悬浮液过滤,将滤纸上剩余残渣用蒸馏水冲洗3遍。沉淀放入烘箱烘干并称质量,收集所有的滤液及漂洗水。利用紫外分光光度计在280 nm处测定悬浮液滤液和漂洗水的吸光值,以此计算滤液中蛋白的含量。包埋率计算如公式(1)所示:
包埋率![]()
(1)
未包埋的蛋白含量为测得的滤液和漂洗水中的蛋白含量总和。利用包埋率计算CaCO3上包埋蛋白质的质量,总沉淀物的质量减去这部分蛋白质的质量,将剩余其他沉淀物的质量除以Na2CO3与CaCl2质量之和,计算得出CaCO3的产率。蛋白质的荷载比计算如公式(2)所示:
荷载比![]()
(2)
1.2.3 大豆蛋白微球的制备
参考MADADLOU等[13]的方法稍作修改,将CaCO3沉淀按其原pH进行复溶,并向SPI-CaCO3复合微球悬浮液(10 mg/mL)中加入谷氨酰胺转氨酶(0.1 unit/mg SPI),磁力搅拌2 h(37 ℃,200 r/min)。搅拌结束后,将CaCO3颗粒悬浮液冷却至室温,并把配制好的0.25 mol/L 的乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)与SPI-CaCO3复合微球悬浮液按照体积比1∶1加入到悬浮液中。随后将悬浮液磁力搅拌24 h(4 ℃,100 r/min),以此来螯合CaCO3模板。所得样品在蒸馏水中透析3 d,除去EDTA和Ca2+,在透析袋中加入叠氮化钠(质量分数0.005%)来抑制微生物的生长。
1.2.4 粒径表征
参考VOLODKIN等[14]的方法稍加修改,利用激光粒度仪对CaCO3、SPI-CaCO3复合微球和大豆蛋白微球样品进行粒径分布测定,以此来表征整个实验过程中CaCO3以及大豆蛋白的粒径变化。
1.2.5 冷冻扫描电镜
参考YU等[15]的方法稍加修改,将SPI-CaCO3复合微球和大豆蛋白微球分别放置在铝铂上,在液氮(-210 ℃)中进行冷冻,随后将冷冻后的样品转移到低温系统中,最终在放大倍数50 000×下获得冷冻扫描图像。
1.2.6 热稳定性分析
根据MIRIANI等[16]的方法稍作修改,将SPI与制备好的大豆蛋白微球用0.01 mol/L的磷酸盐缓冲溶液(phosphate buffer saline,PBS)稀释到0.1 mg/mL,在80 ℃下加热20 min。使用280 nm的激发光谱以及300~450 nm的发射光谱对加热后的样品进行荧光检测。
1.2.7 槲皮素-蛋白质复合微球的制备
将0.1 g槲皮素与10 mL 0.33 mol/L的Na2CO3进行混合,利用磁力搅拌器在300 r/min下搅拌15 min,随后将10 mL 0.33 mol/L CaCl2加入混合溶液,后续实验操作与大豆蛋白微球制备方法一致,制备完成即为蛋白质槲皮素复合微球。
1.2.8 槲皮素-蛋白质复合微球的定量及体外释放
将20 mg槲皮素-蛋白质复合微球溶于20 mL PBS中,加入2 μL水解蛋白酶,在50 ℃下水解3 h,用紫外分光光度计在374 nm波长下测定水解液吸光值,从而确定复合微球中槲皮素含量。参考MINEKUS等[17]的方法,配制胃、肠模拟液,取20 mg样品溶液于20 mL电解液中,胃部的模拟pH值为3,加入25 000 U/mg的胃蛋白酶,随后将混合液置于透析袋中,每15 min取1次透析液,利用紫外分光光度计在374 nm下测定吸光值。将样品在胃部的模拟环境中释放1 h,随后加入15 000 U/mg的胰蛋白酶以及5 mg/mL的胆盐,将pH值调节至7,后续与胃部模拟一致。释放过程中取透析液在374 nm处测定吸光值。
1.3 统计分析
所有的测量均在3次以上,结果均以平均值±标准差表示。均数比较采用单因素方差分析(ANOVA) 和邓肯检验(P<0.05)。
2 结果与分析
2.1 包埋特性的分析
由图1可知,加入SPI后CaCO3的生成率没有明显变化。但包埋率随着SPI浓度的增加有所下降,而装载率随着蛋白浓度的增加而相应的增加。在MADADLOU等[13]的实验中发现了相似的变化规律。这可能与SPI吸附到CaCO3微球表面的方式有关。一般来说,由于CaCO3多孔的结构会为SPI的吸附提供一定的毛细力,CaCO3与蛋白质携带的不同电荷也为吸附作用提供了静电相互作用。当包埋到CaCO3表面的SPI到达一定量后,毛细力和静电相对减弱,因此SPI不会无休止的吸附到CaCO3上。近年来,BABABUSHEVICH等[18]研究了抑肽酶、胰岛素和过氧化氢酶包埋到CaCO3上的包埋规律,发现相较于蛋白质的分子质量,蛋白质的等电点更能主导装载量的变化。因此可以推断静电相互作用是蛋白质包埋的主要作用力。
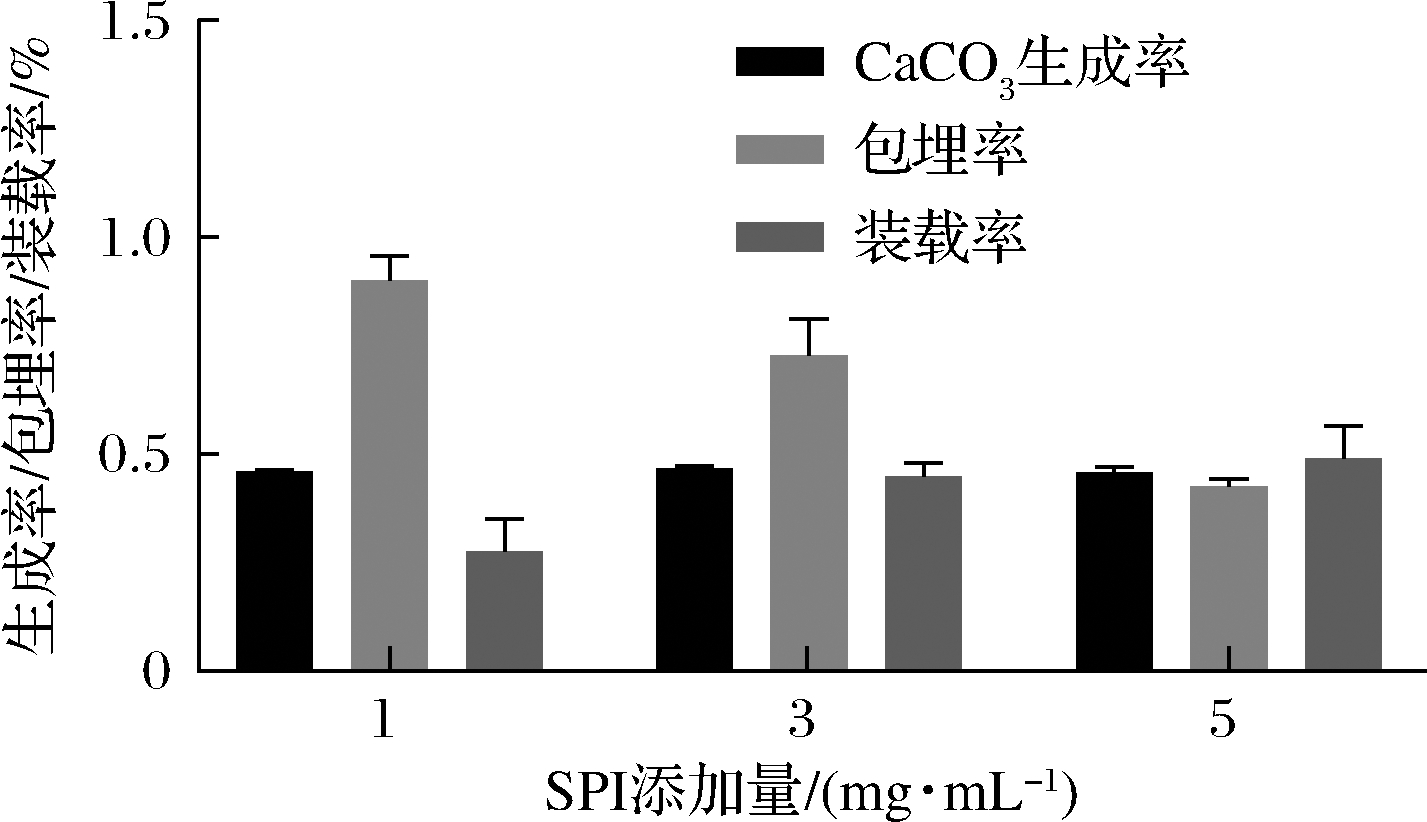
图1 SPI添加量对CaCO3的包埋特性的影响
Fig.1 The yield of CaCO3 microparticles,coating efficiency and loading ratio in different SPI concentration
2.2 粒径分析
由图2可知,CaCO3的粒径比较均一,主要分布在3~12 μm,这与VOLODKIN等[12]的研究结果一致。CaCO3因其具有非常小的粒径分布范围,在一些抗癌药物的递送中有着优异的表现[19]。如图2所示,在CaCO3模板上包埋SPI后,SPI-CaCO3复合微球的粒径会增大。D50指样品的累计粒度分布百分数达到50%时所对应的粒径。样品A~D的D50分别是9.150, 10.258, 11.701和8.669μm。结合图3扫描电镜图片,在加入SPI后,生成的SPI-CaCO3复合微球是非常圆滑的球面,而未加蛋白的CaCO3微球表面附着了一些不规则的CaCO3附着物,由此推断这可能是在加入SPI后复合微球粒径减小的主要原因,在MADADLOU等[13]的研究中也解释了类似的现象,在加入蛋白后促进了离子更好的融合,减少了不规则的物质,从而形成了更小的微粒。当使用EDTA螯合CaCO3后,蛋白微球的粒径增大,这可能是因为模板的去除使SPI不能继续维持完整球形结构,具有“坍塌”的现象,因此粒径会增大。
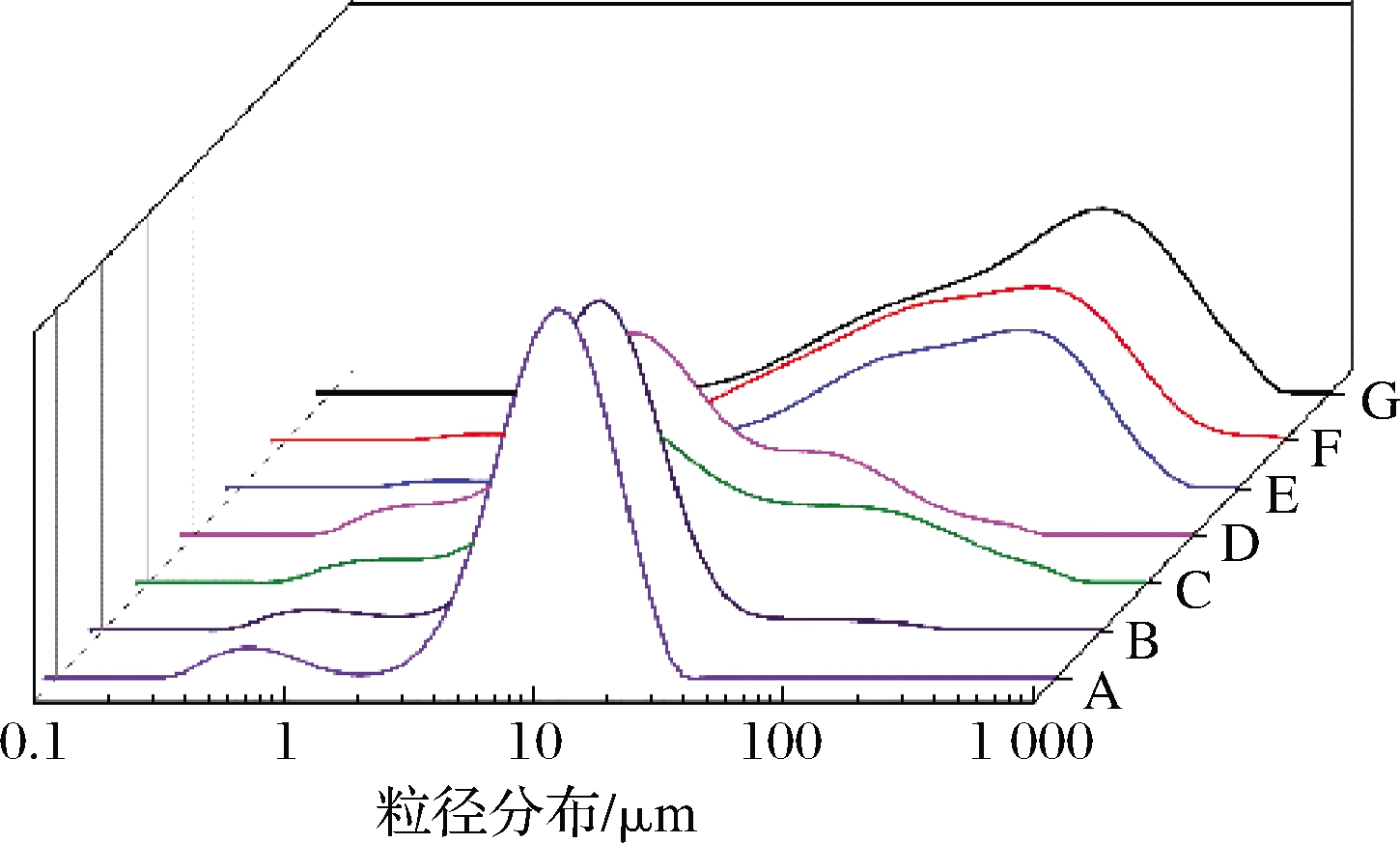
A-CaCO3微球;B-1 mg/mL SPI-CaCO3复合微球;C-3 mg/mL SPI-CaCO3复合微球;D-5 mg/mL SPI-CaCO3复合微球; E-1 mg/mL SPI微球;F-3 mg/mL SPI微球;G-5 mg/mL SPI微球
图2 粒径分布图
Fig.2 Particle size distribution
2.3 扫描电镜分析
由图3-a可知,未添加SPI的CaCO3表面多孔,赋予了它非常高的表面积。由图3-b可知,添加SPI后,CaCO3的表面十分光滑,且更加均一,分散程度更好,这可能是由于SPI的加入限制了CaCO3的成长,减少了表面附着的不规则的CaCO3[20]。由图3-c可知,当SPI失去CaCO3模板的支撑后会形成塌陷的结构,不会继续维持完整的球形。这些结构的变化也与粒径的变化规律相符,表面附着物的减少,使得粒径有所降低,蛋白质结构的坍塌变形,造成粒径变大。在VOLODKIN等[21]的实验中,有着类似的实验现象,蛋白质的脱水以及脱去模板后蛋白质机械强度降低是造成蛋白质坍塌的主要原因[22]。但是即便如此,蛋白微球依旧维持着多孔的结构,这为蛋白微球作为递送载体承载药物或营养物质提供了可能,类似球形的结构也使蛋白微球拥有制备高蛋白饮料的机会。
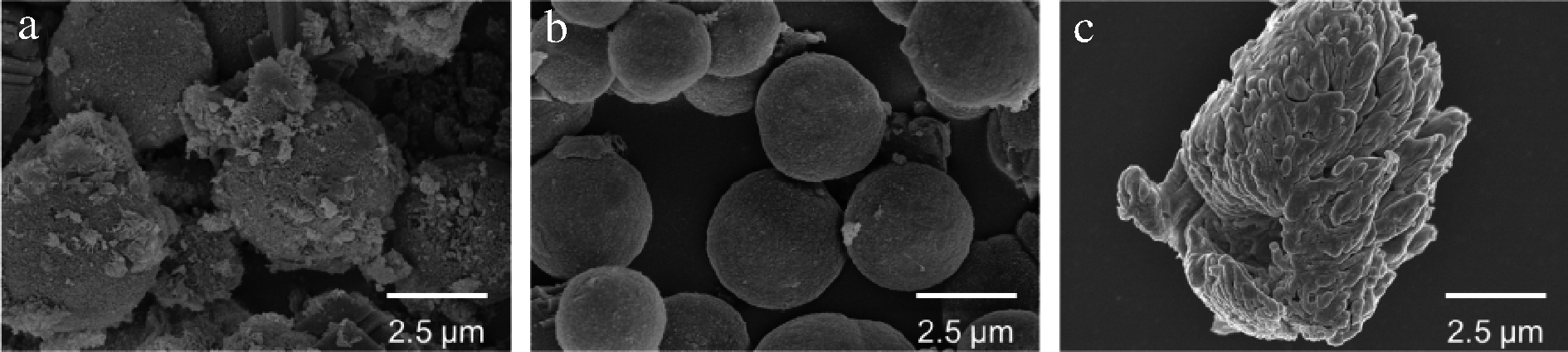
a-CaCO3;b-3 mg/mL SPI-CaCO3复合微球;c-3 mg/mL SPI微球
图3 CaCO3、3 mg/mL SPI-CaCO3复合微球和3 mg/mL SPI微球的扫描电镜图
Fig.3 The scanning electron microscopy (SEM) images of CaCO3,3 mg/mL CaCO3-SPI microparticles,and 3 mg/mL SPI microparticles
2.4 蛋白微球的热稳定性分析
由图4可知,相较于SPI,将SPI制备成蛋白微球后,荧光强度有所增加。一般情况下,碱性环境使蛋白质变性,从而在355 nm附近有吸收峰,但本实验中蛋白质在355 nm处没有出现吸收峰,这代表碱性条件没有使蛋白质变性[23]。随着蛋白质浓度的增加,荧光强度有所降低,荧光的强度与蛋白质内疏水性色氨酸残基的暴露程度密切相关,同时二硫键会淬灭色氨酸荧光,酰基的转移也会使荧光降低[24]。荧光强度的降低可能是由于蛋白质浓度增加时,蛋白质被谷氨酰胺转氨酶催化生成了更多的二硫键以及酰基的转移所致。此外,经过加热的蛋白微球仅发生了较小范围的红移(由333 nm红移到337 nm),然而未经加工的SPI则发生了较大的红移(由328nm红移到344 nm)。热处理会通过破坏氢键和非极性疏水基团来影响蛋白质的三维结构,这些结构的破坏使得荧光峰值发生偏移。因此,蛋白微球的制备增强了蛋白质的热稳定性。
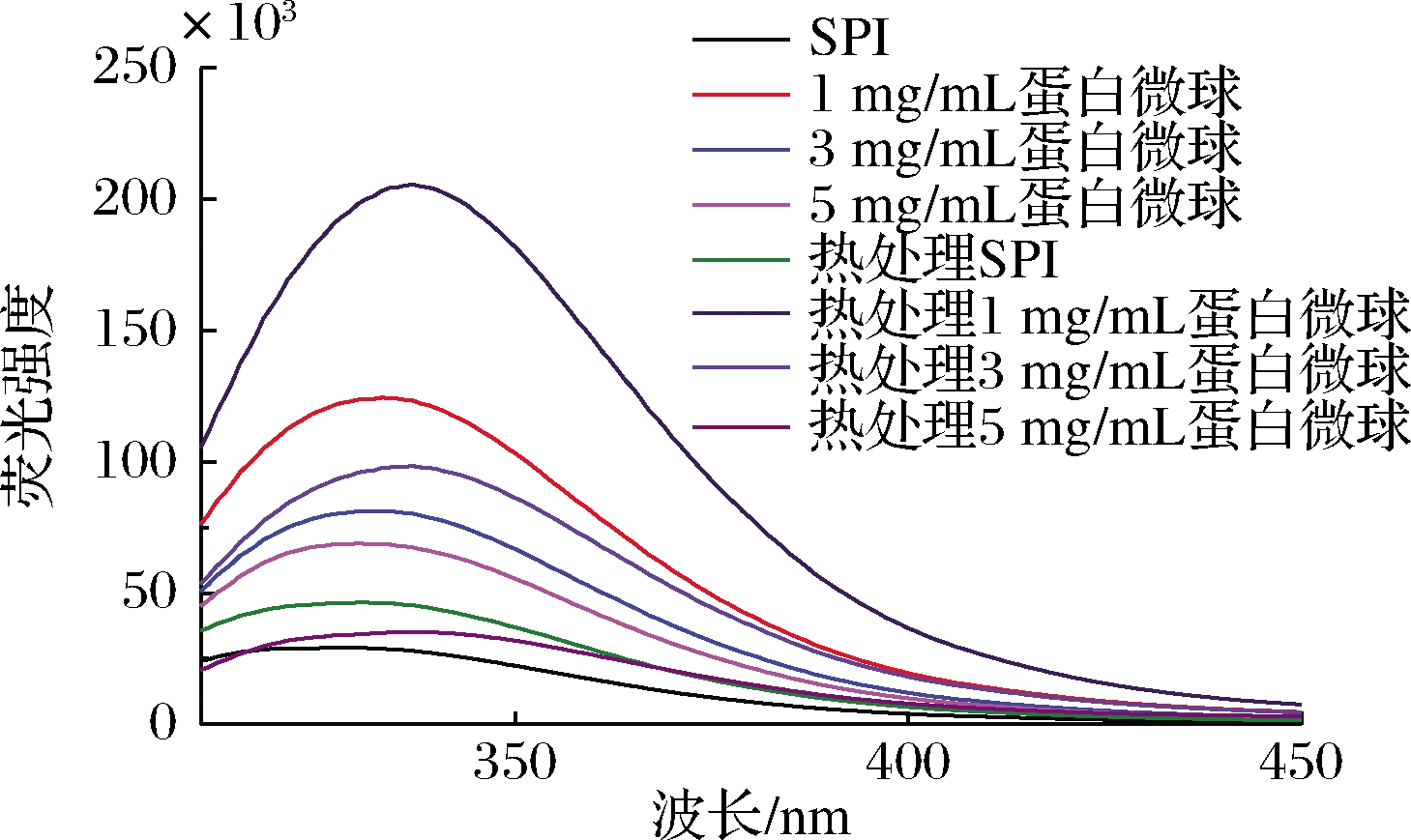
图4 不同浓度下制备的蛋白微球和加热后的 蛋白微球荧光图谱
Fig.4 Fluorescence spectra of unheated and heated SPI,SPI microparticles of different concentration
2.5 槲皮素-蛋白质复合微球体外释放
槲皮素在人体内的吸收主要在小肠,所以槲皮素的延缓释放非常重要,通过对槲皮素蛋白质复合微球的体外释放行为的研究能够很好地评价复合微球的缓释行为。如图5所示,槲皮素-蛋白质复合微球在模拟胃部释放的过程中呈现出匀速的释放方式,2 h内释放量达到槲皮素总量的32.419%,在肠道内的释放,前期释放较慢,在45~90 min内释放速度较快,达到槲皮素总量的35.580%,后续在释放时间为4 h时达到槲皮素总量的71.205%,证实了蛋白微球对槲皮素的释放有一定的延缓释放的作用。复合微球在模拟胃液和模拟肠液中都没有达到100%的释放量,这可能是由于复合微球制备过程中碳酸钙的脱去不完全,导致复合微球中碳酸钙对蛋白质及槲皮素有一定的吸附作用,从而影响了槲皮素的释放速率。
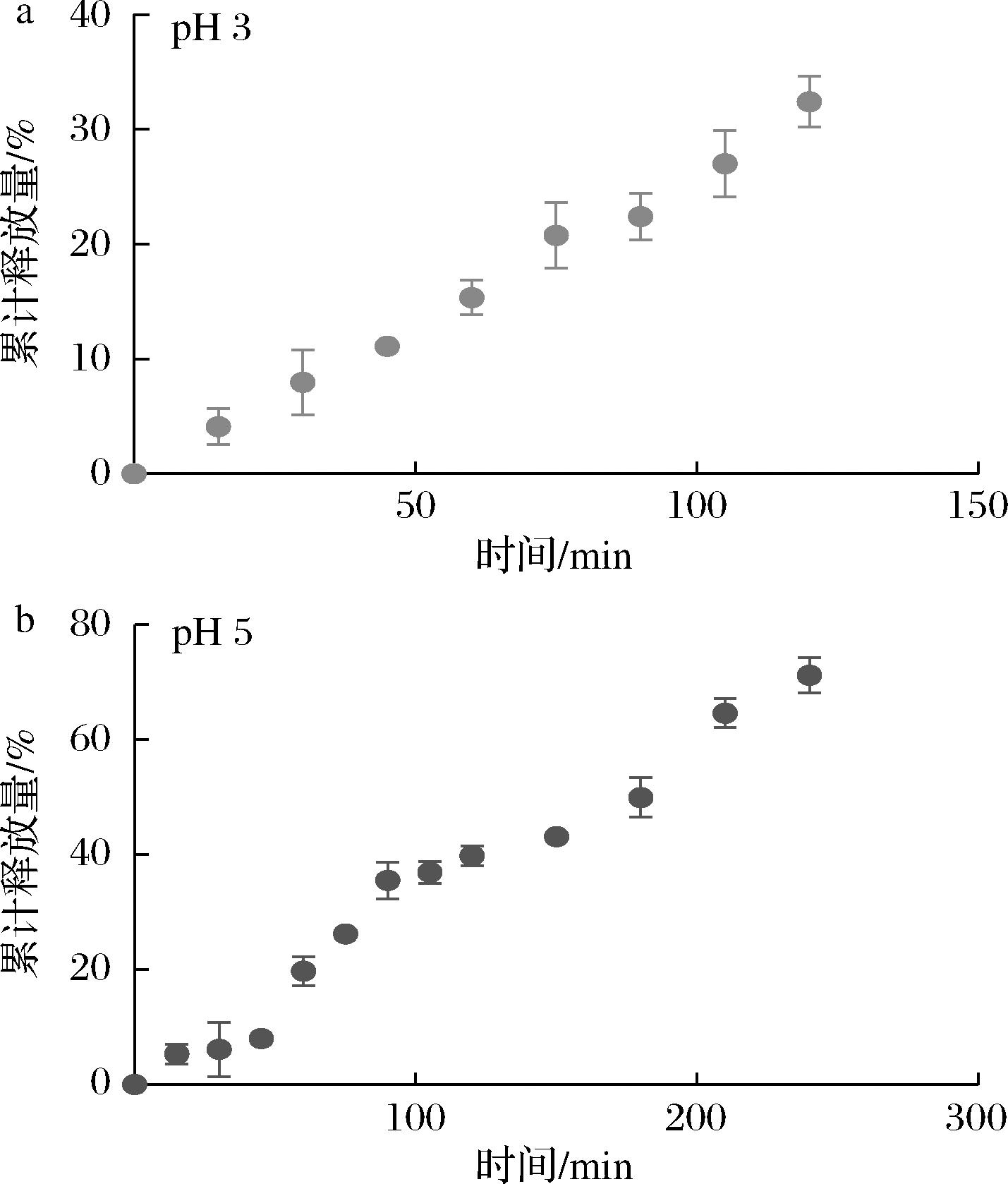
a-pH 3;b-pH 5
图5 槲皮素-蛋白复合微球的体外模拟释放特性
Fig.5 In vitro release profiles of quercetin-CaCO3 composite microsphere
3 结论与讨论
在本研究中,利用多孔、高表面积、粒径均一的碳酸钙作为模板,首次将大豆分离蛋白包埋到碳酸钙模板上,通过调节不同的蛋白加入量,螯合掉碳酸钙模板,制备出粒径均一的蛋白微球,主要为需要在体内特定部位释放的物质提供一种新型的更天然、更具营养价值的运输载体,并对其结构和功能进行了探究。通过电子显微镜,激光共聚焦和冷冻电镜结果可知,蛋白质的加入会改善碳酸钙不规则的样貌,蛋白质会进入到碳酸钙的表面以及孔隙中,且制备的蛋白微球维持多孔结构,具有作为微胶囊递送药物或营养物质的潜力。最后通过对热处理后的蛋白微球进行荧光分析可知,本实验制备的蛋白微球具有较好的热稳定性,能够承受巴氏杀菌等需加热的加工过程。槲皮素作为示例物质,其在微球中释放特性表明,复合微球对槲皮素具有一定的缓释作用,这一结果有效解决了槲皮素生物利用度差的问题,因此大豆蛋白微球作为一种递送载体具有一定的可行性。
[1] 田焱松, 高育哲,赵闪闪,等.粮食蛋白质微胶囊的研究进展[J].现代食品,2019,16:99-101.
TIAN Y S,GAO Y Z,ZHAO S S,et al.Research progress on grain protein microcapsules[J].Modern Food,2019,16:99-101.
[2] PEANPARKDEE M,IWAMOTO S,YAMAUCHI R.Microencapsulation:A review of applications in the food and pharmaceutical industries[J].Reviews in Agricultural Science,2016,4:56-65.
[3] 庄丰辰,胡锦华,周鹏.乳蛋白微胶囊包埋共轭亚油酸及其稳定性研究[J].食品安全质量检测学报,2018,9(16):4 381-4 386.
ZHUANG F C,HU J H,ZHOU P.Microcapsulation of conjugated linoleic acid with milk proteins and its stability[J].Journal of Food Safety & Quality,2018,9(16):4 381-4 386.
[4] 张灿, 吴彩娥,范龚健,等.植物蛋白微胶囊对益生菌包埋的研究进展[J].食品工业科技,2017,38(5):385-389.
ZHANG C,WU C E,FAN G J,et al.Progress in the research of plant protein materials for probiotics encapsulation[J].Science and Technology of Food Industry,2017,38(5):385-389.
[5] COCHEREAU R,NICOLAI T,CHASSENIEUX C,et al.Mechanism of the spontaneous formation of plant protein microcapsules in aqueous solution[J].Colloids and Surfaces
a:Physicochemical and Engineering Aspects,2019,562:213-219.
[6] DI GIORGIO L,SALGADO P R,MAURI A N.Encapsulation of fish oil in soybean protein particles by emulsification and spray drying[J].Food Hydrocolloids,2019,87:891-901.
[7] NOSHAD M,MOHEBBI M,KOOCHEKI A,et al.Microencapsulation of vanillin by spray drying using soy protein isolate-maltodextrin as wall material[J].Flavour and Fragrance Journal,2015,30(5):387-391.
[8] VOLODKIN D.CaCO3 templated micro-beads and-capsules for bioapplications[J].Advances in Colloid and Interface Science,2014,207:306-324.
[9] TAN C,SELIG M J,LEE M C,et al.Encapsulation of copigmented anthocyanins within polysaccharide microcapsules built upon removable CaCO3 templates[J].Food Hydrocolloids,2018,84:200-209.
[10] PENG C Y,ZHAO Q H,GAO C Y,et al.Sustained delivery of doxorubicin by porous CaCO3 and chitosan/alginate multilayers-coated CaCO3 microparticles[J].Colloids and Surfaces
a:Physicochemical and Engineering Aspects,2010,353(2-3):132-139.
[11] 鞠梦楠, 祝钢,陈红宇,等.大豆球蛋白-花青素Pickering乳液性质[J].食品科学,2020,41(2):1-7.
JU M N,ZHU G,CHEN H Y,et al.Physiochemical characterization of Pickering emulsions stabilized by anthocyanin and soybean protein[J].Food Science,2020,41(2):1-7.
[12] VOLODKIN D V,PETROV A I,PREVOT M,et al.Matrix polyelectrolyte microcapsules:New system for macromolecule encapsulation[J].Langmuir,2004,20(8):3 398-4 006.
[13] MADADLOU A,FLOURY J,PEZENNEC S,et al.Encapsulation of β-lactoglobulin within calcium carbonate microparticles and subsequent in situ fabrication of protein microparticles[J].Food Hydrocolloids,2018,84:38-46.
[14] VOLODKIN D V,SCHMIDT S,FERNANDES P,et al.One-step formulation of protein microparticles with tailored properties:Hard templating at soft conditions[J].Advanced Functional Materials,2012,22(9):1 914-1 922.
[15] YU S Y,PENG W,SI W,et al.Enhancement of bacteriolysis of Shuffled phage PhiX174 gene E[J].Virology Journal of Plant Physiology,2011,8(1):206.
[16] MIRIANI M,IAMETTI S,BONOMI F,et al.Structural changes of soy proteins at the oil-water interface studied by fluorescence spectroscopy[J].Colloids and Surfaces B:Biointerfaces,2012,93:41-48.
[17] MINEKUS M,ALMINGER M,ALVITO P,et al.A standardised static in vitro digestion method suitable for food-an international consensus[J].Food Function,2014,5:1 113-1 124.
[18] BALABUSHEVICH N G,LOPEZ DE GUERENU A V,FEOKTISTOVA N A,et al.Protein-containing multilayer capsules by templating on mesoporous CaCO3 particles:POST-and PRE-loading approaches[J].Macromolecular Bioscience,2016,16(1):95-105.
[19] ZHAO Q H,ZHANG S,TONG W J,et al.Polyelectrolyte microcapsules templated on poly (styrene sulfonate)-doped CaCO3 particles for loading and sustained release of daunorubicin and doxorubicin[J].European Polymer Journal,2006,42(12):3 341-3 351.
[20] STEIN E W,VOLODKIN D V,MCSHANE M J,et al.Real-time assessment of spatial and temporal coupled catalysis within polyelectrolyte microcapsules containing coimmobilized glucose oxidase and peroxidase[J].Biomacromolecules,2006,7(3):710-719.
[21] VOLODKIN D V,VON KLITZING R,MÖHWALD H.Pure protein microspheres by calcium carbonate templating[J].Angewandte Chemie,2010,49(48):9 258-9 261.
[22] TONG W J,DONG W F,GAO C Y,et al.Multilayer capsules with cell-like topology:Fabrication and spontaneous loading of various substances in aqueous and ethanol solutions[J].Macromolecular Chemistry and Physics,2005,206(17):1 784-1 790.
[23] JIANG J,CHEN J,XIONG Y L,et al.Structural and emulsifying properties of soy protein isolate subjected to acid and alkaline pH-shifting processes[J].Agricultural and Food Chemistry,2009,57(16):7 576-7 583.
[24] MUINO P L,CALLIS P R.Solvent effects on the fluorescence quenching of tryptophan by amides via electron transfer.Experimental and computational studies[J].The Journal of Physical Chemistry B,2009,113(9):2 572-2 577.