玉米须是一种药食两用的传统中药材[1],资源丰富,生理功能广泛。玉米须多糖是其最重要的功能成分之一,但目前开发利用非常有限,因此有关玉米须多糖的研究成为近年来的热点。通常采用热水浸提后乙醇沉淀的方法制备大分子多糖,但此法需要消耗大量乙醇,工艺控制也较复杂,而超滤法是利用膜过滤的物理方法分离获得大分子物质,具有操作简单、无试剂消耗、无相变等优点,应用越来越广泛[2-4]。目前因多糖纯化比较复杂且得率较低,有关多糖的开发多以粗多糖为目标物,而关于采用超滤法制备的玉米须粗多糖的性质和功能少有报道。本课题组报道过超滤制备玉米须粗多糖的工艺,并分析了其简单成分组成[5],并发现其可以正向调节小鼠体内免疫功能[6]。因此本研究较系统地分析了超滤法制备的玉米粗多糖的性质,重点分析了该糖的矿物质组成、单糖组成和多糖的表面结构,并研究了该粗多糖促进酸奶中益生菌增殖活性,以期为玉米须多糖的开发利用提供理论支持。
1 材料和方法
1.1 材料
1.1.1 原料
玉米须,安徽亳州中药材批发市场,经清洗、烘干、粉碎备用。无菌砖纯牛奶、益消牌原味发酵乳,伊利乳业。
1.1.2 主要试剂
1-苯基-3-甲基-5-吡唑啉酮(3-methyl-1-phenyl-2-pyrazolin-5-one,PMP)、鼠李糖、甘露糖、木糖、阿拉伯糖、葡萄糖、半乳糖、半乳糖醛酸标准品,Sigma公司;苯酚、浓硫酸、甲醇、氯仿等试剂均为国产分析纯。
1.1.3 主要仪器
UF-20中空纤维超滤装置,大城县华泰净化技术有限公司;722 N可见分光光度计,上海箐华科技仪器有限公司;PYX-DHS-500BS隔水电热培养箱,北京市永光明医疗仪器厂;S—4300扫描电子显微镜,日本Hitachi公司;傅里叶-红外色谱仪,美国PE公司;高效液相色谱,美国Agilent公司;NexION350X电感耦合等离子体质谱(inductively coupled plasma massspectrometry,ICP-MS),美国PerkinElmer公司;756 PC紫外可见分光光度计,上海菁华科技仪器有限公司。
1.2 实验方法
1.2.1 玉米须多糖超滤制备
玉米须粉热水煮沸2 h,3 000 r/min离心分离上清液,玉米须残渣同法再提取1次,合并2次提取上清液,经截留分子质量为10 kDa超滤膜超滤分离的小分子物质,收集超滤浓缩液,进一步浓缩后烘干至质量恒定,获得玉米须超滤粗多糖,保存于干燥器中备用。
1.2.2 玉米须多糖成分分析
多糖测定采用苯酚-硫酸法[7];蛋白质测定采用凯氏定氮法[8];总黄酮测定采用AlCl3分光光度法[9];总酚测定采用福林酚法[10];脂肪测定采用索氏提取法[11];灰分含量测定采用坩埚法[12]。
1.2.3 玉米须多糖单糖组成分析
(1)单糖标准品的PMP衍生化:用0.3 mol/L的NaOH溶液分别配制浓度为10 mmol/L的鼠李糖、甘露糖、木糖、阿拉伯糖、葡萄糖、半乳糖、半乳糖糖醛酸标准品,取0.5 mL等体积混合溶液加入0.5 mL 0.5 mol/L PMP甲醇溶液,密封后涡旋30 s,于70 ℃水浴反应30 min,冷却后加入0.5 mL 0.3 mol/L的HCl溶液涡旋30 s以中和溶液。加入3 mL氯仿萃取,涡旋3 min后离心,收集上清液,同法反复萃取3次,上清液适当稀释,膜过滤后,进行高效液相分析。
(2)多糖样品水解及PMP衍生化:分别称取20 mg多糖样品于安瓿管中,加入2 mL 2 mol/L三氟乙酸,封管120 ℃水解4 h后吹干,再加入2 mL甲醇吹干,重复加甲醇约3次以除尽三氟乙酸。加入2 mL 0.3 mol/L NaOH溶液溶解,取0.5 mL溶液按(1)进行PMP衍生化。
(3)液相色谱条件:安捷伦ZORBAX Eclipse XDB-C18柱 (4.6 mm×250 mm,5 μm),PAD检测器,检测波长254 nm,柱温30 ℃,流动相为100 mmol/L磷酸盐缓冲溶液(pH 6.7)∶乙腈=83∶17(体积比),流速1.0 mL/min,进样量20 μL。
1.2.4 玉米须多糖矿物质元素ICP-MS分析
(1)微波消解
准确称量0.200 g的样品于消解罐中,再加入1 mL浓硝酸,3 mL浓盐酸,1 mL H2O2,上罐后按确定的消解条件进行微波消解,同时做空白对照。将消解液转移到100 mL塑料容量瓶中,用体积分数3%的HNO3溶液定容至100 mL备用。消解条件:当消解仪升温至100 ℃时,保持2 min;140 ℃时,保持2 min;170 ℃时,保持2 min;200 ℃时,保持5 min;220 ℃时,保持10 min;MAX,235 ℃。
(2)ICP-MS工作参数
雾化气流量0.99 L/min;辅助气流量1.2 L/min;等离子气流量18 L/min;ICP射频功率1 600 W;模拟阶段电压-1 650 V;脉冲电压800 V;检测器电压12 V;偏转板电压-12 V;模式:KED,3 mL/min。
1.2.5 玉米须多糖微观结构分析
取适量玉米须多糖干样品,黏着于附有铜胶带的样品台上,置于离子溅射仪中镀上一层导电金粉,然后将其安放在扫描电镜下观察。工作条件:加速电压20 kV。
1.2.6 紫外扫描分析
称取多糖样品,用蒸馏水配制成0.25 mg/mL的溶液,在200~600 nm下进行紫外-可见光扫描。
1.2.7 红外扫描分析
取干燥玉米须多糖样品10 mg,与KBr 100 mg进行充分混合,经玛瑙研钵充分研磨后压片进行红外光谱扫描,扫描波数为4 000~400 cm-1。
1.2.8 促进酸奶中益生菌增殖活性研究[13]
在无菌室中采用无菌操作将原料乳(纯牛奶)加入无菌烧杯中(100 mL/杯),加入不同质量的玉米须多糖,另设空白对照组,每实验设置3次重复,接入含有混合益生菌种(嗜热链球菌、保加利亚乳杆菌、乳双歧杆菌、嗜酸乳杆菌的混合菌种,活菌总数为1×106 CFU/mL)的原味发酵乳,接种量16.7%,封口后45 ℃培养8 h,检测益生菌增殖情况。
乳酸菌检测依据GB 4789.35—2010《食品安全国家标准 食品微生物学检验 乳酸菌检验》方法进行。选2~3个连续的适宜稀释度,每个稀释度取0.1 mL样品,分别置于3个MRS琼脂平板,使用涂布棒进行表面涂布。(36±1)℃,培养(48±2) h后计数平板上的所有菌落数。
2 结果与分析
2.1 玉米须粗多糖成分
超滤法制备的玉米须粗多糖主要是由2种含量相当的大分子物质多糖和蛋白质组成,其中多糖含量35.43%、蛋白质含量34.51%,两者占粗多糖的近70%,课题组前期研究显示,玉米须粗多糖热水总浸提物提取率为8.37%,而超滤可分离除去热水总浸提物33.75%的组分[5],表明超滤法可以有效制备大分子物质多糖,但同醇沉制备法一样,也会产生大量大分子蛋白质。超滤多糖中还含有4.78%灰分,少量的总黄酮和总酚,基本不含脂肪。
2.2 矿物质元素分析
矿物质元素是人体重要的营养素之一,参与许多重要的生理功能。同时,矿物质元素会与许多大分子物质结合,参与这些大分子物质的结构组成和功能发挥。分析显示玉米须粗多糖,除主要由大分子多糖和蛋白质等组成,还含有大量灰分,但目前有关其组成中矿物质元素的分布情况未见报道。采用ICP-MS分析发现(表1),玉米须超滤粗多糖中富含K、Mg、P、Fe和Ca元素,除Ca 含量134.60 mg/100 g和Fe含量185.81 mg/100 g外,其他3种元素均超过200 mg/100 g,其中K含量尤其高,达到1 196.90 mg/100 g,超过其他元素总量之和。粗多糖中Na和Zn含量较低,只有43.40和50.40 mg/100 g,Al含量最低仅为21.23 mg/100 g。玉米须富含K元素,K具有利尿功效,现证实通过超滤制备的玉米须粗多糖也含有大量K元素,这可能是玉米须多糖的一个重要特征,推测其可能会结合到多糖的糖链上,直接影响玉米须多糖的结构和功能,相关研究可重点关注。
表1 玉米须超滤粗多糖主要矿物质含量
Table 1 Main mineral content of corn silk ultrafiltration crude polysaccharide
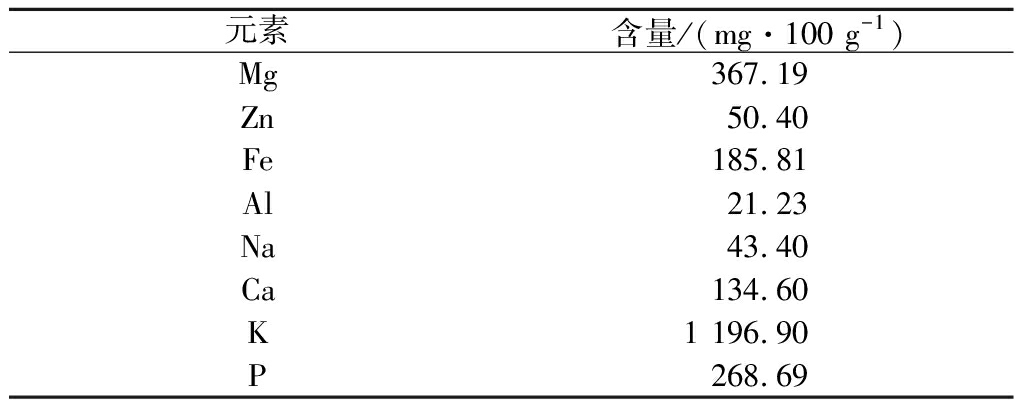
元素含量/(mg·100 g-1)Mg 367.19Zn50.40Fe 185.81Al 21.23Na 43.40Ca 134.60K 1 196.90P 268.69
2.3 紫外分析
使用紫外-可见分光光度计对玉米须粗多糖进行光谱扫描。由图1可知,在260~280 nm 处出现明显的吸收峰,说明有蛋白质存在,与化学分析结果一致,而在350~550 nm 波长内,没有发现类胡萝卜素的特征吸收峰[14]。
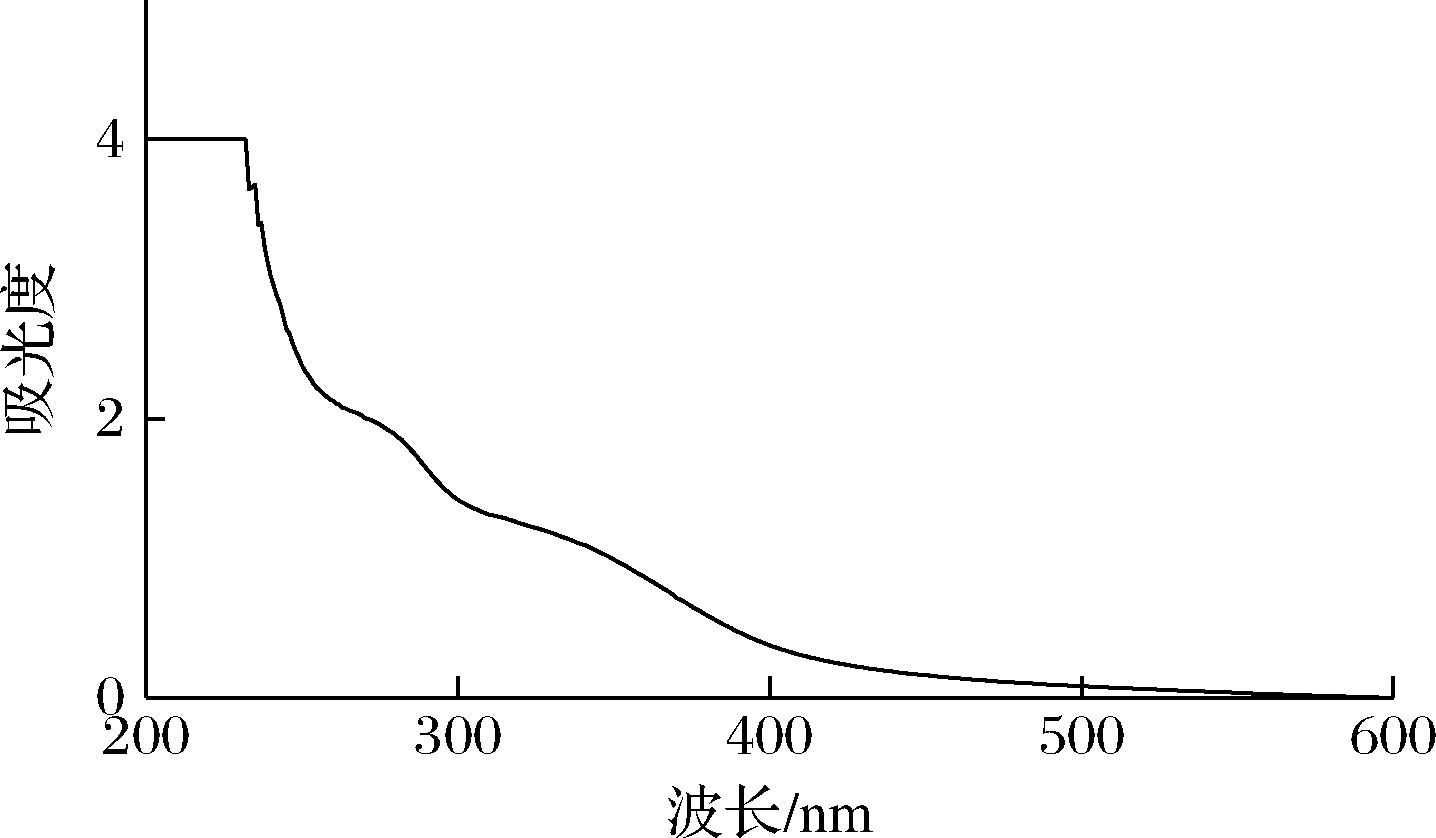
图1 玉米须粗多糖的紫外-可见光扫描谱图
Fig.1 UV-Vis scanning spectrum of polysaccharide from Stigma maydis
2.4 红外分析
玉米须粗多糖红外分析结果(图2)显示,它具有多糖特征吸收峰,3 400 cm-1(O—H)、2 900 cm-1(C—H)、1 650 cm-1(C![]() O)、1 100-1 020 cm-1(C—O),其组成单糖中包括α型糖苷键(809 cm-1吸收峰)和吡喃环糖环(1 100-1 020 cm-1之间存在3个拉伸峰),并可能含有鼠李糖(600 cm-1)。因此玉米须多糖可能主要由α-吡喃糖组成,且组成单糖中可能有鼠李糖。
O)、1 100-1 020 cm-1(C—O),其组成单糖中包括α型糖苷键(809 cm-1吸收峰)和吡喃环糖环(1 100-1 020 cm-1之间存在3个拉伸峰),并可能含有鼠李糖(600 cm-1)。因此玉米须多糖可能主要由α-吡喃糖组成,且组成单糖中可能有鼠李糖。
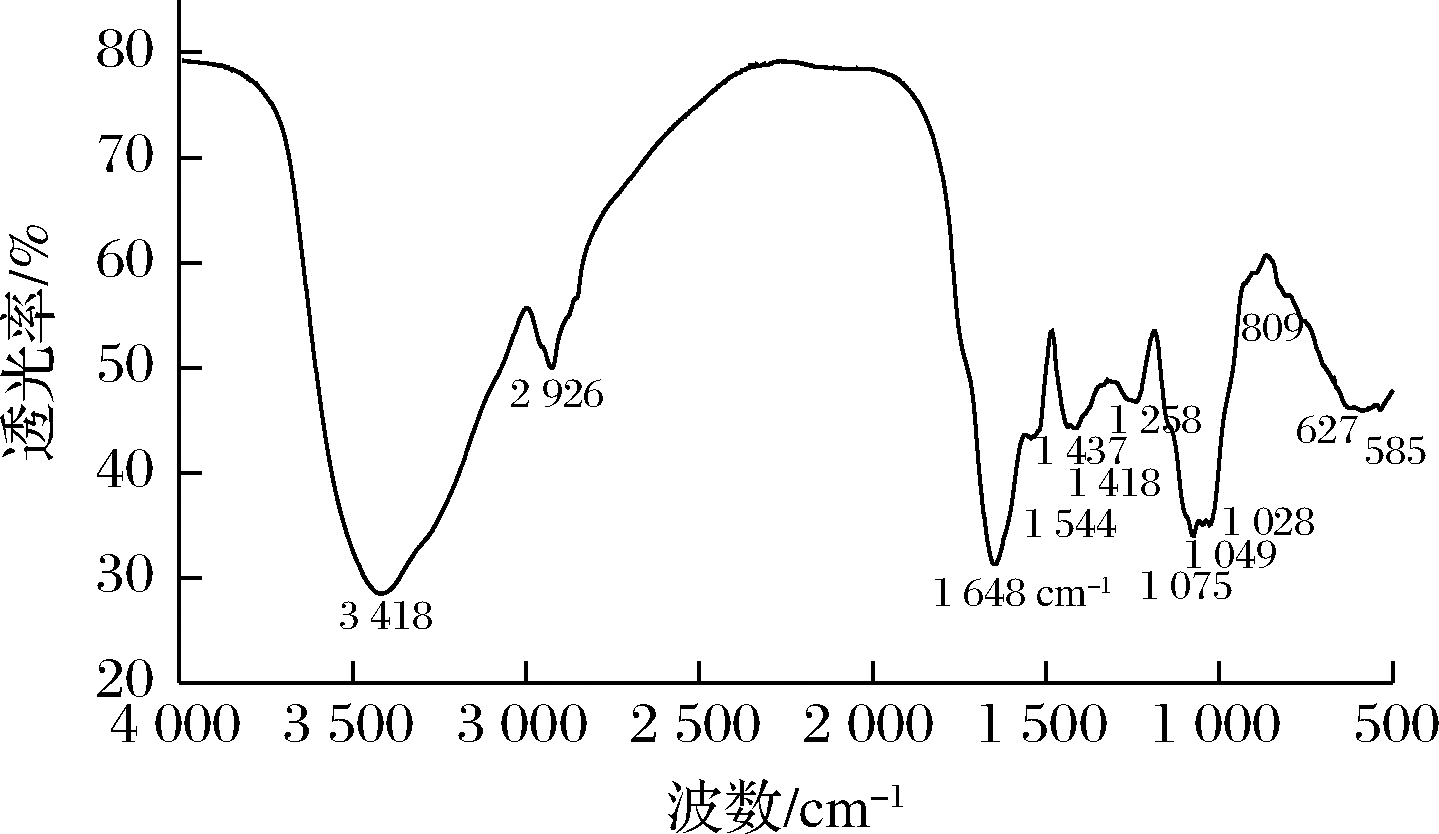
图2 玉米须粗多糖的红外扫描谱图
Fig.2 Infrared scanning spectrum of polysaccharide from Stigma maydis
2.5 单糖组成
玉米须超滤粗多糖先后经离子层析和凝胶层析分离后,采用三氟乙酸水解和单糖衍生化,再进行高效液相色谱层析,根据与标准单糖保留时间进行对比,分析多糖组分的单糖构成。通过高效液相色谱分析发现,一种酸性玉米须多糖组分主要由甘露糖、鼠李糖、葡萄糖醛酸、葡萄糖、半乳糖和阿拉伯糖组成,其摩尔比约为1∶0.31∶0.32∶1.39∶3.06∶0.60,不含半乳糖醛酸和木糖,如表3所示。在保留时间为11.58和19.05 min出现2个未知峰,表明该多糖中可能还含有2个未知的单糖,其中保留时间为19.05 min组分的峰面积比较小,表明其含量可能比较低。可见,该酸性多糖组成单糖中半乳糖、葡萄糖和甘露糖含量很高,3种单糖含量之和约为所有已知单糖组分总和的80%以上,其中半乳糖含量最高,约为所有已知单糖组分总和的45%以上。另外,高效液相色谱分析发现鼠李糖是玉米须多糖的组成单糖之一,与红外分析相一致。报道显示,在玉米须多糖中发现有甘露糖[15-18]、鼠李糖[16-17]、葡萄糖[17-18]、半乳糖[15,17-18]和阿拉伯糖[15-18]的存在,与本研究结果一致。本研究中未发现有木糖,但有学者报道玉米须中有木糖的存在[15,17-18],还有报道称玉米须多糖组成单糖中有来苏糖[18]和果糖[15],而本研究中发现2个未知单糖峰,在后续研究中可进一步验证。贾亚敏等[17]研究显示半乳糖和葡萄糖这2种单糖的含量比较高,与本研究结果一致;而关于甘露糖含量的报道不一致,本研究中发现其含量也较高,但也有其含量很低的报道[17]。现有报道中未见有关糖醛酸的存在,本研究中发现在玉米须酸性多糖中含有葡萄糖醛酸,但其含量相对较低,不含有半乳糖醛酸。
表2 高效液相色谱分析中单糖出峰时间和浓度
Table 2 Peak time and concentration of monosaccharide in HPLC
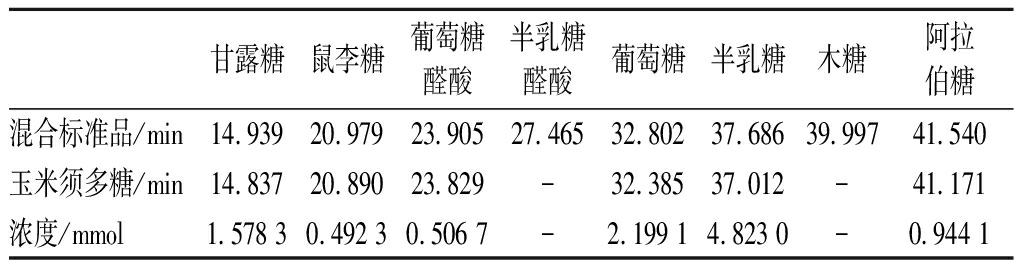
甘露糖鼠李糖葡萄糖醛酸半乳糖醛酸葡萄糖半乳糖木糖阿拉伯糖混合标准品/min14.93920.97923.90527.46532.80237.68639.99741.540玉米须多糖/min14.83720.89023.829-32.38537.012-41.171浓度/mmol1.578 30.492 30.506 7-2.199 14.823 0-0.944 1
2.6 电镜扫描分析
玉米须多糖在扫描电镜下,呈现出边缘带分枝的片状结构和大小不均的杆柱状形态。放大100倍时(图3-a),该多糖呈现出不规则片状和杆柱状形态,片状结构为主体,且大小不一,片状边缘有分枝,这可能与该多糖冻干后成非常轻薄的絮层状有关。多糖的分枝结构在枸杞多糖[19]和银合欢种子多糖[20]中也有发现。放大至150倍(图3-b),多糖表面形貌平整光滑,清晰可见片状结构通过许多分枝连接,有一些细分枝成杆柱状,可以延伸很长。放大到700倍(图3-c)和1 000倍(图3-d),杆柱状分枝和片状结构的表面非常光滑、平整,片状结构上裂口呈现不规则锯齿状。在10 000倍视野中(图3-e),可见多糖为连续的膜状结构,表面略微凹凸不平。与此相似,在高倍镜下,虎奶菇菌核多糖[21]、豌豆水溶性粗多糖[22]、枸杞多糖[19]表面也为平整、致密的平面结构。但豌豆多糖经离子和凝胶层析获得的几个组分,在10 000倍时,其结构为致密的圆球颗粒[22];银合欢种子多糖[20]经纯化后也为致密的球状,与玉米须多糖有明显差异。另外也有多糖具有不同表面形态的报道,金针菇根部多糖呈现絮状结构[23]、防风多糖呈现出不规则的纤维丝状与颗粒状的堆积[24]、虎奶菇菌核多糖聚集体SHNP呈成屑状、片状和杆柱状[21]。可见,不同种类的多糖在电镜扫描分析中表现出的表面形态并不一致。综合分析,粗多糖因通常混有大量的蛋白质等大分子物质,其表面结构通常可能是连续的,且比较光滑,而经过一定纯化后,不同种类多糖的微观结构可能会有不同表现,有的是连续的平面结构,有的是致密的球状等。这可能和多糖的单糖组成和高级结构有直接关系。

a-×100;b-×150;c-×700;d-×1 000;e-×10 000
图3 玉米须中性多糖扫描电镜照片
Fig.3 Scanning electron microscope images of neutral polysaccharide from Stigma maydis
2.7 玉米须粗多糖促进酸奶中益生菌增殖作用
在前期研究中发现采用超声波提取、乙醇沉淀获得的玉米须粗多糖可以促进酸奶中乳酸菌总数和嗜热链球菌的增长[16]。本研究分析了采用超滤法分离的玉米须粗多糖对酸奶中益生菌促生长作用的影响。由图4可见,超滤法制备的玉米须粗多糖可以促进酸奶中乳酸菌增殖,且呈现剂量依赖。通过2种不同方法制备的玉米须粗多糖的活性表现一致,可见玉米须粗多糖确实具有促进益生菌增殖的作用,具备后续开发潜力。

图4 玉米须超滤粗多糖对乳酸菌菌落总数的影响
Fig.4 Effect of addition crude polysaccharide from S.maydis into yogurt making on lactic acid bacteria count
3 结论
超滤法分离制备玉米须粗多糖主要含有35.43%多糖、34.51%蛋白质、4.78%灰分,还有少量的总黄酮和总酚,基本不含脂肪;经ICP-MS分析,该多糖中富含K、Mg、P、Fe和Ca元素,除Ca 含量134.60 mg/100 g和Fe含量185.81 mg/100 g外,其他3种元素均超过200 mg/100 g,其中K含量尤其高,达到1 196.90 mg/100 g,超过其他元素总量之和,Na和Zn含量较低,只有43.40和50.40 mg/100 g,Al含量最低仅为21.23 mg/100 g;高效液相色谱分析发现一种酸性玉米须多糖主要由甘露糖、鼠李糖、葡萄糖醛酸、葡萄糖、半乳糖和阿拉伯糖组成,其摩尔比约为1∶0.31∶0.32∶1.39∶3.06∶0.60,不含有半乳糖醛酸和木糖,还可能含有2个未知的单糖,可见甘露糖、葡萄糖和半乳糖是该多糖的主要单糖,含量逐渐升高;扫描电镜显示,玉米须多糖呈现为边缘带分枝的片状结构和大小不均的杆柱状,其中片状结构为主体,且大小不一,片状边缘有分枝,表面结构非常光滑、平整;红外分析发现其具有多糖的典型吸收峰;添加超滤分离制备的玉米须粗多糖制作酸奶,发现其可以促进酸奶中乳酸菌增殖,表现出剂量依赖性。
[1] 中华人民共和国卫生部药材标准委员会.中华人民共和国卫生部药材标准(1985版)[M].北京:人民卫生出版社,1986.
Chinese Medicine Standards Committee,Ministry of Health of PRC.Medicinal material standard of ministry of health of PRC (1985)[M].Beijing:People's Hygiene Press,1986.
[2] 邓朝阳, 张森旺,王慧宾,等.超滤膜提取金银花多糖及其抗氧化活性的影响[J].生物化工,2017,3(6):38-41.
DENG C Y,ZHANG S W,WANG H B,et al.Extraction and isolation of polysaccharide from Lonicera japonica by membrane separation technology and evaluation of its antioxidant activity[J].Shengwu Huagong,2017,3(6):38-41.
[3] 刘军海. 超滤法提取茶多糖研究[J].食品工业科技,2007,28(9):124-126;129.
LIU J H.Research on extraction of tea polysaccharide by ultrafiltration[J].Science and Technology of Food Industry,2007,28(9):124-126;129.
[4] 潘晓鸥, 李健,宋毅,等.超滤法在中药分离、纯化工艺中的应用进展[J].华西医学,2004,19(2):351-352.
PAN X O,LI J,SONG Y,et al.Application progress of ultrafiltration in separation and purification of traditional Chinese Medicine[J].West China Medical Journal,2004,19(2):351-352.
[5] 宫春宇,邢悦,单佳明,等.玉米须多糖超滤制备工艺及成分分析[J].食品科技,2020,45(6):249-253.
GONG C Y,XING Y,SHAN J M,et al.Ultrafiltration technology and composition analysis of corn silk polysaccharide[J].Food Science and Technology,2020,45(6):249-253.
[6] 宫春宇,单佳明,邢悦,等.玉米须多糖体内免疫调节作用研究[J].食品科技,2020,45 (5):191-195.
GONG C Y,SHAN J M,XING Y,et al.Enhanced efficacy of immunization in vivo with polysaccharide from Stigma maydis[J].Science and Technology,2020,45 (5):191-195.
[7] 张惟杰. 糖复合物生化研究技术[M].2版.杭州:浙江大学出版社,1994.
[8] 国家卫生和计划生育委员会, 国家食品药品监督管理总局.食品安全国家标准 食品中蛋白质的测定:GB 5009.5—2016[S].北京:中国标准出版社,2017.
National Health and Family Planning Commission of PRC,National Medical Products Administration.GB 5009.5—2016 National food safety standard,Determination of protein in food[S]. Beijing:China Standard Press,2017.
[9] 中华人民共和国农业部.荞麦及其制品中总黄酮含量的测定:NY/T 1295—2007[S].北京:中国农业出版社,2007.
Ministry of Agriculture of the PRC.NY/T 1295—2007 Determination of flavones in buckwheat and its products[S].Beijing:China Agriculture Press,2007.
[10] 安徽省食品行业协会. T/AHFIA 005—018植物提取物及其制品中总多酚含量的测定-分光光度法[S].2018.
Anhui Food Industry Association.T/AHFIA 005—018 Determination of total polyphenol in plant extracts and its products Spectrophotometric method[S].2018.
[11] 中华人民共和国国家卫生和计划生育委员会,国家食品药品监督管理总局.GB 5009.6—2016食品安全国家标准-食品中脂肪的测定[S].北京:中国标准出版社,2016.
National Health and Family Planning Commission of PRC,National Medical Products Administration.GB 5009.6—2016 National food safety standard Determination of fat in food[S].Beijing:China Standard Press,2016.
[12] 中华人民共和国国家卫生和计划生育委员会,国家食品药品监督管理总局.GB 5009.4—2016食品安全国家标准-食品中灰分的测定[S].北京:中国标准出版社,2016.
National Health and Family Planning Commission of PRC,National Medical Products Administration.GB 5009.4—2016 National food safety standard Determination of ash in food[S].Beijing:China Standard Press,2016.
[13] 宫春宇,单佳明,余世锋,等.超声波提取玉米须多糖工艺及活性研究[J].粮食与油脂,2020,33(5):85-89.
GONG C Y,SHAN J M,YU S F,et al.Study on ultrasonic extracting process and bioactivity of ploysaccharides from Stigma maydis[J].Cereals & Oils,2020,33(5):85-89.
[14] 孙汉文, 刘占锋.枸杞多糖的超声波辅助水提取与分级纯化[J].食品工业科技,2009,30(3):230-233.
SUN H W,LIU Z F.Ultrasonic-assisted water-extraction technology and fractionation-purification of Lycium barbarum polysaccharides[J].Science and Technology of Food Industry,2009,30(3):230-233.
[15] 赵文竹,于志鹏,于一丁,等.玉米须多糖纯化工艺的研究[J].食品工业科技,2009,30(12):292-296.
ZHAO W Z,YU Z P,YU Y D,et al.Study on purification technology of polysaccharides from Stigma maydis[J].Science and Technology of Food Industry,2009,30(12):292-296.
[16] 王磊,刘秀凤,邱芳萍,等.微波辅助提取玉米须多糖及其组成的研究[J].食品与生物技术学报,2009,28 (1):72-75.
WANG L,LIU X F,QIU F P,et al.Extraction of corn-silk polysaccharides by microwave-assisted technology[J].Journal of Food Science and Biotechnology,2009,28 (1):72-75.
[17] 贾亚敏, 朱艳霞,郭玉海.玉米须多糖理化特性及免疫调节活性研究[J].中国农业大学学报,2010,15(4):20-24.
JIA Y M,ZHU Y X,GUO Y H.Physical and chemical properties of corn silk polysaccharide and its immunity activity[J].Journal of China Agricultural University,2010,15(4):20-24.
[18] 刘晓飞,刘宁,张娜,等.气相色谱-质谱联用法测定玉米须多糖的单糖组成[J].食品科学,2012,33(20):249-251.
LIU X F,LIU N,ZHANG N,et al.Determination of monosaccharides hydrolyzed from corn silk polysaccharide by GC-MS[J].Food Science,2012,33(20):249-251.
[19] 郭琦. 枸杞多糖的提取、分离纯化_溶液性质及其结构的初步研究[D].西安:陕西师范大学,2012.
GUO Q.The extraction,isolation and purification,solution properties and structural analysis of Lycium barbarum polysaccharide[D].Xi’an:Shaanxi Normal University,2012.
[20] 杨永利,郭守军,叶文斌,等.银合欢种子多糖微结构的原子力显微镜观察[J].食品科学,2012,33(15):99-102.
YANG Y L,GUO S J,YE W B,et al.Microstructural observation of Leucaena glaucal seed polysaccharides under atomic force microscope[J].Food Science,2012,33(15):99-102.
[21] 刘阿娟,张静,张化朋,等.虎奶菇菌核多糖SHNP 的分离纯化及形貌观测[J].农产品加工,2013(9):66-69.
LIU A J,ZHANG J,ZHANG H P,et al.Purification and atomic force microscope observation of SHNP from the mushroom sclerotia of Pleurotus tuber-regium[J].Academic Periodical of Farm Products Processing,2013(9):66-69.
[22] 张淑杰,权威,姜宏伟,等.不同纯化程度豌豆水溶性多糖的电镜扫描分析[J].农业生物技术学报,2019,27(10):1 822-1 830.
ZHANG S J,QUAN W,JIANG H W,et al.Analysis of the polysaccharides with different purification levels in pea (Pisum sativum) by scanning electron microscope[J].Journal of Agricultural Biotechnology,2019,27(10):1 822-1 830.
[23] 张亚男,王昌禄,李贞景,等.金针菇根部多糖的结构特征[J].食品科技,2015,40(3):283-286.
ZHANG Y N,WANG C L,LI Z J,et al.Structural characterization of polysaccharides from root of Flammulina velutipes[J].Food Science and Technology,2015,40(3):283-286.
[24] 戴晶晶,张静,孙润广,等.防风多糖的理化特性、形貌特征及结构分析[J].中草药,2013,44(4):391-396.
DAI J J,ZHANG J,SUN R G,et al.Analyses on properties for physicochemistry,morphology,and structure of Saposhnikovia divaricata polysaccharides[J].Chinese Traditional and Herbal Drugs,2013,44(4):391-396.