高血压是冠心病、动脉硬化、脑卒中、心力衰竭的主要发病因素。根据流行疾病学研究,现在有超过10亿人患有高血压,因此高血压的预防和治疗已成为全球亟待解决的公共问题[1]。血管紧张素Ⅰ转换酶(angiotensin I-converting enzyme,ACE)是一种二肽羧肽酶,对血压调节起重要作用。目前治疗高血压的药物以血管紧张素受体拮抗剂(沙坦类)与钙通道阻滞剂(地平类)为主,但这些化学合成药物常会引发咳嗽、皮疹、头疼等副作用[2]。食源性ACE抑制肽具有毒副作用小、作用平缓兼具有其他有益的生理作用功能[3]。因此利用天然、安全食源性蛋白制备的ACE抑制肽作为化学药物替代品成为研究热点[4]。
芝麻是我国重要的油料作物,制油后的副产物—芝麻饼粕主要成分为蛋白质(含量约50%),可以作为活性肽的重要来源[5]。研究证实芝麻蛋白通过酶解可以产生ACE抑制肽[6-8]。有学者通过对蛋白酶筛选发现,利用碱性蛋白酶(alcalase)酶解蛋白制备的ACE抑制肽活性较高[6,9]。alcalase由多种蛋白酶复合而成,水解能力强,水解产物以短肽为主,其他蛋白酶如胰蛋白酶、木瓜蛋白酶、中性蛋白酶、菠萝蛋白酶等的酶解专一性较强,只能酶解蛋白质上的特定肽键,如胰蛋白酶酶切位点主要是C端的Arg和Lys,水解效果较弱。受限于靶标分子(ACE)活性位点的空阻影响,短肽较长肽更容易进入ACE的活性口袋,从而显示出较高的ACE抑制活性[10]。但alcalase属于外切蛋白酶,制备的ACE抑制肽由于疏水基团的暴露,往往产生苦味,从而限制了其在食品领域的应用[11]。风味蛋白酶(flavourzyme)是一种风味修饰酶,以疏水性专一的外切蛋白酶为主[12],可有效降低大豆[13]、玉米[14]、鲑鱼蛋白酶解液[15]的苦味。然而,目前采用flavourzyme修饰活性肽风味的报道较少,且较少讨论风味修饰后对活性及结构特性影响的研究。
因此,本研究利用alcalase和flavourzyme两步水解芝麻粕蛋白,对产生的 ACE抑制肽进行活性、苦味评价及氨基酸分析,最后采用液相-二级质谱联用(liquid chromatography-mass spectrometry/mass spectrometry,LC-MS/MS)技术解析芝麻ACE抑制肽的结构特性,以期为以后芝麻来源的高活性、低苦味降压肽的开发提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 原料与试剂
芝麻粕:实验室自制,芝麻经亚临界脱油后获得,其基本组成见表1。Alcalase(235 000 U/mL)、flavourzyme(19 000 U/mL),诺维信(中国)投资有限公司;Na2HPO4、NaH2PO4、三氯乙酸,均为分析纯,天津市科密欧化学试剂有限公司;马尿酰组氨酰亮氨酸(hippuryl-His-Leu,HHL)、ACE、邻苯二甲醛(o-phthaldialdehyde,OPA)、二硫苏糖醇(dithiothreitol,DTT),Sigma公司。
表1 芝麻粕基本成分组成 单位:%
Table 1 Basic composition of sesame meal
蛋白脂肪水分灰分碳水化合物48.34±0.350.62±0.054.80±0.188.86±0.4637.38±0.23
1.1.2 仪器与设备
RRHP-350型粉碎机,上海顶帅电器有限公司;Cary Eclipse型荧光光度计,安捷伦科技(中国)有限公司;DF-101S型集热式恒温加热磁力搅拌器,巩义市予华仪器有限责任公司;DL-5-B型离心机,上海安亭科学仪器厂;DELTA 320型pH计,上海梅特勒-托利多仪器有限公司;TestcellC-70型平膜装置,美国Millipore公司;电喷雾组合型离子阱Orbitrap质谱仪,美国Thermo Fisher Scientific公司;K-05型自动定氮仪,上海晟声自动化分析仪器有限公司。
1.2 试验方法
1.2.1 芝麻粕的酶解反应
参考袁东振等[6]的方法,对芝麻粕进行酶解反应。将芝麻粕粉碎并过100目筛,收集筛下物并均匀分散在0.05 mol/L NaH2PO4-Na2HPO4缓冲溶液(pH 8.2)中,料液比为1∶10(g∶mL),将分散液在沸水浴中加热10 min后进行酶解反应。
(1)研究alcalase加入量(3 000、4 000、5 000、6 000、7 000、8 000、9 000、10 000 U/g 蛋白)对多肽得率以及ACE抑制活性的影响,反应温度55 ℃,反应时间180 min。
(2)固定alcalase添加量,研究flavourzyme加入量(1 000、2 000、3 000、4 000、5 000、6 000 U/g蛋白)对多肽得率以及ACE抑制活性的影响,反应温度55 ℃,反应时间180 min。
(3)固定alcalase和flavourzyme添加量,研究flavourzyme加入时间(alcalase反应0、30、60、90、120、150 min)对多肽得率以及ACE抑制活性的影响,反应温度55 ℃,反应时间180 min。
酶解反应结束后迅速放入沸水浴中灭酶10 min,然后在5 000 r/min下离心20 min,取上清液备用。
1.2.2 多肽得率测定
将1 mL酶解液和2 mL 100 g/L的三氯乙酸在漩涡混合仪上混合均匀,然后在8 000 r/min下离心20 min,取上清液并用凯式定氮法测定其中的多肽含量。多肽得率的计算如公式(1)所示:
多肽得率![]()
(1)
式中:m1,酶解液中的多肽质量,g;m0,未酶解原液中的蛋白质量,g。
1.2.3 ACE活性抑制率的测定
参照LI等[16]的方法并略有改动。将酶解液进行适当稀释(肽质量浓度为0.8 mg/mL),并使用96孔酶标板作为反应容器。取15 μL稀释液(对照液以蒸馏水代替)和30 μL 4.66 mmol/L HHL[0.05 mol/L pH 8.3的硼酸盐缓冲液(含0.3 mol/L NaCl)配制]混合,随后加入30 μL ACE(12.5 mU/mL),置于37 ℃恒温箱中1 h,反应结束后加入125 μL 1.2 mol/L NaOH溶液终止酶反应。接着加入20 μL 20 g/L的OPA,混合均匀并在室温下放置20 min,用6 mol/L的HCl溶液(30 μL)终止衍生反应。反应液稀释10倍后测定荧光吸收强度,激发波长340 nm,发射波长455 nm,狭缝宽度5 nm。ACE活性抑制率的计算见公式(2)。将酶解液稀释不同倍数,以多肽浓度的对数值为横坐标,ACE活性抑制率为纵坐标,绘制回归直线,计算抑制率达到50%时抑制肽的浓度(即半抑制浓度),记为IC50值。
ACE活性抑制率![]()
(2)
式中:a,抑制剂与ACE都存在时的荧光吸收强度;b,抑制剂不存在而ACE存在时的荧光吸收强度;c,抑制剂存在而ACE不存在时的荧光吸收强度;d,抑制剂与ACE都不存在时的荧光吸收强度。
1.2.4 氨基酸组成分析
氨基酸测定方法参照GB/T 18246—2000。游离氨基酸测定采用HPLC法,样品酸水解后加入氟苯进行衍生反应,然后色谱分析游离氨基酸组成。色谱检测条件:C18色谱柱(250 mm×4.6 mm,5 μm),流动相A为0.05 mol/L乙酸钠,流动相B为体积分数50%乙腈水溶液,流速为1.2 mL/min,温度25 ℃,检测波长为360 nm。
1.2.5 苦味评价
参照HOMFMANN[17]的方法略有修改,取1 mL样品(肽质量浓度为5 mg/mL)至烧杯中,添加蒸馏水逐步稀释,直至尝不出苦味为止,记录加水量即为稀释倍数。稀释倍数越大,说明样品液苦味越显著。
1.2.6 ACE肽序列鉴定和合成
样品经自填脱盐柱脱盐后,采用反相高效液相色谱(reversed-phase high performance liquid chromatography,RP-HPLC)进行分离纯化。色谱条件:C18色谱柱(150 μm×150 mm,1.9 μm);流动相A为体积分数0.1%甲酸和2%乙腈水溶液,流动相B为体积分数0.1%甲酸和80%乙腈水溶液;流速600 nL/min。梯度洗脱条件为0~20 min,6%~14% B;20~50 min,14%~30% B;50~60 min,30%~95% B。
利用电喷雾组合型离子阱Orbitrap质谱仪进行质谱分析。一级质谱参数:分辨率70 000,AGC目标为3×106,最大IT为40 ms,扫描范围300~1 400 m/z;二级质谱参数:分辨率17 500,AGC目标为1×105,最大IT为60 ms,TopN为20,NCE/steppedNCE为27。
为验证质谱鉴定的多肽活性,将选择的多肽进行固态化学合成(无锡亚肽公司),纯度>95%,然后溶于去离子水中,稀释不同浓度梯度,测定其IC50值。
1.2.7 数据分析
所有实验均重复3次,数据结果以平均值±标准方差表示。质谱解析多肽序列采用Denovo的方法。数据显著性分析采用SPSS Statistics20软件处理。
2 结果与分析
2.1 alcalase/flavourzyme两步水解芝麻粕制备ACE抑制肽
2.1.1 alcalase添加量对多肽得率和ACE活性抑制率的影响
从图1可以看出,随着alcalase添加量的增加,多肽得率不断增加,当添加量高于9 000 U/g 蛋白时,多肽得率略有下降,这可能是因为当alcalase添加量较高时,水解程度加深造成多肽发生部分水解,生成游离氨基酸,导致多肽得率降低[18]。Alcalase单独酶解后多肽得率最高为63.43%。由图1可知,alcalase水解后的ACE抑制活性与多肽得率的变化趋势较类似,即随着alcalase添加量的增加,ACE抑制活性逐渐增强,在alcalase添加量为9 000 U/g 蛋白时,ACE抑制活性最高(78.92%),继续增加酶量会使具有ACE抑制活性多肽发生降解,ACE活性抑制率减小。
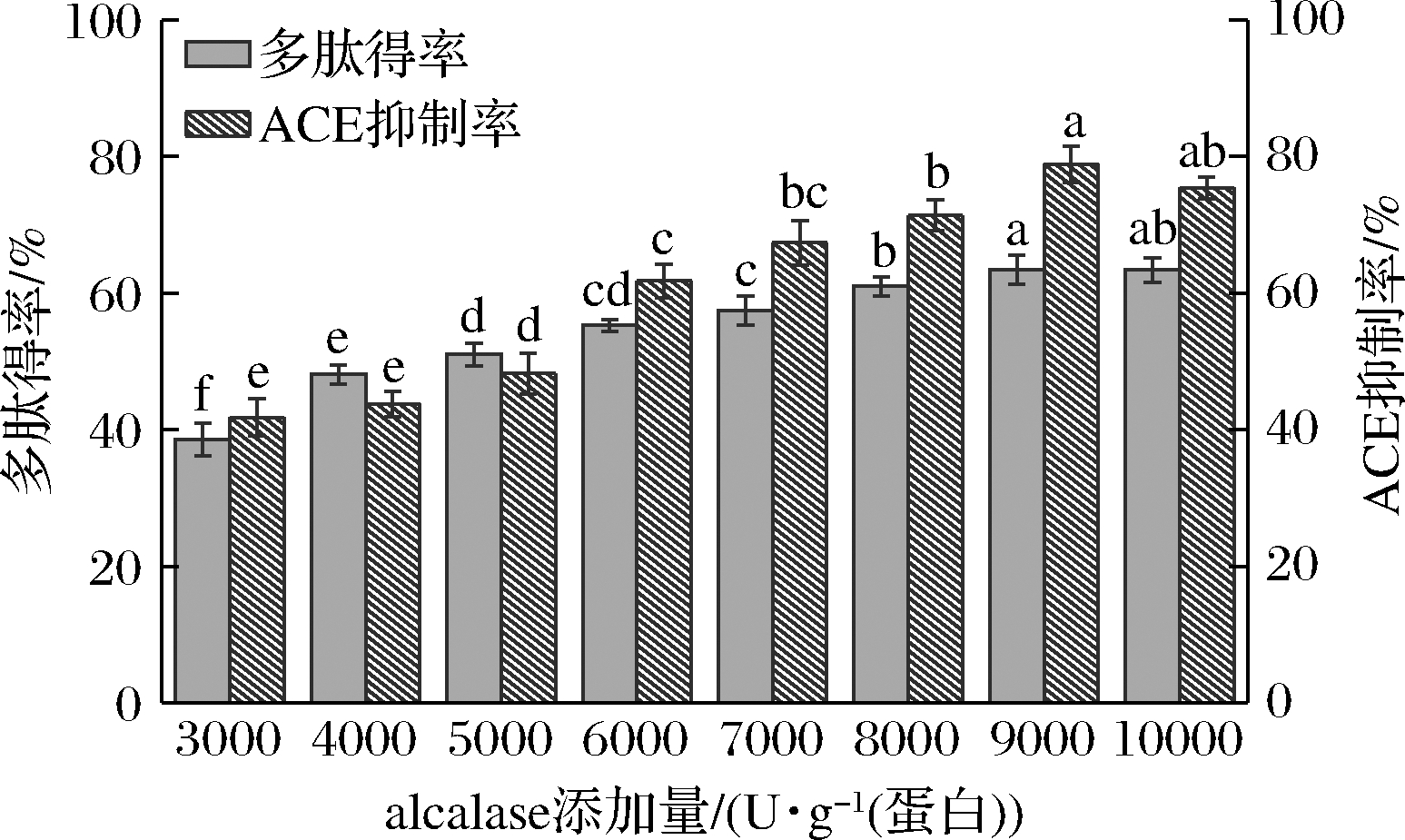
图1 Alcalase添加量对多肽得率和ACE活性抑制率的影响
Fig.1 Effect of alcalase addition on peptide yield and ACE activity inhibition rate
2.1.2 flavourzyme添加量对多肽得率和ACE活性抑制率的影响
固定alcalase添加量为9 000 U/g 蛋白,在alcalase水解芝麻粕的基础上,研究flavourzyme添加量对多肽得率和ACE活性抑制率的影响规律。当flavourzyme添加量<4 000 U/g 蛋白时,多肽得率和ACE抑制率(图2)随着flavourzyme添加量的增加而略有增加。Alcalase属于内切蛋白酶,flavourzyme则以外切蛋白酶为主,双酶水解增加了蛋白的酶切位点,得到更多的活性肽,因此表现更高的ACE抑制活性;当flavourzyme添加量>4 000 U/g 蛋白,多肽得率和ACE抑制活性明显降低,说明较多的氨基酸残基被解离出来,多肽的ACE抑制活性可能被破坏。
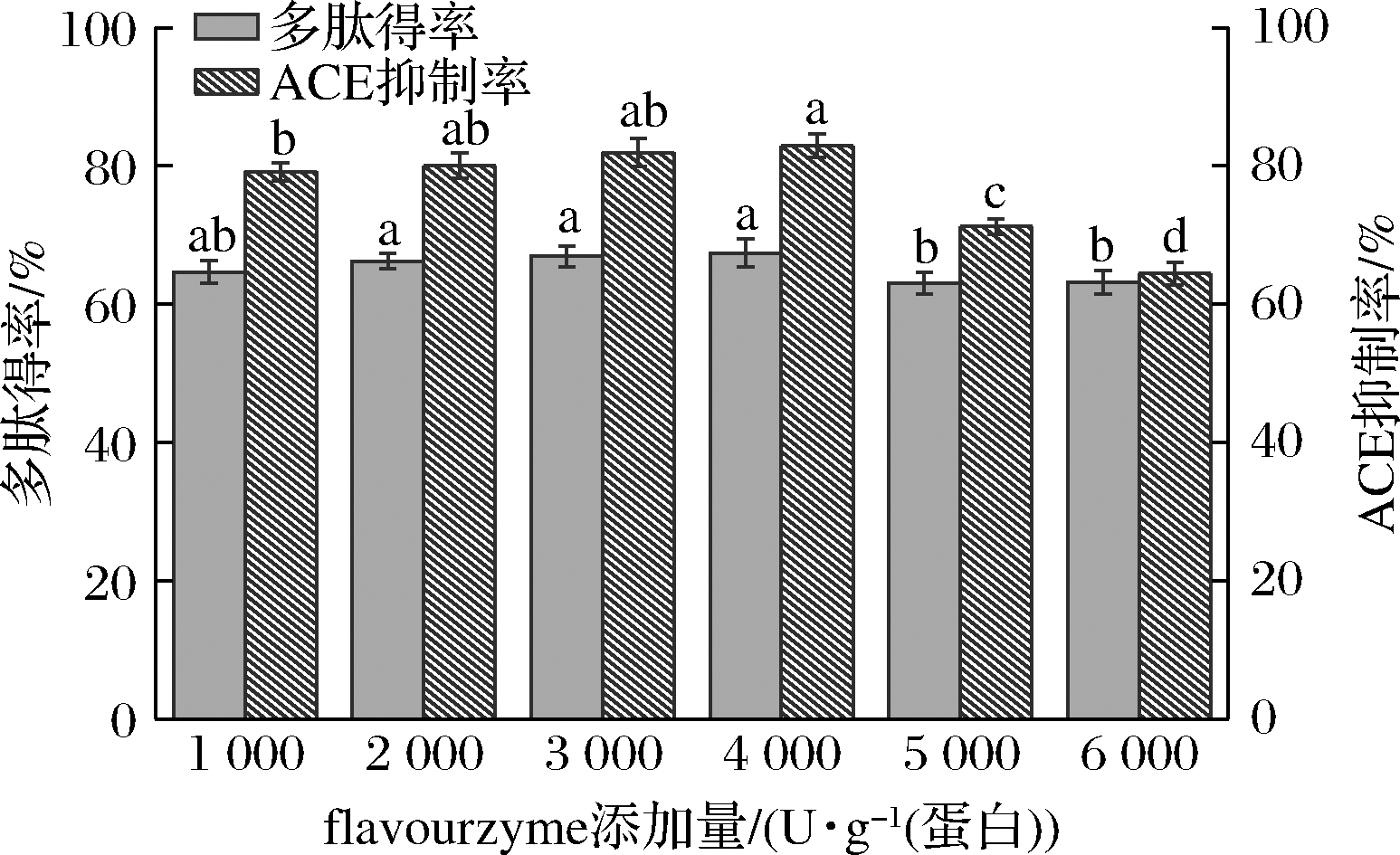
图2 flavourzyme添加量对多肽得率和ACE抑制率的影响
Fig.2 Effect of flavourzyme addition on peptide yield and ACE activity inhibition rate
2.1.3 flavourzyme添加时间对多肽得率和ACE活性抑制率的影响
固定alcalase添加量为9 000 U/g 蛋白,flavourzyme添加量为4 000 U/g 蛋白,考察flavourzyme添加时间对多肽得率和ACE活性抑制率的影响规律。从图3可知,随着flavourzyme添加时间的推迟,多肽得率和ACE抑制率呈现先升后降的变化趋势,在alcalase酶解60 min后加入flavourzyme,反应结束后的多肽得率及ACE抑制率较高。这可能是由于alcalase酶解一定时间后蛋白分子结构舒展,暴露更多的肽键,有利于flavourzyme充分水解,而超过60 min后加入flavourzyme,由于flavourzyme酶解时间的缩短从而造成多肽得率及ACE抑制率降低。由以上研究可知,在最佳酶解条件下,与单独的alcalase酶解相比,alcalase/flavourzyme两步水解后的多肽得率(77.88%)和ACE抑制率(88.10%)明显提高。
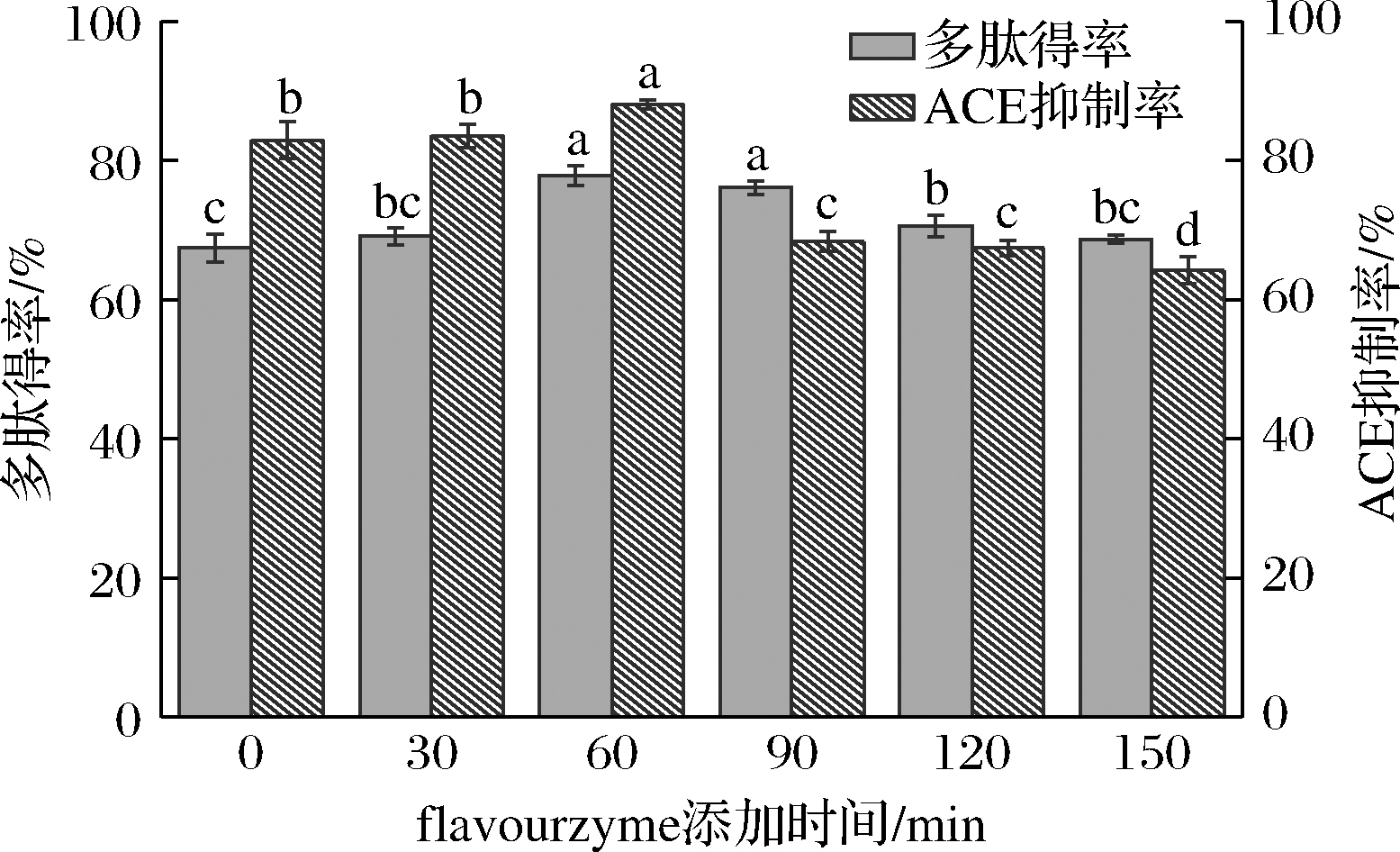
图3 Flavourzyme添加时间对多肽得率和ACE抑制率的影响
Fig.3 Effect of flavourzyme addition time on peptide yield and ACE activity inhibition rate
2.2 ACE抑制肽的活性分析及苦味评价
活性肽是一类相对分子质量<10 kDa的多肽[19],将芝麻粕酶解液依次通过截留分子质量不同的超滤膜,分别收集3 k~10 kDa和<3 kDa组分,测定各组分中的多肽量,计算相对百分含量和IC50值,如表2所示。与单独alcalase水解相比,alcalase/flavourzyme两步水解后生成的3 k~10 kDa多肽减少,而<3 kDa的小分子肽比例由66.96%增加至82.70%,且3 k~10 kDa和<3 kDa 2个组分均表现出较高的ACE抑制活性(3 k~10 kDa组分:IC50值由1.305 mg/mL降低为0.723 mg/mL;<3 kDa组分:IC50值由0.254 mg/mL降低为0.181 mg/mL)。从表2也可以看出,<3 kDa组分的IC50值低于3 k~10 kDa组分的IC50值,且alcalase/flavourzyme两步水解后<3 kDa组分表现出最低的IC50值,说明高活性ACE抑制肽的分子质量主要集中于3 kDa以下,与WANG等[5]的研究结果一致。
表2 不同相对分子质量ACE抑制肽的相对含量、 IC50值及苦味评价
Table 2 Relative content,IC50 values and bitterness evaluation of ACE inhibitory peptides with different molecular weights
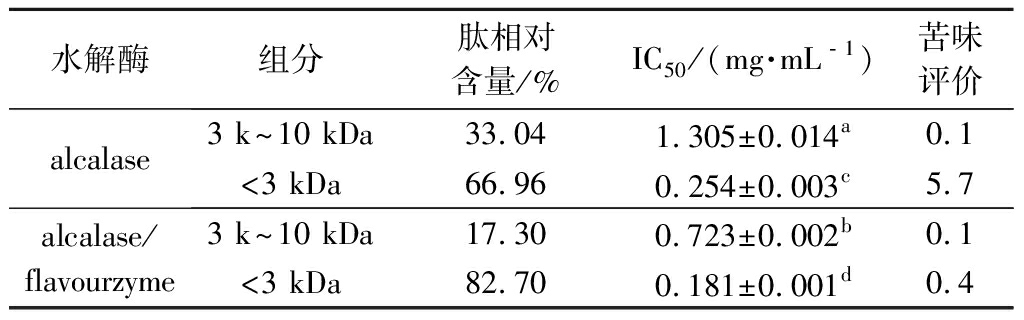
水解酶组分肽相对含量/%IC50/(mg·mL﹣1)苦味评价alcalase3 k~10 kDa33.041.305±0.014a0.1<3 kDa66.960.254±0.003c5.7alcalase/flavourzyme3 k~10 kDa17.300.723±0.002b0.1<3 kDa82.700.181±0.001d0.4
注:同列不同上标字母代表差异显著(P<0.05)
另外,结合苦味评价结果可知,添加flavourzyme前后,3 k~10 kDa ACE抑制肽基本无苦味(稀释倍数均为0.1),但<3 kDa组分的稀释倍数由5.4减少为0.4,说明flavourzyme的添加有效降低了高活性ACE抑制肽的苦味强度。
2.3 ACE抑制肽的氨基酸组成
由表3可知,alcalase和alcalase/flavourzyme水解后收集的3 k~10 kDa和<3 kDa组分,氨基酸组成均较全面(除未检测的色氨酸),含量较高的氨基酸为Glu,是重要的健脑物质,具有较高的营养价值。与alcalase单独水解相比,alcalase/flavourzyme两步水解后3 k~10 kDa组分的必需氨基酸含量略有下降,而<3 kDa组分的必需氨基酸含量明显增加。依据FAO/WHO提出的理想模式,必需氨基酸含量为40%左右且必需/非必需氨基酸的比值大于60%,蛋白质的质量较好[20],由此可见,alcalase/flavourzyme水解后的高活性ACE抑制肽接近理想模式(必需氨基酸含量为42.89%,必需/非必需氨基酸比值为75.10%)。alcalalse水解后游离氨基酸含量较高的为Glu和Cys,而alcalase/flavourzyme水解后这2种氨基酸比例明显下降,表明flavourzyme添加后游离氨基酸总量增加。与alcalalse水解相比,alcalase/flavourzyme水解后苦味游离氨基酸增加(由28.00%增加至57.24%),但结合表2的苦味评价,alcalase/flavourzyme水解后的苦味强度低于单独alcalalse酶解,进一步证实了在alcalalse基础上添加flavourzyme水解后产生的肽段苦味较低。
表3 不同相对分子质量ACE抑制肽的氨基酸组成 单位:%
Table 3 Amino acid composition of ACE inhibitory peptides with different molecular weights
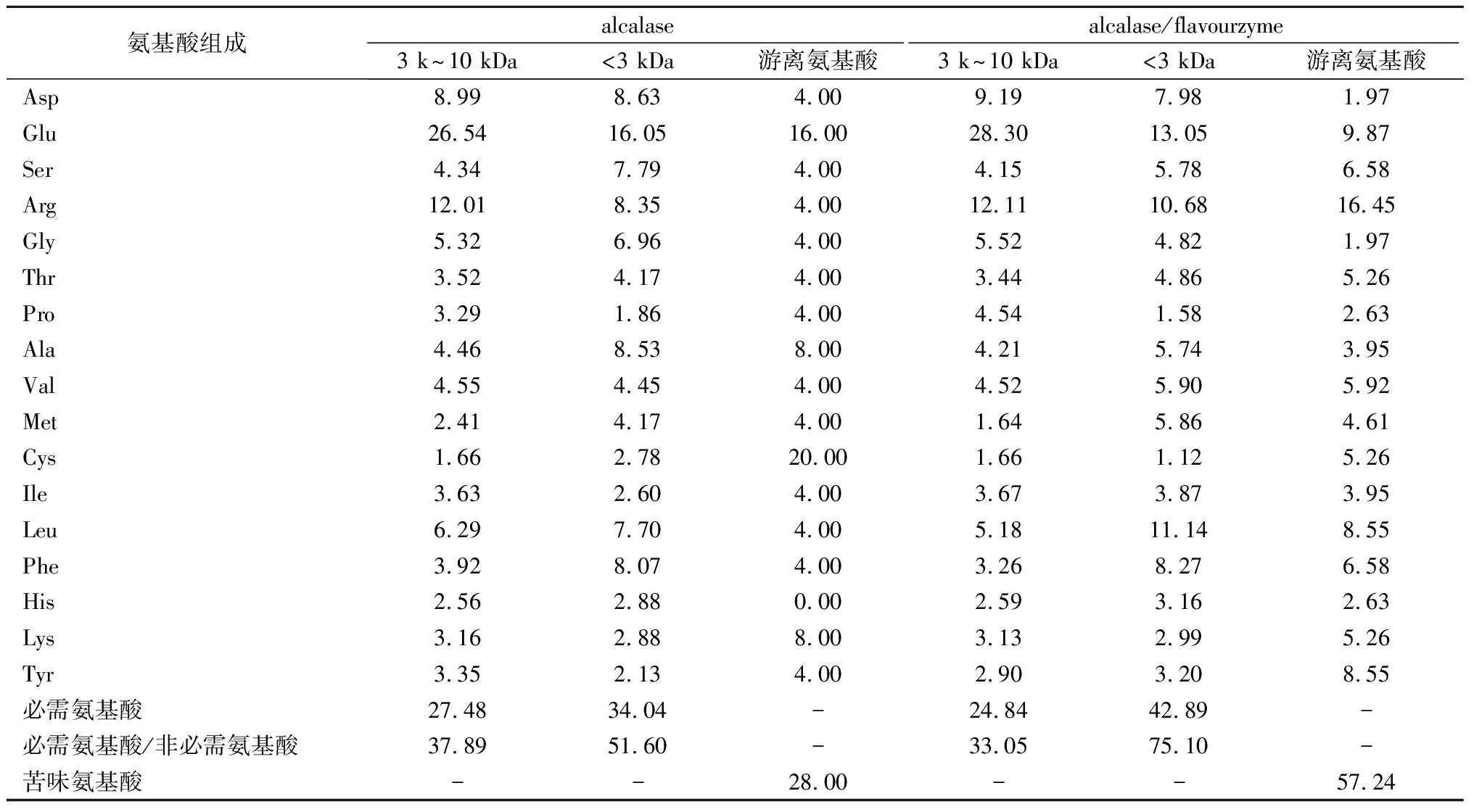
氨基酸组成alcalasealcalase/flavourzyme3 k~10 kDa<3 kDa游离氨基酸3 k~10 kDa<3 kDa游离氨基酸Asp8.998.634.009.197.981.97Glu26.5416.0516.0028.3013.059.87Ser4.347.794.004.155.786.58Arg12.018.354.0012.1110.6816.45Gly5.326.964.005.524.821.97Thr3.524.174.003.444.865.26Pro3.291.864.004.541.582.63Ala4.468.538.004.215.743.95Val4.554.454.004.525.905.92Met2.414.174.001.645.864.61Cys1.662.7820.001.661.125.26Ile3.632.604.003.673.873.95Leu6.297.704.005.1811.148.55Phe3.928.074.003.268.276.58His2.562.880.002.593.162.63Lys3.162.888.003.132.995.26Tyr3.352.134.002.903.208.55必需氨基酸27.4834.04-24.8442.89-必需氨基酸/非必需氨基酸37.8951.60-33.0575.10-苦味氨基酸--28.00--57.24
注:必需氨基酸:Val、Met、Leu、Phe、Ile、Thr、Lys;苦味氨基酸:His、Arg、Val、Met、Ile、Leu、Phe、Try;-表示未测
2.4 ACE抑制肽(<3 kDa)的结构鉴定
单独alcalase酶解和alcalase/flavourzyme两步水解后分子质量<3 kDa的组分,通过LC-MS/MS分析鉴定的多肽分别有246和223个,其组成如图4所示,alcalase和alcalase/flavourzyme水解后产生多肽(<3 kDa)的氨基酸数量为4~11个,其中四肽和五肽的含量较高。与alcalase水解相比,alcalase/flavourzyme两步水解后的四肽含量由54.88%增加至75.34%,五肽含量由30.89%下降至11.66%,说明flavourzyme能将较多的五肽进一步水解生成四肽。
将以上2种方式水解后鉴定的肽,按可信度评分高低进行排序,并依次与BIOPEP数据库(http://www.uwm.edu.pl/bioche mia/index.php/en/biopep)中已知的ACE肽结构序列进行比对[21],分别筛选出前10条潜在ACE抑制肽进行分析。从表4可知,与alcalase单独酶解后的肽段分子质量(468~776 Da)相比,alcalase/flavourzyme两步水解的肽段分子质量(398~529 Da)较小。ONDETTI等[22]研究发现活性肽C端的3个氨基酸序列对ACE抑制能力影响较大,综合比较alcalase和alcalase/flavourzyme水解后肽段序列(表4),发现有5对短肽结构较类似,分别是KLPLL和APLL、TLPVL和LPVL、HWAY和LPAY、LLPY和LGPY、KFPL和LGPL。而对于结构差异较大的其余短肽,alcalase/flavourzyme两步酶解后的肽段有2条C端氨基酸残基为Leu、1条C端氨基酸残基为Tyr、1条C端氨基酸残基为Ala和1条C端氨基酸残基为Ser。活性肽C末端氨基酸残基为Leu、Tyr、Pro、Trp和Phe时常具有较强的ACE抑制活性[23-24],因此可推测经alcalase/flavourzyme两步水解制备的ACE抑制肽活性较高,与测定的分子质量<3 kDa肽段的IC50值(alcalase:0.254 mg/mL;alcalase/flavourzyme:0.181 mg/mL)结果一致。对结构差异较大的10条多肽进行固态化学合成,并测定其IC50值,如表4所示,alcalase/flavourzyme两步酶解后产生的WGGL、LPSL和LPGGY的IC50值较低,分别为 0.004、0.001和0.006 mg/mL,表明这3种氨基酸序列对ACE抑制活性的提高有重要作用。
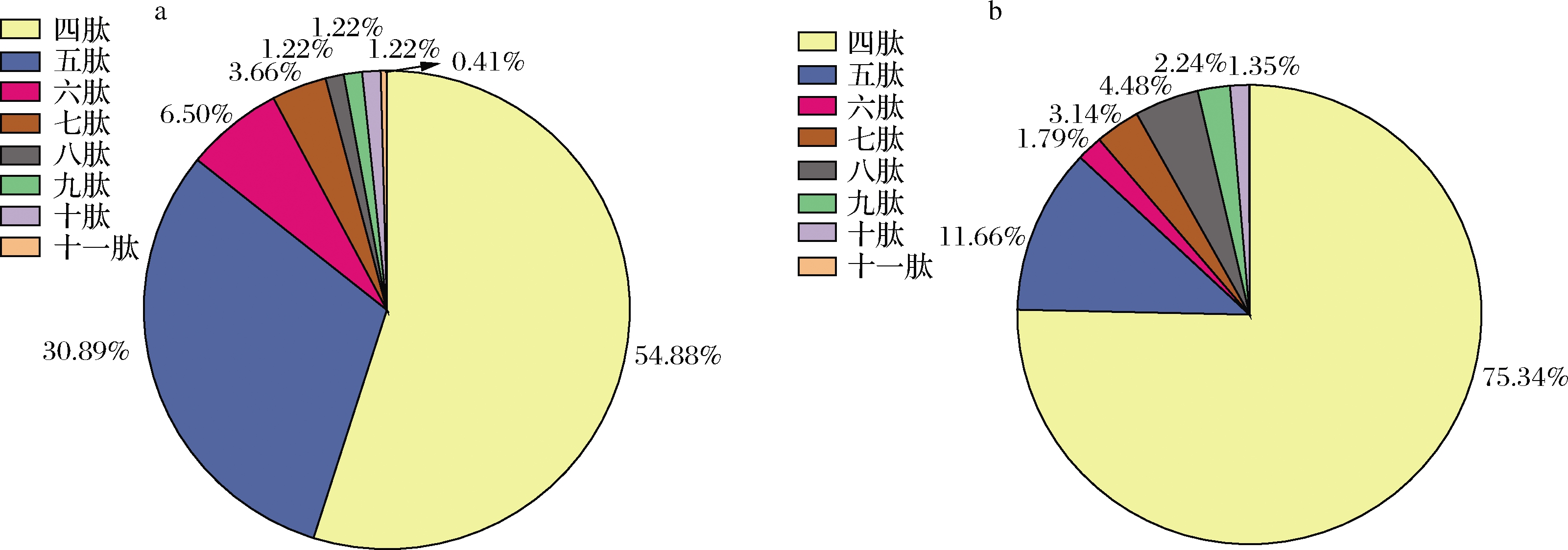
a-alcalase;b-alcalse/flavourzyme
图4 Alcalase和alcalase/flavourzyme水解后的多肽(<3 kDa)组成
Fig.4 Composition of peptides(<3 kDa) prepared by alcalase hydrolysis and alcalase/flavourzyme two-step hydrolysis
表4 Alcalase水解和alcalase/flavourzyme 两步水解制备的ACE抑制肽(<3 kDa)序列分析
Table 4 Sequence analysis of ACE inhibitory peptides(<3 kDa) prepared by alcalase hydrolysis and alcalase/flavourzyme two-step hydrolysis
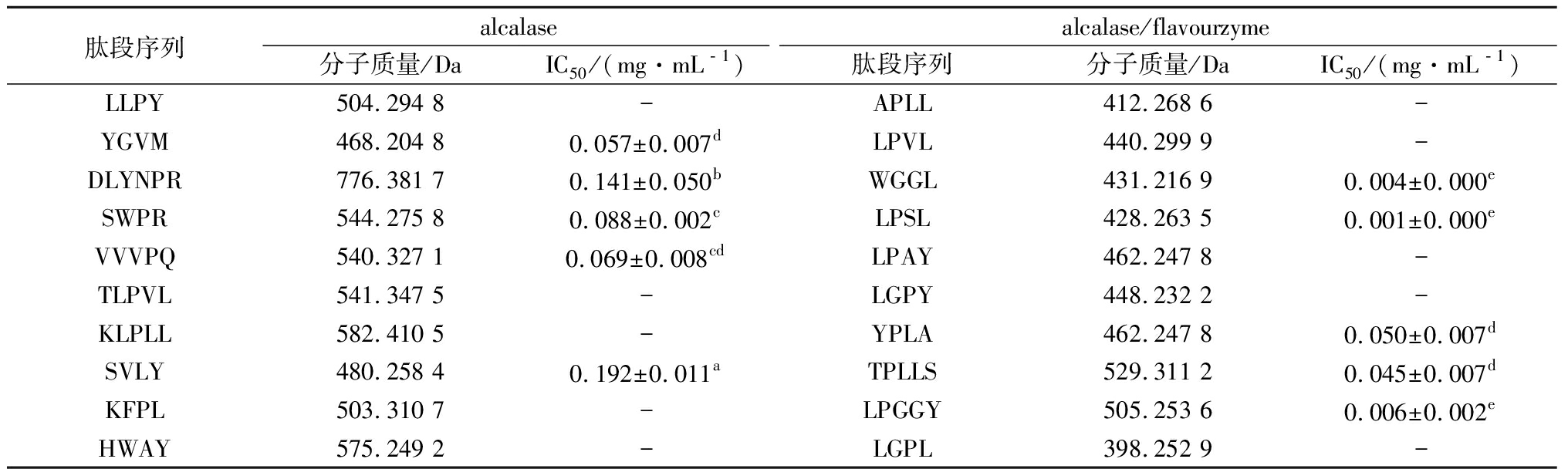
肽段序列alcalasealcalase/flavourzyme分子质量/DaIC50/(mg·mL﹣1)肽段序列分子质量/DaIC50/(mg·mL﹣1)LLPY504.294 8-APLL412.268 6-YGVM468.204 80.057±0.007dLPVL440.299 9-DLYNPR776.381 70.141±0.050bWGGL431.216 90.004±0.000eSWPR544.275 80.088±0.002cLPSL428.263 50.001±0.000eVVVPQ540.327 10.069±0.008cdLPAY462.247 8-TLPVL541.347 5-LGPY448.232 2-KLPLL582.410 5-YPLA462.247 80.050±0.007dSVLY480.258 40.192±0.011aTPLLS529.311 20.045±0.007dKFPL503.310 7-LPGGY505.253 60.006±0.002eHWAY575.249 2-LGPL398.252 9-
注:-表示未测;肩标不同字母表示不同样品具有显著性差异(P<0.05)
3 结论
利用alcalase/flavourzyme两步水解相比alcalalse单独酶解芝麻饼粕蛋白后的多肽得率及ACE活性明显提高。高活性芝麻ACE抑制肽的分子质量<3 kDa,营养价值较高且苦味较低。鉴定的10条ACE抑制肽的分子质量范围为398~529 Da,其中氨基酸序列为WGGL、LPSL和LPGGY对ACE抑制活性提高有主要贡献作用,可用于功能性食品的开发。然而由于实验的局限性,后续研究有待深入分析高活性、低苦味芝麻ACE抑制肽的构效关系,为芝麻降压肽的应用推广提供理论指导。
[1] ASOODEH A,HAGHIGHI L,CHAMANI J,et al.Potential angiotensin I converting enzyme inhibitory peptides from gluten hydrolysate:Biochemical characterization and molecular docking study[J].Journal of Cereal Science,2014,60(1):92-98.
[2] DASKAYA-DIKMEN C,YUCETEPE A,KARBANCIOGLU-GULER F,et al.Angiotensin-I-converting enzyme (ACE) inhibitory peptides from plants[J].Nutrients,2017,9(4):316.
[3] 苗欣宇,王祖浩,王鹏,等.红松仁清蛋白ACE抑制肽的分离纯化与结构鉴定[J].食品科学,2017,38(5):129-133.
MIAO X Y,WANG Z H,WANG P,et al.Isolation,purification and structural analysis of ACE inhibitory peptides derived from red pine (Pinus koraiensis Sieb.et Zucc.) nuts albumin[J].Food Science,2017,38(5):129-133.
[4] BHASKAR B,ANANTHANARAYAN L,JAMDAR S.Purification,identification,and characterization of novel angiotensin I converting enzyme (ACE) inhibitory peptides from alcalase digested horse ram flour[J].LWT-Food Science and Technology,2019,103:155-161.
[5] WANG R D,LU X,SUN Q,et al.Novel ACE inhibitory peptides derived from simulated gastrointestinal digestion in vitro of sesame (Sesamum indicum L.) protein and molecular docking study[J].International Journal of Molecular Sciences,2020,21(3):1 059.
[6] 袁东振,张国治,芦鑫,等.Alcalase酶解芝麻蛋白制备ACE抑制肽的工艺研究[J].河南工业大学学报(自然科学版),2016,37(1):35-42.
YUAN D Z,ZHANG G Z,LU X,et al.Preparation of ACE inhibitory peptides by Alcalase enzymatic hydrolysis of sesame protein[J].Journal of Henan University of Technology(Natural Science Edition),2016,37(1):35-42.
[7] 王振斌,刘加友,陈兵兵,等.响应面优化酶法制备芝麻饼粕ACE抑制肽研究[J].中国粮油学报,2015,30(9):88-93.
WANG Z B,LIU J Y,CHEN B B,et al.The response surface optimizate preparation of sesame dregs’ ACE inhibitory peptides with enzyme[J].Journal of the Chinese Cereals and Oils Association,2015,30(9):88-93.
[8] 梁玉杰.固定化酶酶解芝麻饼粕蛋白制备ACE抑制肽的研究[D].郑州:河南农业大学,2014.
LIANG Y J.Preparation of ACE inhibitory peptides from hydrolysis of sesame meal protein by immobilized enzyme[D].Zhengzhou:Henan Agricultural University,2014.
[9] BHASKAR B,ANANTHANARAYAN L,JAMDAR S N.Effect of enzymatic hydrolysis on the functional,antioxidant,and angiotensin I-converting enzyme (ACE) inhibitory properties of whole horse gram flour[J].Food Science and Biotechnology,2019,28(1):43-52.
[10] 王亚林.食品蛋白质降血压肽(ACEIP)的开发研究[J].粮食与饲料工业,2003,11(1):40-41.
WANG Y L.Research advances in antihypertensive peptides(ACEIP) derived from food proteins[J].Cereal and Feed Industry,2003,11(1):40-41.
[11] 罗贤慧,李理.高温豆粕肽粉的苦味及ACE抑制活性研究[J].中国酿造,2012,31(10):120-123.
LUO X H,LI L.Bitterness and ACE inhibitory activity of the high-temperature soybean meal peptide[J].China Brewing,2012,31(10):120-123.
[12] 唐传核,彭志英.大豆蛋白水解物的苦肽以及脱除方法进展[J].中国油脂,2000,25(6):167-172.
TANG C H,PENG Z Y.Bitter peptides of soybean protein hydrolysate and its eliminating method[J].China Oils and Fats,2000,25(6):167-172.
[13] 李丹丹,江连洲,李杨,等.风味酶和活性炭对大豆分离蛋白水解液脱苦效果比较研究[J].中国油脂,2011,36(8):24-27.
LI D D,JIANG L Z,LI Y,et al.Debittering effect of flavor enzyme and active carbon on the hydrolysate of soy protein isolate[J].China Oils and Fats,2011,36(8):24-27.
[14] 战旭梅,刘萍,祁兴普,等.不同脱苦方法对玉米活性肽苦味脱除效果的研究[J].食品研究与开发,2020,41(13):161-166.
ZHAN X M,LIU P,QI X P,et al.Study on the effect of different debitterness methods on the removal of bitter taste from corn peptides[J].Food Research and Development,2020,41(13):161-166.
[15] SINTHUSAMRAN S,IDOWU A T,BENJAKUL S,et al.Effect of proteases and alcohols used for debittering on characteristics and antioxidative activity of protein hydrolysate from salmon frames[J].Journal of Food Science and Technology,2020,57(2):473-483.
[16] LI F J,YIN L J,LU X,et al.Changes in angiotensin I-converting enzyme inhibitory activities during the ripening of Douchi (a Chinese traditional soybean product) fermented by various starter cultures[J].International Journal of Food Properties,2010,13(3):512-524.
[17] HOFMANN T.Taste-active maillard reaction products:The “tasty” world of nonvolatile maillard reaction products[J].Annals of the New York Academy of Sciences,2005,1 043(1):20-29.
[18] 张宇昊,王强.Alcalase酶水解花生蛋白制备花生短肽的研究[J].农业工程学报,2007,23(4):258-263.
ZHANG Y H,WANG Q.Peanut protein hydrolyzing by Alcalase to prepare peanut oligopeptides[J].Transactions of the Chinese Society of Agricultural Engineering,2007,23(4):258-263.
[19] 李子健,刘秀丽,裴乐,等.生物活性肽的研究进展[J].畜牧与饲料科学,2019,40(12):20-24.
LI Z J,LIU X L,PEI L,et al.Research progress on bioactive peptides[J].Animal Husbandry and Feed Science,2019,40(12):20-24.
[20] 徐世涛,朱秋劲,熊延敏,等.单-双酶法提取的苏麻多肽的呈味及氨基酸分析[J].食品与发酵工业,2020,46(3):235-241.
XU S T,ZHU Q J,XIONG Y M,et al.Analysis of taste components and amino acid of Suma polypeptides extracted by single-dual enzymatic hydrolysis[J].Food and Fermentation Industries,2020,46(3):235-241.
[21] LIANG R,ZHANG M S,LIN S Y.Recombinant expression of bioactive peptides:A review[J].Advanced Materials Research,2014,881:331-334.
[22] ONDETTI M A,RUBIN B,CUSHMAN D W.Design of specific inhibitors of angiotensin converting enzyme.New class of orally active antihypertensive agents[J].Science,1977,196(4 288):441-444.
[23] 贾俊强,马海乐,王振斌,等.降血压肽的构效关系研究[J].中国粮油学报,2009,24 (5):110-114.
JIA J Q,MA H L,WANG Z B,et al.Structure-activity relationship of antihypertensive peptides[J].Journal of the Chinese Cereals and Oils Association,2009,24(5):110-114.
[24] CHEUNG H S,WANG F L,ONDETTI M A,et al.Binding of peptide substrates and inhibitors of angiotensin-converting enzyme.Importance of the COOH-terminal dipeptide sequence[J].The Journal of Biological Chemistry,1980,255:401-407.