黑枸杞(Lycium ruthenicum Murray)为茄科(Solanaceae)枸杞属(Lycium L.)多棘刺灌木[1],主要分布于我国的甘肃、宁夏、新疆、内蒙古、西藏和陕北的黄土高原一带,生长于盐碱、干旱和沙漠地区[2]。在古代,黑枸杞就已被用于治疗心脏病、更年期和月经不调等疾病[3],其果实含有丰富的生物活性物质[4],多糖作为黑枸杞果实最主要的活性成分之一,具有抗氧化[5]、抗辐射[6]、增强机体免疫[7]等能力。
目前国内外学者对黑枸杞多糖的研究主要集中于高效提取、结构特征和生物活性方面,热水浸提是提取黑枸杞多糖最常用且较为简单的方法,但是高温和较长的提取时间会导致多糖降解[8]。超声波能有效破坏细胞壁,增强细胞内容物的传质能力,可以大幅缩短提取时间,提高提取率[9]。
黑枸杞因其多糖、花青素类物质含量较高而作为一种天然抗氧化物被广泛应用于食品保鲜领域[10]。乳酸菌作为传统发酵食品的主要发酵菌株,不仅能够利用碳水化合物生成乳酸,还可以发酵糖类产生丰富的风味物质,在发酵食品中发挥着重要的作用[11]。
活性多糖可以作为促进乳酸菌生长或改善发酵乳抗氧化能力的添加剂[12-15],然而将多糖直接应用于乳酸菌本身以研究多糖对乳酸菌生长特性或抗氧化能力影响等方面却鲜有报道。本文以野生黑枸杞为原料,采用单因素与响应面设计优化超声波提取黑枸杞多糖的工艺条件;研究黑枸杞多糖对嗜热链球菌G2与副干酪乳杆菌L9的生长特性的影响以及多糖对2株乳酸菌抗氧化能力的影响,初步探索将黑枸杞多糖应用于发酵乳制品以及发酵食品的可行性,为开发更多的活性多糖食品打好坚实的基础。
1 材料与方法
1.1 材料与试剂
黑枸杞,采自甘肃民勤,均为野外生长,鲜果采摘经自然晾干后保存于4 ℃冰箱;副干酪乳杆菌L9、嗜热链球菌G2,由甘肃农业大学食品科学与工程学院分离鉴定并保存;L9与G2的培养分别采用MRS固体培养基与GM17固体培养基,液体培养基同为MRS与GM17。
苯酚、浓硫酸、乙醇(95%)、正丁醇、三氯甲烷、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、铁氰化钾、抗坏血酸等,均为分析纯。
1.2 仪器与设备
Scientz-ⅡD超声细胞破碎仪、Scientz-ND真空冷冻干燥机,宁波新芝生物科技股份有限公司;723型可见分光光度计,上海光谱仪器有限公司;RE-52AA旋转蒸发仪,上海亚荣生化仪器厂;TGL-20M高速台式冷冻离心机、HG303-4电热恒温培养箱,上海一恒科学仪器有限公司。
1.3 实验方法
1.3.1 黑枸杞的预处理
筛选表面无伤口且无腐烂的野生黑枸杞,放置于室外阳光充足处自然晒干,将晒干的黑枸杞干果粉碎并过筛网,保存于4 ℃冰箱备用。
1.3.2 超声波提取黑枸杞多糖的工艺优化
1.3.2.1 黑枸杞多糖浸提液的制备
称量黑枸杞粉末2.00 g,加入一定量的蒸馏水搅拌均匀并进行超声波提取。完成后离心(4 000 r/min,15 min)并抽滤,去沉淀留上清液,精确吸取上清液1 mL于100 mL容量瓶,定容后用于多糖含量的测定。
1.3.2.2 黑枸杞多糖含量的测定
采用硫酸-苯酚法[16],葡萄糖标准曲线为:y=11.429x-0.022 4,R2=0.993 2;多糖提取率按公式(1)计算:
提取率![]()
(1)
式中:0.9,葡萄糖转化为多糖的转化因子;n,多糖浸提液稀释倍数;ρ,多糖浸提液中糖浓度,g/L;V,提取液总体积,mL;m,所称取黑枸杞粉末的质量,g。
1.3.2.3 单因素试验
称量黑枸杞粉末2.00 g,设定超声波功率为250 W、超声时间15 min,颗粒过筛目数为60目,选用不同液料比[20、30、40、50、60 (mL∶g)]探究液料比对黑枸杞多糖提取率的影响;设定液料比为上述单因素最佳、超声功率为250 W、过筛目数为60目,选用不同提取时间(5、10、15、20、25 min)探究超声时间对黑枸杞多糖提取率的影响;设定液料比和超声时间为上述单因素试验最佳、过筛目数为60目,探究不同超声功率(50、150、250、350、450 W)对黑枸杞多糖提取率的影响;在液料比、超声时间、超声功率为最佳的基础上,选用不同的筛网(20、40、60、80、100目)探究黑枸杞颗粒粒度大小对多糖提取率的影响。
1.3.2.4 响应面优化实验设计
由图1-d可知,当筛网孔径<60目时,多糖提取率提升并不显著,且筛网孔径越小原料浪费越多,故选择液料比(A)、超声时间(B)、超声功率(C)3个单因素进行响应面优化实验,因素与水平设计见表1。
表1 Box-Behnken 试验设计因素水平表
Table 1 Factors and levels of the Box-Behnken experiment design
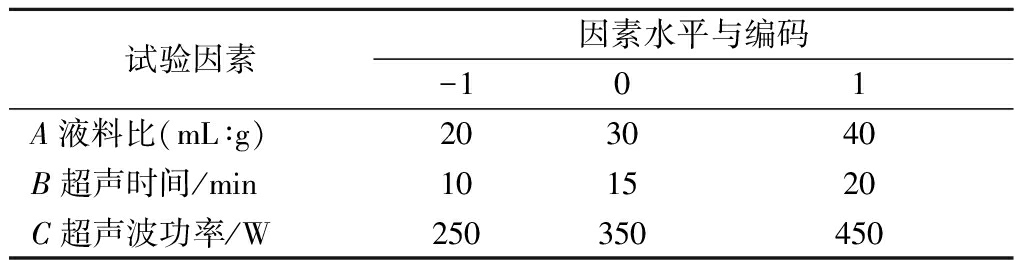
试验因素因素水平与编码-101A液料比(mL∶g)203040B超声时间/min101520C超声波功率/W250350450
1.3.3 黑枸杞多糖冻干粉的制备
采用最优工艺制备黑枸杞多糖浸提液,将浸提液旋转蒸发至原体积的1/4,加4倍体积的95%乙醇4 ℃醇沉24 h后离心得沉淀,沉淀用无水乙醇清洗(脱脂)3次,加纯水复溶并使用Sevag试剂进行脱蛋白操作,将上清液保留并分装于培养皿进行冷冻干燥后得黑枸杞粗多糖冻干粉,保存于4 ℃冰箱备用。
1.3.4 乳酸菌的纯化培养
无菌环境下,分别称取L9与G2的冻干菌粉0.06 g于100 mL生理盐水(0.85%)中复水30 min,以10倍梯度稀释法取10-4~10-8 五个浓度梯度涂平板,放于37 ℃恒温培养箱培养48 h后挑取生长良好的单菌落划线培养3代,经镜检确定为纯种菌后保存于4 ℃冰箱备用。
1.3.5 黑枸杞多糖对乳酸菌生长特性的影响
无菌环境下挑取预先纯化的乳酸菌单菌落于液体培养基中活化培养3代,制得液体种子。将黑枸杞多糖按不同添加量[17](0、0.5、1、1.5 g/L)加入新鲜无菌的液体培养基加热使其溶解并灭菌,待冷却后按1%的接种量接入液体种子,放入37 ℃恒温培养箱待测。
乳酸菌的生长曲线[18]采用比浊法绘制;产酸用pH计直接测定。
1.3.6 黑枸杞多糖对乳酸菌抗氧化能力的影响
1.3.6.1 乳酸菌菌悬液及无细胞提取物的制备
乳酸菌的活化培养同1.3.5。将黑枸杞多糖按不同的添加量(0.0、0.5、1.0、1.5 g/L)加入新鲜无菌的液体培养基,加热使其溶解,灭菌后冷却至37 ℃接入液体种子,放入恒温培养箱培养24 h。
将培养完成的乳酸菌液体培养基离心(10 000 r/min,20 min)后获得乳酸菌菌体,用PBS缓冲液(0.02 mol/L,pH=7.4)洗涤2次以除去残留的培养基成分与多糖成分,将乳酸菌菌体重悬于PBS缓冲液中并调节菌液浓度为1.0×109CFU/mL(OD600=1.0);共设置2组菌悬液,一组为完整细胞组(intact cells,IC),另一组进行超声细胞破碎处理(300 W,20 min;开5 s,关5 s)后离心(10 000 r/min,20 min)取上清液作为无细胞提取物(cell free extracts,CFE)。
1.3.6.2 抗氧化能力的测定
DPPH自由基清除能力的测定参考RIZZELLO等[19]的方法,总还原力的测定参考WU等[20]的方法。
1.4 数据处理与统计分析
试验所做平行次数均为3次,取平均值进行数据分析;采用Excel进行数据统计,Origin 2018绘图,SPSS 22.0数据分析,Design-Expert.V 8.0.6.1进行响应面实验设计与分析。
2 结果与分析
2.1 单因素试验结果
图1呈现了液料比、超声时间、超声功率、筛网孔径大小的单因素试验结果。分析黑枸杞多糖的提取率随各个单因素不同水平的变化规律并综合考虑实际操作与节能等原因,选择液料比为40(mL:g)、超声15 min、超声波功率为350 W作为最佳条件,并在液料比30~50(mL:g)、超声10~20 min、超声波功率250~450 W进行中心复合试验。
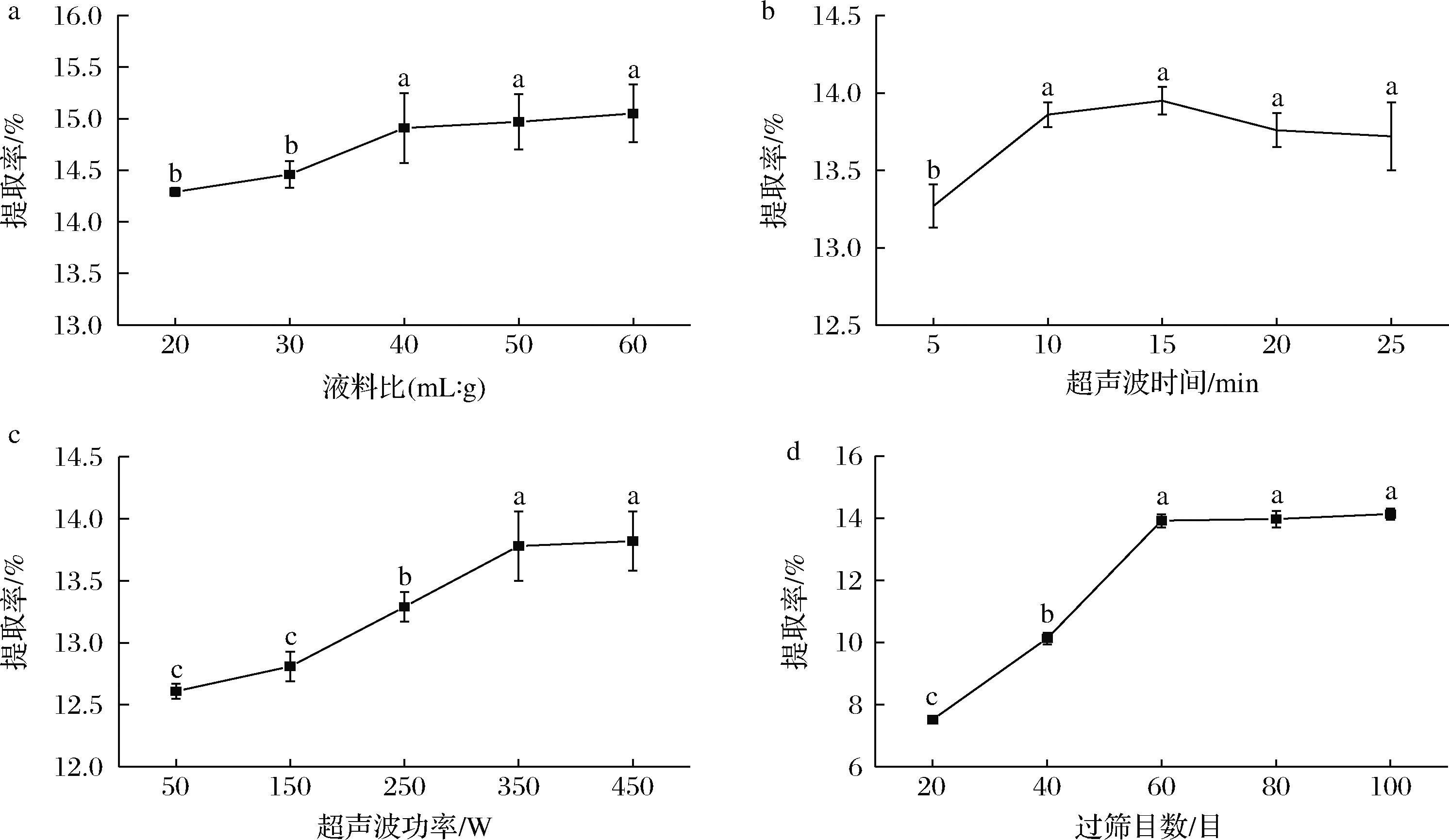
a-料液比;b-超声波时间;c-超声波功率;d-过筛目数
图1 单因素试验结果
Fig.1 Single factor experiment results 注:图中不同小写字母表示组间差异显著(P<0.05)(下同)
2.2 响应面优化实验结果
2.2.1 响应面优化设计
本次优化实验共17组,每组实验重复3次,试验设计和结果见表2。
表2 Box-Behnken 试验设计与结果
Table 2 Box-Behnken experimental design and results
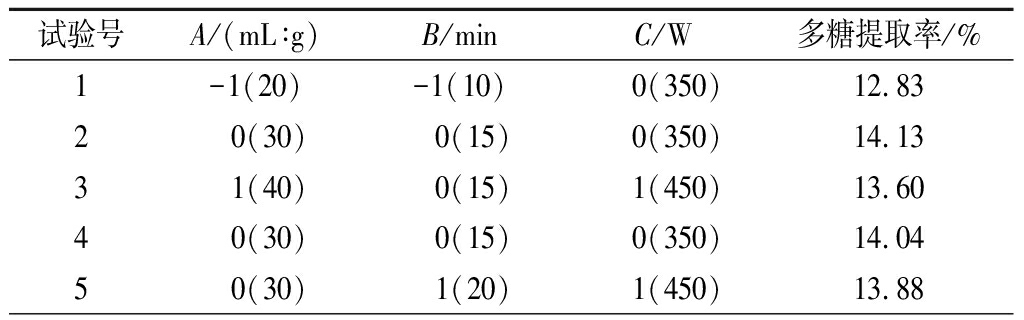
试验号A/(mL∶g)B/minC/W多糖提取率/%1-1(20)-1(10) 0(350)12.832 0(30) 0(15) 0(350)14.133 1(40) 0(15) 1(450)13.604 0(30) 0(15) 0(350)14.045 0(30) 1(20) 1(450)13.88
续表2
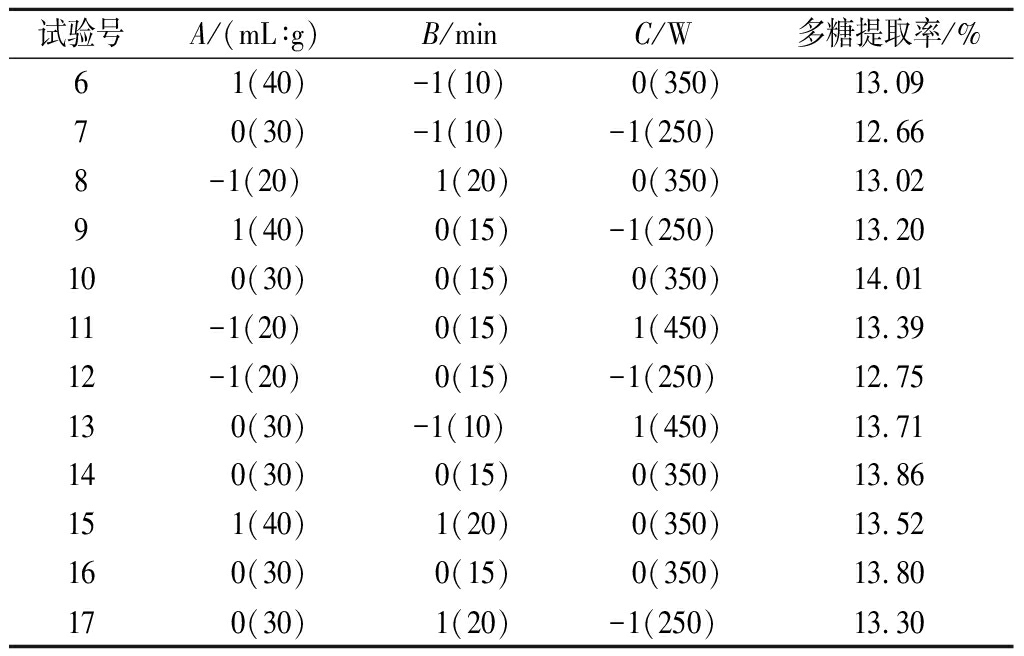
试验号A/(mL∶g)B/minC/W多糖提取率/%6 1(40)-1(10) 0(350)13.097 0(30)-1(10)-1(250)12.668-1(20) 1(20) 0(350)13.029 1(40) 0(15)-1(250)13.2010 0(30) 0(15) 0(350)14.0111-1(20) 0(15) 1(450)13.3912-1(20) 0(15)-1(250)12.7513 0(30)-1(10) 1(450)13.7114 0(30) 0(15) 0(350)13.8615 1(40) 1(20) 0(350)13.5216 0(30) 0(15) 0(350)13.8017 0(30) 1(20)-1(250)13.30
2.2.2 回归模型分析
响应面试验模型方差分析见表3。应用Design-Expert 8.0.6.1进行2次多项回归拟合软件拟合出的3元2次回归方程为:Y=13.97+0.18A+0.18B+0.33C+0.060AB-0.060AC-0.12BC-0.50A2-0.35B2-0.23C2。对回归方程进行方差分析,结果显示模型显著(P<0.01),失拟项不显著(P>0.05),调整系数![]() 接近回归方程系数R2 = 96.60%,表明可用该回归方程对试验结果进行分析预测。
接近回归方程系数R2 = 96.60%,表明可用该回归方程对试验结果进行分析预测。
表3 方差分析
Table 3 Variance analysis
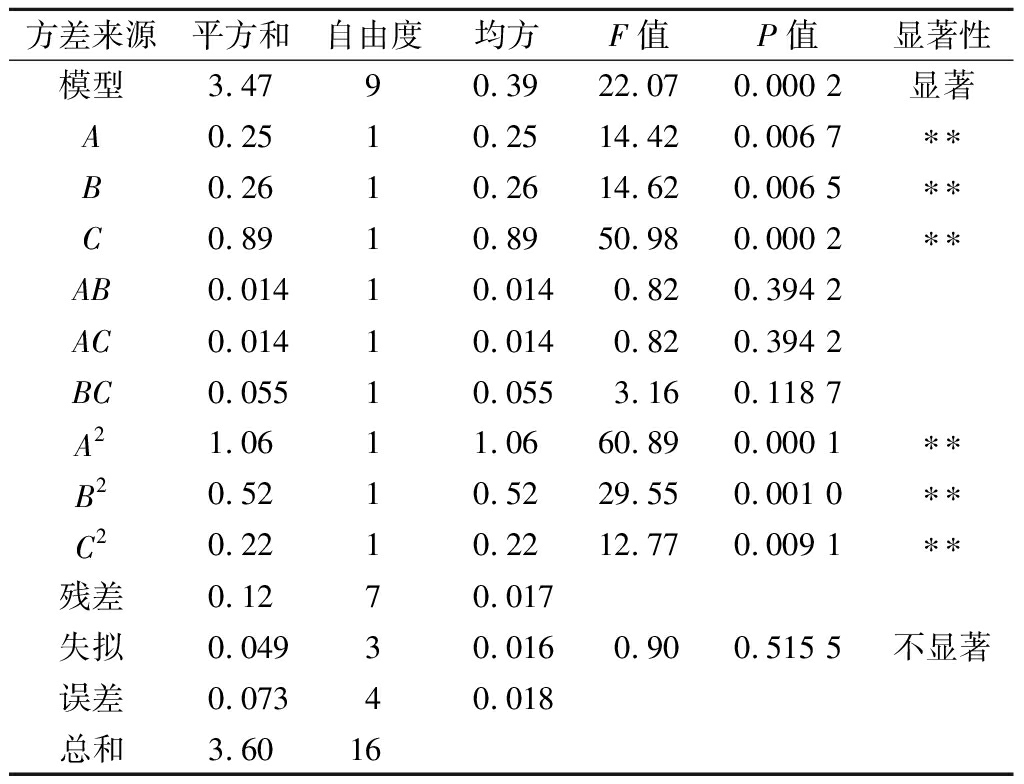
方差来源平方和自由度均方F值P值显著性模型3.4790.3922.070.000 2显著A0.2510.2514.420.006 7∗∗B0.2610.2614.620.006 5∗∗C0.8910.8950.980.000 2∗∗AB0.01410.0140.820.394 2AC0.01410.0140.820.394 2BC0.05510.0553.160.118 7A21.0611.0660.890.000 1∗∗B20.5210.5229.550.001 0∗∗C20.2210.2212.770.009 1∗∗残差0.1270.017失拟0.04930.0160.900.515 5不显著误差0.07340.018总和3.6016
注:**表示P﹤0.01 水平下差异极显著;*表示P﹤0.05水平下差异显著
模型中1次项A、B、C,2次项A2、B2、C2对多糖的提取率影响高度显著(P<0.01);交互项AB、AC、BC对多糖的提取率影响不显著;方差分析结果表明,影响黑枸杞多糖提取率的因素主次顺序为:超声功率>超声时间>液料比。
2.2.3 响应面作用交互分析
由图2可知,各个交互项之间均呈现不同的弯曲程度,其中图2-a的响应曲面图相对较陡,故因素B和A交互效应最大,该结果与方差分析结果一致。
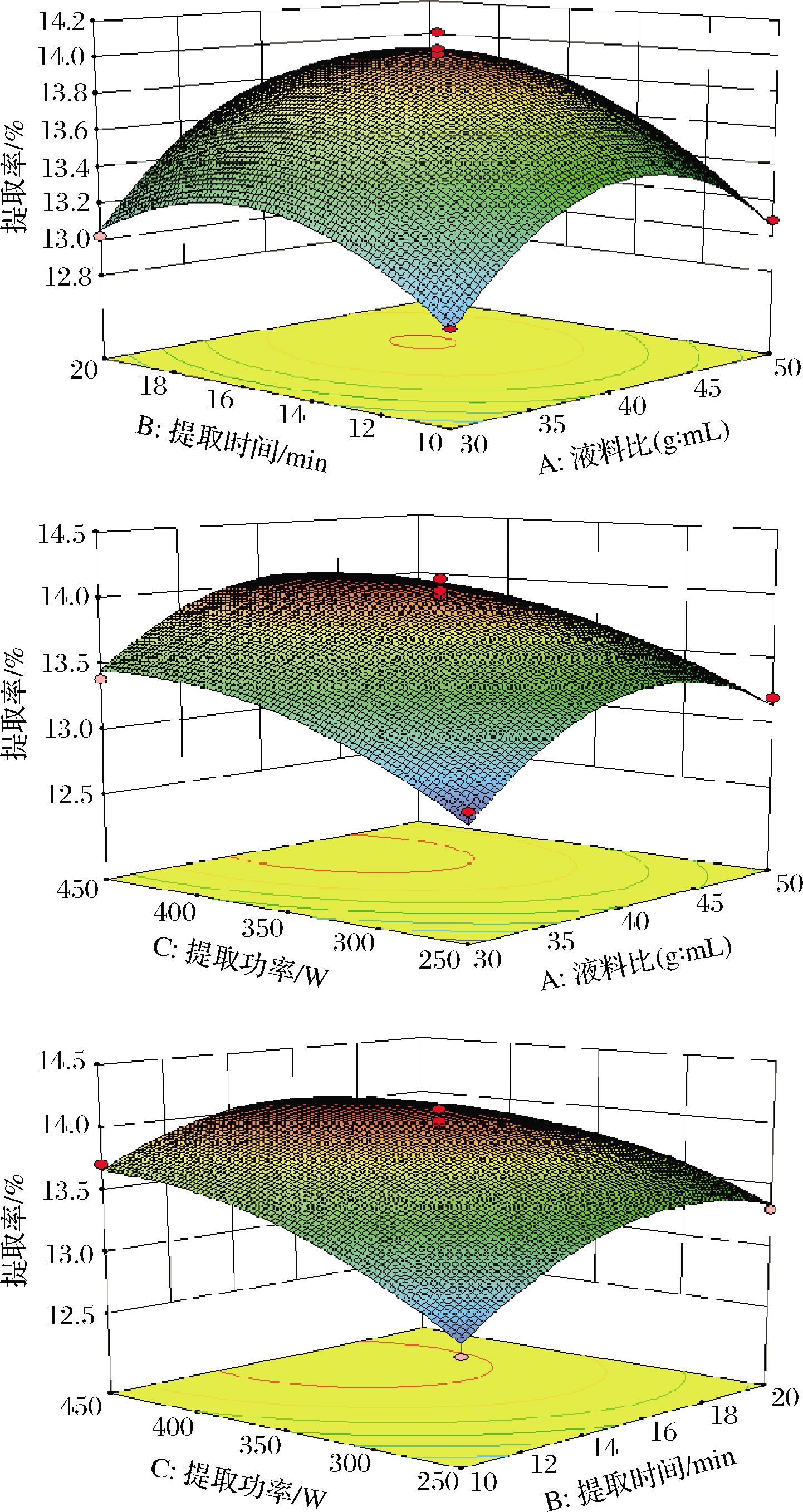
a-提取时间与液料比;b-提取功率与液料比;c-提取功率与提取时间
图2 各因素交互作用对黑枸杞多糖提取率的影响
Fig.2 Effect of interaction of various factors on extraction rate of L.ruthenicum Murray polysaccharide
2.2.4 超声波提取黑枸杞多糖最佳工艺参数确定
通过模型预测得到黑枸杞多糖的最佳提取条件为:液料比41.46(mL∶g),提取15.78 min,提取功率416.66 W,黑枸杞多糖的提取理论值为14.106%。依据最佳条件并考虑实际操作将其做出调整:液料比41.5(mL∶g),超声16 min,超声波功率418 W。以该实际提取条件为基础进行3次重复验证试验,得到黑枸杞多糖的实际提取率为(14.13±0.74)%,与预测值相差不大,说明此提取条件适用于黑枸杞多糖提取工艺的优化。将得到的黑枸杞多糖冻干粉加三级水复溶,溶解后采用硫酸-苯酚法测得其多糖含量为65%。
2.3 黑枸杞多糖对G2、L9生长特性的影响
图3-a显示了黑枸杞多糖对嗜热链球菌G2生长特性的影响。结果表明,随着培养时间的延长,黑枸杞多糖不仅缩短了G2的生长停滞期使其提前进入对数生长期,而且加快了乳酸菌的增殖速度,整个生长过程多糖组生物量始终高于对照组;由产酸曲线可知,黑枸杞多糖能够加速体系pH下降速度。不同多糖添加量处理中,0.5 g/L多糖组不仅获得了最大的乳酸菌生物量,同时pH下降速度也最快,表明0.5 g/L的黑枸杞多糖对嗜热链球菌G2的促生长效果明显。
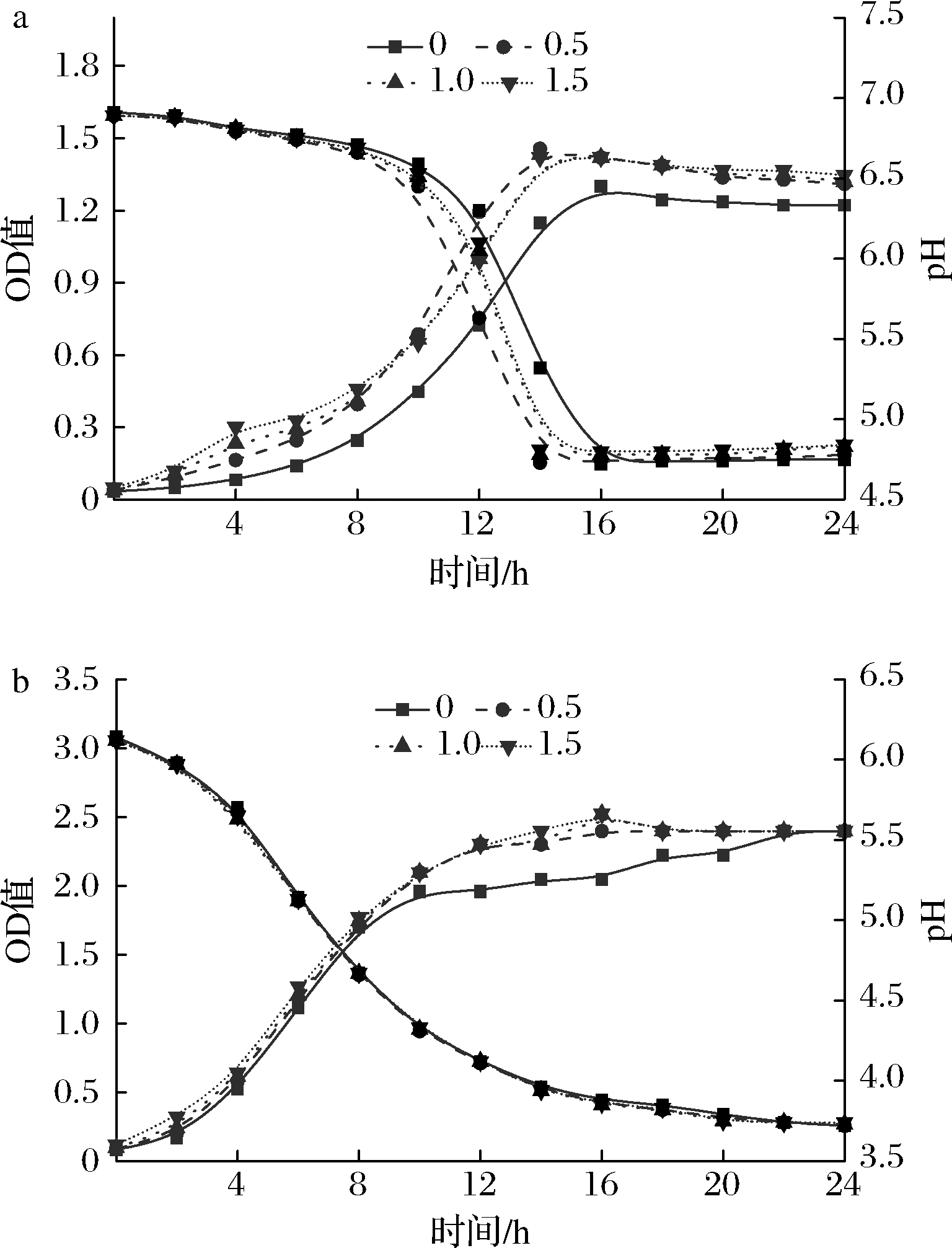
a-嗜热链球菌G2;b-副干酪乳杆菌L9
图3 黑枸杞多糖对乳酸菌生长特性的影响
Fig.3 Effect of L.ruthenicum Murray polysaccharides on the growth characteristics of lactic acid bacteria
图3-b反映了黑枸杞多糖对副干酪乳杆菌L9生长特性的影响。添加黑枸杞多糖的培养过程中,L9的生长没有出现明显的停滞期,能较快适应生长环境,进入对数生长期;培养过程中,黑枸杞多糖延长了L9的对数生长期,并加快了乳酸菌的增殖速度。产酸曲线显示,不同多糖添加水平,其pH下降速度与对照组几乎保持一致,说明黑枸杞多糖对L9产酸影响较弱,这可能是由于L9前期产酸较多、产酸速率较快导致乳酸菌的生长环境受到限制,无法从多糖及其他成分中吸收营养物质进行代谢,使乳酸菌的生长受到了抑制;不同多糖含量对L9的促生长效果影响微弱,且各多糖组间差异不显著(P>0.05)。
2.4 黑枸杞多糖对G2、L9抗氧化能力的影响
2.4.1 黑枸杞多糖对G2、L9 DPPH自由基清除能力的影响
由图4-a可知,黑枸杞多糖对嗜热链球菌G2清除DPPH自由基的能力影响显著。G2本身清除自由基的能力较弱,G2的菌悬液(IC-G2)清除自由基的能力稍强于G2的无细胞提取物(CFE-G2);将黑枸杞多糖应用于G2生长环境,发现IC-G2与CFE-G2清除自由基的能力均显著提升(P<0.05),且清除效果随多糖添加量的增加而显著提高(P<0.05);其中,1.5 g/L的多糖组其IC-G2与CFE-G2均获得了最高的自由基清除率,这可能是由于黑枸杞多糖同时促进了G2胞内与胞外抗氧化物质的生成,从而提高清除DPPH自由基的能力。由图4-c可知,黑枸杞多糖对副干酪乳杆菌L9清除DPPH自由基的能力无显著提升效果。对比不同处理组,发现黑枸杞多糖对L9的菌悬液(IC-L9)清除自由基的能力影响并不显著(P>0.05),只有微弱的提升效果;对L9的无细胞提取物(CFE-L9)清除自由基的能力影响显著(P<0.05),但依赖较高的剂量关系,且各多糖组之间并无显著差异。对比IC-L9与CFE-L9清除DPPH自由基的能力,发现IC-L9自由基清除率明显高于CFE-L9,初步证明L9清除自由基的能力主要依靠胞内抗氧化物质。
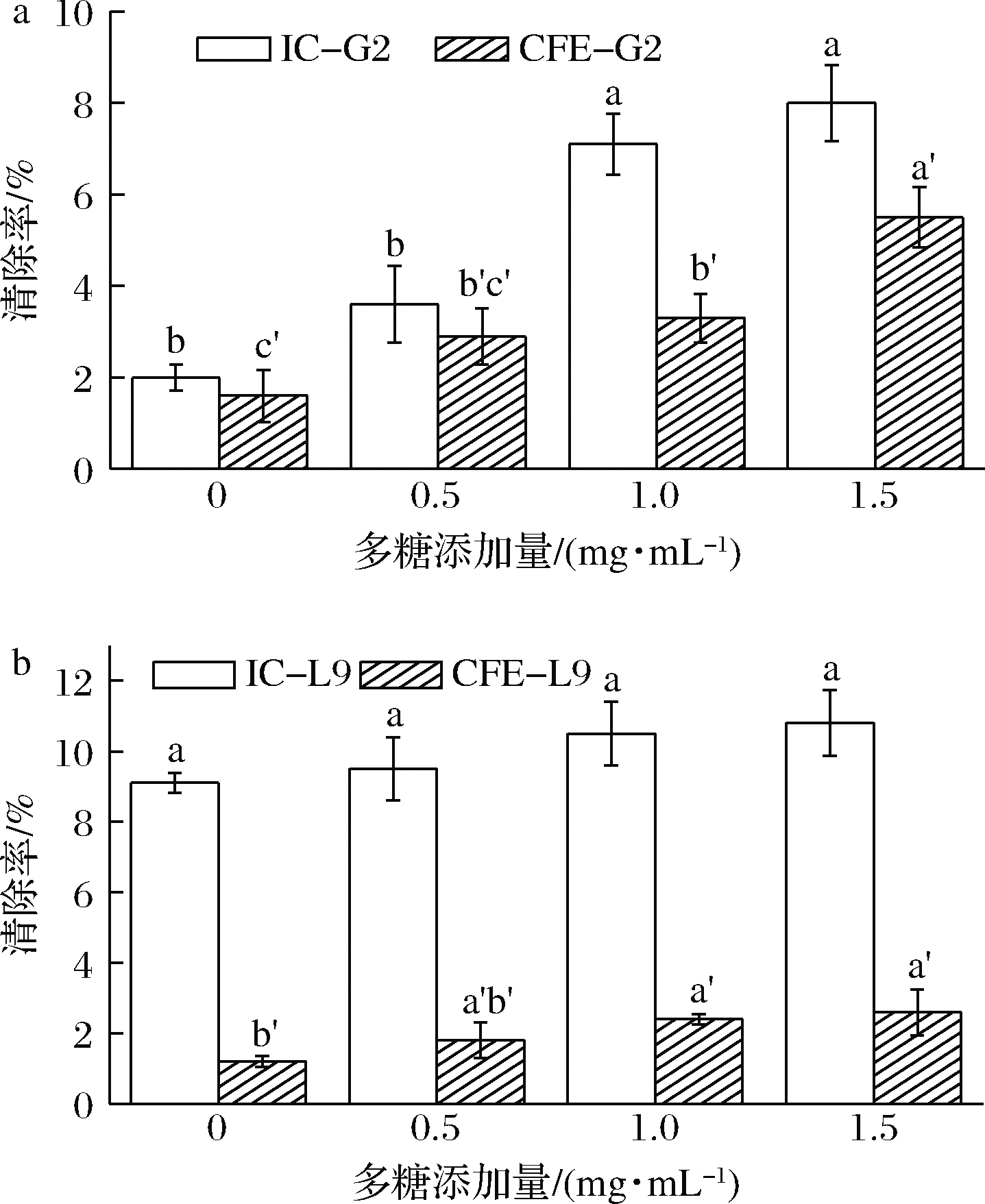
a-嗜热链球菌G2;b-副干酪乳杆菌L9
图4 黑枸杞多糖对乳酸菌DPPH自由基清除能力的影响
Fig.4 Effect of L.ruthenicum Murray polysaccharide on DPPH free radical scavenging ability of lactic acid bacteria 注:完整细胞组(IC)的差异显著用a的形式表示,无细胞提取物 组(CFE)的差异显著用a’的形式表示(P<0.05)(下同)
2.4.2 黑枸杞多糖对乳酸菌还原力的影响
研究了黑枸杞多糖对此2株乳酸菌(嗜热链球菌G2和副干酪乳杆菌L9)的还原力的影响。由图5-b与图5-c可知,黑枸杞多糖对G2与L9还原力的影响效果都较为显著(P<0.05),IC-G2、CFE-G2与IC-L9、CFE-L9的还原力强度随黑枸杞多糖添加量的增大而提高;通过对比IC与CF两组数据间的差异,发现G2与L9其IC的还原力都强于CFE,且1.5 g/L的多糖组都获得了最高的还原力。

a-嗜热链球菌G2;b-副干酪乳杆菌L9
图5 黑枸杞多糖对乳酸菌还原力的影响
Fig.5 Effect of L.ruthenicum Murray polysaccharide on the reducing power of lactic acid bacteria
3 讨 论
本试验基于超声波法提取黑枸杞多糖,得到多糖的实际提取率为(14.13±0.74)%,在同为超声波法提取黑枸杞多糖的前提下,前人通过工艺优化得出的提取率分别可以达到7.01%[21]、8.25%[5],本工艺在仅提取1次的条件下多糖提取率可达14.13%,与前人所得的多糖提取率相比,得到大幅提高。
黑枸杞多糖对乳酸菌生长特性影响的试验结果表明,添加量为0.5 g/L的多糖组对G2的促生长作用表现最佳,但多糖含量对L9的促生长效果影响微弱。孟鸽等[22]将霍山石斛多糖加入嗜酸乳杆菌的生长环境中,发现添加6 g/L霍山石斛多糖能够显著提升其生物量,表现出最佳的促生长作用。刘丽莎等[23]发现,随着白术多糖添加量的增大,植物乳杆菌的促生长作用显著增强并在2.0%时达饱和;但对嗜酸乳杆菌而言,白术多糖对其促生长作用仅在1.0%的范围内随多糖添加量增加而增强,且促生长效果明显低于对植物乳杆菌的促生长效果。这表明多糖能够影响乳酸菌生长的因素较多,机理较为复杂。
乳酸菌的抗氧化试验结果显示,G2与L9本身抗氧化性能较弱,2个菌株均不属于高抗氧化菌种。本研究将黑枸杞多糖作用于乳酸菌生长环境,得出随着黑枸杞多糖添加量的增加,完整细胞悬液与无细胞提取物的抗氧化能力也逐渐上升,且1.5 g/L的多糖组对乳酸菌的抗氧化能力促进效果最好。结果表明,通过黑枸杞多糖的添加,成功改善了菌株的抗氧化能力;同时,王婧莹[24]等研究发现0.1%~0.3%的NaCl能提高保加利亚乳杆菌的体外抗氧化能力,且0.2% NaCl抗氧活性最好,但是否为NaCl促进了菌种抗氧化物质的产生还有待验证。
4 结论
本研究通过单因素与响应面设计获得了黑枸杞多糖的最佳提取条件,得到一种简便且高效的黑枸杞多糖超声提取方法,大幅缩短了黑枸杞多糖的提取时间并相对提高了多糖提取率。黑枸杞多糖不仅能够促进嗜热链球菌G2的增殖并加快其降酸速度,而且延长了副干酪乳杆菌L9的对数生长期;其中0.5 g/L多糖对G2的促生长作用强,但对L9促生长效果影响不明显;同时,随着黑枸杞多糖添加量的增加,G2与L9的抗氧化性能均有所提升,其中1.5 g/L多糖组抗氧化性能最强。黑枸杞多糖对2株乳酸菌生长起到促进作用,并且能够有效提升其抗氧化能力,本研究为今后有效发挥乳酸菌菌株的作用、开发功能性发酵食品提供理论基础和科学依据。
[1] LV X,WANG C J,CHENG Y,et al.Isolation and structural characterization of a polysaccharide LRP4-A from Lycium ruthenicum Murr[J].Carbohydrate Research,2013,365:20-25.
[2] LIU Z G,TANG X H,LIU C,et al.Ultrasonic extraction of anthocyanins from Lycium ruthenicum Murr.and its antioxidant activity[J].Food Science & Nutrition,2020,8(6):2 642-2 651.
[3] ZHANG J T,DONG Y S,NISAR T,et al.Effect of superfine-grinding on the physicochemical and antioxidant properties of Lycium ruthenicum Murray powders[J].Powder Technology,2020,372:68-75.
[4] 张佳, 赫军,张蕾,等.黑果枸杞果实化学成分研究[J].中国药学杂志,2016,51(24):2 150-2 154.
ZHANG J,HE J,ZHANG L,et al.Chemical constituents from fruits of Lycium ruthenicum Murr[J].Chinese Pharmaceutical Journal,2016,51(24):2 150-2 154.[知网]
[5] LIU Z G,DANG J,WANG Q L,et al.Optimization of polysaccharides from Lycium ruthenicum fruit using RSM and its anti-oxidant activity[J].International Journal of Biological Macromolecules,2013,61:127-134.
[6] DUAN Y B,CHEN F,YAO X C,et al.Protective effect of Lycium ruthenicum Murr.against radiation injury in mice[J].International Journal of Environmental Research and Public Health,2015,12(7):8 332-8 347.
[7] GONG Y,WU J,LI S T.Immuno-enhancement effects of Lycium ruthenicum Murr.polysaccharide on cyclophosphamide-induced immunosuppression in mice[J].International Journal of Clinical and Experimental Medicine,2015,8(11):20 631-20 637.
[8] CHEN R Z,LI Y,DONG H,et al.Optimization of ultrasonic extraction process of polysaccharides from Ornithogalum caudatum Ait and evaluation of its biological activities[J].Ultrasonics Sonochemistry,2012,19(6):1 160-1 168.[LinkOut]
[9] JING C L,YUAN Y,TANG Q,et al.Extraction optimization,preliminary characterization and antioxidant activities of polysaccharides from Glycine soja[J].International Journal of Biological Macromolecules,2017,103:1 207-1 216.
[10] 杨斌, 王向未.黑枸杞及其功能性成分在食品工业中的应用及开发进展[J].轻工科技,2014,30(10):22-23.
YANG B,WANG X W.Application and development progress of Lycium Ruthenicum Murr.and its functional components in food industry[J].Light Industry Science and Technology,2014,30(10):22-23.
[11] CHEN X Y,ZHAO X,QIAN Y,et al.Screening and identification of lactic acid bacteria strains with high acid-producing from traditional fermented yak yogurt[J].BIO Web of Conferences,2017,8:03002.
[12] LI S Q,SHAH N P.Effects of Pleurotus eryngii polysaccharides on bacterial growth,texture properties,proteolytic capacity,and angiotensin-I-converting enzyme-inhibitory activities of fermented milk[J].Journal of Dairy Science,2015,98(5):2 949-2 961.
[13] YEUNG Y K,LEE Y K,CHANG Y H.Physicochemical,microbial,and rheological properties of yogurt substituted with pectic polysaccharide extracted fromUlmus davidiana[J].Journal of Food Processing and Preservation,2019,43(4):e13 907.
[14] 李宁宁, 王正荣,孙春晓,等.牛蒡多糖对发酵乳品质和抗氧化性的影响[J].食品与发酵工业,2019,45(10):97-103.
LI N N,WANG Z R,SUN C X,et al.Burdock polysaccharides enhanced the quality and antioxidative activity of fermented milk[J].Food and Fermentation Industries,2019,45(10):97-103.
[15] 李广富, 陈伟,范路平,等.茶树菇多糖酸奶的抗氧化活性与抗衰老研究[J].现代食品科技,2015,31(10):140-145;173.
LI G F,CHEN W,FAN L P,et al.In vitro antioxidative and anti-aging effects of Agrocybe aegerita polysaccharide yogurt[J].Modern Food Science and Technology,2015,31(10):140-145;173.
[16] WU C Y,WANG X S,WANG H,et al.Extraction optimization,isolation,preliminary structural characterization and antioxidant activities of the cell wall polysaccharides in the petioles and pedicels of Chinese herbal medicine Qian (Euryale ferox Salisb.)[J].International Journal of Biological Macromolecules,2014,64:458-467.
[17] 赵岩岩, 赵圣明,李帅,等.山楂叶多糖对发酵乳品质及抗氧化活性的影响[J].食品科学,2020,41(2):73-79.
ZHAO Y Y,ZHAO S M,LI S,et al.Effect of polysaccharides from hawthorn leaves on the quality and antioxidant activity of fermented milk[J].Food Science,2020,41(2):73-79.
[18] 杨剑, 卿煜维,邓放明,等.传统发酵辣椒中产香乳酸菌的分离鉴定[J].食品与发酵工业,2019,45(24):58-63.
YANG J,QING Y W,DENG F M,et al.Screening and identification of aroma-producing lactic acid bacteria from traditional fermented chili[J].Food and Fermentation Industries,2019,45(24):58-63.
[19] RIZZELLO C G,LORUSSO A,RUSSO V,et al.Improving the antioxidant properties of quinoa flour through fermentation with selected autochthonous lactic acid bacteria[J].International Journal of Food Microbiology,2017,241(16):252-261.
[20] WU H C,CHEN H M,SHIAU C Y.Free amino acids and peptides as related to antioxidant properties in protein hydrolysates of mackerel (Scomber austriasicus)[J].Food Research International,2003,36(9-10):949-957.
[21] 贾文聪, 伊明·尕哈甫,古丽格娜·吐尔地,等.黑果枸杞多糖提取及脱蛋白、脱色最佳工艺的研究[J].新疆医科大学学报,2018,41(7):900-906.
JIA W C,YIMING G H F,CHEN D X,et al.Study on the optimal process of extraction,deproteinized and decolorization of Lycium ruthenicum Murr.polysaccharides[J].Journal of Xinjiang Medical University,2018,41(7):900-906.
[22] 孟鸽, 魏明,赵世光,等.霍山石斛多糖对嗜酸乳杆菌生理特性影响研究[J].食品科技,2017,42(4):184-187;193.
MENG G,WEI M,ZHAO S G,et al.The effects of polysaccharides fromDendrobium huoshanense on physiological characteristics of Lactobacillus acidophilus[J].Food Science and Technology,2017,42(4):184-187;193.
[23] 刘丽莎, 王锐,旭日花,等.白术多糖对益生菌的促生长作用及结构分析[J].食品科学,2010,31(19):124-128.
LIU L S,WANG R,XU R H,et al.Promoting effect of polysaccharides isolated from Rhizoma atractylodis macrocephalae on the growth of probiotics and structure analysis[J].Food Science,2010,31(19):124-128.
[24] 王婧莹, 张国芳,杜鹏,等.NaCl对保加利亚乳杆菌抗氧化活性的影响[J].中国食品学报,2019,19(6):61-67.
WANG J Y,ZHANG G F,DU P,et al.Effects of NaCl on antioxidant activity of Lactobacillus bulgaricus[J].Journal of Chinese Institute of Food Science and Technology,2019,19(6):61-67.