黑果腺肋花楸(Aronia melanocarpa (Michx.)Ell.),原产于美国东北部,是一种集食用、药用、园林和生态等价值于一身的珍贵经济树种[1],其浆果(俗称野樱莓、不老莓)富含黄酮、花青素和多酚等物质。20世纪90年代,不老莓被引种至中国,并于辽西地域开始栽培[2],截至2015年,该树种在我国栽培面积约为533~600 hm2,辽宁、吉林、黑龙江、内蒙古、河南、河北、北京、山东、新疆、江苏、山西等13个省(自治区、直辖市)均有不同面积种植。近年来,我国相继完成了繁殖、栽培、区域试验等方面的研究[3]。2018年9月,不老莓通过我国国家卫生健康委员会审查,成为新食品原料[4],正式在食品加工领域崭露头角。
不老莓提取物具有极强的抗氧化、抗炎、抑菌等生物活性,在治疗和预防癌症、心血管疾病、慢性炎症、辐射病、重金属中毒症等多种疾病中起到一定作用[5-8]。同时,不老莓富含多酚类物质,如花青素、黄酮等的含量高于大部分已知植物[9],是天然的抗氧化剂资源,也是决定不老莓生物活性的关键因素。此外,研究表明不老莓中含有丰富的有机酸类物质,也为其生物活性作出贡献。另一方面,由于其缩合单宁含量较高,使果实口感较涩,不适宜鲜食。但是,不老莓浆果出汁率可高达(78.65±1.05)%[10],因此,通过工艺手段将不老莓加工成果汁,可以丰富其口感,降低涩感,同时较大程度地保留其生物活性。总体而言,不老莓果汁类产品具有非常广阔的市场前景。目前,不老莓果实中多酚与有机酸组成已有一定研究,但仍缺乏对不老莓果汁类产品酚类物质与有机酸特征的相关研究,对于消费者的选购与不老莓果汁的产业化发展均造成了一定的影响。
综上,本研究通过对市售不老莓果汁类产品的有机酸与酚类物质组成进行解析,同时分析与抗氧化能力的相关性,从而对此类产品的营养价值与抗氧化能力作出评价,以期为消费者的选购与不老莓果汁的产业化发展提供理论依据和数据支撑。
1 材料与方法
1.1 材料与试剂
6种市售不老莓果汁类产品购于超市或网上商城,样品信息如表1所示。
表1 六种市售不老莓果汁类产品
Table 1 Six kinds of commercial A.melanocarpa juices

产品编号果汁含量/%产地出售规格价格/元ZH-20%20山西360 mL×1瓶10ZH-30%30山西360 mL×1瓶15ZH-40%40山西360 mL×1瓶18K-30%30辽宁1 L×1瓶89L-45%45辽宁360 mL×1瓶99ZH-100%100山西250 mL×1瓶199
福林酚(浓度1 mol/L),北京索莱宝科技有限公司;2,4,6-三吡啶基三嗪(2,4,6-tripyridin-2-yl-1,3,5-triazine,TPTZ)(纯度≥98%)、6-羟基-2,5,7,8-四甲基色烷-2-羧酸(Trolox)(浓度≥98%),上海源叶科技有限公司;DPPH试剂(纯度>97.0%),梯希爱化成工业发展有限公司;没食子酸、原花青素B1、原儿茶酸、绿原酸、儿茶素、原花青素B2、龙胆酸、咖啡酸、反式对香豆酸、反式阿魏酸、槲皮素-3-D-β-葡萄皮糖苷、槲皮素、奎宁酸、苹果酸、莽草酸、乳酸、乙酸、柠檬酸、丙酸(浓度≥98%),美国Sigma公司;甲醇、乙腈(均为色谱纯),美国Tedia公司;其余试剂均为国产分析纯。
1.2 仪器与设备
Centrifuge 5804R冷冻离心机,德国Eppendorf公司;UV2800紫外分光光度计,尤尼柯(上海)仪器有限公司;Waters 2695高效液相色谱仪,包括自动进样器、柱温箱、Waters 2996 紫外检测器、Empower 色谱工作站,美国Waters公司。
1.3 实验方法
1.3.1 样品制备
10 mL果汁经8 000 r/min离心10 min,取上清液稀释,得到待测样品。
1.3.2 总酚含量测定
参照LI等[11]采用福林酚法并稍作改动。取待测样品0.2 mL于10 mL比色管,先后加入2 mL 稀释10倍的福林酚溶液和1.8 mL质量分数7.5%的Na2CO3溶液,混匀避光放置1 h,于765 nm处测定吸光度值,结果以没食子酸当量表示。没食子酸标准溶液的质量浓度为0~200 mg/L,标准曲线为y=0.005 7x+0.056 6(R2=0.999 0)。
1.3.3 总黄酮含量测定
参照PRAKASH等[12]的方法并稍作改动。取5 mL待测样品于10 mL比色管中,加入质量分数5% NaNO2溶液0.3 mL,避光反应6 min,加入质量分数10% Al(NO3)3溶液0.3 mL,避光反应6 min,再加入1.0 mol/L NaOH溶液2 mL,并使用体积分数30%乙醇定容至10 mL,避光反应15 min,于510 nm处测吸光度值,结果以儿茶素当量表示。儿茶素标准溶液质量浓度为0~60 mg/L,标准曲线为y=0.016 2x+0.016 3 (R2=0.999 2)。
1.3.4 总花色苷含量测定
参照刘树勋等[13]的方法并稍作改动。取一定体积未稀释原果汁于2支10 mL比色管中,分别使用pH 1.0 HCl-KCl缓冲液和pH 4.5 HCl-CH3CO2 Na·3H2O溶液定容至5 mL,于黑暗处反应15 min,测定反应液在520及700 nm处的吸光度值,pH 1.0反应液体系在520及700 nm处吸光度相减记为A1,pH 4.5反应液体系在520及700 nm处吸光值相减记为A2,样品花色苷含量按公式(1)计算:
样品花色苷含量![]()
(1)
式中:MW,二甲花翠素葡萄糖苷分子质量493.5;DF,稀释倍数;ε,二甲花翠素葡萄糖苷的消光系数28 000。
1.3.5 缩合单宁含量测定
参照王储炎等[14]的方法并稍作改动。取待测样品0.5 mL于10 mL比色管中,先后加入3%的香草醛-甲醇溶液2.5 mL及体积分数30%的硫酸-甲醇溶液2.5 mL,30 ℃避光反应20 min后于500 nm处测定吸光度值,结果以儿茶素当量表示。儿茶素标准溶液质量浓度为0~400 mg/L,标准曲线为y=0.002 4x+0.008 8 (R2=0.999 5)。
1.3.6 HPLC测定单体酚及有机酸含量
(1) 样品处理
取10 mL果汁8 000 r/min离心10 min,上清液使用纯净水稀释,0.45 μm滤膜过滤后待测。
(2)单体酚含量测定
色谱柱:CAPCELL PAK C18色谱柱(250 mm×4.6 mm,5 μm);柱温28 ℃;DAD检测器,检测波长280 nm;进样量10 μL,以峰面积外标法定量。
梯度洗脱:流速0.5 mL/min;流动相A:V(水)∶V(乙腈)=19∶1,含体积分数0.3%乙酸;流动相B:V(乙腈)∶V(水)=9∶1,含体积分数0.2%乙酸。
梯度洗脱程序:0~16 min,B为12%~14%;16~18 min,B为14%;18~30 min,B为14%~16%;30~36 min,B为16%~20%;36~46 min,B为20%~24%;46~56 min,B为24%~30%;56~66 min,B为30%~50%;66~70 min,B为50%;70~80 min,B为50%~12%;80~85 min,B为12%。
(3)有机酸含量测定
色谱柱:CAPCELL PAK C18色谱柱(250 mm×4.6 mm,5 μm);柱温45 ℃;DAD检测器,检测波长210 nm;进样量10 μL,以峰面积外标法定量。
等度洗脱:流速0.5 mL/min;流动相A:0.02 mol/L K2HPO4,H3PO4溶液调节pH至2.3;流动相B:甲醇。
洗脱程序,流动相A∶B=99∶1(体积比)。
1.3.7 抗氧化活性测定
(1)铁离子还原能力(ferric ion reducing antioxidant power,FRAP)
参照BENZIE等[15]的方法并稍作改动。取0.25 mL待测样品和8 mL TPTZ工作液于10 mL比色管中,37 ℃反应15 min,在593 nm处测定其吸光度值,FRAP以Trolox当量表示。Trolox标准溶液浓度为0~1 mmol/L,标准曲线为y=1.154 4x+0.270 9 (R2=0.999 7)。
(2)DPPH自由基清除能力
参照文献[16]的方法并稍作改动。取0.25 mL待测样品和4 mL DPPH反应液于10 mL比色管中,避光反应30 min,在517 nm处测定其吸光度值,DPPH自由基清除能力以Trolox当量表示。Trolox标准溶液浓度为0~1 mmol/L,标准曲线为y=-1.228 5x+1.737 (R2=0.999 5)。
1.3.8 数据分析
所有实验重复3次,结果以(x±s)表示。采用SPSS 21.0软件单因素ANOVA模块对数据进行单因素方差分析,双变量相关模块计算Pearson系数对数据进行相关性分析,以P≤0.05表示差异显著,以P≤0.01表示差异极显著。
2 结果与分析
2.1 市售不老莓果汁类产品酚类物质含量分析
不老莓果汁类产品的酚类化合物种类与其果实一致,包括单体多酚及聚合多酚2种。单体多酚由酚酸、黄酮和花青素及其糖苷类化合物组成,其中花色苷是主要的呈色物质。聚合多酚即缩合单宁,由不同数量的表儿茶素微粒和儿茶素聚合而成,为呈涩物质[17]。
研究表明,不老莓果实中花色苷约占总酚含量25%,且远高于黄酮类化合物含量[18],这与不老莓果汁类产品的测定结果有较大差异。如图1所示,在不老莓果汁类产品中,黄酮类化合物占总酚含量21%~63%,而花色苷最多仅占总酚含量6%,最低为K-30%,未检出花色苷类物质。花色苷保留率与温度显著相关,WILKES等[19]研究了不老莓果汁加工过程中及其在25 ℃、6个月贮存期内花青素的稳定性,发现热处理后花青素被大量降解,其浓度呈线性下降。而较低温度和较低pH值贮藏的不老莓中花青素的含量最高,这在HOWARD等[20]的实验中得到了证实。实验结果表明,深加工果汁会造成不老莓果实中花青素及其糖苷类化合物的较大损失。
不老莓果实中,呈涩物质缩合单宁的总酚含量占比高达66%[18],由图1可知,在其果汁类产品中,缩合单宁占总酚含量5%~31%,与果实相比显著降低,从而使涩感降低,风味得到较大改善。然而,缩合单宁具有极强的抗氧化能力,是不老莓生物活性的最重要来源之一。因此,在果汁加工过程中,若一味追求除去缩合单宁以降低涩感,则会导致产品营养价值大大下降。ZH-20%、ZH-30%、ZH-40%产品中,缩合单宁均占总酚含量约30%左右,较好地实现了果汁产品口感与营养价值的平衡。
2.2 市售不老莓果汁类产品单体酚组成差异分析
在所有样品中,共检测出12种单体酚(表2),其中包括7种酚酸(没食子酸、原儿茶酸、绿原酸、龙胆酸、咖啡酸、反式对香豆酸、反式阿魏酸),3种黄烷醇(原花青素B1、原花青素B2、儿茶素)及2种黄酮醇(槲皮素-3-D-β-葡萄糖苷、槲皮素)。L-45%是唯一检测出咖啡酸、反式对香豆酸及槲皮素-3-D-β-葡萄糖苷的样品;而槲皮素只在ZH-30%、ZH-40%、ZH-100%中存在;K-30%单体酚种类及含量均最低。
表2 市售不老莓果汁类产品单体酚含量及组成差异
Table 2 Content and composition differences of mono-phenols in commercial A.melanocarpa juices

单体酚单体酚含量/(μg·mL-1)K-30%ZH-20%ZH-30%ZH-40%ZH-100%L-45%没食子酸0.207±0.093e1.974±0.196d2.657±0.253d3.950±0.198c14.100±0.833b55.184±0.974a原花青素B1508.634±3.957c66.944±9.451f271.414±31.234e348.499±7.243d604.342±37.191b808.288±7.131a原儿茶酸4.209±0.047d8.889±1.903cd7.883±0.600cd11.477±0.050c56.953±6.167a27.160±2.185b绿原酸8.251±0.074f53.368±2.412e75.663±6.991d104.175±6.062c265.561±11.877a172.542±1.082b儿茶素-8.134±1.473d18.304±3.379cd24.388±1.008c174.314±11.786a69.248±2.001b原花青素B210.303±0.614c3.587±0.913d10.304±1.809c13.691±0.711c42.400±5.542a34.194±0.504b龙胆酸--64.244±8.437c89.962±4.602bc260.564±0.682b2 203.674±191.302a咖啡酸-----7.128±0.417a反式对香豆酸-----2.798±0.488a反式阿魏酸--9.984±1.261d14.096±0.226c42.967±1.278a28.841±1.535b槲皮素-3-D-β-葡萄糖苷-----22.411±1.829a槲皮素--6.489±0.445c7.736±0.347b13.500±0.474a-
注:同一列肩标不同小写字母代表差异显著(P≤0.05);-,该物质未检出(下同)
酚酸是不老莓果实及其加工产品中最主要的单体酚类化合物,绿原酸与新绿原酸被认为是不老莓中主要的非类黄酮多酚类化合物[21-22]。ROP等[23]通过对5个不老莓品种Aron、Fertödi、Hugin、Nero和Viking的实验证实了绿原酸和新绿原酸是非常重要的抗氧化剂,果实抗氧化能力与二者均呈线性正相关关系,相关函数分别为y=0.007 5x-0.105 2 (R2=0.788)及y=0.025 8x-1.326 8 (R2=0.940)。在6种被测样品中,ZH-100%绿原酸含量最高,因此其抗氧化能力较强。
3种黄烷醇类化合物在6种被测样品中广泛存在,且含量均较高。原花青素B1、原花青素B2及儿茶素聚合度均小于6,属于低聚原花青素,是不老莓果实及其相关产品中有效的生物活性成分。此外,原花青素聚合程度与其生物利用率关系显著,低聚合度更有利于人体肠道对原花青素的吸收[24]。ZH-100%儿茶素及原花青素B2含量显著高于其他样品,是人体原花青素的优质来源。

a-总酚;b-总黄酮;c-总花色苷;d-缩合单宁
图1 市售不老莓果汁类产品酚类物质含量
Fig.1 Phenolic content of commercial A.melanocarpa juices 注:组间不同小写字母代表差异显著(P≤0.05)(下同)
在不老莓果实中,存在4种不同的黄酮醇化合物,分别是槲皮素-3-半乳糖苷、槲皮素-3-葡萄糖苷、槲皮素-3-芦丁苷和槲皮素-3-洋槐糖苷[25-26]。而在被测的6种样品中,仅在L-45%中检测出含量较高的槲皮素-3-D-β-葡萄糖苷,其他3种黄酮醇并未被检测出。这表明在不老莓果实深加工为果汁的过程中,黄酮醇类化合物损失较大。![]() 等[27]研究发现,巴氏杀菌使樱桃汁中黄酮醇的含量增加了5%,这可以为不老莓果汁加工工艺的完善提供思路。
等[27]研究发现,巴氏杀菌使樱桃汁中黄酮醇的含量增加了5%,这可以为不老莓果汁加工工艺的完善提供思路。
2.3 市售不老莓果汁类产品有机酸组成差异分析
已有研究表明,不老莓属于苹果酸型果实,有机酸类型以苹果酸和柠檬酸为主,其鲜果中苹果酸含量为1.31%,柠檬酸含量为0.21%[28]。此外,不老莓果实中也含有其他种类的有机酸,如奎宁酸、莽草酸等,为其抗氧化活性作出贡献。与鲜果相比,市售不老莓果汁类产品中苹果酸与柠檬酸含量显著降低,这说明将不老莓加工成果汁产品,可以使其酸甜度更协调,改善风味,消费者接受度更高。具有抗氧化活性的奎宁酸与莽草酸同样在果汁产品中被检测到(表3)。
表3 市售不老莓果汁类产品有机酸含量及组成差异
Table 3 Content and composition differences of organic acids in commercial A.melanocarpa juices
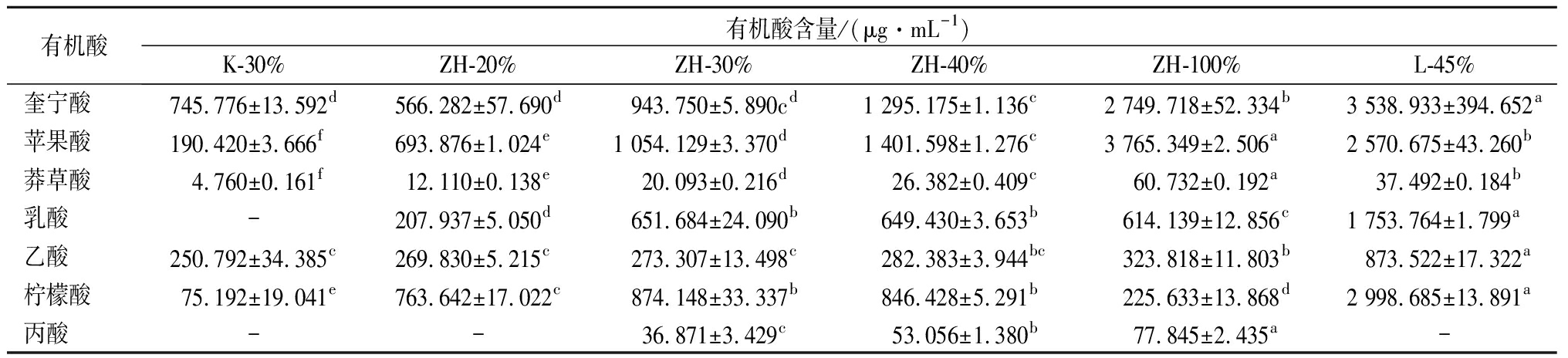
有机酸有机酸含量/(μg·mL-1)K-30%ZH-20%ZH-30%ZH-40%ZH-100%L-45%奎宁酸745.776±13.592d566.282±57.690d943.750±5.890cd1 295.175±1.136c2 749.718±52.334b3 538.933±394.652a苹果酸190.420±3.666f693.876±1.024e1 054.129±3.370d1 401.598±1.276c3 765.349±2.506a2 570.675±43.260b莽草酸4.760±0.161f12.110±0.138e20.093±0.216d26.382±0.409c60.732±0.192a37.492±0.184b乳酸-207.937±5.050d651.684±24.090b649.430±3.653b614.139±12.856c1 753.764±1.799a乙酸250.792±34.385c269.830±5.215c273.307±13.498c282.383±3.944bc323.818±11.803b873.522±17.322a柠檬酸75.192±19.041e763.642±17.022c874.148±33.337b846.428±5.291b225.633±13.868d2 998.685±13.891a丙酸--36.871±3.429c53.056±1.380b77.845±2.435a-
研究发现,柠檬汁与5%(体积分数)的不老莓果汁混合,得到的混合果汁花青素保留率更高,比单纯的柠檬汁或不老莓果汁抗氧化能力更强[29]。ZH-20%、ZH-30%、ZH-40%柠檬酸含量高于同系列100%果汁ZH-100%,表明前者在加工过程中额外添加了柠檬酸,这不仅可以改善果汁风味,还对花青素稳定性具有积极影响。
2.4 市售不老莓果汁类产品抗氧化活性分析
市售不老莓果汁类产品抗氧化能力测定结果如图2所示。L-45%抗氧化能力最强,其次是ZH-100%、ZH-40%、ZH-30%和ZH-20%,K-30%抗氧化能力最弱。ZH-20%、ZH-30%、ZH-40%在低浓度果汁产品中表现出较强的抗氧化能力。L-45%抗氧化活性最强,这是由于其属于复配产品,调配过程中添加了其他水果的浓缩汁。抗氧化活性测定结果表现与酚类物质含量一致,即酚类物质含量越高,抗氧化能力越强。
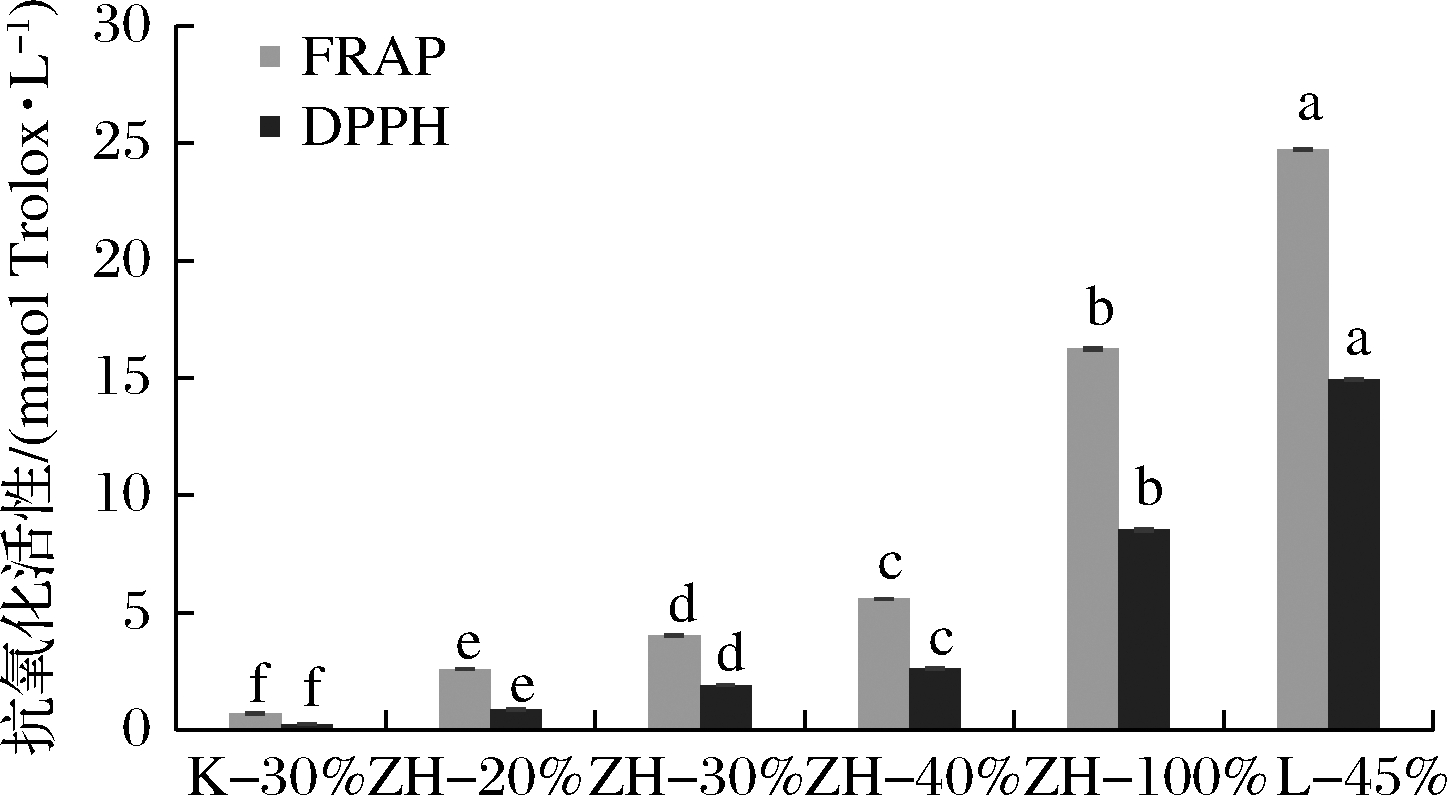
图2 市售不老莓果汁类产品抗氧化活性
Fig.2 Antioxidant capacity of commercial A.melanocarpa juices
褚大可等[30]测定了14种不同类别市售果汁的抗氧化能力,其中葡萄果汁铁离子还原能力最弱,为1 114.31 μmol Trolox/L;柠檬汁抗氧化能力最强,但也仅为3 262.97 μmol Trolox/L。而本实验测定出ZH系列果汁及L-45%的铁离子还原能力高达2.587~24.717 mmol Trolox/L。因此,市售不老莓果汁抗氧化活性远高于其他类型果汁,具有极高的营养价值。
有研究发现,4 kPa真空度下浸渍有利于不老莓抗氧化成分的稳定[31]。这或许可以为不老莓果汁类产品加工工艺的改进提供新思路。
2.5 市售不老莓果汁类产品有机酸及酚类物质含量与抗氧化活性相关性分析
由图3可知,FRAP及DPPH抗氧化活性与酚类物质含量均呈极显著(P≤0.01)正相关关系,包括总酚、总黄酮、总花色苷、缩合单宁以及没食子酸和奎宁酸2种酚酸。这说明在不老莓果汁类产品中,酚类物质是最主要的抗氧化活性来源,没食子酸及奎宁酸是提供生物活性的重要酚酸类化合物。

图3 市售不老莓果汁类产品酚类物质及有机酸含量与抗氧化活性相关热图
Fig.3 Heat map of phenolic compounds and organic acids content and antioxidant activity of commercial A.melanocarpa juices 注:*代表相关性显著,P≤0.05;**代表相关性极显著,P≤0.01
原花青素B2、龙胆酸、咖啡酸、反式对香豆酸、槲皮素-3-D-β-葡萄糖苷及有机酸中的乳酸和乙酸与FRAP、DPPH呈显著(P≤0.05)正相关关系,也为不老莓果汁类产品的营养价值作出贡献。
值得一提的是,乙酸与总酚、总花色苷、缩合单宁均有极显著(P≤0.01)正相关关系,Pearson系数分别为0.928、1.000和0.956。乳酸与总酚、总花色苷呈显著正相关(P≤0.05),Pearson系数分别为0.908、0.913,与缩合单宁呈极显著(P≤0.05)正相关,Pearson系数为0.940。这表明在不老莓果汁加工过程中,以乳酸与乙酸为代表的部分有机酸对酚类物质有一定的保护作用,可以减少其降解。因此,有机酸含量较高的ZH-100%是优良的低浓度不老莓果汁加工原料。
3 结论
本实验研究了K-30%、ZH-20%、ZH-30%、ZH-40%、ZH-100%及L-45%共6种市售不老莓果汁类产品的有机酸类物质、酚类物质含量及抗氧化活性,并进行了相关性分析。结果表明,与不老莓果实相比,深加工为果汁后,6种果汁普遍损失了较多花青素及其糖苷类化合物;ZH-20%、ZH-30%、ZH-40%产品缩合单宁在总酚含量中占比合理,较好地实现了口感与营养价值的平衡。ZH-100%绿原酸及低聚原花青素(儿茶素、原花青素B2)含量显著高于其他样品,具有良好的抗氧化能力,也是人体原花青素的优质来源。总酚、总黄酮、总花色苷、缩合单宁以及没食子酸和奎宁酸与抗氧化能力呈极显著正相关关系,酚类物质是不老莓果汁类产品最主要的抗氧化活性来源,没食子酸及奎宁酸是为其提供生物活性的重要酚酸类化合物。在不老莓果汁加工过程中,柠檬酸对花青素有一定的保护作用,因此,与其他低浓度不老莓果汁相比,额外添加柠檬酸的ZH-20%、ZH-30%、ZH-40%花青素稳定性更强、含量更高。有机酸含量较高的ZH-100%是优良的低浓度不老莓果汁加工原料,本研究通过对市售不老莓果汁类饮料的生物活性物质及抗氧化能力进行分析评价,为此类产品的开发提供了数据基础,也为不老莓果汁加工工艺的完善提供了改进方向。
[1] BALCEREK M,SZOPA J.Ethanol biosynthesis and hydrocyanic acid liberation during fruit mashes fermentation[J].Czech Journal of Food Sciences,2012,30(2):144-152.
[2] 李建勋. 二倍体与四倍体黑果腺肋花楸抗氧化特性比较研究[D].延吉:延边大学,2017.
LI J X.A comparative study of diploid and tetraploid Aronia melanocarpa elliot antioxidant properties[D].Yanji:Yanbian University,2017.
[3] 胡文泽, 李淼,郭东旭,等.黑果腺肋花楸研究进展[J].食品与发酵工业,2020,46(23):316-322.
HU W Z,LI M,GUO D X,et al.Research progress on Aronia melanocarpa[J].Food and Fermentation Industries,2020,46(23):316-322.
[4] 国家卫生健康委员会.关于黑果腺肋花楸果等2种新食品原料的公告2018年第10号[J].中国食品卫生杂志,2018,30(6):638.
National Health Commission of the People’s Republic of China.Announcement No.10 of 2018 on 2 new food ingredients such as Aronia melanocarpa[J].Chinese Journal of Food Hygiene,2018,30(6):638.
[5] DENEV ![]() M,KRATCHANOVA M,et al.Black chokeberry (Aronia melanocarpa) polyphenols reveal different antioxidant,antimicrobial and neutrophil-modulating activities[J].Food Chemistry,2019,284:108-117.
M,KRATCHANOVA M,et al.Black chokeberry (Aronia melanocarpa) polyphenols reveal different antioxidant,antimicrobial and neutrophil-modulating activities[J].Food Chemistry,2019,284:108-117.
[6] SIDOR ![]() A,GRAMZA-MICHA
A,GRAMZA-MICHA OWSKA A.Black chokeberry (Aronia melanocarpa) and its products as potential health-promoting factors-An overview[J].Trends in Food Science & Technology,2019,89:45-60.
OWSKA A.Black chokeberry (Aronia melanocarpa) and its products as potential health-promoting factors-An overview[J].Trends in Food Science & Technology,2019,89:45-60.
[7] JURIKOVA T,MLCEK J,SKROVANKOVA S,et al.Fruits of black chokeberry Aronia melanocarpa in the prevention of chronic diseases[J].Molecules,2017,22(6):E944.
[8] CHOI H S,KIM J H,KIM S L,et al.Catechol derived from Aronia juice through lactic acid bacteria fermentation inhibits breast cancer stem cell formation via modulation Stat3/IL-6 signaling pathway[J].Molecular Carcinogenesis,2018,57(11):1 467-1 479.
[9] 魏鑫, 杨玉春,张素敏,等.辽阳地区黑果腺肋花楸优质高效栽培技术[J].北方果树,2021(1):23-25;33.
WEI X,YANG Y C,ZHANG S M,et al.High quality and high efficiency cultivation technique of Sorbus nobilis in Liaoyang area[J].Northern Fruits,2021(1):23-25;33.
[10] 徐杰, 李新光,王建中,等.黑果腺肋花楸果汁的酶解制备工艺优化及其功能性质[J].食品工业科技,2020,41(1):125-131;137.
XU J,LI X G,WANG J Z,et al.Optimization of enzymatic hydrolysis for production of Aronia melanocarpa juice and its functional properties[J].Science and Technology of Food Industry,2020,41(1):125-131;137.
[11] LI Z X,TENG J,LYU Y L,et al.Enhanced antioxidant activity for apple juice fermented with Lactobacillus plantarum ATCC14917[J].Molecules,2019,24(1):E51.
[12] PRAKASH MARAN J,MANIKANDAN S,VIGNA NIVETHA C,et al.Ultrasound assisted extraction of bioactive compounds from Nephelium lappaceum L.fruit peel using central composite face centered response surface design[J].Arabian Journal of Chemistry,2017,10(1):S1 145-S1 157.
[13] 刘树勋, 杨航宇,王绍阳,等.野生蓝莓酒皮渣花色苷及其抗氧化活性研究[J].中国酿造,2016,35(2):115-118.
LIU S X,YANG H Y,WANG S Y,et al.Anthocyanins of wild blueberry wine pomace and its antioxidant activity[J].China Brewing,2016,35(2):115-118.
[14] 王储炎, 张继刚,杨柳青,等.3种乳酸菌发酵对蓝莓多酚、原花青素含量及抗氧化活性的影响[J].食品科学,2020,41(24):87-94.
WANG C Y,ZHANG J G,YANG L Q,et al.Comparative effects of fermentation with three species of lactic acid bacteria on polyphenol and proanthocyanidin contents and antioxidant activity of blueberry fruit[J].Food Science,2020,41(24):87-94.
[15] BENZIE I F F,STRAIN J J.The ferric reducing ability of plasma (FRAP) as a measure of “antioxidant power”:The FRAP assay[J].Analytical Biochemistry,1996,239(1):70-76.
[16] BRAND-WILLIAMS W,CUVELIER M E,BERSET C.Use of a free radical method to evaluate antioxidant activity[J].LWT-Food Science and Technology,1995,28(1):25-30.
[17] 王鹏. 国外黑果腺肋花楸多酚类物质功能性研究进展[J].林业科技,2014,39(4):67-70.
WANG P.Research progress about function of Aronia melanocarpa in foreign country[J].Forest Science and Technology,2014,39(4):67-70.
[18] 王柳, 许一鸣,牟贺,等.黑果腺肋花楸功效及药用食用研究进展[J].现代食品,2018(7):53-56.
WANG L,XU Y M,MOU H,et al.Research progress on the efficacy and medicinal edibility of Aronia melanocarpa Elliot[J].Modern Food,2018(7):53-56.
[19] WILKES K,HOWARD L R,BROWNMILLER C,et al.Changes in chokeberry (Aronia melanocarpa L.) polyphenols during juice processing and storage[J].Journal of Agricultural and Food Chemistry,2014,62(18):4 018-4 025.
[20] HOWARD L R,BROWNMILLER C,PRIOR R L,et al.Improved stability of chokeberry juice anthocyanins by β-cyclodextrin addition and refrigeration[J].Journal of Agricultural and Food Chemistry,2013,61(3):693-699.
[21] HIRTH M,PREIß R,MAYER-MIEBACH E,et al.Influence of HTST extrusion cooking process parameters on the stability of anthocyanins,procyanidins and hydroxycinnamic acids as the main bioactive chokeberry polyphenols[J].LWT-Food Science and Technology,2015,62(1):511-516.
[22] SZOPA A,KOKOTKIEWICZ A,KUBICA P,et al.Comparative analysis of different groups of phenolic compounds in fruit and leaf extracts of Aronia sp.:A.melanocarpa,A.arbutifolia,and A.prunifolia and their antioxidant activities[J].European Food Research & Technology,2017,243(9):1 645-1 657.
[23] ROP O,MLCEK J,JURIKOVA T,et al.Phenolic content,antioxidant capacity,radical oxygen species scavenging and lipid peroxidation inhibiting activities of extracts of five black chokeberry (Aronia melanocarpa (Michx.) Elliot) cultivars[J].Journal of Medicinal Plant Research,2010,4(22):2 431-2 437.
[24] TAO W Y,ZHANG Y,SHEN X M,et al.Rethinking the mechanism of the health benefits of proanthocyanidins:Absorption,metabolism,and interaction with gut microbiota[J].Comprehensive Reviews in Food Science and Food Safety,2019,18(4):971-985.
[25] EFENBERGER-SZMECHTYK M,NOWAK ![]() A,et al.Composition and antibacterial activity of Aronia melanocarpa (Michx.) Elliot,Cornus mas L.and Chaenomeles superba Lindl.leaf extracts[J].Molecules,2020,25(9):2 011.
A,et al.Composition and antibacterial activity of Aronia melanocarpa (Michx.) Elliot,Cornus mas L.and Chaenomeles superba Lindl.leaf extracts[J].Molecules,2020,25(9):2 011.
[26] SIDOR A,GRAMZA-MICHA OWSKA A.Black Chokeberry Aronia melanocarpa L.-A qualitative composition,phenolic profile and antioxidant potential[J].Molecules,2019,24(20):3 710.
OWSKA A.Black Chokeberry Aronia melanocarpa L.-A qualitative composition,phenolic profile and antioxidant potential[J].Molecules,2019,24(20):3 710.
[27] ![]()
![]() J,PUTNIK P,et al.Stability of polyphenols in chokeberry juice treated with gas phase plasma[J].Food Chemistry,2016,212:323-331.
J,PUTNIK P,et al.Stability of polyphenols in chokeberry juice treated with gas phase plasma[J].Food Chemistry,2016,212:323-331.
[28] 王莹, 柳青,陈月,等.黑果腺肋花楸活性成分及研究开发进展[J].食品工业,2020,41(6):249-253.
WANG Y,LIU Q,CHEN Y,et al.Research development and active ingredients in Aronia melanocarpa[J].The Food Industry,2020,41(6):249-253.
[29] GIRONÉS-VILAPLANA A,VALENT O P,ANDRADE P B,et al.Phytochemical profile of a blend of black chokeberry and lemon juice with cholinesterase inhibitory effect and antioxidant potential[J].Food Chemistry,2012,134(4):2 090-2 096.
O P,ANDRADE P B,et al.Phytochemical profile of a blend of black chokeberry and lemon juice with cholinesterase inhibitory effect and antioxidant potential[J].Food Chemistry,2012,134(4):2 090-2 096.
[30] 储大可, 黄莹偲,陈冠林,等.14种市售果汁抗氧化活性的比较研究[J].食品工业,2013,34(10):178-181.
CHU D K,HUANG Y S,CHEN G L,et al.Comparison of antioxidant activities of 14 kinds of commercial juices[J].The Food Industry,2013,34(10):178-181.
![]() B,et al.Effect of vacuum impregnation with apple-pear juice on content of bioactive compounds and antioxidant activity of dried chokeberry fruit[J].Foods,2020,9(1):108.
B,et al.Effect of vacuum impregnation with apple-pear juice on content of bioactive compounds and antioxidant activity of dried chokeberry fruit[J].Foods,2020,9(1):108.