浓香型白酒酿造过程中微生物的来源十分广泛,如窖泥、曲药和酿造区域空气中的微生物[1],研究表明酿造周围环境微生物对传统白酒酿造真菌的贡献率可达20%~39%[2-3]。酵母菌是浓香型白酒中产生乙醇和其他香气成分的功能微生物,曲药自身的酵母菌和窖房环境中弥漫的酵母菌是糟醅发酵过程中的主要菌源,然而环境空气中酵母菌的类别和量比关系与当地的自然环境条件息息相关,因此,有必要对酿酒周围环境中的酵母菌进行系统研究。
目前,白酒酿造领域对酵母菌的研究主要集中在对曲药、糟醅和窖泥中酵母菌群落结构的分析以及可培养酵母分离筛选,以及发酵特性方面的研究[4-7],部分涉及已分离酵母菌的风味[8-12]。杨建刚等[13]从泸州老窖酒不同发酵阶段酒醅中共分离到130株酵母菌,其中126株被鉴定为15个不同的种,并讨论了酵母种对部分风味特征形成的影响;明红梅等[14]从不同发酵时期的浓香型大曲中分离到6株酵母,并检测其中1株异常威克汉姆酵母发酵液中的挥发性成分,发现对浓香型大曲贡献的关键香味成分为愈创木酚、苯乙醇、吡嗪类等;杜刚等[15]从酒曲中分离纯化出10株酵母菌用于果酒发酵;谭壹等[16]利用7种不同的培养基从五粮液发酵中期糟醅获得57株酵母菌,经鉴定分别属于Saccharomyces cerevisiae、Pichia kudriavzevii、Candida rugosa和Candida glabrata 这4个不同的种;窦晓等[17]在不同发酵时期的大曲中分离得到260株酵母菌,结果鉴定为22个种,主要为Pichia caribbica,W.anomalus,S.fibuligera,C.orthopsilosis,Meyerozyma guilliermondii,S.cerevisiae,Cryptococcus neoformans var.grubii,Clavispora lusitaniae等。但是涉及浓香型白酒酿造周围环境空气中酵母菌种类及其风味物质的研究鲜有报道。
本研究通过传统培养方法对五粮液车间空气中酵母菌进行分离、纯化,对筛选到的酵母进行鉴定,研究其生物学特性和风味物质组成,为浓香型白酒酵母菌种资源的完善提供有力的菌种资源和数据支撑,为其在浓香型白酒生产中的应用提供理论基础。
1 材料与方法
1.1 材料
1.1.1 菌株
所有酵母菌株均由宜宾五粮液股份有限公司技术研究中心实验室保藏,分离自五粮液酿造环境中。
1.1.2 培养基
分离筛选:YEPD琼脂培养基中加入0.2%的脱氧胆酸钠和0.2%的氯霉素。
发酵:麦芽汁培养基,青岛海博生物技术有限公司。
1.2 试剂和仪器
YEPD琼脂培养基、麦芽汁培养基,青岛海博生物技术有限公司;脱氧胆酸钠,北京奥博星生物技术有限责任公司;氯霉素,广州赛国生物科技有限公司;Ezup柱式真菌基因组DNA抽提试剂盒,生工生物工程(上海)股份有限公司;API 20 ACUX鉴定试剂盒,生物梅里埃公司;FKC-1型浮游菌采样器,浙江苏净净化设备有限公司;离心机,Eppendorf公司;显微镜,日本Olympus公司;生化培养箱,上海一恒科技仪器有限公司;乙醇(HPLC,纯度为99.8%),美国Honeywell公司;4-辛醇(GC纯),美国Sigma-Aldrich公司。
毛细管色谱柱TG-WAX(30.0 m×0.25 mm,0.25 μm),美国Thermo公司;固相微萃取手柄和50 μm CAR/DVB/PDMS纤维萃取头,美国Supelco公司;气质联用仪(GC-MS)和液相色谱仪,美国Agilent公司;PAL RTC2多功能样品前处理平台(带有SPME模块),瑞士CTC公司。
1.3 实验方法
1.3.1 样品的采集
在五粮液酿酒车间和制曲车间外围环境采集空气样品,采用FKC-1型浮游菌采样器,距离地面80 cm,将直径为9 cm的麦芽汁琼脂平板置于采样器内,每次采样设置3个平行,空气流量为100 L/min,采样时间为1 min。
1.3.2 菌株的分离
将采集样品后的平板倒置于28 ℃培养箱中培养2~3 d,待菌落长出后,挑选菌落形态不同的疑似酵母单菌落于YEPD琼脂培养基中,编号并划线纯化,重复纯化2~3次,直至平板上的菌落都为同一形态,利用传代培养法,在4 ℃下进行斜面保存并编号。
1.3.3 菌株的鉴定
1.3.3.1 菌株形态学鉴定
参照《酵母菌的特征与鉴定手册》进行[18]。
菌落形态观察:将纯化后的菌株接种于YEPD平板,置于28 ℃培养2~3 d,观察单菌落,并记录菌落的大小、形状、颜色、透明度、质地、边缘、湿润程度等菌落特征。
显微镜观察细胞形态:挑取单菌落于5 mL麦芽汁液体培养基中,于28 ℃、120 r/min振荡培养24 h,显微镜下观察细胞的微观特征。
1.3.3.2 菌株生理生化鉴定
按照梅里埃酵母菌生理生化鉴定试剂盒说明(API 20A CUX)测定菌株的生理生化特征。假菌丝观察:将酵母接种于玉米粉琼脂培养基上,28 ℃培养3 d,观察酵母是否含有假菌丝。
1.3.3.3 菌株分子鉴定
基因组DNA提取:将活化的菌株接入50 mL麦芽汁培养基中,160 r/min、28 ℃摇瓶培养24 h后,室温下12 000 r/min离心5 min获得菌体,用Ezup柱式真菌基因组DNA抽提试剂盒提取菌株的基因组DNA。
PCR扩增:采用酵母菌通用引物为NL1(5′-GCATATCAA TAAGCGGAGGAAAAG-3′)和NL4(5′-GGTCCGTGTTTCAAGACGG-3′),PCR反应体系包括(μL):基因组DNA 0.5、10×Buffer(含Mg2+)2.5、dNTP 1、聚合酶0.2、引物0.5、模板0.5,加双蒸水至25;PCR循环条件为94 ℃ 4 min预变性、94 ℃ 45 s变性、55 ℃ 45 s退火、72 ℃ 1 min延伸、循环30次,72 ℃ 10 min修复延伸,4 ℃终止反应。经PCR反应扩增出26S rDNA产物,用PCR及酶反应产物纯化试剂盒将PCR产物进行纯化,将纯化产物送至上海生工生物工程股份有限公司完成测序。
1.3.4 酵母菌的系统发育分析
参考文献[19]所述方法将菌株26S rDNA D1/D2序列提交NCBI数据库进行同源性比对,选取相似度较高的模式菌株的26S rDNA D1/D2区域序列作为参比对象;利用MEGA 5.0软件进行多序列比对、Kimura-2模型计算进化距离、最后采用邻接法(neighbor-joining)绘制系统发育树,其中进化树拓扑分析为1 000次。
1.3.5 挥发性风味成分的测定
使用HS-SPME-GC-MS检测菌株发酵体系中挥发性风味成分[19]。吸取2 mL发酵液于20 mL顶空样品瓶中,加入内标(4-辛醇,终质量浓度0.5 mg/L),60 ℃平衡15 min,插入萃取头吸附45 min后,插入GC进样口热解析3 min。
色谱和质谱条件:进样口温度为230 ℃,载气(He)流速为1 mL/min,采用不分流模式进样;气相色谱升温程序:起始温度40 ℃,保持5 min,以4 ℃/min升至230 ℃,保持15 min。质谱EI源,电子轰击能量70 eV;离子源温度200 ℃,四级杆温度150 ℃,质数扫描范围35~350 amu。
1.4 数据分析
使用R语言软件[20]进行挥发性风味物质热图的绘制。
2 结果与分析
2.1 菌株的分离
从五粮液酿酒车间和制曲车间外围环境采集空气样品,从中共分离到酵母菌株73株,分属于11个属,14个种(表1)。
表1 酵母菌的分离结果
Table 1 Yeasts isolated from workshop

所属属种菌株数/株代表菌株所属属种菌株数/株代表菌株Wickerhamiella pararugosa3Y1Naumovozyma castellii2Y8Pichia kudriavzevii17Y2Meyerozyma caribbica6Y9Pichia exigua4Y3Debaryomyces hansenii15Y10Candida ethanolica1Y4Zygosaccharomyces bailii1Y11Kazachstania bulderi1Y5Clavispora lusitaniae2Y12Saccharomyces unisporus1Y6Debaryomyces subglobosus3Y13Saccharomyces cerevisiae9Y7Saccharomycopsis fibuligera8Y14
2.2 菌株的鉴定
2.2.1 形态特征
14株不同种酵母菌菌落和显微镜形态结构如图1所示:此14株菌菌落均为不透明,其中Y1、Y2、Y5、Y7、Y8和Y9的菌落形态相似,均为表面光滑湿润,边缘整齐无扩散,易挑取,区别在于菌落颜色有一定差异;Y4和Y6的菌落形态相似,都是表面干燥不光滑,边缘不整齐无扩散,易挑取;而Y3则为乳白色,表面干燥不光滑,菌落分2圈,里圈光滑,外圈有颗粒状,边缘整齐扩散,易挑取。

图1 代表性酵母菌的菌落和微观结构
Fig.1 The colony morphologies and micromorphologies of representative yeasts 注:A~N分别为Y1、Y2、Y3、Y4、Y5、Y6、Y7、Y8、Y9、Y10、 Y11、Y12、Y13、Y14的菌落形态;a~n为Y1、Y2、Y3、Y4、 Y5、Y6、Y7、Y8、Y9、Y10、Y11、Y12、Y13、Y14的显微形态
微观形态方面,此14株菌细胞大都为椭圆形(Y7为圆形),多核(Y9单核),单生,芽殖,但细胞大小不一。其中Y4藕节状,裂殖或芽殖,Y6为藕节状,无核。
2.2.2 生理生化特征
利用API 20A CUX生理生化鉴定试剂盒测定菌株的生理生化特征(表2),不同种的酵母菌株在碳氮源的利用上不完全相同。Y1、Y2、Y3、Y4、Y7、Y8、Y10、Y13等8株菌在碳氮源利用方面符合酵母菌的特征与鉴定手册[18]。
表2 代表性酵母菌的生理生化特征
Table 2 Physiological and biochemical tests of representative yeasts
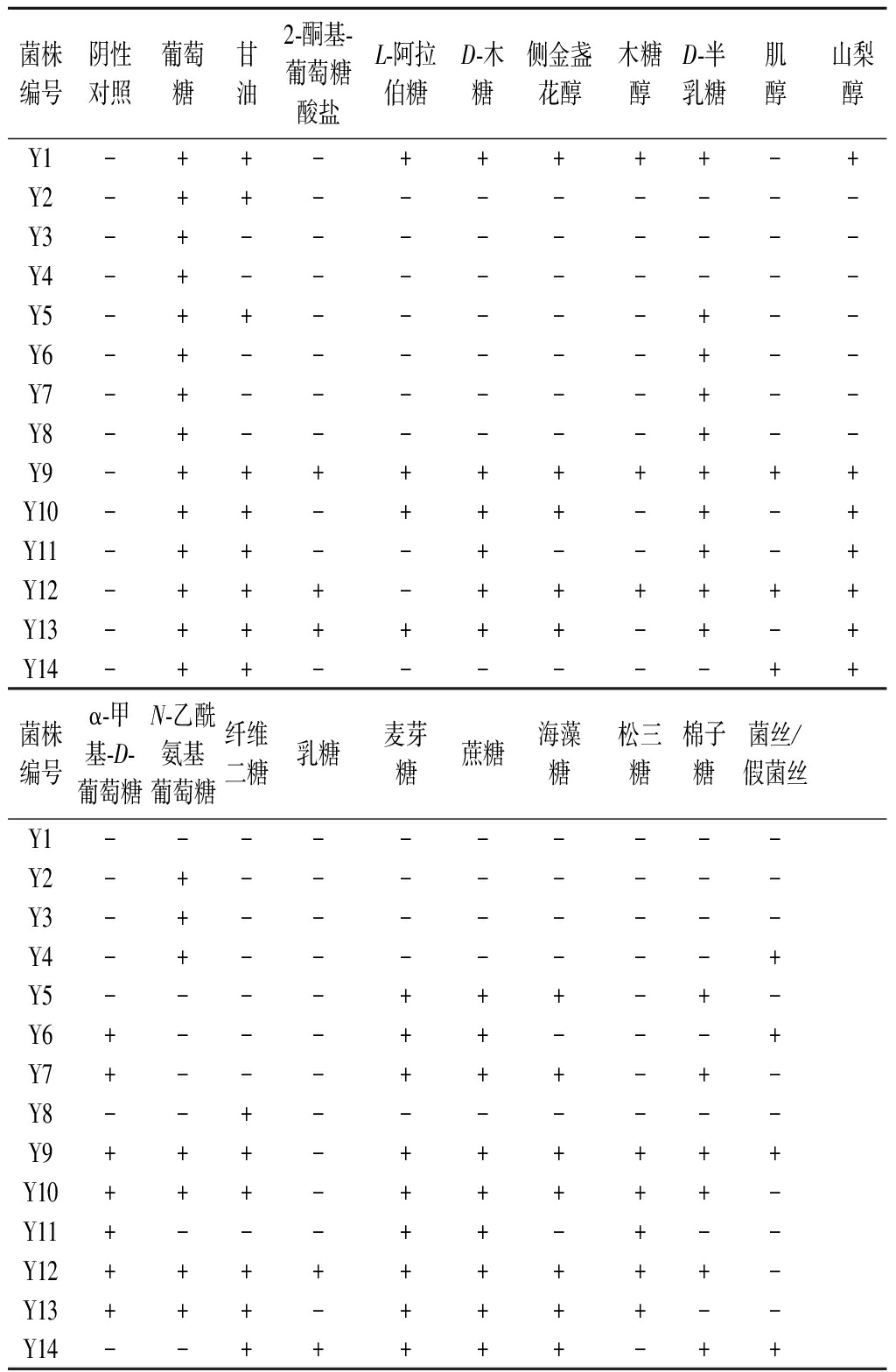
菌株编号阴性对照葡萄糖甘油2-酮基-葡萄糖酸盐L-阿拉伯糖D-木糖侧金盏花醇木糖醇D-半乳糖肌醇山梨醇Y1-++-+++++-+Y2-++--------Y3-+---------Y4-+---------Y5-++-----+--Y6-+------+--Y7-+------+--Y8-+------+--Y9-++++++++++Y10-++-+++-+-+Y11-++--+--+-+Y12-+++-++++++Y13-++++++-+-+Y14-++------++菌株编号α-甲基-D-葡萄糖N-乙酰氨基葡萄糖纤维二糖乳糖麦芽糖蔗糖海藻糖松三糖棉子糖菌丝/假菌丝Y1----------Y2-+--------Y3-+--------Y4-+-------+Y5----+++-+-Y6+---++---+Y7+---+++-+-Y8--+-------Y9+++-++++++Y10+++-+++++-Y11+---++-+--Y12+++++++++-Y13+++-++++--Y14--+++++-++
注:+:为阳性;-:为阴性
所有的酵母菌均能利用葡萄糖(表2),淀粉是浓香型白酒糟醅中主要的碳源物质,由此可见本研究中从车间空气中筛选的酵母菌株均具备代谢葡萄糖的能力。另外,Y6的碳源利用结果和酵母菌的特征与鉴定手册中相差较大,Y6可额外利用半乳糖、蔗糖、麦芽糖和α-甲基-D-葡萄糖苷,Y11可额外利用麦芽糖、松三糖、木糖和α-甲基-D-葡萄糖苷,具体原因仍需进一步探讨。假菌丝方面,Y4、Y6、Y9和Y14有假菌丝出现,其他10株菌都没有发现假菌丝。
2.3 系统发育分析
核糖体DNA中的26S rDNA D1/D2区具有较高的突变率,可作为亲缘关系较近的菌株之间的分类研究[21]。此14株不同种的酵母菌株的26S rDNA D1/D2序列和用BLAST检索到的与之有高度同源性菌株的26S rDNA D1/D2序列通过MEGA5.0软件进行比对和构建N-J系统发育树(图2),可通过系统发育树的建立对此14株不同种的酵母菌种间亲缘关系进行了直观界定。
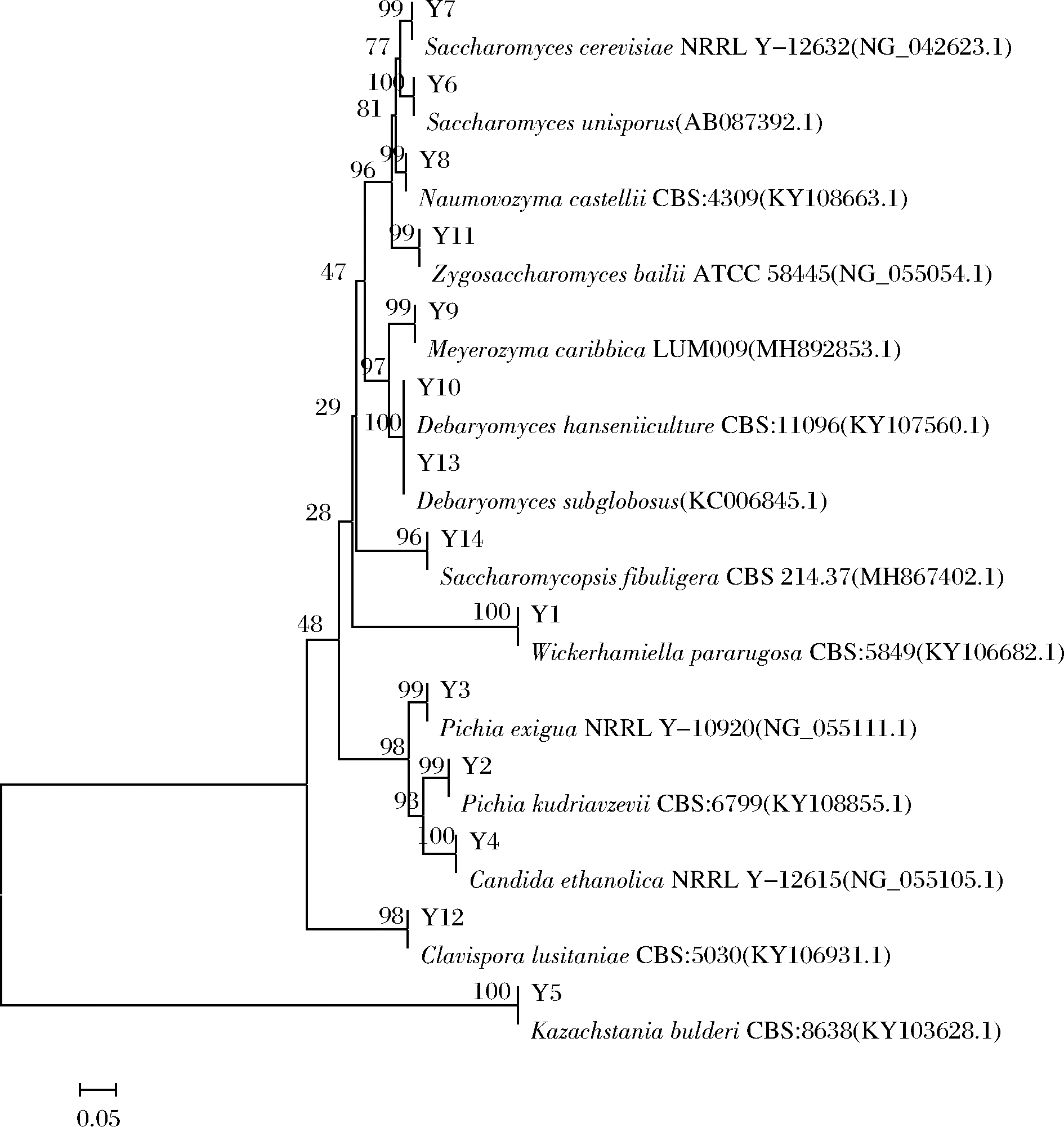
图2 代表性菌株系统发育树
Fig.2 Phylogenetic tree of representative strains 注:采用邻接法对丰度大于1%的菌株序列构建系统发育树;分支点 的数字为分子的Bootstrap值,标尺表示核酸距离,分支长度为相似度
由图2可知,Y1和Wickerhamiella pararugosa聚为一支、Y2和Pichia kudriavzevii聚为一支、Y3和Pichia exigua聚为一支、Y4和Candida ethanolica聚为一支、Y5和Kazachstania bulderi聚为一支、Y6和Saccharomyces unisporus聚为一支、Y7和Saccharomyces cerevisiae聚为一支、Y8和Naumovozyma castellii聚为一支、Y9和Meyerozyma caribbica聚为一支、Y10和Debaryomyces hansenii聚为一支、Y11和Zygosaccharomyces bailii聚为一支、Y12和Clavispora lusitaniae聚为一支、Y13和Debaryomyces subglobosus聚为一支、Y14和Saccharomycopsis fibuligera聚为一支。由系统发育树可以直观地看出该14株酵母菌都已经鉴定到种。
2.4 菌株发酵挥发性风味物质
酵母在发酵过程中能产生一些次级代谢产物或代谢产物,如高级醇类、酸类、酯类、萜烯类、酚类、吡嗪类等,这些物质对白酒的风味具有重要的贡献。因此,使用HS-SPME/GC-MS测定此14株不同种酵母菌发酵液中的挥发性风味物质。
2.4.1 风味物质总含量
五粮液酿造环境中产酒酵母相对丰富一些,醇类物质主要在酵母繁殖过程中形成,产酒酵母合成高级醇的能力比较强,而酸和醇发生酯化反应又会产生酯类物质,酯类是芳香化合物,在浓香型白酒中起着重要作用,是形成酒体香气浓郁的主要因素。如图3所示,酵母菌发酵液风味物质中,总酯和总醇含量相对较高。其中,Y1、Y2、Y5酯类总含量比较高,含量都在60 mg/L以上,Y1最高达到95 mg/L;Y1、Y5、Y7、Y8、Y10醇类总含量比较高,都在60 mg/L以上,Y7(S.cerevisiae)则高达115 mg/L。
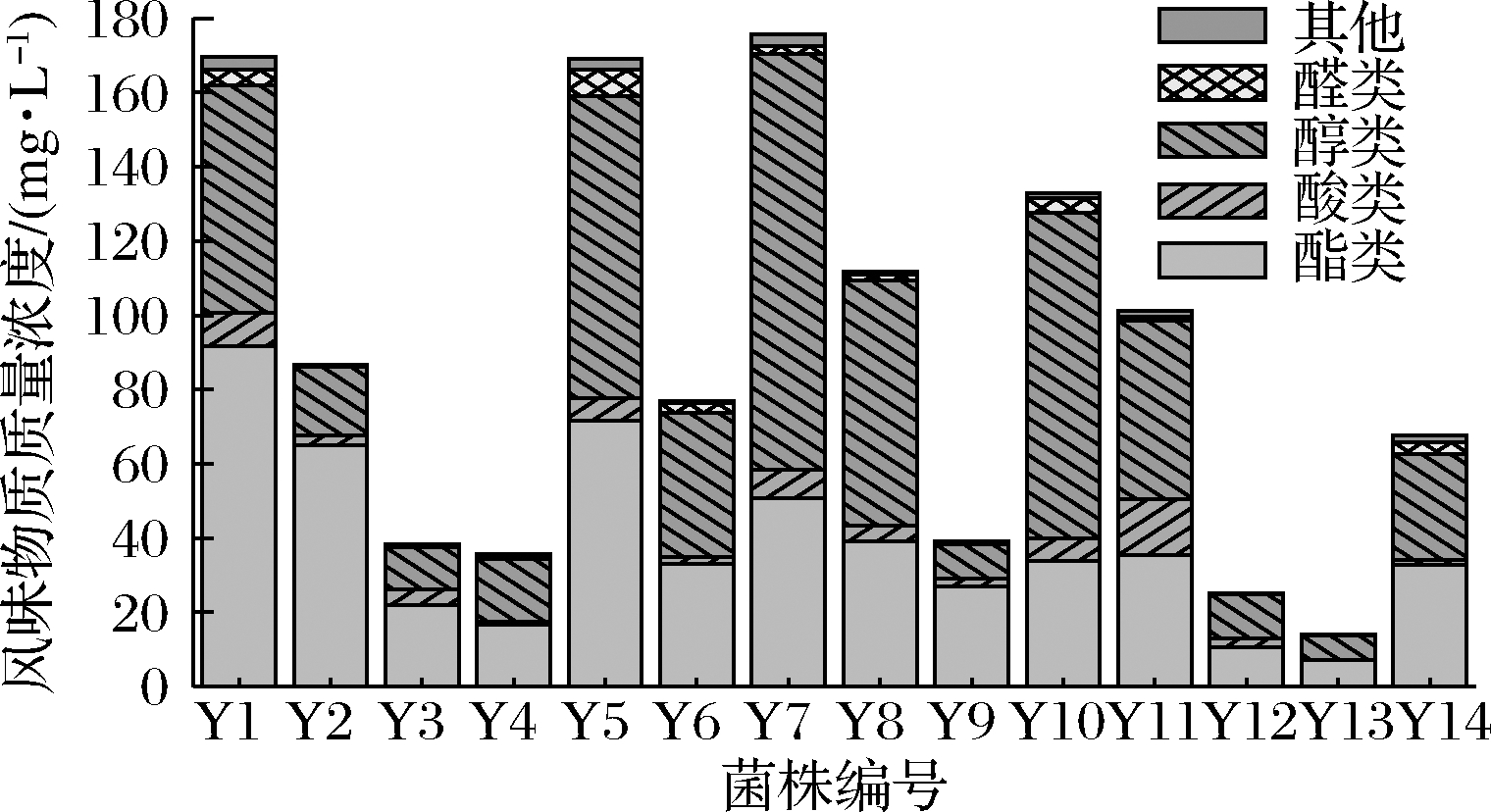
图3 酵母菌风味物质总含量
Fig.3 Total content of flavor compounds in yeasts
酸类影响白酒的口感和后味,是影响白酒口味的主要因素,酵母菌发酵液中酸类成分总含量相对较低,可能是因为酵母本身产酸能力较弱,加上酸和醇又发生酯化反应生成了酯类物质,使得发酵液中总酸含量偏低,总含量最高的是Y11(15.12 mg/L),其次是Y1(8.9 mg/L);发酵液中醛酮类含量极低,Y5醛类总含量最高,仅7 mg/L。
2.4.2 风味物质
白酒中酯的形成主要是由微生物细胞中所含酯酶的催化作用而产生的,酵母对乙酯的合成能力最强[10]。如图4-a所示,发酵液中酯类物质主要是乙酯,己酸乙酯是浓香型白酒的主体香成分,王涛等[22]发现浓香型白酒酿造环境中存在大量能够促进糟醅产已酸乙酯的酵母,本文中W.pararugosa(Y1)、K.bulderi(Y5)和Z.bailii(Y11)都可产生己酸乙酯,对于此3株菌能否促进糟醅产生更多的己酸乙酯还需进一步研究;发酵液中检测出的乙酸乙酯含量也比较高,Y1、Y2、Y5中乙酸乙酯含量相对较高,Y1最高达到了70 mg/L。醇类除乙醇外,含量比较高的有苯乙醇、异戊醇和异丁醇,对形成酒的风味和促使酒体丰满、浓厚起着重要的作用,Y7和Y10主要产苯乙醇,还有一定量的异戊醇。Y2、Y5、Y11棕榈酸乙酯含量较高,高沸点酯在白酒中有一定的含量范围时能够稳定酒体的香气。酸类主要是己酸、乙酸和乳酸等有机酸类,影响白酒的口感和后味,其中Y1发酵液己酸含量较高,Y11发酵液乙酸含量较高,乳酸不具挥发性,故未检出;醛类物质中含量相对较高的是苯甲醛和苯乙醛,但相比其他主体风味物质这2种醛类在发酵液中含量均比较低。

图4 酵母菌风味物质含量
Fig.4 Content of flavor compounds in yeasts
此14株酵母菌能产生多种风味物质,除正常主体风味外,还会产生其他多种微量成分,多以水果香味为主。如图4-b所示,发酵液中微量风味物质主要有庚酸乙酯、辛酸乙酯、丁酸丁酯、十二酸乙酯、戊酸乙酯、壬酸乙酯、十四酸乙酯、苯酚、乙偶姻和吡嗪类等。Y1、Y5、Y7、Y8、Y10、Y11、Y14发酵液微量风味物质非常丰富;SUSANNE[23]分离的1株C.pararugosa在15 ℃下温育的葡萄酒中存在较低浓度的挥发性酚,其他有关W.pararugosa产酚类物质的报道几乎没有,对S.cerevisiae的报道以产醇酯类物质居多[24],而本文中W.pararugosa(Y1)和S.cerevisiae(Y7)发酵液中除了有酯类和醇类物质外,苯酚含量较高,分别为2 260和2 427 μg/L,酚类化合物是白酒中重要的呈香呈味物质和有益成分[25],因此有必要对这2株菌所产风味物质进行深入研究。乙偶姻是传统发酵食品中重要香气成分四甲基吡嗪生物合成的前体物质,是多种微生物糖代谢的中间产物[26-27],具有特殊奶油香气,是白酒微量风味的重要组成成分。K.bulderi(Y5)发酵液中风味物质较丰富,除主体风味醇酯外,还检测出了乙偶姻,达到1 568 μg/L。Y3和Y12发酵液中风味成分基本一致,都检测出较高的异戊酸,异戊酸是生成异戊酯类的前体物质,参与白酒的风味组成;吡嗪具有明显的焦香或烤坚果香味,是白酒中含氮微量成分,同时也是白酒香气成分的重要组成物质[28]。本研究中检测到的吡嗪类物质有6种,分别是:2,5-二甲基吡嗪、2,6-二甲基吡嗪、甲基吡嗪、三甲基吡嗪、2-乙基-6-甲基吡嗪和2-乙基-3,5-二甲基吡嗪,除菌株Y4,其他13株酵母菌发酵液中都检测出此6种吡嗪类物质,且Y1这6种物质含量较高。
综上可见,酵母菌产生的风味物质差异较大,可能是由于这些酵母菌之间生理生化差异明显,因而导致最终产物不同,其中Y1、Y5、Y7和Y11这4株菌产风味物质较丰富且含量较高,表明这4株酵母菌在浓香型白酒中具有更好的应用潜力,可以作为后续重点研究菌株。
3 结论
本研究利用传统培养法从五粮液酿造车间空气中分离筛选出73株酵母菌,它们分属于11个属14个种,其中,毕赤酵母属Pichia最多,其次是德巴利酵母属Debaryomyces,酿酒酵母属Saccharomyces和复膜孢酵母属Saccharomycopsis,表明白酒酿造糟醅和车间空气中的酵母菌种属的关联度较大。进一步利用HS-SPME/GC-MS分析了酵母菌在麦芽汁培养基中的风味成分,结果表明酵母菌除了主要的乙酸乙酯、异戊醇、苯乙醇等常见风味物质外,还会产生其他多种风味成分,如W.pararugosa、P.kudriavzevii和K.bulderi可产生乙酸乙酯,W.pararugosa、K.bulderi和Z.bailii可产生己酸乙酯,W.pararugosa和S.cerevisiae能产生苯酚,P.exigua和C.lusitaniae能产生异戊酸等。本研究中的酵母菌虽然代谢的风味物质含量较低,但种类丰富,在发酵过程中对白酒风味的贡献度以及代谢调控高产风味物质性能优化等还需进一步深入研究。
[1] 彭俊, 杨团元,刘蒲临,等.白酒酿造酒醅与周边土壤中酵母菌多样性及东方伊萨酵母发酵特性比较[J].中国酿造,2019,38(8):77-84.
PENG J,YANG T Y,LIU P L,et al.Comparison of diversity of yeast and fermentation characteristic of Issatchenkia orientalis from fermented grains and surrounding soil of Baijiu production[J].China Brewing,2019,38(8):77-84.
[2] 杨宽, 毛如志,赵悦,等.云南香格里拉葡萄酒产区酿酒相关酵母菌的生物多样性[J].微生物学通报,2018,45(12):2 708-2 721.
YANG K,MAO R Z,ZHAO Y,et al.Biodiversity of wine-related yeasts isolated from Shangri-La wine-producing region of Yunnan[J].Microbiology China,2018,45(12):2 708-2 721.
[3] WANG X S,DU H,ZHANG Y,et al.Environmental microbiota drives microbial succession and metabolic profiles during Chinese liquor fermentation[J].Applied and Environmental Microbiology,2018,84(4).DOI:10.1128/AEM.02 369-17.
[4] 罗方雯, 黄永光,涂华彬.茅台镇酱香白酒不同酿造区域可培养酵母种群结构多样性分析[J].食品科学,2020,41(12):143-149.
LUO F W,HUANG Y G,TU H B.Structure and diversity of culturable yeast populations in different Maotai-flavor liquor brewing regions of Maotai town,Guizhou province[J].Food Science,2020,41(12):143-149.
[5] 孙晓璐, 张新红,王明跃,等.皖北地区白酒大曲中酵母菌的筛选与鉴定[J].食品工业科技,2015,36(24):194-197.
SUN X L,ZHANG X H,WANG M Y,et al.Selection and identification of yeast strains in Daqu liquor in the north of Anhui province[J].Science and Technology of Food Industry,2015,36(24):194-197.
[6] 赵群丽. 酱香大曲中酿酒微生物的筛选及发酵工艺研究[D].贵阳:贵州大学,2016.
ZHAO Q L.Screening of brewing microorganisms from Maotai-flavor Daqu and studying on fermentation conditions[D].Guiyang:Guizhou University,2016.
[7] 王晓丹, 陈美竹,班世栋,等.茅台大曲中酵母的分离、鉴定及其功能初探[J].食品科学,2017,38(4):51-57.
WANG X D,CHEN M Z,BAN S D,et al.Separation,identification and functional characterization of yeast strains from Moutai-flavor Daqu,a traditional Chinese liquor fermentation starter[J].Food Science,2017,38(4):51-57.
[8] 邵明凯, 王海燕,徐岩,等.酱香型白酒发酵中酵母群落结构及其对风味组分的影响[J].微生物学通报,2014,41(12):2 466-2 473.
SHAO M K,WANG H Y,XU Y,et al.Yeast community structure and its impact on flavor components during the fermentation process of Chinese Maotai-flavor liquor[J].Microbiology China,2014,41(12):2 466-2 473.
[9] 成林, 成坚,王琴,等.酒曲微生物菌群对酿造酒产品风味影响的研究进展[J].中国酿造,2020,39(10):1-4.
CHENG L,CHENG J,WANG Q,et al.Research progress on the effect of Jiuqu microbial flora on the flavor of brewed alcoholic drink[J].China Brewing,2020,39(10):1-4.
[10] 范光森, 许岱,富志磊,等.古井贡酒曲中酵母的分离及其产香挥发性风味物质分析[J].中国食品学报,2018,18(7):220-229.
FAN G S,XU D,FU Z L,et al.Screen of aroma-producing yeast strains from Gujinggong Daqu and analysis of volatile flavor compounds produced by them[J].Journal of Chinese Institute of Food Science and Technology,2018,18(7):220-229.
[11] WU D H,LI X M,LU J,et al.Constitutive expression of the DUR1,2 gene in an industrial yeast strain to minimize ethyl carbamate production during Chinese rice wine fermentation[J].FEMS Microbiology Letters,2016,363(1).DOI:10.1093/femsle/fnv214.
[12] CUS F,JENKO M.The influence of yeast strains on the composition and sensory quality of gewurztraminer wine[J].Food Technology and Biotechnology,2013,51(4):547-553.
[13] 杨建刚, 苏畅,窦晓,等.泸型酒发酵过程中酵母菌演替规律及其对部分风味分子形成的影响[J].食品科学,2018,39(18):166-172.
YANG J G,SU C,DOU X,et al.Analysis of yeast succession during the fermentation of Luzhou-flavor liquor and its effect on the formation of selected flavor components[J].Food Science,2018,39(18):166-172.
[14] 明红梅, 郭志,周健,等.浓香型大曲中产香微生物的筛选及鉴定[J].现代食品科技,2015,31(4):186-191.
MING H M,GUO Z,ZHOU J,et al.Screening and identification of aroma-producing microorganisms in Luzhou-flavor Daqu[J].Modern Food Science and Technology,2015,31(4):186-191.
[15] 杜刚, 陆小凯,詹梦涛,等.酒曲中酵母菌的分离鉴定及果酒发酵的初步研究[J].食品研究与开发,2019,40(15):8-13.
DU G,LU X K,ZHAN M T,et al.Isolation and identification of yeasts from koji and the primary study on fruit wine fermentation[J].Food Research and Development,2019,40(15):8-13.
[16] 谭壹, 赵东,陈敏,等.浓香型白酒发酵旺盛期糟醅中酵母菌菌群研究[J].食品研究与开发,2020,41(6):175-180.
TAN Y,ZHAO D,CHEN M,et al.Study on the yeast group of dregs in the main stage of fermentation of Luzhou-flavor liquor[J].Food Research and Development,2020,41(6):175-180.
[17] 窦晓, 杨建刚,曹新志,等.基于26S rRNA D1/D2区序列对不同时期大曲中酵母菌的分离与鉴定[J].现代食品科技,2018,34(2):97-101.
DOU X,YANG J G,CAO X Z,et al.Isolation and identification of yeast from daqu in different periods by 26S rRNA D1/D2 region sequence[J].Modern Food Science and Technology,2018,34(2):97-101.
[18] 巴尼特. 酵母菌的特征与鉴定手册[M].青岛:青岛海洋大学出版社,1991.
BARNETT J A.Characteristics and Identification of Yeast Manual[M].Qingdao:Qingdao Ocean University Press,1991.
[19] 张霞, 郑佳,赵东,等.多粮浓香型白酒中特征酵母菌与耐酸乳杆菌的关系[J].微生物学通报,2019,46(7):1 571-1 581.
ZHANG X,ZHENG J,ZHAO D,et al.Relationship between typical yeasts and Lactobacillus acetotolerans in multi-grain strong aroma Baijiu[J].Microbiology China,2019,46(7):1 571-1 581.
[20] 高江婧, 任聪,刘国英,等.浓香型白酒酒醅风味物质和微生物菌群结构随发酵时间的变化规律[J].食品与发酵工业,2019,45(20):1-6.
GAO J J,REN C,LIU G Y,et al.Dynamic changes of flavor compounds and microbial community in fermented grains of Chinese strong aroma-type Baijiu during fermentation[J].Food and Fermentation Industries,2019,45(20):1-6.
[21] 赵丽丽, 陈存社,郭凤莲.26S rDNA 序列分析法鉴定酵母菌[J].中国酿造,2008,27(15):49-51.
ZHAO L L,CHEN C S,GUO F L.Identification of yeast by 26S rDNA sequencing[J].China Brewing,2008,27(15):49-51.
[22] 王涛, 姚韬,李涛,等.浓香型白酒酿造相关酵母发酵糟醅产己酸乙酯的研究[J].食品与发酵工业,2013,39(1):41-45.
WANG T,YAO T,LI T,et al.The role of Luzhou-flavor liquor correlated yeasts in promoting caproic acid ethyl ester generating in fermentative grain[J].Food and Fermentation Industries,2013,39(1):41-45.
[23] JENSEN S L,UMIKER N L,ARNEBORG N,et al.Identification and characterization of Dekkera bruxellensis,Candida pararugosa,and Pichia guilliermondii isolated from commercial red wines[J].Food Microbiology,2009,26(8):915-921.
[24] 周森, 李艳敏,胡佳音,等.清香型大曲酿酒酵母株系分类及其可挥发代谢产物分析[J].中国酿造,2017,36(9):137-141.
ZHOU S,LI Y M,HU J Y,et al.Strain classification and volatile metabolites analysis of Saccharomyces cerevisiae from light-flavor Daqu[J].China Brewing,2017,36(9):137-141.
[25] 史冬梅, 王松,赵东瑞,等.GC-MS/SIM法检测103种白酒中6种酚类化合物[J].中国食品学报,2019,19(4):235-248.
SHI D M,WANG S,ZHAO D R,et al.Determination of 6 phenols in 103 kinds of Chinese baijiu by GC-MS/SIM[J].Journal of Chinese Institute of Food Science and Technology,2019,19(4):235-248.
[26] ZHU B F,XU Y.Production of tetramethylpyrazine by batch culture of Bacillus subtilis with optimal pH control strategy[J].Journal of Industrial Microbiology & Biotechnology,2010,37(8):815-821.
[27] 陈诗佳, 李玲玲,陈叶福,等.高产乙偶姻酵母菌种的选育与提高白酒中四甲基吡嗪含量的研究[J].酿酒科技,2018(10):114-119.
CHEN S J,LI L L,CHEN Y F,et al.Breeding of yeast strains with high-yield of acetoin and its application in baijiu production to improve tetramethylpyrazine content[J].Liquor-Making Science & Technology,2018(10):114-119.
[28] 黄家岭, 廖妍俨,孙棣,等.顶空固相微萃取-气相色谱法检测白酒中吡嗪类化合物[J].中国酿造,2016,35(8):163-168.
HUANG J L,LIAO Y Y,SUN D,et al.Detection of pyrazine compounds in Baijiu by HS-SPME-GC[J].China Brewing,2016,35(8):163-168.