铝瓶包装由于其具有质量轻、成本低、密封性好、导热性能高、耐受高温、可回收、有良好的机械强度和装饰性能等优势,广泛应用于饮料等食品工业中[1-2]。然而,食品工业中使用铝瓶包装的主要问题是产生腐蚀。因此,常在与食品直接接触的铝瓶包装内表面上涂有机聚合物涂层,以在铝瓶包装和食品之间提供保护[3]。目前常用的涂料主要有环氧酚醛树脂、丙烯酸树脂、酚醛树脂、乙烯基树脂等[4],然而,用于包装的保护性内涂层中的某些成分可能会从包装材料迁移到食品中,这些成分可能是起始物质、添加剂、降解产物等[5-7]。研究发现食品接触材料中,可能存在醛类(甲醛、乙醛等)[8]、芳香族伯胺[9]、酚类[10-11]、重金属[12]等有害化学物质,在食品的保藏过程中,这些化学物质可能会从食品接触材料迁移到食品中,当其迁移量超过一定的阈值时,可能直接危害人体的健康。为保证食品接触材料的安全,欧盟发布了(EU)10/2011,其中规定甲醛、乙醛的迁移量不得超过15和6 mg/kg。我国也发布了食品接触材料相关标准,如GB 9685—2016《食品安全国家标准 食品接触材料及制品用添加剂使用标准》、GB 31604.1—2015《食品安全国家标准 食品接触材料及制品迁移试验通则》等,其中GB 9685—2016规定了甲醛和乙醛迁移限量分别为15和6 mg/kg。
人们接触醛类物质会引起恶心、头痛、咳嗽和眼睛、鼻子和喉咙发炎等症状,从而在短期内影响健康[13]。甲醛已被公认为具有致突变性和致癌性[14]。乙醛是乙醇产生的内源性代谢物,也被认为是一种普遍存在的化合物,虽然没有证据表明其对人体有致癌性,但是,它是一种强堕胎药,且对大鼠有致畸作用[15]。目前,对于食品及食品相关产品中甲醛、乙醛的测定方法主要有分光光度法[16]、电化学法[17]、气相色谱[18]、液相色谱法[19]等。目前,我国GB 31604.48—2016《食品安全国家标准 食品接触材料及制品 甲醛迁移量的测定》中,关于甲醛迁移量的测定方法是分光光度法,虽然此法操作简单,但检出限低,且容易产生假阳性;SN/T 3385—2012《食品接触材料 高分子材料 聚对苯二甲酸乙二醇酯(PET)树脂及其制品中乙醛的测定 顶空气相色谱法》中关于乙醛的测定方法是顶空气相色谱法,此法重现性和准确性不够好,并且只能单独检测乙醛。电化学方法由于操作繁琐,效率不高,在甲醛的检测方面应用较少[20]。
目前,对于铝瓶包装中甲醛、乙醛同步检测和迁移规律的研究较少,本文建立了高效液相色谱法同步测定铝瓶包装中甲醛、乙醛迁移量方法,并对衍生条件进行优化,选择体积分数分别为4%的乙酸、10%、20%、50%的乙醇为食品模拟物研究了铝瓶中甲醛、乙醛在不同温度和时间下的迁移规律,为铝瓶等金属容器中甲醛、乙醛迁移量的测定以及食品接触材料相关标准的修订提供参考依据。
1 实验部分
1.1 仪器与试剂
LC-20AD型高效液相色谱-紫外检测器,日本岛津仪器有限公司;AL204型电子天平,梅特勒-托利多仪器;BSP-250型生化培养箱,上海博讯实业有限公司医疗设备厂;铝瓶(内涂层为热固性环氧酚醛涂料),容积500 mL,由国内某企业提供。
甲醛标准品(10 000 mg/L)、乙醛标准品(1 000 mg/L),上海安谱实验科技股份有限公司;2,4-二硝基苯肼(2,4-dinitrophenylhydrazine,DNPH),西格玛奥德里奇贸易有限公司;磷酸(分析纯),北京化工厂;冰乙酸(分析纯),天津市大茂化学试剂厂;乙腈、无水乙醇(色谱纯),北京诺其雅盛生物科技有限公司。
1.2 实验方法
1.2.1 迁移实验
根据GB 31604.1—2015,选择相应的食品模拟物以及浸泡条件对样品进行预处理。选择体积分数分别为4%乙酸、10%乙醇、20%乙醇、50%乙醇共4种食品模拟物来分别模拟酸性食品(pH<5)、非酸性食品(pH≥5)、乙醇含量≤10%的含酒精饮料、20%<乙醇含量≤50%的含酒精饮料开展迁移实验。为研究铝瓶包装在不同温度和时间条件下甲醛、乙醛的迁移规律,实验设计为3 组(每组做3个平行样),将预处理好的样品分别在20、40、60 ℃的恒温箱中进行保温试验,分别在0、1、2、3、4、5、6、7、8、9、10 d进行取样并测试[18]。为了防止甲醛、乙醛的挥发,保温过程中,保持铝瓶密封,取样前冷却至室温。
1.2.2 标准溶液配制及试剂配制
甲醛、乙醛混合标准储备液:分别准确移取100 μL甲醛标准品、1 mL乙醛标准品于10 mL容量瓶中,加纯水定容,配制100 mg/L的混合标准储备液。
甲醛、乙醛混合标准工作液:分别准确移取甲醛、乙醛混合标准储备液10、20、50、100、200 μL于10 mL容量瓶中,加纯水定容,配制甲醛、乙醛混合标准工作液质量浓度为0.1、0.2、0.5、1.0、2.0 mg/L。
DNPH溶液的配制:准确称取0.30 g DNPH于100 mL棕色容量瓶中,加入5 mL磷酸溶液,用乙腈定容,质量浓度为3 mg/mL。
1.2.3 衍生反应
分别吸取1.00 mL混合标准工作液及样品溶液于10 mL具塞比色管中,分别加入2.0 mL 3 mg/mL的DNPH衍生化试剂,立即盖好塞子后摇匀,放置在60 ℃恒温水浴中加热30 min使其衍生化,冷却至室温后,用0.22 μm有机滤膜过滤,滤液待高效液相色谱分析。
1.2.4 色谱条件
色谱柱:Venusil C18(4.6 mm×250 mm,5 μm);流动相为V(乙腈)∶V(水)=60∶40;流速0.8 mL/min;检测波长365 nm;柱温35 ℃;进样量10 μL。
1.3 数据与分析
利用岛津LC Solution软件对数据进行处理,使用Origin 2019软件绘图。
2 结果与分析
2.1 色谱条件优化
本文选择了流动相分别为V(乙腈)∶V(水)=80∶20、70∶30、60∶40、55∶45对流动相系统进行考察。在V(乙腈)∶V(水)=60∶40时,甲醛-PNPH、乙醛-PNPH能达到很好分离,分离度好,峰形左右对称,保留时间较短,结果如图1所示,因此,本试验最终选择V(乙腈)∶V(水)=60∶40为流动相。
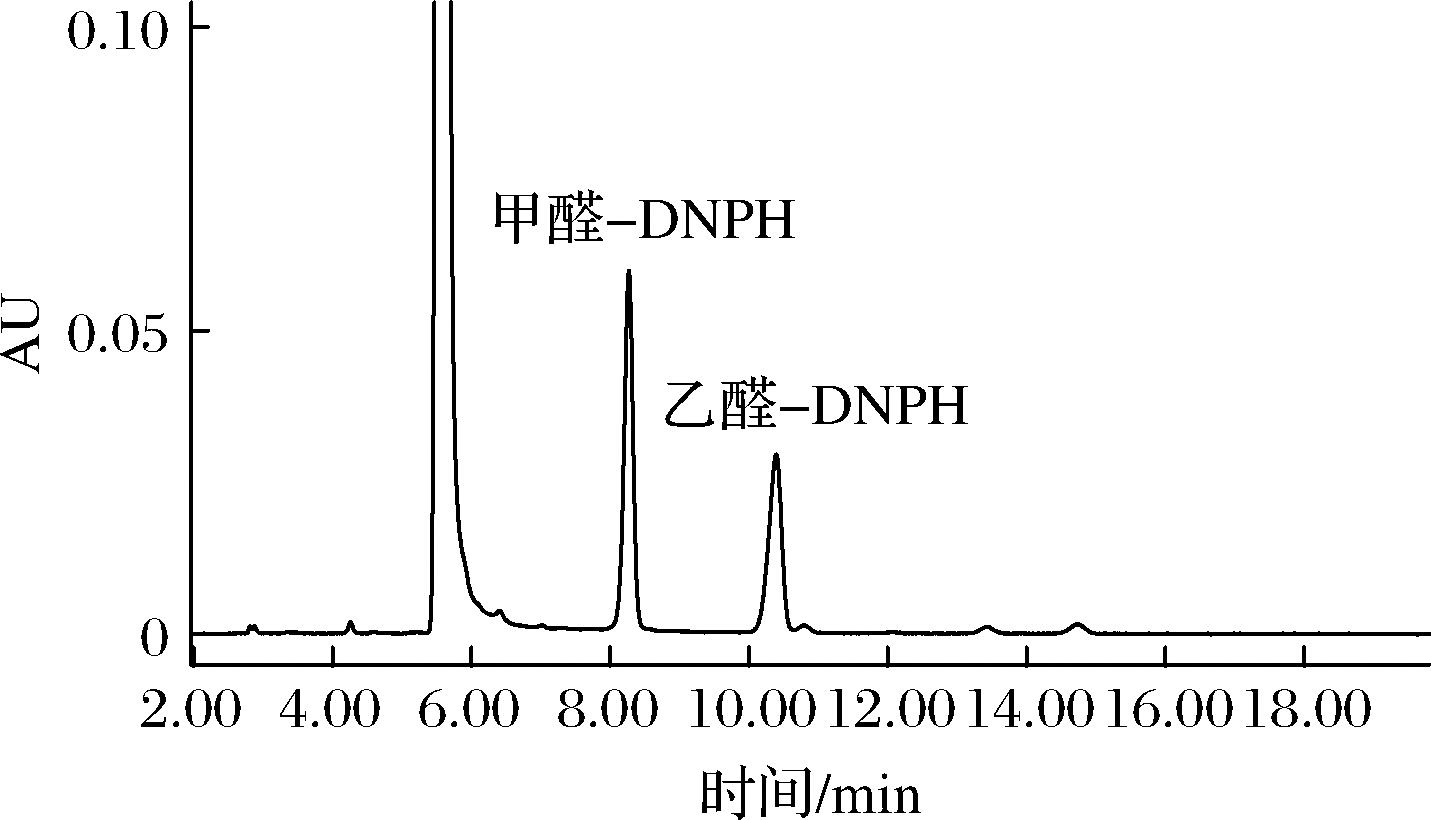
图1 甲醛-DNPH、乙醛-DNPH 色谱图
Fig.1 Chromatograms of formaldehyde-DNPH and acetaldehyde-DNPH
2.2 衍生条件的选择
2.2.1 衍生剂浓度的选择
在酸性条件下甲醛和乙醛与衍生剂(DNPH)在水浴中衍生,生成苯腙类物质。在衍生过程中,衍生剂的浓度低会导致部分甲醛、乙醛没有与衍生剂反应完全,造成检测结果偏低,因此,衍生剂的加入量直接影响着衍生效果。因此,在其他试验条件不变的情况下,选择1、2、3、4、5 mg/mL质量浓度的衍生剂分别与甲醛、乙醛进行衍生反应来考察衍生剂浓度对检测结果的影响。如图2-a所示,当衍生剂的质量浓度在1~3 mg/mL时,甲醛-DNPH、乙醛-DNPH峰面积随着衍生剂浓度的增大而增大;当衍生剂的质量浓度在3~5 mg/mL时,甲醛、乙醛衍生物峰面积随着衍生剂浓度的增大而基本保持不变,因此本试验选择3 mg/mL为衍生剂最佳质量浓度。
2.2.2 衍生化水浴温度的选择
在衍生过程中,水浴温度的选择对衍生反应有着重要的影响。因此,在其他试验条件不变的情况下,选择水浴温度分别为40、50、60、70、80 ℃条件下衍生剂与甲醛、乙醛进行衍生,来考察衍生温度对检测结果的影响。为了防止甲醛、乙醛的挥发,用封口膜将盖好塞子的比色管密封。如图2-b所示,当衍生化水浴温度在40~60 ℃时,甲醛-DNPH、乙醛-DNPH峰面积随着水浴温度的增大而增大;衍生化水浴温度在60~80 ℃时,甲醛、乙醛衍生物峰面积随着水浴温度的增大而减小,主要是因为温度过高会导致甲醛、乙醛衍生物不稳定而发生分解,这与赵贞等[22]的研究结果一致,因此本试验选择60 ℃为最佳水浴温度。
2.2.3 衍生化水浴时间的选择
在衍生的过程中,当水浴时间不够时,衍生反应不完全,会造成检测结果不准确。因此,在其他试验条件不变的情况下,选择衍生剂与甲醛、乙醛分别衍生10、20、30、40、50 min来考察衍生时间对检测结果的影响。如图2-c所示,当水浴衍生时间在10~30 min时,甲醛-DNPH、乙醛-DNPH峰面积随着衍生时间的延长而增大;衍生时间30~50 min时,甲醛、乙醛衍生物峰面积随着水浴衍生时间的延长而基本保持不变,因此本试验选择30 min为最佳水浴衍生时间。
2.2.4 衍生化加酸量的选择
衍生的过程中需要在酸性条件下进行,加酸量也会直接影响检测结果。因此,在其他试验条件不变的情况下,选择加入3、4、5、6、7 mL的磷酸溶液来配制衍生试剂,使甲醛、乙醛与其衍生来考察加酸量对检测结果的影响。如图2-d所示,在进行衍生时,当加酸量在1~3 mL时,甲醛-DNPH、乙醛-DNPH峰面积随着加酸量的增大而增大;当加酸量在3~5 mL时,甲醛、乙醛衍生物峰面积随着加酸量的增大而基本保持不变,因此本试验在配制衍生剂时加入5 mL磷酸为最佳加酸量。
综上所述,甲醛、乙醛的最佳衍生条件:衍生剂质量浓度3 mg/mL、水浴温度60 ℃、水浴时间30 min、加入5 mL磷酸。
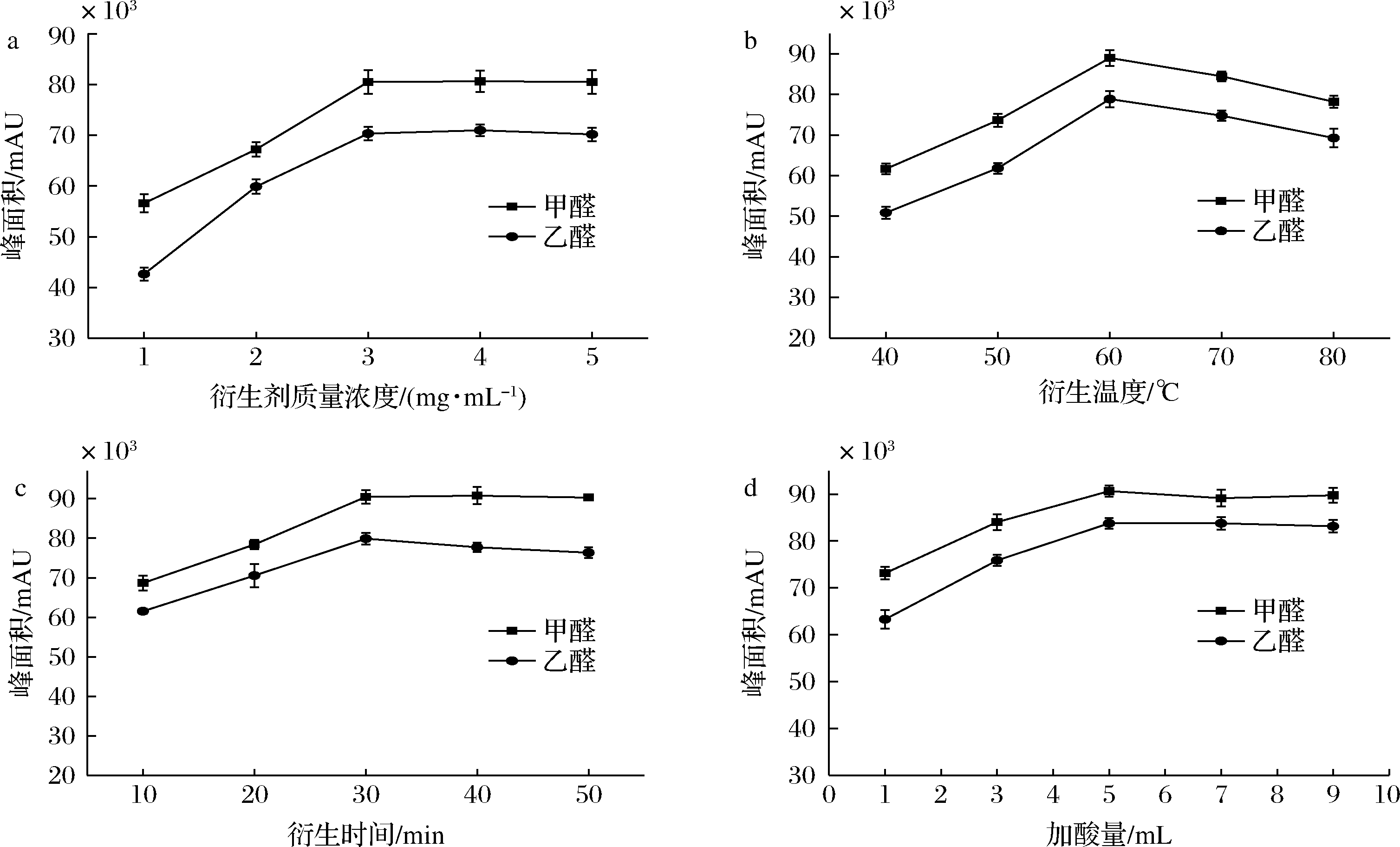
a-衍生剂质量浓度;b-衍生温度;c-衍生时间;d-加酸量
图2 甲醛、乙醛衍生条件优化
Fig.2 Optimization of the derivation conditions of formaldehyde and acetaldehyde
2.3 标准曲线和检出限、定量限
分别用不同的食品模拟物配制标准溶液,绘制不同食品模拟物下甲醛和乙醛标准工作曲线,得到线性回归方程和检出限、定量限,以3倍信噪比来计算检出限,以10倍信噪比来计算定量限。如表1所示。结果表明,甲醛、乙醛在质量浓度范围内线性关系良好。
表1 线性关系和检出限及定量限
Table 1 Linear relationship,limit of detection and limit of quantitative
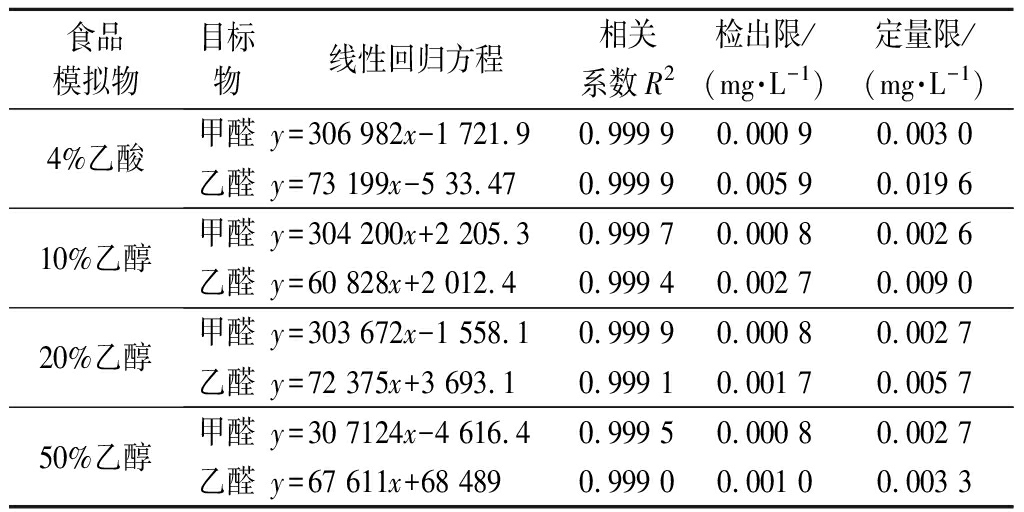
食品模拟物目标物线性回归方程相关系数R2检出限/(mg·L-1)定量限/(mg·L-1)4%乙酸甲醛y=306 982x-1 721.90.999 90.000 90.003 0乙醛y=73 199x-5 33.470.999 90.005 90.019 610%乙醇甲醛y=304 200x+2 205.30.999 70.000 80.002 6乙醛y=60 828x+2 012.40.999 40.002 70.009 020%乙醇甲醛y=303 672x-1 558.10.999 90.000 80.002 7乙醛y=72 375x+3 693.10.999 10.001 70.005 750%乙醇甲醛y=30 7124x-4 616.40.999 50.000 80.002 7乙醛y=67 611x+68 4890.999 00.001 00.003 3
2.4 回收率与精密度
为了验证该方法测量结果的准确性,选取食品模拟物4%乙酸、10%乙醇、20%乙醇、50%乙醇分别进行加标实验。分别在上述食品模拟物中添加甲醛、乙醛混合标准储备液,添加质量浓度分别为0.25、0.50、1.00 mg/L,经衍生后进行色谱分析,每个样品平行6 次,结果见表2。甲醛、乙醛的回收率在80.22%~107.41%,重复测定6次的相对标准偏差(relative standard deviation,RSD)<6.57%。说明该方法准确,可靠,能够实现铝瓶包装中甲醛、乙醛的迁移量的准确检测。
表2 样品加标回收率与精密度
Table 2 Standard recovery and precision of samples
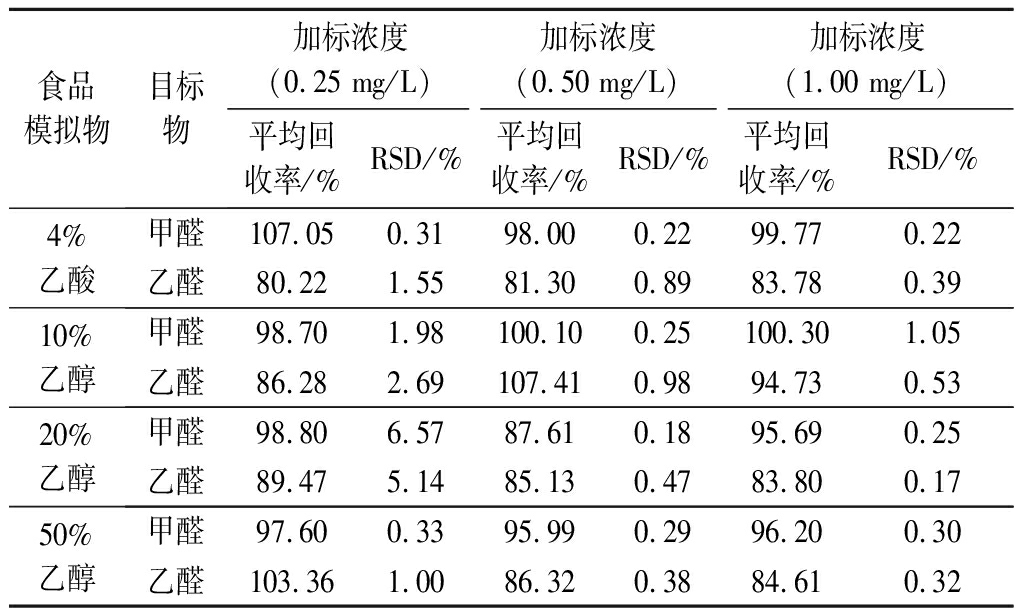
食品模拟物目标物加标浓度(0.25 mg/L)加标浓度(0.50 mg/L)加标浓度(1.00 mg/L)平均回收率/%RSD/%平均回收率/%RSD/%平均回收率/%RSD/%4%乙酸甲醛107.050.3198.000.2299.770.22乙醛80.221.5581.300.8983.780.3910%乙醇甲醛98.701.98100.100.25100.301.05乙醛86.282.69107.410.9894.730.5320%乙醇甲醛98.806.5787.610.1895.690.25乙醛89.475.1485.130.4783.800.1750%乙醇甲醛97.600.3395.990.2996.200.30乙醛103.361.0086.320.3884.610.32
2.5 特定迁移量的测试
根据GB 31604.1—2015中特定迁移实验条件的规定,预期使用条件是在室温或低于室温条件下贮存180 d,选择升温加速条件为60 ℃、10 d,因此,利用本文建立的测定方法对60 ℃下保温10 d的4%乙酸、10%乙醇、20%乙醇、50%乙醇4种食品模拟物中甲醛、乙醛的迁移量进行了检测,每个样品做3次平行,测定结果的平均值见表3。
表3 特定迁移量的测定结果 单位:mg/kg
Table 3 Determination results of specipic migration amounts
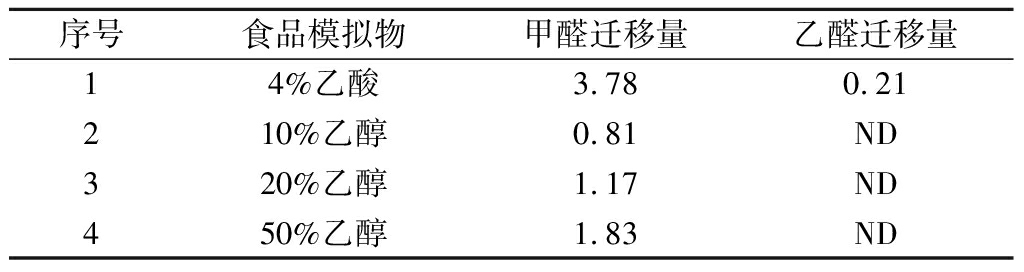
序号食品模拟物甲醛迁移量乙醛迁移量14%乙酸3.780.21210%乙醇0.81ND320%乙醇1.17ND450%乙醇1.83ND
注:ND表示未检出
铝瓶向4%乙酸、10%乙醇、20%乙醇、50%乙醇食品模拟物中迁移出甲醛含量依次为3.78、0.81、1.17、1.83 mg/kg,铝瓶在4%乙酸食品模拟物中迁移出乙醛含量为0.21 mg/kg,铝瓶在其他食品模拟物中未迁移出乙醛,且迁移出的甲醛、乙醛含量均未超过GB 9685—2016中甲醛、乙醛的限量值。总体上铝瓶中甲醛的迁移量远高于乙醛,这主要是由于铝瓶内涂层为热固性环氧酚醛涂料,甲醛是环氧酚醛涂料的起始物质,其含量比乙醛高。在相同的温度和时间下,对于不同食品模拟物,甲醛、乙醛的迁移量存在一定差异。铝瓶中甲醛向不同食品模拟物中迁移量由大到小依次为:4%乙酸溶液>50%乙醇溶液>20%乙醇溶液>10%乙醇溶液,铝瓶在4%乙酸食品模拟物中迁移出乙醛,在其他3种食品模拟物中未迁移出乙醛,这可能是因为甲醛、乙醛在4%乙酸溶液中的溶解度高于乙醇溶液,且随着乙醇溶液浓度的增加,甲醛、乙醛的溶解度更高。根据相关理论,接触介质对该类化合物的溶解度越大,传质阻力越小,扩散能力越强。
2.6 不同温度下甲醛、乙醛向食品模拟物中的迁移规律
根据GB 31604.1—2015规定,实验条件20 ℃、10 d可替代冷冻贮存30 d以上,40 ℃、10 d可替代冷藏贮存30 d以上,60 ℃、10 d可替代室温或低于室温条件下贮存180 d以上,较高温度或较长时间下的测试结果可代替较低温度或较短时间下的测试结果。本实验选择20、40和60 ℃作为升温加速实验条件来研究甲醛、乙醛的迁移规律。
不同温度下,铝瓶中甲醛向4种食品模拟物中的迁移规律如图3所示,铝瓶中乙醛向4%乙酸食品模拟物中的迁移规律如图4所示。在同一模拟物中,随着贮存温度的升高,甲醛或乙醛的迁移量逐渐增加,且迁移量大小次序为60 ℃>40 ℃>20 ℃,即温度越高迁移量越大、迁移速率越高。根据阿伦尼乌斯方程[23]和Fick第二扩散定律[24],温度上升分子运动增加,迁移过程中的扩散系数增加,甲醛或乙醛分子的自由能增加,扩散活化能降低,使其更容易克服涂层分子间的相互作用力,甲醛、乙醛更容易迁移到食品模拟物中。由图3-b~d、图4可知,同一温度条件下,随着迁移时间的增加,在初始阶段,铝瓶中甲醛、乙醛的迁移量呈现快速上升的趋势,达到某个时间点之后,甲醛或乙醛迁移量的上升速率变慢,并逐渐达到平衡。这主要是由物质的扩散理论所决定,在初始阶段,可迁出物质不断向食品模拟物中扩散,使它们在涂层中的含量不断下降,在食品模拟物中的含量不断增加;随着贮存时间的延长,涂层和食品模拟物中可迁出物质的扩散逐渐达到平衡,迁移量也逐渐保持不变。

图4 不同温度和时间下乙醛向4%乙酸食品 模拟物中迁移规律
Fig.4 Migration pattern of acetaldehyde into 4% acetic acid food simulators at different temperatures and times
此外,除4%乙酸迁移的甲醛之外,迁移温度越高,甲醛或乙醛的迁移量越容易达到平衡,主要原因是温度升高,扩散速度增加。而对于4%乙酸食品模拟物,铝瓶在60 ℃迁移10 d时,甲醛的迁移量并未达到平衡,随着迁移时间的延长有继续增加的趋势。有研究表明,短期储藏的传统迁移试验(如60 ℃、10 d)并不能用于预测长期储藏的食品[25]。因此4%乙酸模拟物条件下,60 ℃、10 d的迁移试验能否预测长期储存的食品还需要进一步研究。
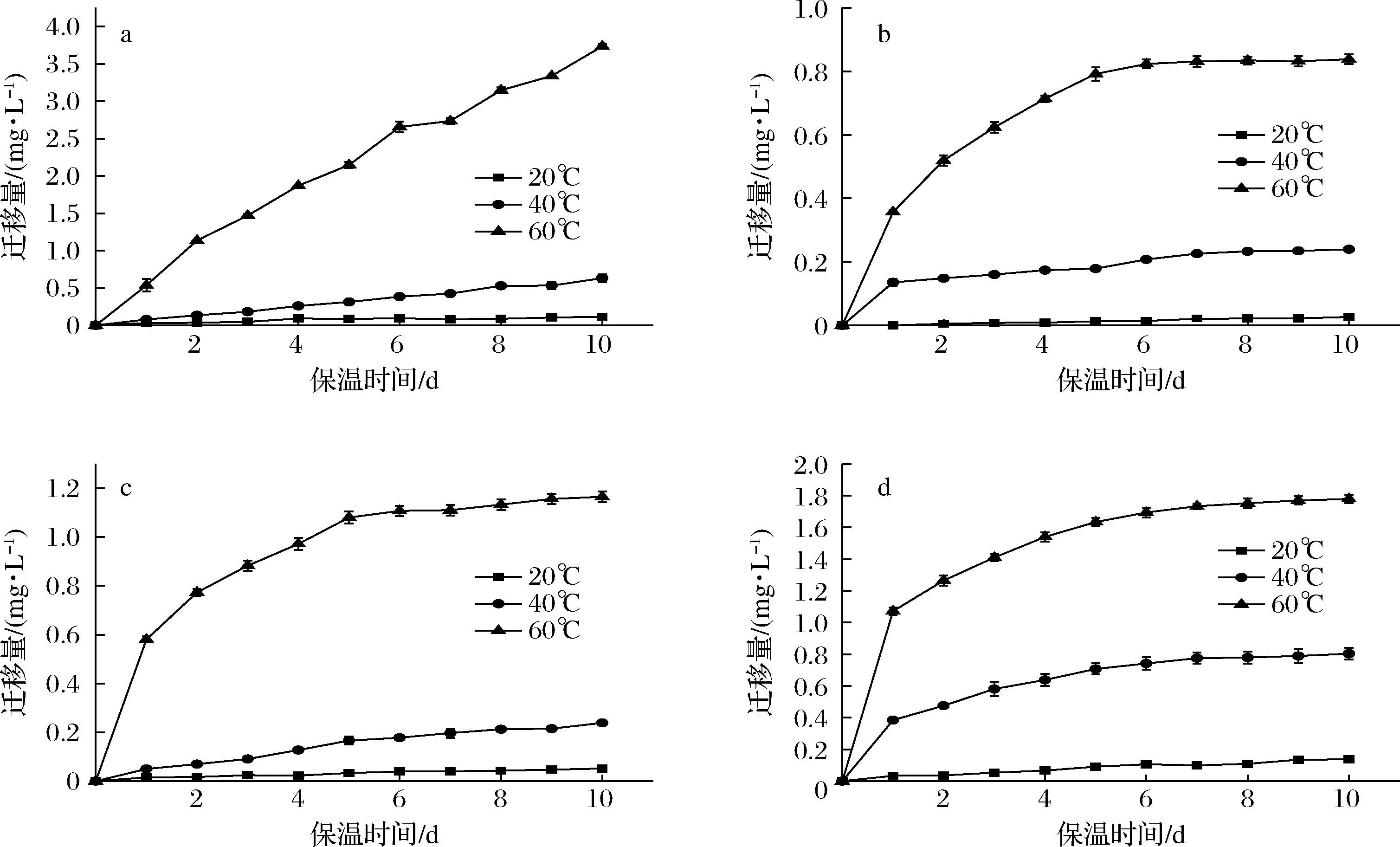
a-4%乙酸;b-10%乙醇;c-20%乙醇;d-50%乙醇
图3 不同温度和时间下甲醛向不同模拟物中迁移规律
Fig.3 Formaldehyde migrates to different simulants under different temperatures and times
3 结论
本研究建立了同时测定铝瓶包装中甲醛、乙醛的高效液相色谱法。该方法在测定范围内,线性关系良好,相关系数R2>0.999,检出限为0.000 8~0.007 8 mg/L,加标回收率为80.22%~107.41%,精密度为0.17%~6.57%。该方法操作简单快速,能够用于铝瓶包装中甲醛、乙醛迁移量的测试与研究。铝瓶向不同模拟物中迁移出的甲醛、乙醛含量均未超过GB 9685—2016中甲醛、乙醛的限量值要求,且在相同条件下,铝瓶中甲醛的迁移量远高于乙醛。铝瓶在4%乙酸食品模拟物中迁移出乙醛而在其他食品模拟物中未迁移出乙醛。随着温度的升高和保温时间的延长,除4%乙酸食品模拟物迁移的甲醛之外,铝瓶中甲醛、乙醛的迁移量逐渐升高直至达到平衡。本研究结果将为铝瓶中甲醛、乙醛的迁移量的测定方法以及食品接触材料相关标准的修订提供参考。
[1] 肖艳. 发展中的中国食品金属包装工业及其市场前景[J].饮料工业,2013,16(5):2-8.
XIAO Y.Development and market prospects of Chinese metal packaging industry for food[J].The Beverage Industry,2013,16(5):2-8.
[2] 郑彦.饮料营销新工具:铝瓶的国际市场环境分析[J].中国包装,2008,28(4):41-42.
ZHENG Y.Beverage marketing new tool:Analysis of international market environment of aluminum bottle[J].China Packaging,2008,28(4):41-42.
[3] MANZOORI J L,AMJADI M,ABOLHASANI D.Spectrofluorimetric determination of tin in canned foods[J].Journal of Hazardous Materials,2006,137(3):1 631-1 635.
[4] PIERGIOVANNI L,LIMBO S.Introduction to food packaging materials[M].Food Packaging Materials.Cambridge:Springer International Publishing,2016.
[5] GROB K,PFENNINGER S,POHL W,et al.European legal limits for migration from food packaging materials:1.Food should prevail over simulants;2.More realistic conversion from concentrations to limits per surface area.PVC cling films in contact with cheese as an example[J].Food Control,2007,18(3):201-210.
[6] 郝倩. 食品接触材料中有害物质的迁移行为及其模型建立[D].天津:天津大学,2014.
HAO Q.Migration modeling of harmful substances from packages to food simulants[D].Tianjin:Tianjin University,2014.
[7] 汪洋.食品包装材料中有害物迁移与暴露参数的质量风险控制研究[D].昆明:昆明理工大学,2018.
WANG Y.Study on quality risk control of hazardous materials migration and exposure parameters in food packaging materials[D].Kunming:Kunming University of Science and Technology,2018.
[8] 葛琨, 胡玉玲,李攻科.食品接触材料样品前处理和检测方法研究进展[J].食品安全质量检测学报,2019,10(14):4 451-4 460.
GE K,HU Y L,LI G K.Research progress on sample pretreatment and detection methods of food contact materials[J].Journal of Food Safety & Quality,2019,10(14):4 451-4 460.
[9] 李丽莎,马芮萍,孙世琨,等.食品接触材料中有害物质的迁移研究展望[J].中国包装,2019,39(6):58-69.
LI L S,MA R P,SUN S K,et al.Research prospects of transport of hazardous substances in food contact materials[J].China Packaging,2019,39(6):58-69.
[10] CAO P,ZHONG H N,QIU K,et al.Exposure to bisphenol A and its substitutes,bisphenol F and bisphenol S from canned foods and beverages on Chinese market[J].Food Control,2021,120:107 502.
[11] GUO M M,HE M F,ZHONG J J,et al.High-performance liquid chromatography (HPLC)-fluorescence method for determination of bisphenol A diglycidyl ether (BADGE) and its derivatives in canned foods[J].Science of the Total Environment,2020,710:134 975.
[12] 周义国. 食品包装制品中的重金属迁移量测定探究[J].现代食品,2020(11):215-217.
ZHOU Y G.Determination of heavy metal transfer in food packaging products[J].Modern Food,2020(11):215-217.
[13] HERRINGTON J S,HAYS M D.Concerns regarding 24-h sampling for formaldehyde,acetaldehyde,and acrolein using 2,4-dinitrophenylhydrazine (DNPH)-coated solid sorbents[J].Atmospheric Environment,2012,55:179-184.
[14] WILLIAMS J,LI H,ROSS A B,et al.Quantification of the influence of NO2,NO and CO gases on the determination of formaldehyde and acetaldehyde using the DNPH method as applied to polluted environments[J].Atmospheric Environment,2019,218:117 019.
[15] DELIKHOON M,FAZLZADEH M,SOROOSHIAN A,et al.Characteristics and health effects of formaldehyde and acetaldehyde in an urban area in Iran[J].Environmental Pollution,2018,242:938-951.
[16] 胡文斌,张少飞,朱秀娟,等.分光光度法测定几种食品中的甲醛[J].农业灾害研究,2020,10(1):111-112;121.
HU W B,ZHANG S F,ZHU X J.Spectrophotometric determination of formaldehyde in several kinds of food[J].Journal of Agricultural Catastrophology,2020,10(1):111-112;121.
[17] 席慧婷. 纳米金粒子-聚吡咯复合电化学传感器的构建及对牛乳中甲醛的检测[D].南昌:南昌大学,2020.
XI H T.Preparation of AuNPs@PPY/GCE electrochemical sensor and detection of formaldehyde in milk[D].Nanchang:Nanchang University,2020.
[18] 黄祝华, 黄舒雯,姜振军,等.气相色谱法测定涂料和胶粘剂中游离甲醛含量[J].中国胶粘剂,2019,28(12):51-55.
HUANG Z H,HUANG S W,JIANG Z J,et al.Determination of free formaldehyde in coating and adhesive by gas chromatography[J].China Adhesives,2019,28(12):51-55.
[19] 曹萍,赵娜,冯博洪.高效液相色谱法检测食品中的甲醛含量[J].食品安全导刊,2020(30):121.
CAO P,ZHAO N,FENG B H.Determination of formaldehyde content in food by high performance liquid chromatography[J].China Food Safety Magazine,2020(30):121.
[20] ABE Y,KOBAYASHI N,YAMAGUCHI M,et al.Determination of formaldehyde and acetaldehyde levels in poly(ethylene terephthalate) (PET) bottled mineral water using a simple and rapid analytical method[J].Food Chemistry,2021,344:128 708.
[21] WANG Y N,GAO X,LIU B J,et al.Identification of chemicals in a polyvinyl chloride/polyethylene multilayer film by ultra-high-performance liquid chromatography/quadrupole time-of-flight mass spectrometry and their migration into solution[J].Journal of Chromatography A,2020,1625:461 274.
[22] 赵贞, 万鹏,李翠枝,等.高效液相色谱法测定饲料中甲醛的含量[J].饲料研究,2020,43(4):88-90.
ZHAO Z,WAN P,LI C Z,et al.HPLC method for determination of formaldehyde in feed[J].Feed Research,2020,43(4):88-90.
[23] SAMSUDIN H,AURAS R,BURGESS G,et al.Migration of antioxidants from polylactic acid films,a parameter estimation approach:Reparameterization of the Arrhenius equation[J].Food Control,2020,113:107 208.
[24] GUENNEAU S,PUVIRAJESINGHE T M.Fick’s second law transformed:One path to cloaking in mass diffusion[J].Journal of the Royal Society Interface,2013,10(83):20 130 106.
[25] PASEIRO-CERRATO R,DEVRIES J,BEGLEY T H.Evaluation of short-term and long-term migration testing from can coatings into food simulants:Epoxy and acrylic-phenolic coatings[J].Journal of Agricultural and Food Chemistry,2017,65(12):2 594-2 602.