色氨酸是人体的必需氨基酸之一,参与机体蛋白质的合成和代谢调节,它是烟酸、5-羟色胺、褪黑激素等生物活性物质的前体物,影响蛋白质、糖类和脂肪等营养物质的代谢。当人体缺乏色氨酸时会引起皮肤疾患、玻璃体退化及心肌纤维化等病症[1]。相较于成人,婴幼儿时期生长发育迅速,在该时期色氨酸及其代谢物对大脑的发育和对进食-饱足、睡眠-觉醒规律等神经行为的调节发展至关重要,因此必须保证婴儿食品中相关营养素的含量和质量[2-4]。消化吸收障碍、代谢紊乱或特定疾病状态的儿童对营养素或膳食有更为特殊的需求。
婴幼儿配方乳粉和特殊医学用途婴儿配方食品作为特定人群的食物来源,其营养成分组成在国家标准中都有特殊规定,对色氨酸的含量和添加形式都有相关的要求[5-6],但缺乏相应的检测方法标准。目前,测定色氨酸的检测方法包括分光光度法[7]、电化学法[8]、氨基酸分析仪法[9]、高效液相色谱法[10-15]、液相色谱串联质谱法[16]和离子色谱法[17]等,液相色谱方法的特异性和定量准确性均有优势。色氨酸多以蛋白质的形式存在于样品中,需水解为游离态后才能测定。目前通常采用的碱水解方法需长时间在高温、高浓度碱液条件下进行,色氨酸有一定损失,且在不同的基质中色氨酸的损失程度不完全一致。
本研究在经典碱水解方法的基础上引入结构与色氨酸相似的内标物α-甲基色氨酸,以内标法定量,使同一水解条件同时适用于婴幼儿配方乳粉和特殊医学配方婴幼儿配方食品(乳蛋白部分水解配方、乳蛋白深度水解配方和氨基酸配方)中色氨酸含量的准确测定。
1 材料与方法
1.1 材料与试剂
色氨酸标准品(C11H12N2O2,CAS号:73-22-3,纯度99.7%),德国Dr.Ehrenstorfer公司;α-甲基-色氨酸标准品(C12H14N2O2,CAS号:110 117-83-4,纯度98%),上海甄准生物科技有限公司;甲醇(色谱纯),美国Merck公司;醋酸铵(色谱纯)、乙酸(色谱纯),美国Fisher Chemical公司;LiOH(分析纯)、盐酸(分析纯),国药集团化学试剂有限公司;聚四氟乙烯材质水解管,带螺纹口外盖,内衬聚四氟乙烯密封垫;水相微孔滤膜(0.22 μm),上海安谱;NIST配方乳粉质控样1849a[(184±10)mg/100 g,k=2]、NIST配方乳粉质控样1869[(228±24)mg/100 g,k=2]、婴幼儿配方乳粉和特殊医学配方婴幼儿食品(乳蛋白部分水解配方、乳蛋白深度水解配方和氨基酸配方),均为市售。实验室用水符合 GB/T 6682 规定的一级水要求。
1.2 标准溶液配制
色氨酸标准溶液(100 μg/mL):准确称取10.0 mg色氨酸标准品用水溶解后定容至100 mL;内标工作液(1 mg/mL):称取10 mg α-甲基-色氨酸标准品用水溶解后定容至10 mL。
1.3 仪器与设备
Thermo Ultimate 3000高效液相色谱仪配有荧光检测器,美国Thermo Fisher公司;KQ-800DE超声清洗仪,宁波新芝生物科技股份有限公司;MS204TS电子天平,瑞士梅特勒公司;DHG-9243BS-Ⅲ电热干燥箱,上海新苗医疗器械制造有限公司;MS 3 basic涡旋混合器,德国IKA公司;IQ 7000超纯水仪,美国 Millipore 公司。
1.4 样品前处理
准确称取混合均匀的固体试样200 mg(精确到1 mg)于配有密封垫的具塞螺纹口聚四氟乙烯离心管中,依次加入0.5 mL内标工作液、5 mL LiOH溶液(4 mol/L),涡旋混匀后于超声波振荡器中振荡5 min,保证样品完全溶解后,置于110 ℃烘箱中水解20 h。取出水解管,待冷却至室温后,用HCl溶液(4 mol/L)调pH值至3~8,将水解液全部转移至50 mL容量瓶中并用水定容,混匀后经0.22 μm水相微孔滤膜过滤备用。
1.5 仪器条件
色谱柱:Xbridge C18(3.5 μm,150 mm×4.6 mm);流动相A:乙酸铵溶液(10 mmol/L,pH 4.0);流动相B:甲醇;梯度洗脱,洗脱程序见表1;柱温35 ℃;进样体积5 μL;荧光检测器激发波长280 nm,发射波长346 nm。每次进样前初始流动相比例平衡5 min。
表1 梯度洗脱程序
Table 1 Gradient elution procedure

时间/min流速/(mL·min-1)A/%B/%0.00.8901010.00.8901010.10.8802023.00.88020
2 结果与讨论
2.1 仪器测定条件的选择和优化
2.1.1 检测器的选择
色氨酸由于其特殊结构,既具有紫外吸收,又具有荧光响应。为使色氨酸的检测能够获得较高的灵敏度,需要确定色氨酸的最大吸收波长,最佳激发波长与最佳发射波长。研究中首先通过二极管阵列检测器(diode array detector,DAD)将色氨酸标准溶液在波长190~450 nm进行扫描,结果表明,在检测波长280 nm处,色氨酸有明显的特征吸收峰,且基质干扰较少,故将吸收波长280 nm作为紫外检测器检测色氨酸的检测波长。同时将最大吸收波长280 nm作为激发波长通过荧光检测器对色氨酸标准溶液进行发射光谱扫描,观察到色氨酸在波长346 nm处具有较高的灵敏度。因此,实验最终确定荧光检测器激发波长为280 nm,发射波长为346 nm。
经大量样本检测表明,在相同流动相条件下,部分样品的紫外色谱图中在目标物的保留时间处有难以分离的干扰峰,并影响到定量结果的准确性,故采用荧光检测器进行检测和定量。样品紫外检测器谱图和荧光检测器谱图见图1。
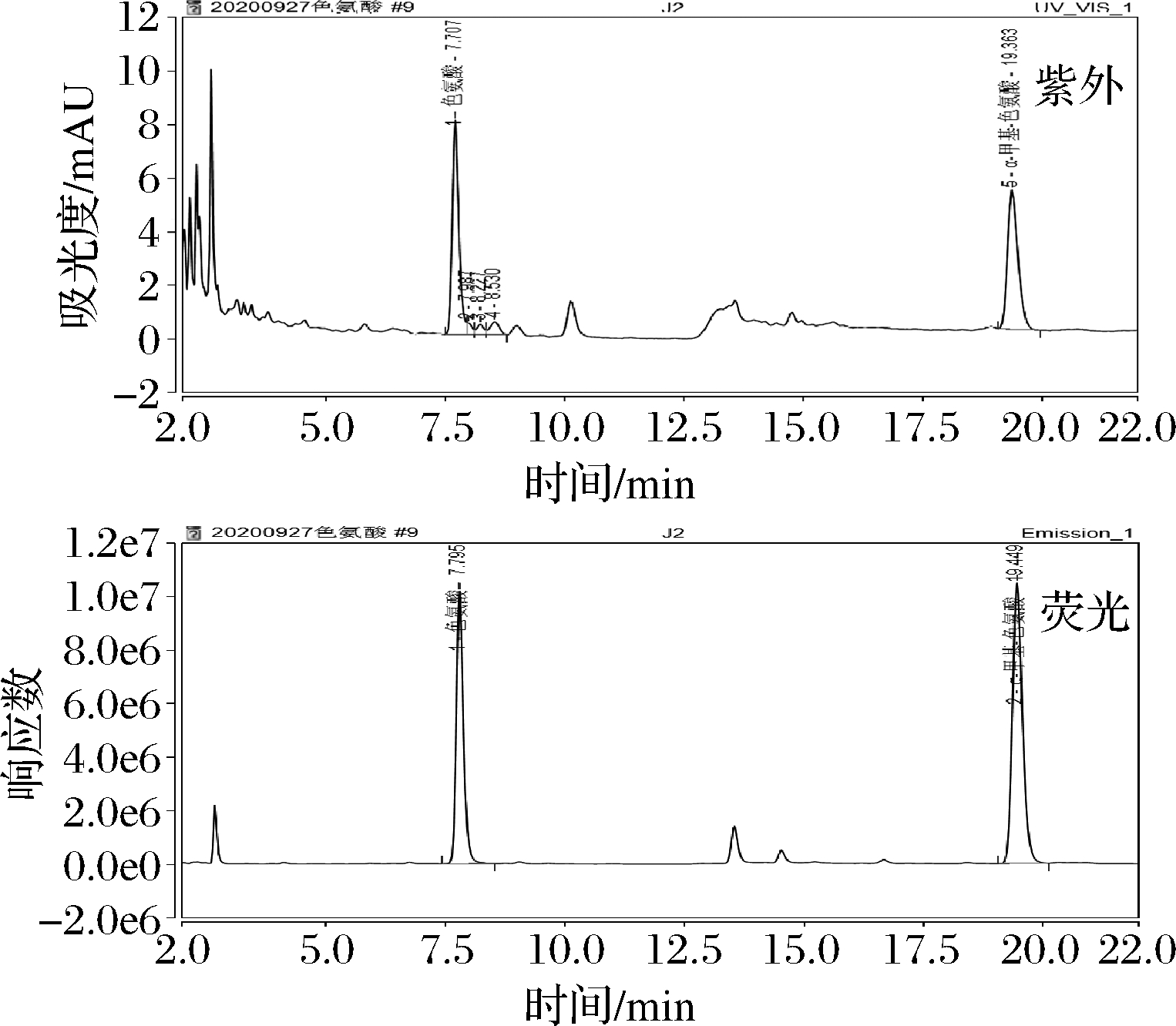
图1 样品紫外检测器与荧光检测器谱图比较
Fig.1 Comparison of spectrogram between UV detector and fluorescence detector
2.1.2 流动相的选择
流动相比较了体积分数0.1%的乙酸-甲醇溶液和10 mmol/L 醋酸铵溶液(pH 4.0)-甲醇体系的洗脱情况,结果表明在0.1%的乙酸溶液条件下个别样品中有明显的干扰峰,且难以与目标物有效分离,导致定量结果不够准确。而在10 mmol/L 醋酸铵溶液(pH 4.0)条件下目标峰和内标峰均可以与干扰峰(图2,峰3)达到基线分离。谱图见图2。
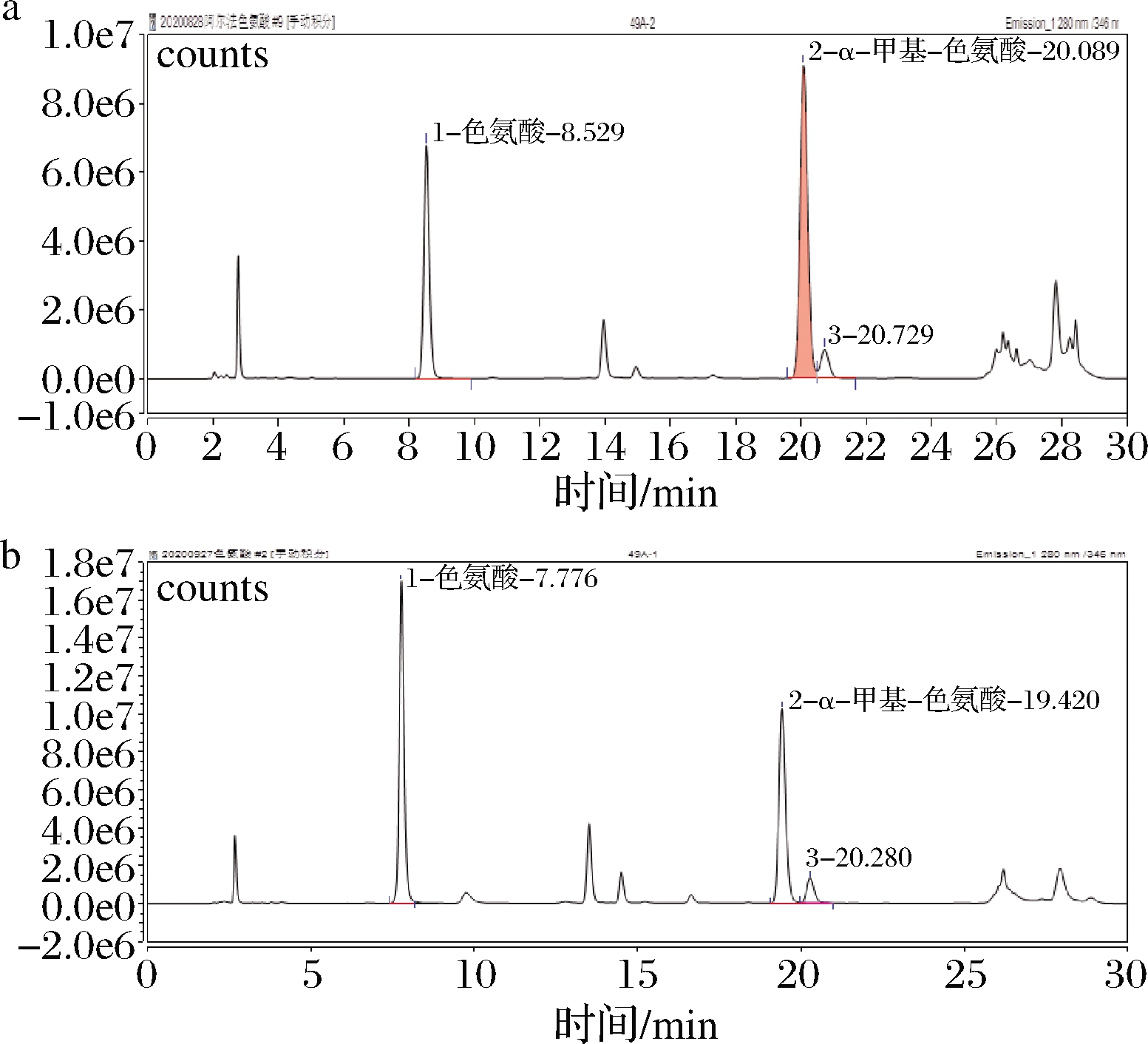
a-甲醇-0.1%乙酸溶液;b-甲醇-醋酸铵溶液
图2 梯度洗脱的色谱图(pH 4.0)
Fig.2 Chromatogram of gradient elution (pH 4.0)
2.2 试样前处理条件的优化
2.2.1 碱的选择
在样品碱水解的过程中,考察不同的碱对水解结果的影响。本研究中,选择蛋白质含量最高的乳粉基质作为实验对象,选取了相同浓度(4 mol/L)的LiOH、NaOH和KOH 3种碱溶液在相同试验条件下进行试验,考察碱水解后色氨酸含量的变化,结果见图3。结果表明,在相同的条件下,使用LiOH溶液处理的样品中色氨酸含量最高,使用外标法定量回收率为83%,而NaOH溶液和KOH溶液对试样中的色氨酸有不同程度地破坏,回收率只有76%和70%,故方法选定LiOH溶液作为水解过程中的碱溶液。
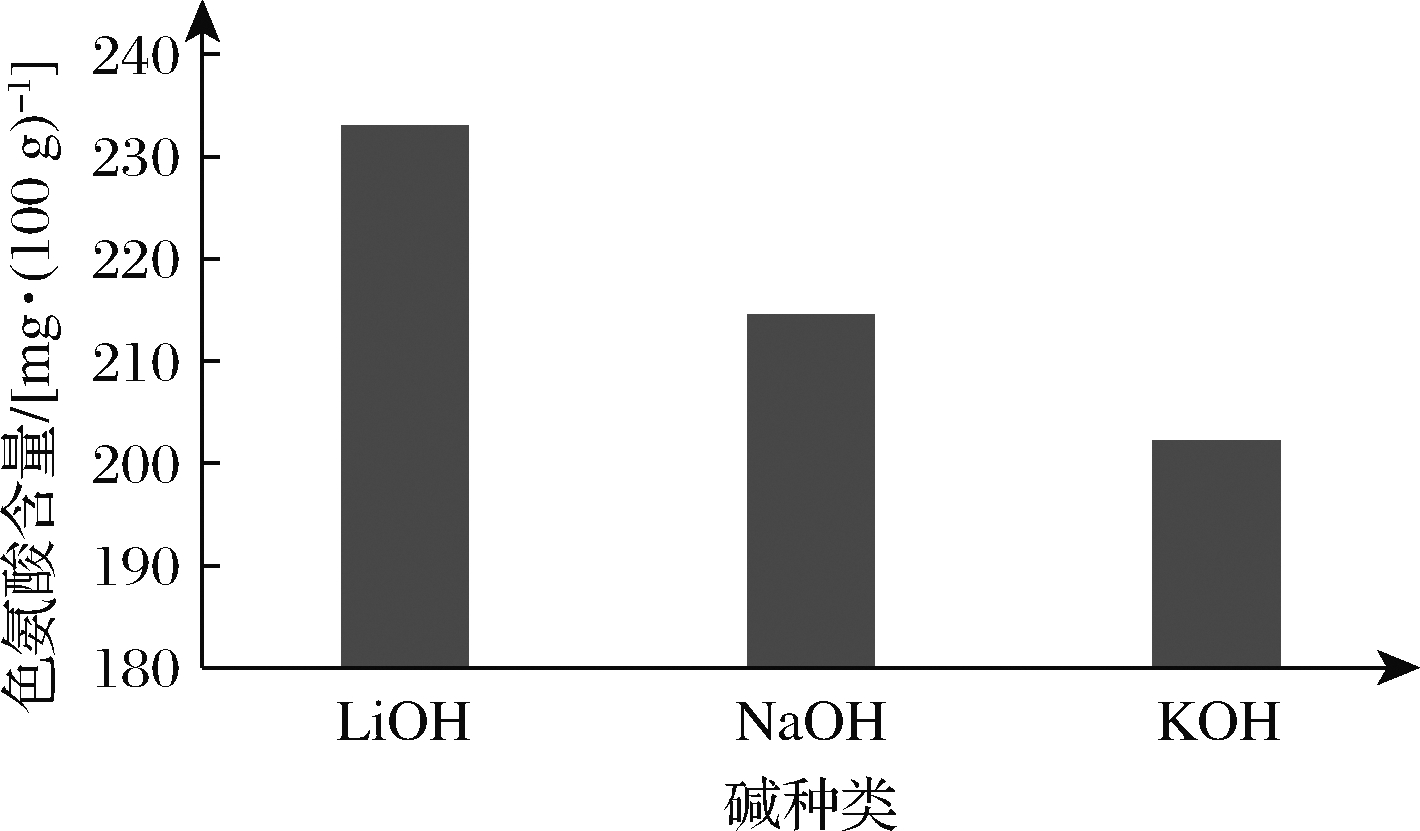
图3 不同碱对色氨酸含量测定的影响
Fig.3 Effect of different bases on the determination of tryptophan content
2.2.2 碱溶液浓度和水解时间的选择
以NIST 1849a配方乳粉质控样作为研究对象,使用2、3和4 mol/L 3种浓度的LiOH溶液分别水解18、20和22 h,测定的色氨酸含量如图4所示。由图4可知,2和3 mol/L碱溶液经22 h仍没有水解完全,而4 mol/L的LiOH在18 h已经水解完全,继续水解20和22 h没有明显变化,为了保证充分的水解,以准确测定总色氨酸的含量,选择4 mol/L LiOH水解溶液、20 h作为最佳的水解条件

图4 不同浓度碱溶液和不同水解时间对色氨酸水解的影响
Fig.4 Effect of different concentration of alkali solutions and different hydrolysis time on tryptophan hydrolysis
2.2.3 水解温度的确定
为考察水解温度的影响,设计了100、110、120 ℃ 3个水解温度进行考察,结果见图5。110和120 ℃水解结果在18和20 h的时候无显著差异,但120 ℃在22 h以后出现了明显的下降;而在100 ℃条件下,样品水解至22 h依然未能水解完全,且增加反应时间后,色氨酸浓度反而出现了下降,通过色氨酸标准品的碱水解实验验证,发现水解时间过长,游离色氨酸会部分被破坏,故本方法选择110 ℃作为水解温度。

图5 不同温度对色氨酸水解的影响
Fig.5 Effect of different temperatures on tryptophan hydrolysis
2.2.4 碱水解法内标确定
由于碱水解过程温度高,时间长,对不同的样品进行加标回收试验发现色氨酸长时间在高温高浓度的碱中会有一定程度的损失,而且不同基质中色氨酸的损失不同。试验增加了在碱水解过程中充氮保护的措施,结果表明,色氨酸的损失在充入氮气保护后略有改善,但使用充氮保护下碱水解的方法测试质控样NIST1849a,结果仅为168 mg/100 g,不能得到满意的结果;参考标准GB/T 15400—2018 《饲料中色氨酸的测定》在水解前对样品进行除脂,试验结果表明除脂仅对水解液的外观有所改变,对测定结果没有改善。因此在优化前处理方法无法有效降低色氨酸损失的前提下,采用色氨酸的结构类似物作为内标进行同步校正,提高定量准确性的同时简化样品处理步骤。本方法将5-甲基-色氨酸和α-甲基-色氨酸作为研究对象来考察其作为内标物定量碱水解方法测定色氨酸含量的可行性。
先后选择了NIST质控样1849a和1869作为研究对象,分别加入5-甲基-色氨酸和α-甲基-色氨酸内标后进行碱水解。不同定量方式和不同内标的定量结果显示(表2),相同条件下以α-甲基-色氨酸作为内标得到的2个质控样的含量均能满足明示的范围,而5-甲基-色氨酸作为内标得到的结果偏高,外标法定量的结果则达不到质控样的明示下限。以α-甲基-色氨酸作为内标来定量能得到更为准确的结果。
表2 不同定量方式和不同内标的定量结果
Table 2 Quantitative results of different quantitative methods and internal standards

质控样名称外标法定量结果/[mg·(100 g)-1]内标法定量结果/[mg·(100 g)-1]5-甲基-色氨酸α-甲基-色氨酸明示范围/[mg·(100 g)-1]1849a166201179174~1941869198253218204~252
2.3 方法学验证
2.3.1 线性范围和定量限
准确吸取色氨酸标准溶液(100 μg/mL)20、100和500、1 000、2 000和5 000 μL于10 mL容量瓶中,加入100 μL内标(1 mg/mL)工作液,用水定容至刻度,混匀后得到质量浓度分别为0.2、1.0、5.0、10.0、20.0、50.0 μg/mL的标准工作溶液,分别将标准系列工作液按照浓度由低到高的顺序注入液相色谱仪中,测得相应色谱峰的峰面积,以系列混合标准工作液的浓度为横坐标,以目标化合物的峰面积与内标的峰面积的比值为纵坐标,绘制标准曲线。相关系数r>0.999,覆盖方法定量限和常见样品的含量水平,线性良好。将S/N>10且能准确定量的最低浓度点计算出的含量确定为方法的定量限。结果见表3。
表3 方法线性方程和定量限
Table 3 Linear equation and limit of quantitation of the method
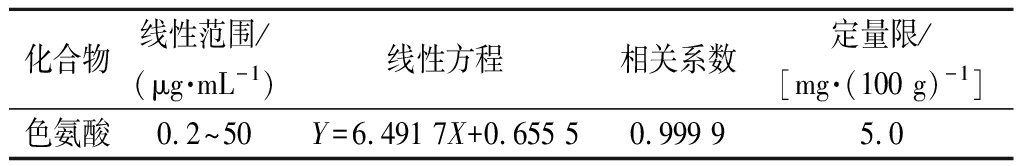
化合物线性范围/(μg·mL-1)线性方程相关系数定量限/[mg·(100 g)-1]色氨酸0.2~50Y=6.491 7X+0.655 50.999 95.0
2.3.2 方法准确度和精密度
试验选取代表性样品进行加标回收试验,样品分别为婴幼儿配方乳粉、乳蛋白部分水解样品和氨基酸配方样品,对样品进行平行试验得出本底值后再对每个样品做0.5、1和2倍本底值水平的加标试验,以回收率和相对标准偏差(relative standard deviation,RSD)评价方法的准确度和精密度。试验样品回收率和RSD见表4。样品的平均回收率在92.5%~97.4%之间,RSD均<3.11%。将试验样品选取4家机构进行验证,实验室间RSD<6.7%,显示了良好的准确度和精密度。
表4 不同样品的回收率及精密度(n=6)
Table 4 Recoveries and RSDs of different samples
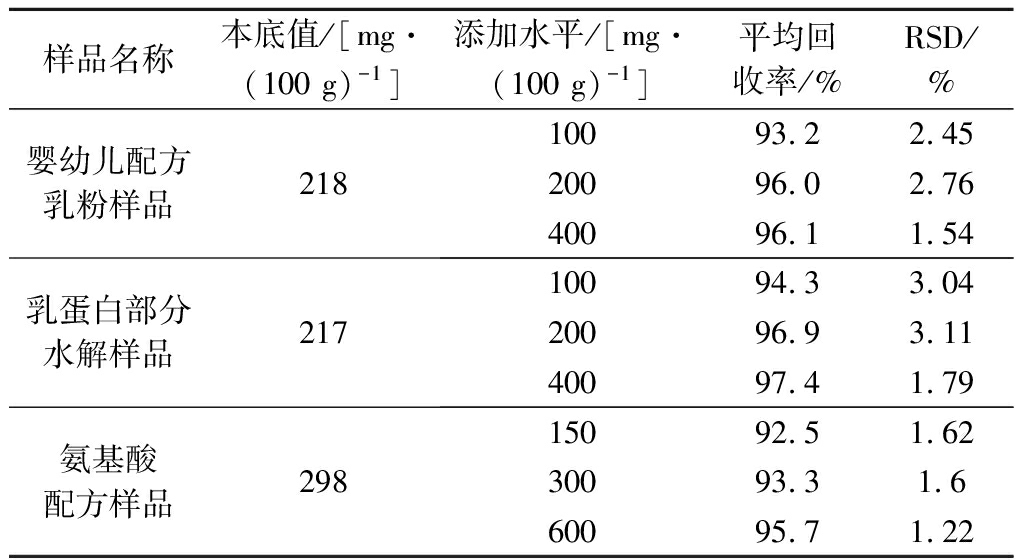
样品名称本底值/[mg·(100 g)-1]添加水平/[mg·(100 g)-1]平均回收率/%RSD/%婴幼儿配方乳粉样品21810093.22.4520096.02.7640096.11.54乳蛋白部分水解样品21710094.33.0420096.93.1140097.41.79氨基酸配方样品29815092.51.6230093.31.660095.71.22
2.3.3 实际样品应用
采用本研究建立的方法对21个不同种类样品进行测定。样品包括不同品牌婴幼儿配方乳粉8个、乳蛋白部分水解配方食品4个、乳蛋白深度水解配方食品4个和氨基酸配方食品5个。样品中色氨酸含量为170~315 mg/100 g,回收率92%~98%,均符合GB 10765—2010《食品安全国家标准 婴儿配方食品》中对色氨酸含量的要求。
3 结论
本研究以α-甲基-色氨酸为内标物,采用碱水解-高效液相色谱法测定了乳粉及特殊医学用途婴儿配方食品中的色氨酸含量。内标法较好地校正了水解过程中高温、高浓度碱溶液和不同基质在处理过程中对色氨酸的影响,同时省略了前处理过程中充氮气保护等步骤,对该方法进行方法学验证,也能得到满意的准确度和精密度。应用于不同种类的样品和质控样中目标物的测定均符合明示值,表明该方法操作简单、准确度高、重复性好,适用于乳粉及特殊医学用途婴儿配方食品中色氨酸的准确定性定量分析,可为企业生产和有关部门监管提供理论支撑。
[1] 黄伟乾,吴芷欣,吴俊发,等.HPLC法测定强化功能饮料中异烟酸、烟酸、烟酰胺、异烟酰胺、1-甲基烟酰胺氯化物、烟酸前体(色氨酸)的研究[J].食品科技,2019,44(6):336-340.
HUANG W Q,WU Z X,WU J F,et al.Determination of nicotinic acid,isonicotinic acid,nicotinamide,isonicotinamide,1-methyl nicotinamide chloride and nicotinic acid precursor (tryptophan) in fortified functional beverages[J].Food Science and Technology,2019,44(6):336-340.
[2] 郭素芳,王临虹,赵卫红,等.中国城市母乳喂养行为的研究[J].中国儿童保健杂志,2001,9(4):227-229.
GUO S F,WANG L H,ZHAO W H F,et al.Breastfeeding practice in urban China[J].Chinese Journal of Child Health Care,2001,9(4):227-229.
[3] 姜中航,付国红,孙志岩,等.模拟母乳及婴儿配方奶粉的研究[J].中国乳品工业,2002,30(5):100-102.
JIANG Z H,FU G H,SUN Z Y,et al.Study on humanized milk and infant formula milk powder[J].China Dairy Industry,2002,30(5):100-102.
[4] HEINE W E.The significance of tryptophan in infant nutrition[M]//Advances in Experimental Medicine and Biology.Boston,MA:Springer US,1999.
[5] 中华人民共和国卫生部.GB 10765—2010 食品安全国家标准婴儿配方食品[S].北京:中国标准出版社,2010.
Ministry of Health of the People's Republic of China.GB 10765—2010 National food safety standard Infant formula[S].Beijing:China Standards Press,2010.
[6] 中华人民共和国卫生部.GB 25596—2010 食品安全国家标准特殊医学用途婴儿配方食品通则[S].北京:中国标准出版社,2010.
Ministry of Health of the People’s Republic of China.GB 25596—2010 General principles of infant formula for special medical purposes[S].Beijing:China Standards Press,2010.
[7] 田洪芸,王文特,王冠群,等.酶解-分光光度法测定乳粉中L-色氨酸含量[J].中国乳品工业,2020,48(1):42-46.
TIAN H Y,WANG W T,WANG G Q,et.al.Determination of L-tryptophan in milk powder by enzymolysis-spectrophotometry[J].China Dairy Industry,2020,48(1):42-46.
[8] TIAN Y,DENG P,WU Y,et al.A simple and efficient molecularly imprinted electrochemical sensor for the selective determination of tryptophan[J].Biomolecules,2019,9(7):294.
[9] 蒲云月,陈少波.氨基酸分析仪法测定奶粉中色氨酸[J].农产品加工,2015(16):42-43.
PU Y Y,CHEN S B.Determination of tryptophan in milk powder by amino acid analyzer[J].Farm Products Processing,2015(16):42-43.
[10] NIELSEN H K,HURRELL R F.Tryptophan determination of food proteins by HPLC after alkaline hydrolysis[J].Journal of the Science of Food & Agriculture,1985,36(9):893-907.
[11] 张松,吴迪.直接水解紫外光谱法测定猪肉中色氨酸的含量[J].黑龙江生态工程职业学院学报,2016,29(5):28-29.
ZHANG S,WU D.Determination of tryptophan in pork by direct hydrolysis UV spectrometry[J].Journal of HeiLongJiang Vocational Institute of Ecological Engineering,2016,29(5):28-29.
[12] 赵艳,宋军,张艳红,等.微波辅助蛋白质水解-反相高效液相色谱法测定饲料中的色氨酸[J].中国饲料,2018(15):69-72.
ZHAO Y,SONG J,ZHANG Y H,et al.Determination of tryptophan in feed by reversed-phase high performance liquid chromatography after microwave-assisted alkaline hydrolysis of protein[J].China Feed,2018(15):69-72.
[13] DRAHER J.HPLC Determination of total tryptophan in infant formula and adult/pediatric nutritional formula following enzymatic hydrolysis,multilaboratory testing study:Final action 2017.03[J].Journal of AOAC International,2019,102(5):1 567-1 573.
[14] 孙立臻, 别梅,冯峰,等.酶水解-液相色谱法测定婴幼儿食品中的色氨酸[J].中国乳品工业,2019,47(9):47-51.
SUN L Z,BIE M,FENG,F,et al.Detection of tryptophan in infant food by enzymatic hydrolysis-high performance liquid chromatography[J].China Dairy Industry,2019,47(9):47-51.
[15] RUTHERFURD S M,RICHARDSON R K,MOUGHAN P J.The stability of tryptophan,5-methyl-tryptophan andα-methyl-tryptophan during NaOH hydrolysis of selected foods[J].Food Chemistry,2015,188:377-383.
[16] 支小平,崔盼盼,柳英霞.高效液相色谱-串联质谱法同时测定人体尿液中的酪氨酸和色氨酸[J].南昌大学学报(理科版),2016,40(4):341-345.
ZHI X P,CUI P P,LIU Y X.Simultaneous determination of tyrosine and tryptophan in human urine by HPLC-MS/MS[J].Journal of Nanchang University (Natural Science),2016,40(4):341-345.
[17] RAVINDRAN G,BRYDEN W L.Tryptophan determination in proteins and feedstuffs by ion exchange chromatography[J].Food Chemistry,2005,89(2):309-314.