肉是高营养的食物来源,可提供高质量的蛋白质、矿物质、维生素和其他微量营养素。肉类商品的价值取决于其食用品质,其中嫩度是影响消费者购买欲望的重要衡量标准[1-2]。动物宰后肌肉嫩度变化的原因主要是肌原纤维蛋白的有限降解[3-5]。影响肌原纤维蛋白降解的蛋白酶系统主要有钙蛋白酶系统、组织蛋白酶系统、蛋白酶体和Caspases[6]。目前报道较多的是钙激活酶系统、组织蛋白酶系统和蛋白酶体。SENTANDREU等[7]于2002年提出了Caspases系统参与宰后成熟过程中蛋白酶水解和肌肉嫩化过程的假设,因此Caspases介导的细胞凋亡被认为是影响肉嫩度变化的新机制。本文对Caspases的家族生物学特性、介导的凋亡途径、Caspases对肉嫩度的影响及其调控机制等方面进行了综述,以期为改善畜禽肉嫩度提供新思路。
1 Caspases家族生物学特性
细胞凋亡是畜禽在被屠宰后细胞自我破坏的程序性死亡过程,整个过程需要30~60 min。凋亡酶使细胞的DNA破碎、细胞形态发生皱缩、线粒体肿胀,并形成凋亡小体,最终导致细胞死亡[8]。Caspases是一种能够诱导细胞凋亡信号发生的蛋白酶[9-10]。其名字来源于肽键水解过程中半胱氨酸侧链所起的亲核作用,以及在天冬氨酸裂解时罕见的一级特异性。Caspases是半胱氨酸依赖的天冬氨酸特异性蛋白酶,哺乳动物中发现的Caspases有14种,按照发现顺序命名为caspase-1~14[11]。根据Caspases的结构和在细胞凋亡进程中的功能可分为3种类型(图1)。

图1 Caspases家族的分类
Fig.1 Classification of Caspases family
第1种是凋亡启动子亚类:包括caspase-8、9、10,处于细胞凋亡的起始阶段,有较长的原结构域,能够激活下游Caspases[12];第2种是凋亡效应子亚类:含有caspase-3、6、7,处于级联反应的下游,能够直接使细胞发生凋亡,特点是效应子分子量相对较小,没有蛋白质结合结构域,但具有剪切细胞结构蛋白的能力[13];第3种是炎症有关亚类,包括caspase-l、4、5、13及小鼠的caspase-11、12,与炎症相关因子的成熟有关,对细胞凋亡有着重要的作用。Caspases的底物包括:凋亡和炎症调节因子;蛋白激酶和其他信号转导调节因子;胞浆和核结构蛋白;修复和管家酶;细胞周期调节因子和疾病相关因子等[14-15]。Caspases是一种专一性细胞质/核质蛋白,它们的序列不编码输出或输入信号[16],通常情况下以单链酶原(等待激活的酶)形式存在,其中N端结构域是可以编码募集和激活信号,并且可以定义Caspases的类型。C端蛋白酶催化单元是一个单一的结构域,但在成熟过程中常被蛋白水解酶裂解成两条链[17]。
凋亡启动子Caspases的酶原是惰性单体,对于它们的激活机制基本确定,最简单的启动子Caspases激活模型,被称为诱导邻近模型[18]。关于凋亡启动子Caspases的生化和结构研究大多集中在caspase-8和9上,启动子Caspases酶原以无活性单体存在于细胞中,当其接收到细胞凋亡信号后被衔接分子召集到寡聚激活平台,通过N端募集结构域招募Caspases酶原形成多蛋白激活复合物,导致部分Caspases酶原浓度升高、水解活性增强,进而达到自我活化的条件。炎症相关Caspases也以相同的方式被激活。
凋亡效应子Caspases中,以caspase-3为例,caspase-3位于细胞凋亡级联反应的末端,通过降解细胞内相应底物使细胞发生凋亡。caspase-3基因首次被克隆出来是在人类的淋巴细胞中,随后NICHO-LSON等[19]发现caspase-3酶原中质量分别为17 kD和12 kD的2个亚基组成的凋亡素(apopain),可以剪切动物细胞中的聚合酶PARP引发细胞发生凋亡,后被命名为caspase-3。与启动子caspases相比较,凋亡效应子caspases-3、7不含有死亡效应结构域(death effector domain,DED),能够直接切割细胞结构蛋白,但需要在启动子Caspases被激活后才能进一步被激活。凋亡效应子caspase-3、7的酶原是专一的二聚体,在被激活时会形成大小2个亚基,然后将其N-端前体结构域移除,结合形成异二聚体,异二聚体还将进一步通过形成四级结构发挥作用[20]。效应子Caspases激活时,蛋白序列从N端到分割点至少间隔4个氨基酸,且第一蛋白位点必须是天冬氨酸(D)。如底物PARP在DEVD↓G处被caspase-3剪切。在脊椎动物中,凋亡和炎症性Caspases具有比较明确的生化和生物学机制[21],但对caspase-2的作用仍不明确。caspase-2在凋亡网络内外发挥着多种作用,同时也参与细胞周期的调控[22]。caspase-14通常不被认为是凋亡或炎症性Caspases,但在皮肤角质化中有着特殊的作用,机制尚不明确[23]。
2 Caspases介导调控细胞凋亡相关通路
在Caspases介导的细胞凋亡中,有3条活化路径,分别为内源性凋亡通路、外源性凋亡通路和内质网(endoplasmic reticulum,ER)介导的凋亡通路(图2)。
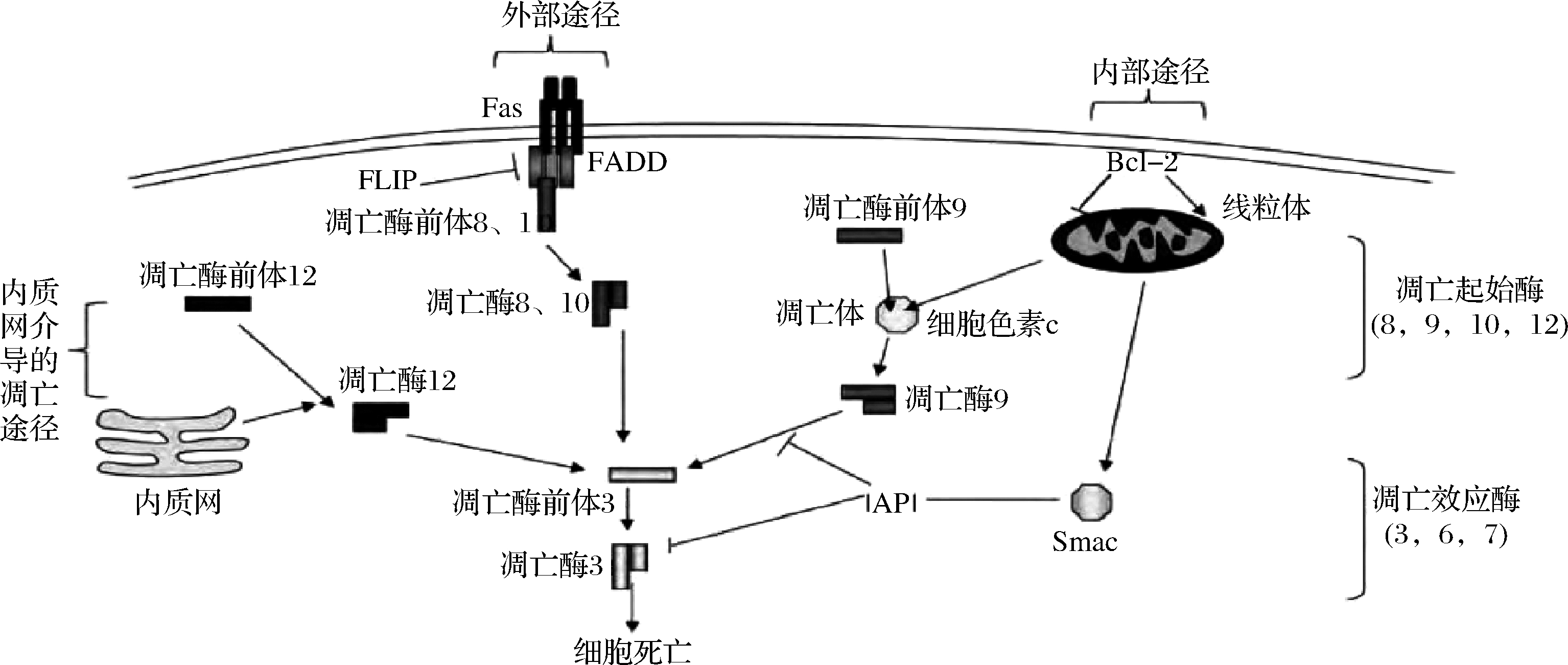
图2 细胞凋亡的内源性通路、外源性通路及内质网途径的模式图[24]
Fig.2 Mode pattern of the intrinsic,extrinsic and ER-mediated apoptosis pathways
2.1 线粒体介导的内源性凋亡通路
当细胞受到内部(如DNA损伤)或外部(如缺血、缺氧等)刺激时,会发生应激反应,刺激细胞,导致线粒体发生改变,线粒体膜通透性增大、跨膜电位降低,主要存在于内膜与外膜之中的细胞色素C(Cyt-c)从受损的线粒体释放到胞浆中。之后,Cyt-c结合caspases活化因子-1(Apaf-1)形成寡聚体并发生相互作用导致Apaf-1的构象发生变化,Apaf-1的氨基端与凋亡酶前体-9(procaspase-9)的募集域(caspase recruitment domain,CARD)相结合,使得procaspase-9自动活化,成熟caspase-9与凋亡小体结合后,caspase-3、7被激活,诱导细胞凋亡的发生[25]。
B淋巴细胞瘤-2 (B cell lymphoma-2,Bcl-2)家族蛋白作为细胞凋亡中的调节因子对线粒体细胞凋亡途径的调控具有极其重要的作用[26],Bcl-2蛋白家族具有高度复杂性,其家族成员已经发展到20多种,如位于线粒体上的抗凋亡蛋白Bcl-2和Bcl-w,通过抑制Cyt-c的释放,对细胞凋亡起到抑制作用;再如存在于细胞质中的促凋亡蛋白Bad、Bid、Bax和Bak,在接收到死亡受体信号传导后转移到线粒体中,通过促进Cyt-c的释放,诱发细胞凋亡[27]。
在Bcl-2家族中,Bcl-2和Bax是线粒体介导的内源性细胞凋亡通路中重要的调节因子。Bcl-2低表达、Bax高表达或Bax/Bcl-2比值上升都会导致凋亡的发生。正常生理状况下Bcl-2和Bax这2种蛋白的表达水平相对稳定,当接收到死亡受体信号传导后,Bax被释放,线粒体外膜上的Bax/Bax二聚体的数量增加,细胞对死亡信号的敏感性增强,从而触发凋亡;而当抗凋亡蛋白Bcl-2表达增高时,Bax/Bax大量分解,结合成为更加稳定的Bcl-2/Bax二聚体,减少对细胞凋亡的诱导作用,延长细胞存活周期[28]。HUANG等[29]对宰后西门塔尔公牛胸最长肌的凋亡因子和Caspases激活途径的变化进行了研究,结果发现在宰后0~0.25 d,肌肉中Bax蛋白表达量显著增加,Cyt-c从线粒体释放到细胞质。这一结果证实了Bax在宰后肌肉细胞线粒体依赖性细胞凋亡中的重要作用,同时能够表明,在宰后牛胸最长肌中,Cyt-C可通过Bax的调节从线粒体释放到细胞质。
2.2 死亡受体介导的外源性凋亡通路
死亡受体介导的外源凋亡通路与死亡诱导信号复合物“细胞膜受体-适配器-Caspases”(DISC)的组装有关。细胞膜的特定死亡受体(例如Fas,TNFR)能够识别具有定位凋亡酶前体-8(Procaspase-8)、凋亡酶前体-10(Procaspase-10)功能的细胞死亡信号(例如Fas配体,TNF-2)[30]。该死亡信号与特定受体相结合可以激活相关死亡结构域(death domain,DD),包括FADD(与Fas相关DD)、TRADD(与TNF受体相关DD)、RAIDD(RIP相关蛋白DD),从而导致相关DD聚合并产生大量DEDs。然后这些DEDs与Procaspase-8的原结构域(Pro-domain)的DEDs相互作用,诱导Procaspase-8蛋白质进行寡聚反应,最终产生大量的DISC。DISC组装后像内在途径中形成的凋亡体一样,将分子信号转化为蛋白酶活性,从而导致caspase-8被激活。被激活的caspase-8通过2种途径导致细胞凋亡。当caspase-8被大量活化时,可以直接处理和激活下游的caspase-3和caspase-7,这些下游Caspases通过裂解各种细胞底物来执行凋亡,从而导致凋亡级联反应的发生;当caspase-8只有少量被活化时,通过切割胞浆中促凋亡蛋白Bid的前体来形成裂解的Bid[31],被裂解的Bid转移至线粒体中,造成了促凋亡蛋白Bax和Bak寡聚后释放Cyt-c,Cyt-c的释放诱导细胞质中凋亡小体的形成,进而诱导细胞凋亡的发生。
FLIP(FLICE-like inhibition protein)是caspase-8的同系物,也参与caspase-8激活[32]。只有在低水平表达下,FLIP才能增强Fas诱导的caspase-8的激活;当FLIP高表达时,会抑制caspase-8的激活,这可能是通过阻断caspase-8的结合位点来实现的[33]。进一步的研究发现,FLIP能够与具有催化活性的caspase-8形成异二聚体,这一发现证实了caspase-8的二聚活化机制[34]。由此可见,caspase-8既能通过Cyt-c诱导、线粒体介导途径活化,也能通过与死亡复合体结合实现自我活化。
2.3 内质网介导的凋亡通路
ER是一种多功能细胞器,可以消除未折叠或错误折叠的蛋白质,只将正确折叠的蛋白质输出,同时对于磷脂的生物合成和维持钙稳态方面起着核心作用。当内质网稳态因缺氧、细胞快速增殖、氧化还原稳态发生改变、蛋白质合成水平提高以及钙离子水平降低时,未折叠或错误折叠的蛋白质大量积累在ER中,导致内质网应激(endoplasmic reticulum stress,ERS)的发生。ERS引发的细胞凋亡有一套独特的信号传导途径,称为ER相关性死亡途径,主要有caspase-12、结合蛋白同源蛋白(CHOP)、c-Jun氨基末端激酶(JNK)3条信号通路[35]。
ER是caspase-12的主要聚集地,当细胞中出现了ERS,会引起caspase-12的活化并最终导致凋亡的发生。在ERS的作用下,ER不受线粒体或其他部位凋亡信号的影响,caspase-7从细胞质基质中移动到ER表面,通过与凋亡酶前体-12(Procaspase-12)相互作用而活化caspase-12,而后激活下游的效应子Caspases[36],导致细胞凋亡的发生。
3 Caspases对肉嫩度的影响及其调控因素
肌原纤维是构成肌纤维的物质基础,也是决定肌肉嫩度的主要因素。其中和肉嫩度相关的蛋白有伴肌动蛋白、结蛋白、肌钙蛋白T、肌联蛋白等[37]。以往研究表明,这些蛋白在钙激活酶的作用下发生降解,导致肌细胞结构的完整性被破坏和肉的嫩化。然而,在钙激活酶无法发挥作用的条件下,依旧有部分与嫩度相关的蛋白发生了降解,这可能与Caspases有关。因此,Caspases对肉嫩度的影响及其调控因素成为了研究热点。ZHANG等[38]研究发现,牛被屠宰后,其肌肉细胞失血失氧,溶酶铁通过降低抗氧化酶活性导致活性氧积累。随后,溶酶体铁介导的溶酶体功能障碍增加了细胞线粒体膜通透性,降低了线粒体膜电位,从而增强了Cyt-c和促凋亡蛋白Bid的释放,导致caspase-9、3的激活,增加了宰后肌肉中结蛋白和肌钙蛋白T的降解程度,加快了宰后肌肉嫩化的进程。李文东等[39]对宰后牦牛肉进行了快速冷却处理,发现当Caspases活力被抑制时,肌原纤维蛋白的降解减少,牛肉的剪切力增大。WANG等[40]利用环孢霉素A抑制caspase-9和caspase-3的活性,使得宰后牦牛背最长肌的细胞凋亡率、肌原纤维断裂指数、Ca2+水平均下降,同时肌肉的剪切力增大。这些研究结果表明Caspases对于肉嫩度有改善作用。此外,如钙蛋白酶系统、小分子热应激蛋白等可直接参与肉的嫩化,同时也可通过调控细胞凋亡影响肉嫩度。
3.1 钙蛋白酶
有研究表明钙蛋白酶(Calpain)可以降解肌纤维中的肌动蛋白、肌联蛋白、肌钙蛋白T和结蛋白等;破坏肌肉的超微结构、使Z线弱化并消失,从而导致了肌肉的肌原纤维小片化,加速了肉的嫩化[41]。Calpain系统中钙蛋白酶Ⅰ是引起宰后成熟过程中肌纤维蛋白降解和嫩化的主要蛋白酶,但将钙蛋白酶Ⅰ基因沉默后,与肉嫩度有关蛋白的水解并未受影响,这表明肌肉嫩化过程中有其酶的参与,形成了多条通路。同时,已有研究发现Caspases和Calpain系统之间相互作用、相互影响的机制,当内质网Ca2+平衡被打破后,Calpain就可以激活caspsae-12,同时可以激活促凋亡蛋白Bcl-XL,诱导线粒体凋亡通路的启动[42]。CHEN等[43]对于宰后成熟过程中鸡胸肉的caspases-3和Calpain的活性进行了测定,结果表明,一些氧化型肌原纤维蛋白更加容易被Calpain和caspase-3进行切割,caspase-3可以对钙蛋白酶抑制蛋白(calpastatin)进行降解,间接上调Calpain活性。同时Caspases通过介导蛋白降解对细胞膜和细胞骨架进行破坏,导致Ca2+的浓度和Calpain的活性增强。而Calpain也能以负调控的方式作用于细胞凋亡,例如切割caspase-3、7、8、9,使之成为无活性的亚型结构,抑制细胞凋亡的发生[44]。HUANG等[45]在宰后牛的骨骼肌中注射了Ca2+,结果发现,在注射Ca2+的样品中caspase-3的活性下降,可能的原因是Calpain的直接切割导致了caspase-3失活。因此,Caspases和Calpain之间存在多种作用途径,可以共同调节宰后肌肉的嫩化。
3.2 小分子热应激蛋白
小分子热应激蛋白(small heat shock proteins,sHSPs)是热应激蛋白(heat shock proteins,HSPs)家族中的第六类,是一类具有低突变率的非特异性细胞蛋白,当动物受到缺氧缺血、氧化、重金属盐等刺激后便会迅速产生,主要包括HSP20、HSP27和αB-晶状体蛋白等[46]。sHSPs能够防止由于肌肉细胞凋亡引起的结构损伤和蛋白质降解,并保护肌动蛋白和其他细胞骨架蛋白免受应激反应引起的断裂。许多学者研究了sHSPs调控细胞凋亡的理论。例如,小鼠细胞中HSP27能干扰线粒体上游的凋亡信号,影响线粒体释放Cyt-c,减少凋亡小体的形成并干扰caspase-9的激活,从而抑制细胞凋亡的发生。进一步的研究发现当羔羊腰部肌肉中的HSP27降解减少时,完整的结蛋白和肌钙蛋白T的含量更高、钙蛋白酶自溶减少、肌肉的剪切力更高[47],因此,HSP27在维持肌肉细胞的完整性和修复变性蛋白质方面具有一定的作用。此外,αB-晶状体能够通过抑制心肌细胞中caspase-3的活化而减少凋亡的发生,而当αB-晶状体蛋白错译突变时则失去了抗凋亡作用,会导致线粒体膜通透性增大从而引起大量Cyt-c的释放,加快细胞凋亡的进程,与之类似的HSP20也具有相同的生物功能。其他sHSPs可以通过干扰细胞凋亡途径中的化学信号来抑制细胞凋亡;也可以通过分子伴侣作用防止受损或未折叠的蛋白质大量聚集,从而抑制ER介导的细胞凋亡。总的来说,sHSPs在细胞凋亡和肌肉嫩度的调控上具有重要作用,不仅可以延缓肌原纤维蛋白的降解,还可以阻碍细胞凋亡的发生。
3.3 宰后处理
随着Caspases对肉嫩度影响的研究更加深入,生产加工中也出现了人为加速细胞凋亡发生的技术,例如∶1)超声波处理:多适用于Ca2+注射的协同工艺,能够直接将肌原纤维小片化,在胴体缺乏能量供给的情况下利于Caspases对肌原纤维的降解[48];2)高压嫩化法:250 MPa超高压处理牛肉10 min,能够迫使肌内周膜、肌外周膜剥离,人工促进肌细胞间隙面积增大,使肌浆网中Ca2+浓度瞬间提高,利于激活Caspases和Calpain,降解肌原纤维蛋白,改善肉嫩度;3)电刺激:对大型屠宰动物来说操作简单卫生环保,非常适于牛羊肉嫩化。田园等[49]的研究表明,电刺激能够改变线粒体膜通透性,释放凋亡因子,快速促进细胞凋亡的发生,能够起到加速嫩化的作用。此外,辐射嫩化、基因工程嫩化等方法也可以加速Caspases的释放与细胞凋亡的发生,但由于技术不成熟,所以并未进行大量的生产实践[50]。
4 结语
宰后肉的成熟和嫩化是一个复杂的生化过程,其中Caspases起着重要的作用。本文明确了Caspases对宰后肉嫩度影响的机制及调控因素,将为改善肉品质提供新的思路和方向。虽然大量试验已经证明,在肌原纤维蛋白水解过程中的细胞死亡主要以凋亡的形式完成,但是Caspases系统的准确作用机制,以及在宰后成熟中与其他酶系统的相互作用机制等问题仍有待更深入的研究验证。
[1] SASAKI K,MOTOYAMA M,NARITA T,et al.Characterization and classification of Japanese consumer perceptions for beef tenderness using descriptive texture characteristics assessed by a trained sensory panel[J].Meat Science,2014,96(2):994-1 002.
[2] MILLER M F,CARR M A,RAMSEY C B,et al.Consumer thresholds for establishing the value of beef tenderness[J].Journal of Animal Science,2001,79(12):3 062-3 068.
[3] PURSLOW P P.Contribution of collagen and connective tissue to cooked meat toughness;some paradigms reviewed[J].Meat Science,2018,144:127-134.
[4] YAN X L,LIU R,ZHANG C Y,et al.The postmortem μ-calpain activity,protein degradation and tenderness of sheep meat from Duolang and Hu breeds[J].International Journal of Food Science & Technology,2018,53(4):904-912.
[5] 钱书意, 李侠,孙圳,等.不同冻结温度下牛肉的肌原纤维蛋白变性与肌肉持水性[J].食品科学,2018,39(15):24-30.
QIAN S Y,LI X,SUN Z,et al.Myofibrillar protein denaturation and water-holding capacity of beef frozen at different temperatures[J].Food Science,2018,39(15):24-30.
[6] KEMP C M,PARR T,BARDSLEY R G,et al.Comparison of the relative expression of caspase isoforms in different porcine skeletal muscles[J].Meat Science,2006,73(3):426-431.
[7] SENTANDREU M A,COULIS G,OUALI A.Role of muscle endopeptidases and their inhibitors in meat tenderness[J].Trends in Food Science & Technology,2002,13(12):400-421.
[8] LANA A,ZOLLA L.Apoptosis or autophagy,that is the question:Two ways for muscle sacrifice towards meat[J].Trends in Food Science & Technology,2015,46(2):231-241.
[9] KOPEINA G S,PROKHOROVA E A,LAVRIK I N,et al.Alterations in the nucleocytoplasmic transport in apoptosis:Caspases lead the way[J].Cell Proliferation,2018,51(5):e12 467.
[10] ABD-ALLAH W H,SALMAN A,SABRY SAAD S.Anticancer activity of newly synthesized 1,1-disubstituted cyclohexane-1-carboxamides:In vitro caspases mediated apoptosis activators in human cancer cell lines and their molecular modeling[J].Drug Development Research,2019,80(7):933-947.
[11] KEMP C M,PARR T.The effect of recombinant caspase 3 on myofibrillar proteins in porcine skeletal muscle[J].Animal,2008,2(8):1 254-1 264.
[12] ZHAO Z Y,YANG P X,ECKERT R L,et al.Caspase-8:a key role in the pathogenesis of diabetic embryopathy[J].Birth Defects Research.Part B,Developmental and Reproductive Toxicology,2009,86(1):72-77.
[13] EARNSHAW W C,MARTINS L M,KAUFMANN S H.Mammalian caspases:Structure,activation,substrates,and functions during apoptosis[J].Annual Review of Biochemistry,1999,68(1):383-424.
[14] GREEN D R,OBERST A,DILLON C P,et al.RIPK-dependent necrosis and its regulation by caspases:A mystery in five acts[J].Molecular Cell,2011,44(1):9-16.
[15] ZHAO R J,LI Y Q,WANG H,et al.The relationship between Caspase family and apoptosis[J].Chinese Journal of Animal Husbandry,2010(17):73-78.
[16] ![]() M,FUNK C.Structural and functional diversity of caspase homologues in non-metazoan organisms[J].Protoplasma,2018,255(1):387-397.
M,FUNK C.Structural and functional diversity of caspase homologues in non-metazoan organisms[J].Protoplasma,2018,255(1):387-397.
[17] RAMIREZ M L G,SALVESEN G S.A primer on caspase mechanisms[J].Seminars in Cell & Developmental Biology,2018,82:79-85.
[18] BOATRIGHT K M,RENATUS M,SCOTT F L,et al.A unified model for apical caspase activation[J].Molecular Cell,2003,11(2):529-541.
[19] NICHOLSON D W,ALI A,THORNBERRY N A,et al.Identification and inhibition of the ICE/CED-3 protease necessary for mammalian apoptosis[J].Nature,1995,376(6 535):37-43.
[20] SAIKUMAR P,DONG Z,MIKHAILOV V,et al.Apoptosis:definition,mechanisms,and relevance to disease[J].The American Journal of Medicine,1999,107(5):489-506.
[21] CHAMCHEU J C,SIDDIQUI I A,ADHAMI V M,et al.Chitosan-based nanoformulated (-)-epigallocatechin-3-gallate (EGCG) modulates human keratinocyte-induced responses and alleviates imiquimod-induced murine psoriasiform dermatitis[J].International Journal of Nanomedicine,2018,13:4 189-4 206.
[22] CARROLL B L,BONICA J,SHAMSEDDINE A A,et al.A role for caspase-2 in sphingosine kinase 1 proteolysis in response to doxorubicin in breast cancer cells-implications for the CHK1-suppressed pathway[J].FEBS Open Bio,2018,8(1):27-40.
[23] HUNT L C,UPADHYAY A,JAZAYERI J A,et al.Caspase-3,myogenic transcription factors and cell cycle inhibitors are regulated by leukemia inhibitory factor to mediate inhibition of myogenic differentiation[J].Skeletal Muscle,2011,1(1):17.
[24] KEMP C M,SENSKY P L,BARDSLEY R G,et al.Tenderness:An enzymatic view[J].Meat Science,2010,84(2):248-256.
[25] 黄兆宇,武睿超,冉江华,等.线粒体调控细胞凋亡的相关研究综述[J].吉林医学,2018,39(7):1 356-1 357.
HUANG Z Y,WU R C,RAN J H,et al.Review of related research on mitochondrial regulation of apoptosis[J].Jilin Medicine Journal,2018,39(7):1 356-1 357.
[26] CZABOTAR P E,LESSENE G,STRASSER A,et al.Control of apoptosis by the BCL-2 protein family:Implications for physiology and therapy[J].Nature Reviews Molecular Cell Biology,2014,15(1):49-63.
[27] THEOFILAS P,BEDNER P,HÜTTMANN K,et al.The proapoptotic BCL-2 homology domain 3-only protein bim is not critical for acute excitotoxic cell death[J].Journal of Neuropathology & Experimental Neurology,2009,68(1):102-110.
[28] ROSET R,ORTET L,GIL-GOMEZ G.Role of Bcl-2 family members on apoptosis:What we have learned from knock-out mice[J].Frontiers in Bioscience:a Journal and Virtual Library,2007,12:4 722-4 730.
[29] HUANG F,HUANG M,ZHANG H,et al.Changes in apoptotic factors and caspase activation pathways during the postmortem aging of beef muscle[J].Food Chemistry,2016,190:110-114.
[30] DENAULT J B,SALVESEN G S.Apoptotic caspase activation and activity[J].Methods in Molecular Biology,2008,414:191-220.
[31] WANG J,CHUN H J,WONG W,et al.Caspase-10 is an initiator caspase in death receptor signaling[J].Proceedings of the National Academy of Sciences of the United States of America,2001,98(24):13 884-13 888.
[32] KIM J Y,SUNG E G,JANG J H,et al.PO-074 Metformin-induced apoptosis facilitates degradation of the C-FLIPL protein through a caspase-dependent pathway in human renal cell carcinoma A498 cells[J].ESMO Open,2018,3:A49-A50.
[33] CHANG D W,XING Z,PAN Y,et al.C-FLIP(L) is a dual function regulator for caspase-8 activation and CD95-mediated apoptosis[J].The EMBO Journal,2002,21(14):3 704-3 714.
[34] LE CLORENNEC C,LAZREK Y,DUBREUIL O,et al.ITCH-dependent proteasomal degradation of c-FLIP induced by the anti-HER3 antibody 9F7-F11 promotes DR5/caspase 8-mediated apoptosis of tumor cells[J].Cell Communication and Signaling,2019,17(1):1-16.
[35] GUO H L,HASSAN H M,DING P P,et al.Pyrazinamide-induced hepatotoxicity is alleviated by 4-PBA via inhibition of the PERK-eIF2α-ATF4-CHOP pathway[J].Toxicology,2017,378:65-75.
[36] MURAKI Y,MAKITA Y,YAMASAKI M,et al.Elevation of liver endoplasmic Reticulum stress in a modified choline-deficient L-amino acid-defined diet-fed non-alcoholic steatohepatitis mouse model[J].Biochemical and Biophysical Research Communications,2017,486(3):632-638.
[37] WU W,WAN O W,CHUNG K.S-nitrosylation of XIAP at Cys 213 of BIR2 domain impairs XIAP’s anti-caspase 3 activity and anti-apoptotic function[J].Apoptosis,2015,20(4):491-499.
[38] ZHANG J Y,YU Q L,HAN L,et al.Effects of lysosomal iron involvement in the mechanism of mitochondrial apoptosis on postmortem muscle protein degradation[J].Food Chemistry,2020,328:127 174.
[39] 李文东, 韩玲,宋仁德,等.快速冷却对宰后牦牛肉成熟过程中细胞凋亡酶活力与嫩度的影响[J].现代食品科技,2019,35(3):73-79.
LI W D,HAN L,SONG R D,et al.The effect of rapid chilling on tenderness and apoptotic activity during yak meat postmortem aging[J].Modern Food Science and Technology,2019,35(3):73-79.
[40] WANG L L,HAN L,MA X L,et al.Effect of mitochondrial apoptotic activation through the mitochondrial membrane permeability transition pore on yak meat tenderness during postmortem aging[J].Food Chemistry,2017,234:323-331.
[41] CHANNON H A,HAMILTON A J,D’SOUZA D N,et al.Estimating the impact of various pathway parameters on tenderness,flavour and juiciness of pork using Monte Carlo simulation methods[J].Meat Science,2016,116:58-66.
[42] SMUDER A J,KAVAZIS A N,HUDSON M B,et al.Oxidation enhances myofibrillar protein degradation via calpain and caspase-3[J].Free Radical Biology and Medicine,2010,49(7):1 152-1 160.
[43] CHEN L,FENG X C,ZHANG Y Y,et al.Effects of ultrasonic processing on caspase-3,calpain expression and myofibrillar structure of chicken during post-mortem ageing[J].Food Chemistry,2015,177:280-287.
[44] 苟惠天, 师希雄.细胞凋亡酶在肉品成熟过程中对其嫩度影响的研究进展[J].食品与发酵工业,2016,42(5):272-276.
GOU H T,SHI X X.Research advances in effect of caspase on meat tenderness during meat aging[J].Food and Fermentation Industries,2016,42(5):272-276.
[45] HUANG F,DING Z J,ZHANG C J,et al.Effects of calcium and zinc ions injection on caspase-3 activation and tenderness in post-mortem beef skeletal muscles[J].International Journal of Food Science & Technology,2018,53(3):582-589.
[46] 李鑫, 邢通,徐幸莲.小分子热应激蛋白与肉嫩度的关系研究进展[J].食品科学,2016,37(13):232-236.
LI X,XING T,XU X L.Relationship between small heat shock proteins and meat tenderness[J].Food Science,2016,37(13):232-236.
[47] CRAMER T,PENICK M L,WADDELL J N,et al.A new insight into meat toughness of callipyge lamb loins-The relevance of anti-apoptotic systems to decreased proteolysis[J].Meat Science,2018,140:66-71.
[48] XIONG G Y,ZHANG L L,ZHANG W,et al.Influence of ultrasound and proteolytic enzyme inhibitors on muscle degradation,tenderness,and cooking loss of hens during aging[J].Czech Journal of Food Sciences,2012,30(3):195-205.
[49] 田园, 党欣,韩玲,等.不同电刺激时间对牦牛肉在成熟过程中品质变化的影响[J].食品工业科技,2014,35(1):56-60;65.
TIAN Y,DANG X,HAN L,et al.Effect of different time electrical stimulation on quality of yak during aging[J].Science and Technology of Food Industry,2014,35(1):56-60;65.
[50] MAKHOVA A A,MINAEV M Y,KULIKOVSKY A V,et al.Enzymatic activity of recombinant metallopeptidase for further using in meat industry[J].Voprosy Pitaniia,2019,88(4):95-104.